El objetivo de este trabajo observacional multicéntrico ha sido comparar los resultados de la resección anterior (RA) y la amputación abdominoperineal (AAP) en el tratamiento del cáncer de recto.
MétodoEntre marzo de 2006 y marzo de 2009, 1.598 pacientes diagnosticados de un tumor del tercio medio o inferior de recto fueron operados en los primeros 38 hospitales incluidos en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos. La cirugía se consideró curativa en 1.343 pacientes. Los resultados clínicos y oncológicos se analizaron con relación al tipo de resección. Todos los pacientes fueron incluidos en el análisis de los resultados clínicos; para el análisis de los resultados oncológicos solo se consideraron los pacientes con operaciones curativas.
ResultadosEn 1.139 (71,3%) de los 1.598 pacientes se practicó una RA y en 459 (28,7%) una AAP. De los 1.343 pacientes operados con intención curativa, en 973 (72,4%) se practicó una RA y en 370 (27,6%) una AAP. No hubo diferencias entre RA y AAP en la mortalidad operatoria (29 vs. 18 pacientes; p=0,141). Con un seguimiento de 60,0 (49,0-60,0) meses no se encontraron diferencias entre ambas operaciones en la recidiva local (HR 1,68 [0,87-3,23]; p=0,12) ni en las metástasis (HR 1,31 [0,98-1,76]; p=0,064). Sin embargo, la supervivencia global fue menor con la AAP (HR 1,37 [1,00-1,86]; p=0,048).
ConclusiónEste estudio no ha identificado la AAP como factor determinante de recidiva local ni de metástasis, pero sí de la disminución de la supervivencia global.
This multicentre observational study aimed to compare outcomes of anterior resection (AR) and abdominal perineal resection (APR) in patients treated for rectal cancer.
MethodsBetween March 2006 and March 2009 a cohort of 1,598 patients diagnosed with low and mid rectal cancer were operated on in the first 38 hospitals included in the Spanish Rectal Cancer Project. In 1,343 patients the procedure was considered curative. Clinical and outcome results were analysed in relation to the type of surgery performed. All patients were included in the analysis of clinical results. The analysis of outcomes was performed only on patients treated by a curative procedure.
ResultsOf the 1,598 patients, 1,139 (71.3%) underwent an AR and 459 (28.7%) an APR. In 1,343 patients the procedure was performed with curative intent; from these 973 (72.4%) had an AR and 370 (27.6%) an APR. There were no differences between AR and APR in mortality (29 vs. 18 patients; P=.141). After a median follow up of 60.0 [49.0-60.0] months there were no differences in local recurrence (HR 1.68 [0.87-3.23]; P=.12), metastases (HR 1.31 [0.98-1.76]; P=.064). However, overall survival was worse after APR (HR 1.37 [1.00-1.86]; P=.048).
ConclusionThis study did not identify abdominoperineal excision as a determinant of local recurrence or metastases. However, patients treated by this operation have a decreased overall survival.
En la cirugía del cáncer de recto de los tercios medio e inferior la cirugía con conservación de esfínteres es la opción más utilizada1,2. Sin embargo, hay pacientes en los que esta opción no es posible porque presentan tumores voluminosos, localmente avanzados o muy bajos. Además, hay pacientes en los se prevé que la función defecatoria será inadecuada si se restablece la continuidad. En estas situaciones la amputación abdominoperineal convencional (AAP), descrita originalmente con la resección del elevador del ano, es una operación realizada con frecuencia, sobre todo en los tumores del tercio inferior3,4.
Aunque estas operaciones no son directamente comparables, algunos estudios muestran que los pacientes tratados con una AAP tienen un pronóstico peor que los tratados con una resección anterior (RA)5,6. Sin embargo, otros indican que no hay diferencias entre ambas operaciones7–10, o que, al menos, las tasas de recidiva local (RL) son similares en ambas operaciones11.
Los diferentes resultados oncológicos pueden tener un origen multifactorial, dependiente de las características de los pacientes y de los tumores12, y también de la técnica quirúrgica13, especialmente si la AAP es realizada de forma sincrónica14. Por todo ello, todavía no hay pruebas de que la AAP, en sí misma, tenga peores resultados oncológicos que la RA.
El objetivo de este trabajo observacional, realizado en el marco del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos, ha sido analizar las diferencias en los resultados de ambas operaciones.
Material y métodosEste estudio observacional multicéntrico se ha realizado en el marco del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos. Esta iniciativa docente se inició en 2006, para introducir la cirugía de escisión del mesorrecto a los grupos multidisciplinares de cirujanos, patólogos y radiólogos de hospitales del sistema público de salud que tratan el cáncer de recto. Una descripción más detallada del mismo ha sido publicada recientemente15.
La cohorte presente incluye 1.598 pacientes diagnosticados de un tumor de recto del tercio medio e inferior, tratados con una AAP convencional o una RA, entre marzo de 2006 y marzo de 2009, en los primeros 38 hospitales incluidos en el proyecto. De ellos, la cirugía se consideró potencialmente curativa en 1.343 pacientes, en los que se practicó un procedimiento localmente radical (R0 y R1), con márgenes libres de tumor o con invasión microscópica de los mismos, en ausencia de metástasis. El seguimiento se realizó hasta marzo de 2014.
Todos los pacientes tenían un adenocarcinoma de recto localizado entre 0 y 12cm del margen anal medidos mediante rectoscopia rígida en la retirada del rectoscopio, o, principalmente, mediante resonancia magnética (MRI)16. Debido al pequeño número de pacientes (5) operados de forma urgente con una RA, estos no se incluyeron en ningún análisis. El tratamiento neoadyuvante, generalmente radioquimioterapia de ciclo largo, se administró de forma habitual a los pacientes con estadios II y III. Las contraindicaciones habituales para este tratamiento fueron: edad avanzada, enfermedad isquémica cardiovascular y radioterapia pélvica previa.
Aunque la frecuencia del seguimiento se dejó a la decisión de cada uno de los hospitales participantes, en general este se realizó cada 6 meses los 2 primeros años, y cada año los siguientes hasta completar 5 años. Generalmente en estas visitas se determinaba el nivel de CEA, se realizaba una TC de tórax y abdomen y, con carácter anual o bienal, se realizaba una colonoscopia. Ante la sospecha de recidiva, el diagnóstico se confirmaba mediante una MRI de la pelvis y una tomografía por emisión de positrones. La información del seguimiento se remitía al registro centralizado del proyecto con una frecuencia anual.
Las variables de resultado fueron: a) clínicas: mortalidad operatoria, complicaciones y reintervenciones, y b) oncológicas: recidiva local, metástasis y supervivencia global.
DefinicionesLa RL fue definida como la reaparición de la enfermedad en la pelvis, incluyendo la anastomosis y la herida perineal, independientemente de que el paciente tuviera metástasis a distancia. La recidiva aislada en los ovarios se consideró como metástasis.
La supervivencia global se definió como el tiempo desde la fecha de la operación hasta la fecha de muerte o último seguimiento de los pacientes que no habían fallecido.
El estadio tumoral se determinó mediante la clasificación TNM (American Joint Committee on Cancer [AJCC] stages I–IV; 5th edition)17.
El proyecto fue aprobado por los Comités de Ética de los centros incluidos.
Análisis estadísticoLas variables continuas se presentan como media y desviación estándar. Las variables categóricas se presentan como valores absolutos y porcentajes.
Los resultados relacionados con la incidencia de RL, metástasis y supervivencia se presentaron como el número total de eventos. Se consideró que los pacientes estaban en riesgo de experimentar los eventos indicados hasta el fallecimiento, la pérdida de seguimiento por cambio de ciudad de residencia o finalización del seguimiento a los 5 años. La incidencia de estos eventos se estimó mediante el método de Kaplan-Meier.
Después de evaluar la proporcionalidad y la linealidad de los hazard ratios (HR), la posibilidad específica del HR de cada evento se estudió mediante el método de regresión de riesgos proporcionales de Cox. Los potenciales factores de confusión, tales como edad, sexo, localización del tumor en el recto, tratamiento neoadyuvante y estadio tumoral fueron incluidos en los modelos. El HR se presenta con el intervalo de confianza del 95% (IC 95%).
Todas las variables significativas fueron incluidas en el análisis final. Las variables de confusión con una asociación marginal (p<0,15) fueron incluidas en el modelo y solo se retiraban si no cambiaban significativamente la probabilidad del modelo ni las estimaciones de las restantes variables. Si una variable fue significativa en el análisis de la RL pero no en el de la supervivencia o viceversa, se incluyó en ambos modelos de regresión.
Los datos fueron analizados con el paquete estadístico R versión 2.11 (R Foundation for Statistical Computing, Viena, Austria).
ResultadosLa cohorte presente incluye 1.598 pacientes tratados con una AAP convencional o una RA entre marzo de 2006 y marzo de 2009 en los primeros 38 hospitales incluidos en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos.
Resultados clínicosEl análisis de los resultados clínicos de ambas operaciones se realizó con los datos de los 1.598 pacientes. De ellos 1.139 (71,3%) fueron tratados con una RA y 459 (28,7%) con una AAP. No hubo diferencias entre la RA y la AAP en la mortalidad operatoria (29 vs. 18 pacientes; p=0,141), ni en las tasas de reoperaciones practicadas en el postoperatorio (112 [9,8%] vs. 37 [8,1%]; p=0,270). Sin embargo, la tasa de complicaciones postoperatorias fue mayor en la AAP (445 [39,1%] vs. 236 [51,4%]; p<0,001).
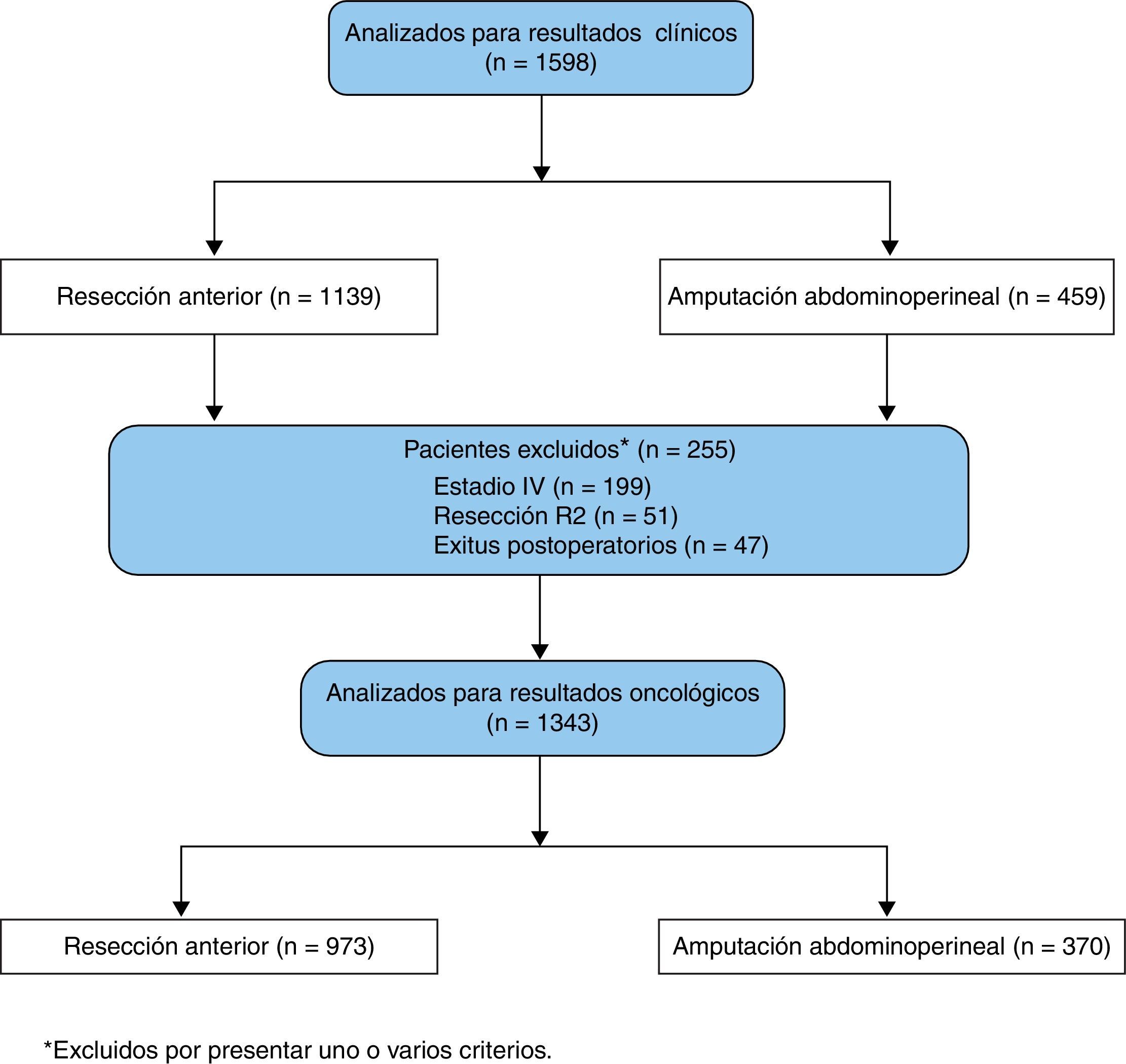
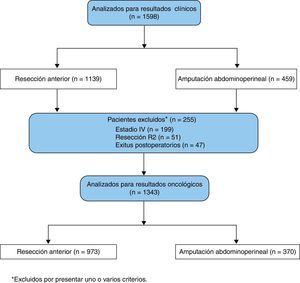
Resultados oncológicosEl análisis de los resultados oncológicos se realizó con 1.343 pacientes en los que la cirugía se consideró potencialmente curativa, excluyendo a 255 pacientes por una o varias de las siguientes razones: metástasis en el diagnóstico (n=199), resecciones R2 (n=51), o fallecidos en el postoperatorio (n=47) (fig. 1).
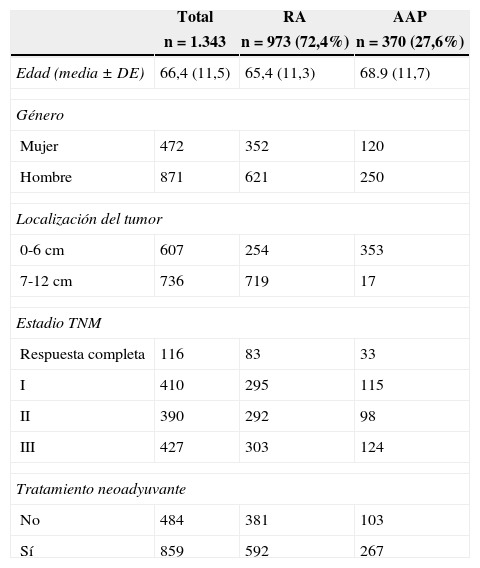
Las características de esta cohorte, en la que la cirugía se consideró potencialmente curativa, se detallan en la tabla 1. En 973 (72,4%) se practicó una RA y en 370 (27,6%) una AAP. La AAP se practicó en 18 (2%) tumores del tercio medio y en 364 (58,2%) tumores del tercio inferior.
Características de los 1.343 pacientes operados con intención curativa
| Total | RA | AAP | |
|---|---|---|---|
| n=1.343 | n=973 (72,4%) | n=370 (27,6%) | |
| Edad (media±DE) | 66,4 (11,5) | 65,4 (11,3) | 68.9 (11,7) |
| Género | |||
| Mujer | 472 | 352 | 120 |
| Hombre | 871 | 621 | 250 |
| Localización del tumor | |||
| 0-6 cm | 607 | 254 | 353 |
| 7-12 cm | 736 | 719 | 17 |
| Estadio TNM | |||
| Respuesta completa | 116 | 83 | 33 |
| I | 410 | 295 | 115 |
| II | 390 | 292 | 98 |
| III | 427 | 303 | 124 |
| Tratamiento neoadyuvante | |||
| No | 484 | 381 | 103 |
| Sí | 859 | 592 | 267 |
AAP: amputación abdominoperineal; RA: resección anterior.
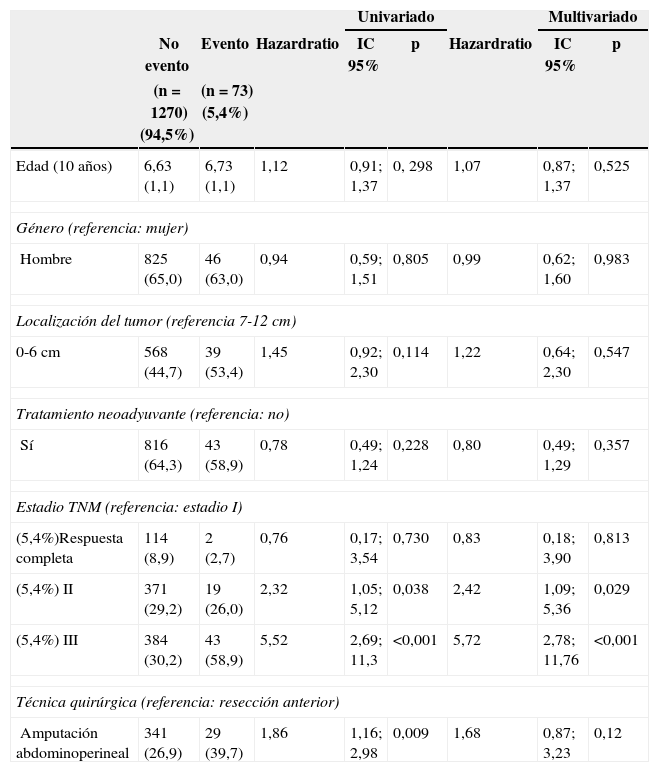
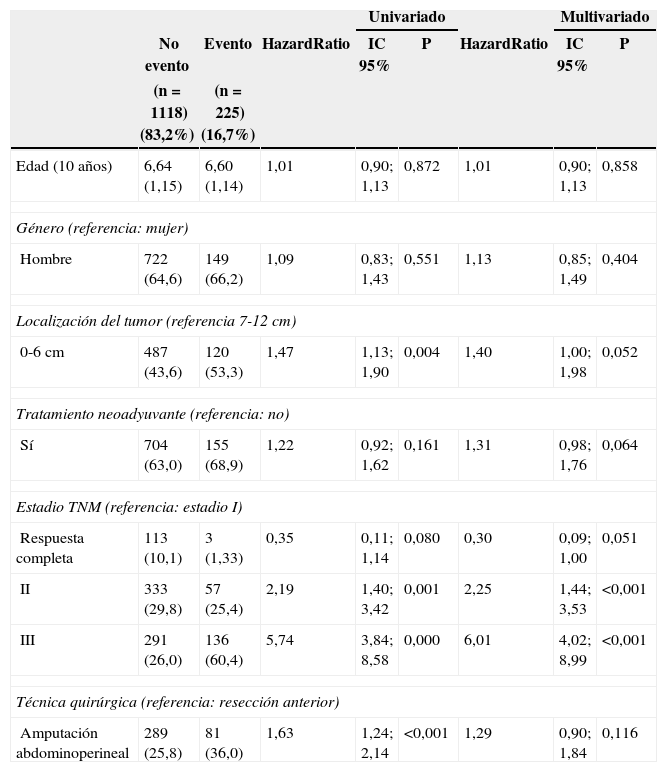
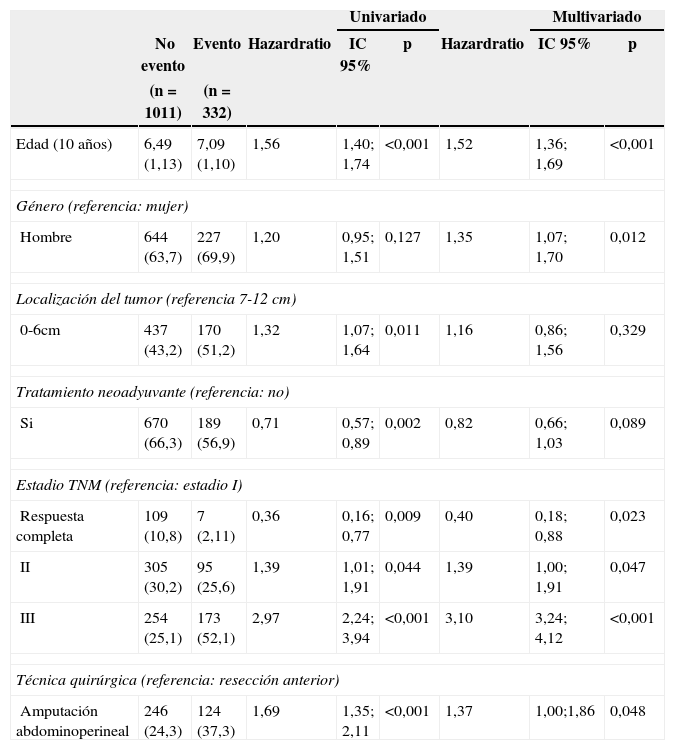
Con un seguimiento de 60,0 (49,0-60,0) meses, la incidencia acumulada de RL fue de 6,22% (7,61-4,81), la de metástasis de 18,44% (20,61-16,21) y la de supervivencia global de 74,46% (76,89-72,11). En las tablas 2–4 se muestran los resultados del análisis de regresión de Cox. Este análisis mostró que la AAP por sí misma no influyó en la aparición de RL (HR 1,68 [0,87-3,23]; p=0,12)] ni de metástasis (HR 1,31 [0,98-1,76]; p=0,064). Sin embargo, la supervivencia global fue menor con la AAP que con la RA (HR 1,37 [1,00-1,86)]; p=0,048).
Factores de riesgo para la aparición de recidiva local
| Univariado | Multivariado | |||||||
|---|---|---|---|---|---|---|---|---|
| No evento | Evento | Hazardratio | IC 95% | p | Hazardratio | IC 95% | p | |
| (n=1270) (94,5%) | (n=73) (5,4%) | |||||||
| Edad (10 años) | 6,63 (1,1) | 6,73 (1,1) | 1,12 | 0,91; 1,37 | 0, 298 | 1,07 | 0,87; 1,37 | 0,525 |
| Género (referencia: mujer) | ||||||||
| Hombre | 825 (65,0) | 46 (63,0) | 0,94 | 0,59; 1,51 | 0,805 | 0,99 | 0,62; 1,60 | 0,983 |
| Localización del tumor (referencia 7-12 cm) | ||||||||
| 0-6 cm | 568 (44,7) | 39 (53,4) | 1,45 | 0,92; 2,30 | 0,114 | 1,22 | 0,64; 2,30 | 0,547 |
| Tratamiento neoadyuvante (referencia: no) | ||||||||
| Sí | 816 (64,3) | 43 (58,9) | 0,78 | 0,49; 1,24 | 0,228 | 0,80 | 0,49; 1,29 | 0,357 |
| Estadio TNM (referencia: estadio I) | ||||||||
| (5,4%)Respuesta completa | 114 (8,9) | 2 (2,7) | 0,76 | 0,17; 3,54 | 0,730 | 0,83 | 0,18; 3,90 | 0,813 |
| (5,4%) II | 371 (29,2) | 19 (26,0) | 2,32 | 1,05; 5,12 | 0,038 | 2,42 | 1,09; 5,36 | 0,029 |
| (5,4%) III | 384 (30,2) | 43 (58,9) | 5,52 | 2,69; 11,3 | <0,001 | 5,72 | 2,78; 11,76 | <0,001 |
| Técnica quirúrgica (referencia: resección anterior) | ||||||||
| Amputación abdominoperineal | 341 (26,9) | 29 (39,7) | 1,86 | 1,16; 2,98 | 0,009 | 1,68 | 0,87; 3,23 | 0,12 |
Factores de riesgo para la aparición de metástasis
| Univariado | Multivariado | |||||||
|---|---|---|---|---|---|---|---|---|
| No evento | Evento | HazardRatio | IC 95% | P | HazardRatio | IC 95% | P | |
| (n=1118)(83,2%) | (n=225)(16,7%) | |||||||
| Edad (10 años) | 6,64 (1,15) | 6,60 (1,14) | 1,01 | 0,90; 1,13 | 0,872 | 1,01 | 0,90; 1,13 | 0,858 |
| Género (referencia: mujer) | ||||||||
| Hombre | 722 (64,6) | 149 (66,2) | 1,09 | 0,83; 1,43 | 0,551 | 1,13 | 0,85; 1,49 | 0,404 |
| Localización del tumor (referencia 7-12 cm) | ||||||||
| 0-6 cm | 487 (43,6) | 120 (53,3) | 1,47 | 1,13; 1,90 | 0,004 | 1,40 | 1,00; 1,98 | 0,052 |
| Tratamiento neoadyuvante (referencia: no) | ||||||||
| Sí | 704 (63,0) | 155 (68,9) | 1,22 | 0,92; 1,62 | 0,161 | 1,31 | 0,98; 1,76 | 0,064 |
| Estadio TNM (referencia: estadio I) | ||||||||
| Respuesta completa | 113 (10,1) | 3 (1,33) | 0,35 | 0,11; 1,14 | 0,080 | 0,30 | 0,09; 1,00 | 0,051 |
| II | 333 (29,8) | 57 (25,4) | 2,19 | 1,40; 3,42 | 0,001 | 2,25 | 1,44; 3,53 | <0,001 |
| III | 291 (26,0) | 136 (60,4) | 5,74 | 3,84; 8,58 | 0,000 | 6,01 | 4,02; 8,99 | <0,001 |
| Técnica quirúrgica (referencia: resección anterior) | ||||||||
| Amputación abdominoperineal | 289 (25,8) | 81 (36,0) | 1,63 | 1,24; 2,14 | <0,001 | 1,29 | 0,90; 1,84 | 0,116 |
Factores de riesgo para la mortalidad
| Univariado | Multivariado | |||||||
|---|---|---|---|---|---|---|---|---|
| No evento | Evento | Hazardratio | IC 95% | p | Hazardratio | IC 95% | p | |
| (n=1011) | (n=332) | |||||||
| Edad (10 años) | 6,49 (1,13) | 7,09 (1,10) | 1,56 | 1,40; 1,74 | <0,001 | 1,52 | 1,36; 1,69 | <0,001 |
| Género (referencia: mujer) | ||||||||
| Hombre | 644 (63,7) | 227 (69,9) | 1,20 | 0,95; 1,51 | 0,127 | 1,35 | 1,07; 1,70 | 0,012 |
| Localización del tumor (referencia 7-12 cm) | ||||||||
| 0-6cm | 437 (43,2) | 170 (51,2) | 1,32 | 1,07; 1,64 | 0,011 | 1,16 | 0,86; 1,56 | 0,329 |
| Tratamiento neoadyuvante (referencia: no) | ||||||||
| Si | 670 (66,3) | 189 (56,9) | 0,71 | 0,57; 0,89 | 0,002 | 0,82 | 0,66; 1,03 | 0,089 |
| Estadio TNM (referencia: estadio I) | ||||||||
| Respuesta completa | 109 (10,8) | 7 (2,11) | 0,36 | 0,16; 0,77 | 0,009 | 0,40 | 0,18; 0,88 | 0,023 |
| II | 305 (30,2) | 95 (25,6) | 1,39 | 1,01; 1,91 | 0,044 | 1,39 | 1,00; 1,91 | 0,047 |
| III | 254 (25,1) | 173 (52,1) | 2,97 | 2,24; 3,94 | <0,001 | 3,10 | 3,24; 4,12 | <0,001 |
| Técnica quirúrgica (referencia: resección anterior) | ||||||||
| Amputación abdominoperineal | 246 (24,3) | 124 (37,3) | 1,69 | 1,35; 2,11 | <0,001 | 1,37 | 1,00;1,86 | 0,048 |
Los estadios tumorales II y III influyeron negativamente en todos los resultados. La respuesta patológica completa aumentó la supervivencia global. Además, en la supervivencia global también influyeron la edad de los pacientes y el sexo masculino.
DiscusiónEste estudio pone de manifiesto que la AAP, en sí misma, no tiene influencia en la aparición de recidiva local ni metástasis, aunque sí empeora la supervivencia global de los pacientes.
La mayor debilidad de este estudio tiene que ver con la naturaleza voluntaria de inclusión de los datos en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos, sobre todo cuando se compara con los registros de los países escandinavos7,11, en los que la inclusión de datos en el registro es obligatoria, o con los estudios aleatorizados5,9,18. Sin embargo, como ya se indicó15, se han tomado diversas iniciativas para asegurar la calidad de los datos. Para evitar sesgos de inclusión, durante el periodo de admisión en el proyecto a cada hospital que solicitaba su admisión se le pedía el número de pacientes operados anualmente en los últimos 5 años. Después de su inclusión en el proyecto, una desviación del 10% en la casuística anual era revisada con el cirujano responsable. La base de datos se actualizaba continuamente y la calidad de los datos fue revisada mensualmente. Cuando se detectaba una inconsistencia (p. ej. una MRI que indicaba la invasión de la fascia visceral del mesorrecto y un estudio de enfermedad en el que no se observaba invasión del margen de resección circular), el registro solicitaba al responsable del hospital la revisión de las hojas operatorias, los informes de anatomía patológica y las fotografías de los especímenes si estaban disponibles. El seguimiento de los pacientes incluía datos de recidiva local, metástasis, segundos tumores y supervivencia/fallecimiento. La información del seguimiento se enviaba anualmente al registro por el cirujano responsable de cada hospital. Los resultados eran auditados por el coordinador del proyecto y, en ciertas instancias, por las autoridades sanitarias19.
También se puede considerar como una limitación del estudio la participación de 38 hospitales por la variabilidad de la práctica13,19. Sin embargo, los centros participantes fueron incluidos en un programa docente uniforme dirigido por el director del Norwegian Colorectal Cancer Project, y los resultados observados en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos2,20 han reproducido los de ese proyecto en 2 estudios previos11,21 y en este. Por tanto, el carácter multicéntrico refleja la validez externa del estudio.
Aunque algunos centros de referencia han mostrado que los resultados de la AAP y la RA son idénticos8,10, los resultados obtenidos de los estudios aleatorizados realizados para comparar las variables de resultado en función de la utilización de tratamientos neoadyuvantes, indican que las tasas de recidiva local y supervivencia son peores con la AAP5,22. Estos resultados peores de la AAP pueden explicarse por las dificultades técnicas de la cirugía en los tumores del tercio inferior, sobre todo en pacientes con pelvis estrechas o tumores voluminosos, y también pueden explicarse por la consideración de que la resección no debe incluir el elevador del ano.
Solo 2 artículos previos7,11 realizados con la misma metodología empleada en este estudio han evaluado la influencia de la AAP en sí misma como un factor pronóstico independiente. El Norwegian Colorectal Cancer Project11 demostró que la AAP no daba lugar a un aumento de las tasas de recidiva local aunque la supervivencia general era peor. En otro estudio realizado por el Stockholm Colorectal Cancer Study Group7 no se pudo demostrar que la AAP fuera un factor pronóstico independiente de ninguna de las variables de resultado oncológico. En este sentido, los resultados observados en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos son similares a los del Norwegian Colorectal Cancer Project.
Se ha sugerido que una operación más radical denominada «AAP extraelevadora» puede reducir el riesgo de invasión del margen de resección circunferencial y de perforación intraoperatoria al conseguir una estandarización de la técnica14. Sin embargo, en un estudio reciente editado en el marco de este proyecto, no se ha observado que esta técnica tenga ninguna ventaja sobre la AAP convencional23.
En conclusión, este estudio no ha identificado la AAP como un factor determinante de recidiva local ni de metástasis, pero sí de disminución de la supervivencia global.
FinanciaciónEste proyecto ha sido financiado con las siguientes ayudas de investigación: FIS numero: PI11/00010, y Consejería de Sanidad, Gobierno de Navarra: 20/11.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo colaborador del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos (años 2006-2009):
Virgen de la Arrixaca (Juan Luján), Bellvitge (Doménico Fraccalvieri, Sebastiano Biondo), Complejo Hospitalario de Navarra (Miguel Ángel Ciga), Clínico de Valencia (Alejandro Espí), Josep Trueta (Antonio Codina), Sagunto (María D. Ruiz), Vall de Hebrón (Eloy Espín), La Fe (Rosana Palasí), Complejo Hospitalario Ourense (Alberto Parajo), Germans Trias i Pujol (Ignasi Camps, Marta Piñol), Lluis Alcanyis (Vicent Viciano), Complejo Asistencial Burgos (Evelio Alonso), Hospital del Mar (Miguel Pera), Meixoeiro (Teresa García, Enrique Casal), Complejo Asistencial Salamanca (Jacinto García), Gregorio Marañón (Marcos Rodríguez), Torrecárdenas (Ángel Reina), General de Valencia (José Roig), Txagorritxu (José Errasti), Donostia (José A. Múgica), Reina Sofía (José Gómez), Juan Ramón Jiménez (Ricardo Rada, Mónica Orelogio), Arnau de Vilanova de Valencia (Natalia Uribe), General de Jerez (Juan de Dios Franco), Arnau de Vilanova de Lleida (José Enrique Sierra), Santa Creu i Sant Pau (Pilar Hernández), Clínico de Santiago de Compostela (Jesús Paredes), Universitario de Jaén (Gabriel Martínez), Clínico San Carlos (Mauricio García), Cabueñes (Guillermo Carreño), General de Albacete (Jesús Cifuentes), Miguel Servet (José Monzón), Xeral de Lugo (Olga Maseda), Universitario de Fuenlabrada (Daniel Huerga), Clínico y Provincial de Barcelona (Luis Flores), Joan XXIII (Fernando Gris), Virgen de las Nieves (Inmaculada Segura, Pablo Palma), Nuestra Señora de la Candelaria (José G. Díaz).
Más información sobre los participantes en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos está disponible en el anexo A.