el cribado poblacional de cáncer colorrectal (CCR) basado en la detección de sangre oculta en heces se ha demostrado efectivo en disminuir la mortalidad por esta enfermedad, si bien es importante encontrar los métodos adecuados para obtener una participación suficiente. El objetivo del estudio fue analizar los resultados clínicos de un programa piloto de cribado de CCR y las causas de rechazo. También se realizó el seguimiento de los casos falsos positivos a los 5 años.
Pacientes y métodose diseñó un estudio de corte transversal en una población diana de 2.105 personas de 50 a 74 años atendidas en un centro de asistencia primaria. La prueba de cribado fue un método inmunológico, que se remitió al domicilio de la población diana.
Resultadosla participación fue del 46,6%, el porcentaje de positividad de la prueba fue del 11,7% y la aceptación de la colonoscopia fue del 79,3%. Se diagnosticó en total a 32 pacientes con adenomas >0,4cm y a 8 con CCR.
Conclusioneslos resultados obtenidos en nuestro estudio, tanto en participación como el seguimiento a los 5 años, permiten creer en la factibilidad de un programa de cribado poblacional de la neoplasia colorrectal en nuestro país.
As colorectal cancer (CRC) screening based on occult blood detection has been shown to be effective in reducing mortality due to this disease, it is now important to decide on the best methods to obtain the maximum numbers of participants. The aim of the study was to analyse the results from a pilot CRC screening programme in a general population sample in Barcelona. A follow-up of false positive cases was made after five years.
Patients and methodA cross section of the population aged 50–74 years in one primary health care centre was studied. The screening test consisted of an immunological method for the detection of faecal occult blood which was sent to the homes of the target population.
ResultsParticipation was 46.6%, 11.7% of the tests were positive, and 79.3% agreed to have a colonoscopy. Eight adenocarcinomas and 32 patients with adenomas >0.4cm were diagnosed.
ConclusionsThe results obtained on the initial participation and the follow-up at five years suggest the viability of a CCR screening programme in our country.
El cáncer colorrectal (CCR) es una enfermedad que, por sus características biológicas y de impacto socioeconómico, cumple perfectamente las condiciones para ser objeto de cribado. La alta prevalencia de este tipo de tumor y la existencia de su precursor, el adenoma —cuyo diagnóstico y tratamiento (polipectomía endoscópica) puede alterar la historia natural de la enfermedad y mejorar su pronóstico—, justifican ampliamente los esfuerzos en la implantación de los programas de cribado poblacional1.
En la actualidad, la utilidad del cribado en la población mayor de 50 años y con riesgo medio de padecer CCR está fuera de toda duda, debido a la evidencia científica aportada tanto por los estudios prospectivos aleatorizados2–4 como por los de casos y controles5. El nivel de evidencia científica tipo A6, alcanzado con los resultados de los distintos estudios controlados, ha determinado su progresiva recomendación por la mayoría de las sociedades científicas7–12.
Por otra parte, también se dispone de estudios que analizaron la relación coste-efectividad de los programas de cribado de CCR. En ellos se ha demostrado un claro beneficio asumiendo un coste de 10.000–25.000 dólares por año de vida ganado13,14. Además, se han puesto de manifiesto otros beneficios después de la implantación de programas de cribado de CCR, que incluyen no sólo el diagnóstico precoz del CCR (prevención secundaria), sino también la disminución de la incidencia de la enfermedad (prevención primaria), la cual según el método de cribado puede oscilar entre el 2015 y el 58%16. Es por ello que el prestigioso National Polip Study Group ha estimado que, después de un programa de cribado y de un control endoscópico adecuado, podría llegar a evitarse hasta el 90% de los casos de CCR17.
Mientras en Estados Unidos el 46% de las personas mayores de 50 años están incluidas en algún programa de cribado para el CCR con un adecuado seguimiento18, en España la práctica de cribar por CCR a la población en riesgo medio es muy escasa y se limita a estudios y programas piloto con estrategias diversas19–27. En este sentido, nuestro grupo publicó los resultados correspondientes a un estudio prospectivo y aleatorizado con el objetivo de demostrar que era posible conseguir una mayor participación en un programa de cribado de CCR según la estrategia de invitación a la que era sometida la población diana23.
El objetivo del trabajo actual es presentar los resultados clínicos obtenidos a partir de la población participante en el mencionado estudio, incluyendo el seguimiento de los falsos positivos a los 5 años. También se presentan los resultados de una encuesta telefónica sobre las causas de no participar en el cribado.
Pacientes y métodoEl diseño del estudio fue un corte transversal que se llevó a cabo en el ámbito del Hospital Universitario del Mar. El periodo de reclutamiento fue entre octubre de 1998 y enero de 1999. Se escogió para este estudio a la población perteneciente a un centro de asistencia primaria de Barcelona. Como único criterio de inclusión, se estableció la edad comprendida entre 50 y 74 años.
La población diana fue de 2.105 personas. Se excluyó a 79 personas por antecedentes personales de CCR o errores de censo.
La prueba de cribado consistió en la utilización del Hexagon Obti Test®, un método inmunológico para la detección de sangre oculta en heces que se ha utilizado en otros estudios de este tipo como alternativa a los métodos químicos tradicionales28,29. Este método, basado en la detección de la hemoglobina humana, no precisa dieta previa y es específico para la detección de la sangre de origen colorrectal30. La prueba se realizó en 2 días consecutivos30. Las muestras recogidas por cada paciente tenían que ser entregadas en el centro de asistencia primaria del que dependían los participantes.
La población diana recibió en su domicilo una carta de invitación al estudio, así como la prueba de cribado junto con la información necesaria. Asimismo se les remitió un cuestionario autoaplicable para obtener información sobre síntomas colorrectales en los últimos 12 meses. A los 15 dias, se realizó una llamada telefónica de refuerzo a los que no habían respondido.
A los no participantes se les efectuó una encuesta telefónica para conocer las posibles causas de que rechazaran participar en el estudio. Las respuestas abiertas se englobaron en uno de los siguientes apartados:
- 1.
No me interesa conocer más datos sobre mi salud.
- 2.
Imposibilidad de realizar la prueba por parte del invitado. En este apartado se agruparon las respuestas de personas que habían manifestado dicha imposibilidad por diversas causas como enfermedad grave o limitante, problemas personales que no deseaban justificar, ausencia temporal por viaje, no comprender las características del estudio y/o las instrucciones, y otras respuestas cuyo sentido general permitía englobarlas en este apartado.
- 3.
Conocimiento previo de la existencia de la sintomatología y control médico adecuado ya en curso.
Las personas en que se detectó presencia de sangre oculta en heces fueron citadas para visita médica y a todos se recomendó la realización de una colonoscopia completa con sedación. La detección de cualquier afección puso en marcha los mecanismos terapéuticos adecuados a cada caso según protocolo asistencial de la Unidad de Cirugía Colorrectal del Hospital del Mar. La estadificación de los CCR detectados se presentan con la clasificación TNM31.
A los pacientes cuyo test de sangre oculta en heces fue positivo y no se halló una causa en la colonoscopia efectuada, se los consideró falsos positivos y se les propuso una nueva colonoscopia para control a los 5 años. Al igual que en estudios previos, se consideró que, para atribuir el origen de la sangre oculta en heces a un pólipo, éste debía medir más de 0,4cm32. Se dio consideración de verdaderos positivos a estos casos y aquellos en que se diagnosticó un CCR.
El estudio fue aprobado por el Comité de Ética Clínica del Hospital Universitari del Mar.
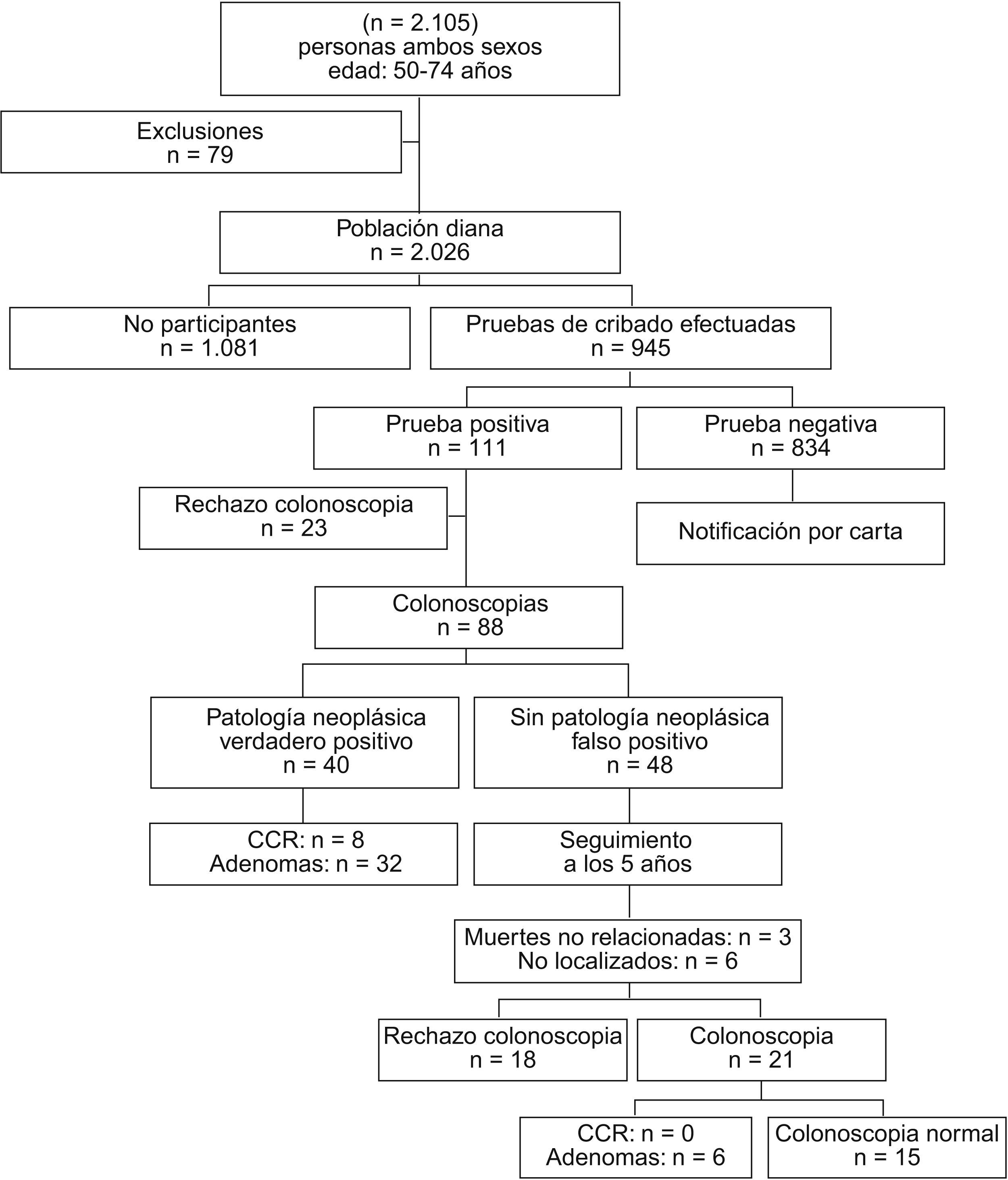
ResultadosResultado de participación y hallazgos clínicosEl total de población participante fue de 945 de las 2.026 personas que se incluyó en el estudio, lo que supuso una participación del 46,6% (fig. 1), y de ellos 881 (93,2%) lo hicieron en primera convocatoria y 64 (6,8%), tras una llamada telefónica de refuerzo.
Las personas que participaron declararon, en un 23,4%, haber observado en alguna ocasión sangre en las heces, un 44,5% había padecido hemorroides, un 11,3% tuvo fisuras anales y un 3,5% apreció emisión de mucosidad.
En 111 (11,7%) de los 945 casos, la prueba de cribado fue positiva para sangre oculta en heces. Se recomendó a todos ellos la práctica de una colonoscopia, y 23 la rechazaron. El índice de aceptación de la colonoscopia fue del 79,3%.
De las 88 colonoscopias realizadas, 87 (98,9%) fueron completas y sólo en 1 caso fue incompleta y se tuvo que realizar un estudio con enema opaco a baja repleción.
En 32 personas se detectaron uno o más pólipos >0,4cm. El número total de pólipos detectados en los 32 pacientes fue 90, de manera que el número de lesiones por paciente osciló de 1 a 14. En todos ellos se realizó una polipectomía endoscópica.
Ocho pacientes fueron diagnosticados de adenocarcinoma colorrectal, lo que supone el 9,1% de las colonoscopias efectuadas y el 8,5‰ de los participantes en el estudio. Los tratamientos practicados a estos pacientes y el resultado histopatológico fueron: 3 polipectomías endoscópicas (pTis pN0 pM0), 2 sigmoidectomías (pT1 pN0 pM0 y pT2 pN0 pM0), 2 hemicolectomías derechas (pT1 pN0 pM0 en ambos casos) y 1 hemicolectomía derecha ampliada con una hepatectomía derecha asociada por metástasis hepáticas sincrónicas (pT3 pN2 pM1). No hubo complicaciones postoperatorias reseñables en ningún caso y los pacientes fueron dados de alta con los controles adecuados a su estadificación patológica.
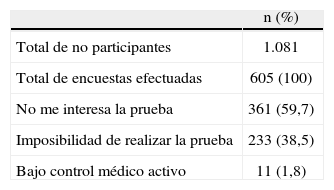
Resultados de la encuesta telefónica sobre causas de no participarSe efectuaron las llamadas a las 1.081 (53%) personas que no habían participado, (40% varones y 60% mujeres). No participaron un 51% de los varones y un 55% de las mujeres. Según edad, no participaron un 54% del grupo de 50–64 años y un 52% del grupo de 65–74 años. Fue imposible el contacto con 476 (44%) casos, después de realizar la llamada en dos ocasiones en distintas franjas horarias de previsible estancia domiciliaria.
Se localizó a 605 personas (el 56% del total), cuyas respuestas fueron englobadas en alguno de los apartados previstos en «Pacientes y método». Los resultados hallados se expresan en la tabla 1.
Seguimiento de los falsos positivos a los 5 añosA los 5 años se intentó contactar con las 48 personas que habían resultado ser falsos positivos tanto para la neoplasia colorrectal como para otra enfermedad que justificara la presencia de sangre en heces.
En 3 casos la persona había fallecido por causas no relacionadas con el CCR. En 6 casos no se pudo localizar al individuo y 18 no aceptaron repetir la colonoscopia. De las 21 personas que aceptaron una nueva colonoscopia, en 15 volvió a ser normal y en 6 se extirparon adenomas entre 0,2 y 1cm. No se detectó ningún caso de CCR.
DiscusiónEl primer punto que debe cumplir un programa de cribado para que sea efectivo en sus objetivos es alcanzar unos índices de participación adecuados. Se ha defendido que son necesarias cifras de participación superiores al 50% para alcanzar una reducción en la mortalidad secundaria a CCR33. Hay evidentes diferencias entre las cifras de participación en los programas de cribado que dependen no sólo del país donde se desarrollan, sino también de la prueba de cribado, el grado de conocimiento previo de la población y de la estrategia utilizada34.
En nuestro país son bien conocidos y aceptados los cribados para el cáncer de cérvix y de mama35. Ello sin duda está motivado por el hecho de que las autoridades sanitarias y los profesionales durante años han elaborado programas y diseñado estrategias que facilitan tanto la realización del cribado de estas enfermedades como el conocimiento y trascendencia que ello tiene para la población general. Sin embargo, no ha sucedido lo mismo hasta ahora con el CCR, lo que supone un primer obstáculo a salvar para cualquier programa de este tipo que quiera ponerse en marcha.
En nuestro estudio, la participación obtenida fue del 46,6%, cifra que pensamos es esperanzadora si tenemos en cuenta la ya mencionada falta de conocimiento previo del diagnóstico precoz de la neoplasia colorrectal. Además, hemos de tener en cuenta que no tenemos demasiadas referencias anteriores por la falta de programas de cribado de cáncer colorrectal en nuestro país35. Últimamente se han publicado los resultados preliminares del programa piloto realizado en el área de L’Hospitalet de Llobregat y llevado a cabo por el Institut Català d’Oncologia. Su participación fue del 17,2% en la primera ronda y del 22,3% en la segunda36.
Esta disparidad de cifras es demostrativa tanto de los múltiples factores que pueden condicionar la participación en estos cribados como de la posibilidad de intervenir en ella. De hecho, en la mayoría de los estudios en que se han practicado intervenciones para aumentar la participación, se ha obtenido un resultado positivo independientemente del método elegido, y es constante que la simple publicidad y conocer las ventajas del método pueden incrementar la participación, como se ha visto comparando la participación en grupos con y sin envío por correo de folletos informativos34. Asimismo, conocer la participación es imprescindible para la previsión del número de colonoscopias a realizar y comprobar si el sistema sanitario puede asumirlas adecuadamente.
Pensamos que es también importante valorar las causas de no participar en el cribado para poder corregirlas en lo posible. Al interpretar los resultados obtenidos, observamos un alto porcentaje de casos en que fue imposible contactar telefónicamente con la persona invitada (44%). Cuando se envía una carta-invitación personalizada, es imprescindible disponer de un censo actualizado y correcto.
Entre las demás causas de no participar destaca que el 56% de los encuestados da razones diversas que pueden englobarse en miedo a la prueba o desinterés. Son precisamente estas personas las que podrían cambiar de actitud ante una adecuada información sobre este tema. Menos del 2% manifiesta estar controlado por su médico de cabecera o especialista.
En nuestro estudio, la prueba de cribado fue positiva en el 11,75% (111/945). Esta cifra debe ser considerada alta si la comparamos con la obtenida en la mayoría de los estudios en que se utilizaron como prueba de cribado métodos químicos sin rehidratar (menor sensibilidad), pero muy parecida a la obtenida con las rehidratación2 o con los métodos inmunológicos como el que hemos utilizado, con los cuales se obtiene un mayor índice de positividad, y aunque obligue a solicitar un mayor número de FCS, ha demostrado su eficacia especialmente en la detección de adenomas, como se ha visto en estudios en que se han comparado ambos métodos37. Un hecho que tener en cuenta también es que casi una cuarta parte de la población estudiada tenía antecedentes de rectorragia, lo cual hace que no sea estrictamente asintomática.
Es obvio que el punto clínicamente más importante es el resultado de las colonoscopias efectuadas y qué tipo de afección se detectó. El hallazgo de 8 casos de CCR es mayor de lo esperado, tanto por los datos de prevalencia en nuestro país como de estudios parecidos2,10,22. De hecho, hubiera sido esperable una incidencia de 2-3 casos/1.000, y en cambio los casos detectados fueron 3 veces más (8,4‰). La muestra es insuficiente para sacar conclusiones en este sentido, aunque ha sido evidente un aumento de la incidencia de casos de CCR en nuestro país en los últimos años38.
Las estadificaciones de los casos de CCR detectados han sido más precoces de lo habitual en la práctica clínica. Tres casos estaban en estadio 0; 4 casos, en estadio I y sólo 1 en estadio IV, lo que está en consonancia con los datos obtenidos en la totalidad de los estudios o programas de cribado del CCR y los justifica. Sin embargo, en el cribado del CCR no sólo es importante el número de casos de cáncer que se detecta, sino que también es muy importante el número de adenomas detectados, ya que, siendo sobradamente conocida la secuencia adenoma-cáncer39, la detección de adenomas durante el cribado y la correspondiente polipectomía determinan que también estamos haciendo prevención primara del CCR. De hecho, en los últimos años, en Estados Unidos, donde la prevalencia del cribado por CCR se acerca al 50% de la poblacion mayor de 50 años, la incidencia de esta enfermedad ha empezado a disminuir15.
En cuanto el seguimiento que se realizó a los 5 años de los casos etiquetados de falsos positivos, es de destacar que no se detectó ningún cáncer y que sólo se detectaron adenomas de pequeño tamaño, lo cual demuestra la fiabilidad de la primera exploración. Si bien 18 personas de este grupo rechazaron la prueba, pensamos que es importante que 21 de ellas sí aceptaran, lo que representa un 54% de aceptación; pensamos que no es un mal dato si tenemos en cuenta que se trata de personas sanas cuya primera colonoscopia no había demostrado ninguna afección.
En conclusión, pensamos que la evidencia publicada sobre la efectividad del cribado para el CCR obliga ya a su implantación, si bien se debe asegurar, en primer lugar, una participación adecuada y, en segundo, disponer de los recursos necesarios para las colonoscopias y otros procedimientos a que la enfermedad detectada diera lugar. Los resultados obtenidos en nuestro estudio abogan por la posibilidad de iniciar un programa de estas características en nuestro país.