Introducción
Una de las interfaces más importantes tras el implante de biomateriales destinados a reparar defectos de la pared abdominal tipo hernia incisional es la peritoneal. En algunos casos, necesariamente, el biomaterial tiene que quedar en contacto con el peritoneo visceral; esta ubicación puede originar complicaciones posquirúrgicas. La formación adherencial generada en esta interfaz en respuesta a la colocación de algún biomaterial puede ser origen de obstrucción intestinal o generar complicaciones graves, en forma de fístula intestinal1-3.
En estudios in vitro realizados por nuestro grupo4, hemos observado que tras la siembra de células mesoteliales sobre diferentes prótesis, en las de tipo reticular el proceso de mesotelización era deficiente, mientras que con las de tipo laminar se obtuvieron los mejores resultados. In vivo, la mesotelización también se consigue rápidamente cuando la superficie de expansión celular es lisa. Es probable que el recubrimiento mesotelial pueda ejercer una función lubricante entre el peritoneo parietal y las vísceras, y evitar la aparición de depósitos de fibrina5 y con ello que los fibroblastos generen adherencias de forma temprana.
Debido fundamentalmente a estos comportamientos biológicos, surgieron las prótesis de última generación de tipo compuesto, que reúnen las características que debería tener una prótesis "casi ideal". Esto es, buena integración tisular, buen comportamiento peritoneal y, finalmente, buena resistencia mecánica. El componente del biomaterial destinado a estar en contacto con la vertiente peritoneal puede ser de tipo físico o químico. Estos componentes ejercen un papel de "barrera" y modulan el comportamiento de la prótesis a nivel de la interfaz visceral. Además, pueden ser biodegradables o no. Las biodegradables tienen como ventaja que a medio/largo plazo dejan menor cantidad de cuerpo extraño residual6.
El objetivo del presente trabajo fue llevar a cabo un estudio secuencial de la formación adherencial sobre varios materiales protésicos de última generación. La aplicabilidad traslacional de este estudio está relacionada en la clínica con la reparación laparoscópica de hernias ventrales.
Material y métodos
Animales de experimentación
Para el estudio se emplearon 24 conejos blancos Nueva Zelanda machos, con un peso aproximado de 2.500 g. Los animales fueron estabulados en condiciones de luz y temperatura constantes durante todo el tiempo de estudio, de acuerdo con la normativa europea vigente (CEE 2871-22 A9).
Material protésico
Los animales fueron divididos en 3 grupos de 8 animales en función del biomaterial utilizado. Se testaron 3 biomateriales de tipo compuesto, formados por una estructura reticular (no absorbible) que favorecería la integración con el tejido receptor y una lámina absorbible o no absorbible, destinada a colocarse en contacto con la vertiente peritoneal, cuya función sería evitar la formación de adherencias durante las primeras etapas del período postoperatorio. Las prótesis empleadas fueron:
Parietex Composite® (Ptx) (Sofradim, Trévoux, Francia): formada por una prótesis reticular multifilamento de poliéster y una lámina absorbible de colágeno recubierta por polietilenglicol/glicerol.
Sepramesh® (Se) (Genzyme Surgical Products, Cambridge, Estados Unidos): compuesta por una prótesis reticular de polipropileno, cubierta por una cara por una lámina absorbible de hialuronato sódico.
PL-PU99 (diseñada por nuestro grupo de investigación): constituida por una prótesis reticular de polipropileno y una lámina no absorbible de poliuretano de 26 µm de espesor.
Procedimiento quirúrgico
Previamente a la cirugía, los animales fueron anestesiados con una mezcla de clorhidrato de ketamina (70 mg/kg), diazepam (1,5 mg/kg) y clorpromazina, administrada por vía intramuscular. En algunos de los animales fue necesario administrar una dosis adicional por vía intraperitoneal durante la intervención.
Utilizando una técnica quirúrgica estéril, se crearon defectos en la pared anterior del abdomen de 7 x 5 cm, que comprendían todos los planos anatómicos (aponeurótico, muscular y peritoneal) excepto la piel. Los defectos fueron reparados fijando una prótesis del mismo tamaño a los bordes de éstos con una sutura continua de polipropileno de 4/0.
Se sacrificó a los animales a los 14 días postimplante.
Estudio laparoscópico
Tras la cirugía, los animales fueron de nuevo anestesiados a los 3, 7, y 14 días, y sometidos a un estudio mediante laparoscopia secuencial, con el fin de evaluar el grado y la evolución de la formación de adherencias.
La técnica se realizó mediante la inserción de un trocar metálico de 3,5 mm (Karl Storz) a través de una incisión de 0,5-0,6 cm, en la vertiente lateral derecha del abdomen, para inducir el neumoperitoneo y, posteriormente, introducir una óptica de 3 mm (Karl Storz, Tuttlingen, Germany).
El neumoperitoneo se realizó con CO2 a una presión máxima de 8 mmHg. Las pequeñas incisiones realizadas en la pared del abdomen, para el seguimiento laparoscópico de cada animal, se realizaron de nuevo en cada uno de los períodos de estudio.
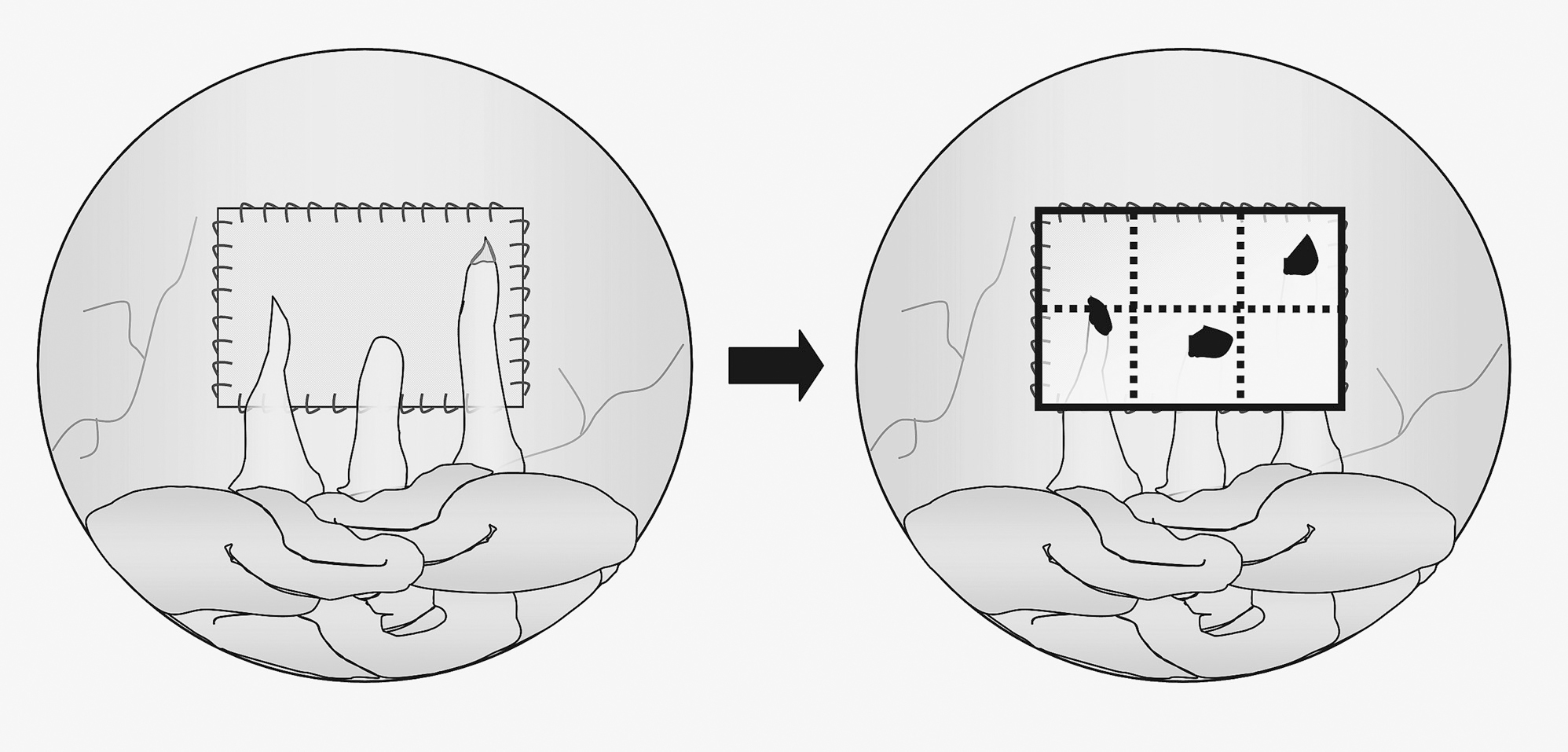
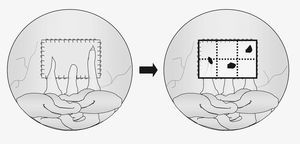
El procedimiento fue grabado en vídeo para facilitar la evaluación de los datos. El biomaterial fue dividido visualmente en 6 cuadrantes para determinar el porcentaje de superficie cubierta por las adherencias y trasladadas a plantillas de polietileno del mismo tamaño que la prótesis (fig. 1). Posteriormente, esas plantillas eran sometidas a análisis de imagen, empleando un aparato computarizado (MICRON, Barcelona, España). Los resultados se expresan como el porcentaje de la superficie del implante ocupada por adherencias, del 0% al 100% (sin adherencias o completamente cubierto por adherencias). Se determinaron las estructuras intraabdominales adheridas, epiplón o intestino, su situación y el aspecto de los implantes.
Fig. 1. Representación esquemática de la valoración de la formación de adherencias.
Las adherencias se clasificaron, tomando como parámetro principal su consistencia, en: a) laxas, de aspecto transparente y de fácil sección; b) firmes, de aspecto blanquecino y más difíciles a la sección, y, c) integradas en la interfaz prótesis/peritoneo visceral, con difícil plano de disección entre el biomaterial y la serosa intestinal.
Estudio morfológico
Se tomaron muestras de la interfaz prótesis/peritoneo visceral y prótesis/tejido receptor para su estudio histológico a microscopia óptica y electrónica de barrido.
Para los estudios de microscopia óptica, las piezas se fijaron en líquido de Bouin, incluidas en parafina, cortadas en secciones de 5 µm y teñidas con hematoxilina-eosina o tricrómico de Masson (variedad Goldner-Gabe). Por último, se observaron en un microscopio Zeiss Axiophot (Carl Zeiss, Oberkochen, Alemania).
Para la microscopia electrónica de barrido, las muestras se fijaron en glutaraldehído al 3% (2 h), y después de mantenerlas al menos 2 h en tampón Milloing (pH 7,3), se deshidrataron en una serie gradual de acetonas. El punto crítico se llevó a cabo en un Polaron E-3000 (Polaron Ltd, Reino Unido). Por último, las piezas fueron metalizadas con oro-paladio y estudiadas en un microscopio Zeiss DSM-950 (Carl Zeiss, Oberkochen, Alemania).
Morfometría del peritoneo
El espesor del peritoneo neoformado en cada uno de los implantes se evaluó mediante un estudio morfométrico de 25 secciones histológicas (5 µm) por grupo, empleando un analizador de imagen computarizado (MICRON).
De cada sección tisular se tomaron 2 medidas al azar del espesor del neoperitoneo, delimitado por los filamentos de la prótesis y el mesotelio neoformado.
Análisis estadístico
El porcentaje de adherencias sobre la superficie protésica y el espesor del neoperitoneo, para los diferentes grupos de estudio (media ± desviación estándar), se compararon utilizando la prueba de la U de Mann-Whitney. Todos los análisis estadísticos se realizaron con el programa Statgraphics plus 5.1 para Windows. Los valores de probabilidad (p) < 0,05 se consideraron estadísticamente significativos.
Resultados
No se observaron signos de infección o rechazo en ninguno de los implantes realizados. En dos de los animales (uno al que se le realizó un implante con Ptx, y otro que había recibido uno de PL-PU99) se observó por laparoscopia un seroma situado entre los dos componentes de la prótesis.
Laparoscopia secuencial
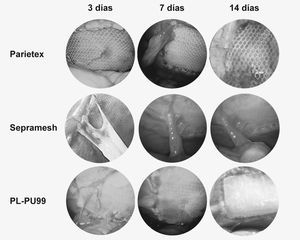
Mediante el estudio por laparoscopia pudo constatarse la formación de adherencias de tipo laxo, durante los primeros 3 días postimplante, en los diferentes biomateriales estudiados.
En los defectos reparados con Ptx, estaban formadas fundamentalmente por epiplón, intensamente vascularizadas y localizadas en el tercio superior del implante, coincidiendo en algunos casos con la zona de fijación al tejido receptor.
La vertiente peritoneal del Se presentó adherencias en las que sólo se encontraba implicado el epiplón o el epiplón y las asas intestinales.
Tanto en las prótesis de Ptx y de Se el componente absorbible era claramente visible, sin que se apreciaran alteraciones macroscópicas en cuanto a su estructura.
Los implantes realizados con PL-PU99 mostraron un aspecto similar en cuanto a la formación de adherencias al de los realizados con Ptx. Las adherencias fueron escasas y se localizaban cerca de las suturas. Estaban constituidas por delgadas franjas de tejido fibroso en las que destacaba una importante vascularización.
Entre los 3 y los 7 días se producía un ligero incremento en la extensión del material adherido. Su consistencia era más compacta y podía apreciarse una red vascular más desarrollada.
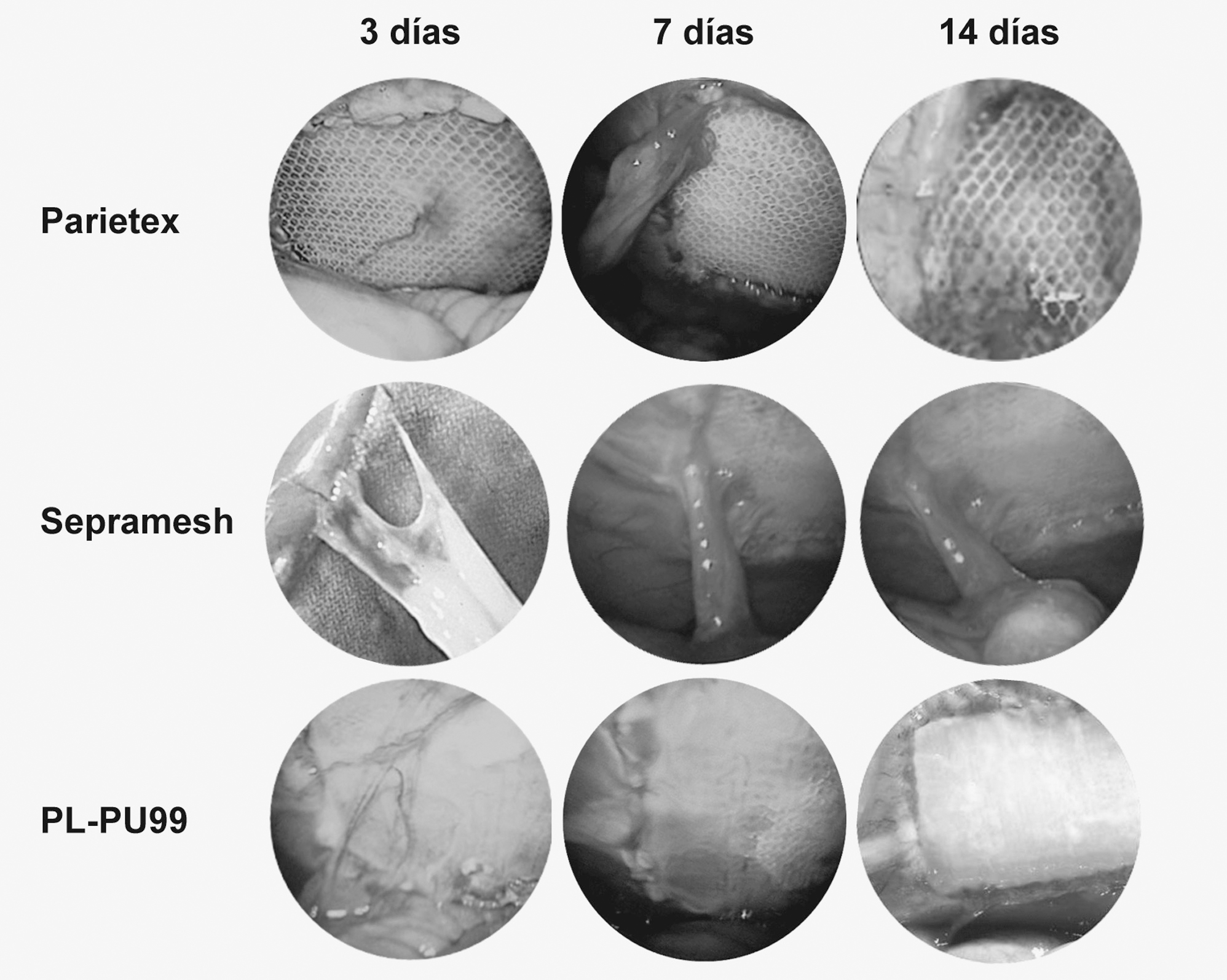
A las 2 semanas, no se apreciaron diferencias en cuanto a su extensión respecto a los 7 días, aunque sí en su consistencia y grado de adhesión, puesto que aparecían fuertemente unidas a la superficie protésica (adherencias de tipo firme) (fig. 2).
Fig. 2. Formación adherencial. Imágenes obtenidas mediante laparoscopia secuencial.
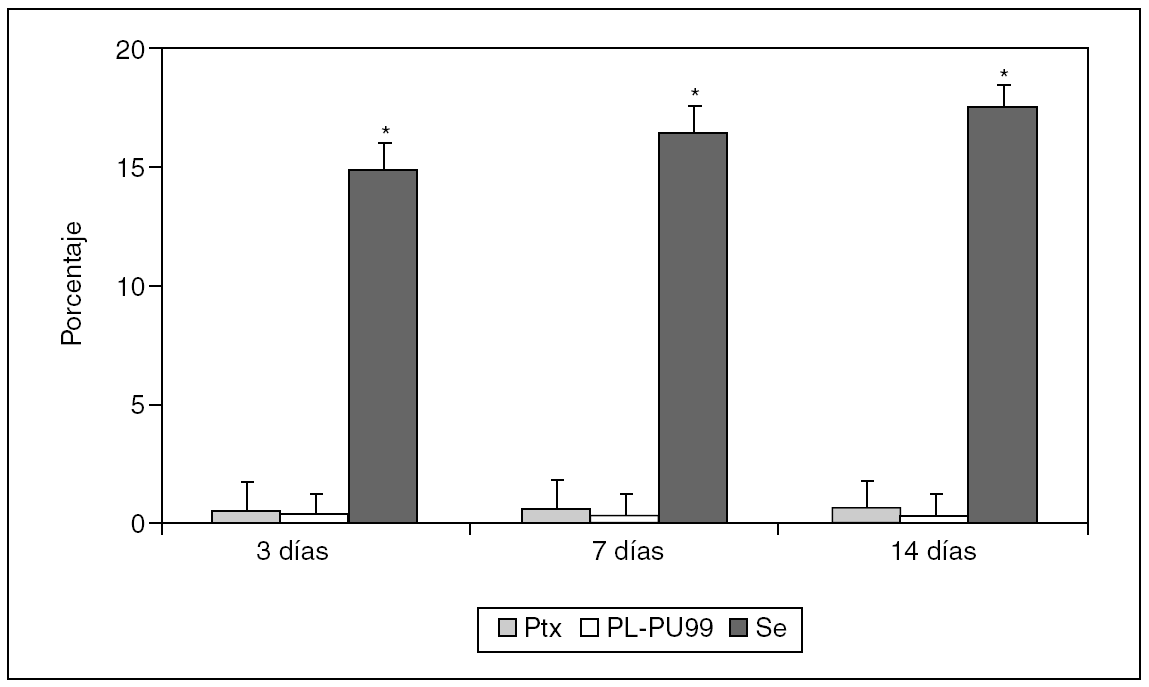
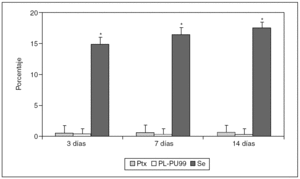
La cuantificación del porcentaje de adherencias para un mismo biomaterial y tiempo de estudio no mostró diferencias estadísticamente significativas. Al comparar los diferentes tipos de prótesis empleados, el porcentaje de adherencias fue significativamente menor en los implantes realizados con Ptx y con PL-PU99 (0,55 ± 0,06% y 0,27 ± 0,20%, respectivamente); los implantes realizados con Se (18,55 ± 1,96%) generaron un mayor número de adherencias (fig. 3).
Fig. 3. Cuantificación del porcentaje de adherencias en cada una de las prótesis y tiempos de estudio. Se observaron diferencias estadísticamente significativas entre el Ptx y PLPU99 respecto al Se (*p < 0,05).
Estudio morfológico
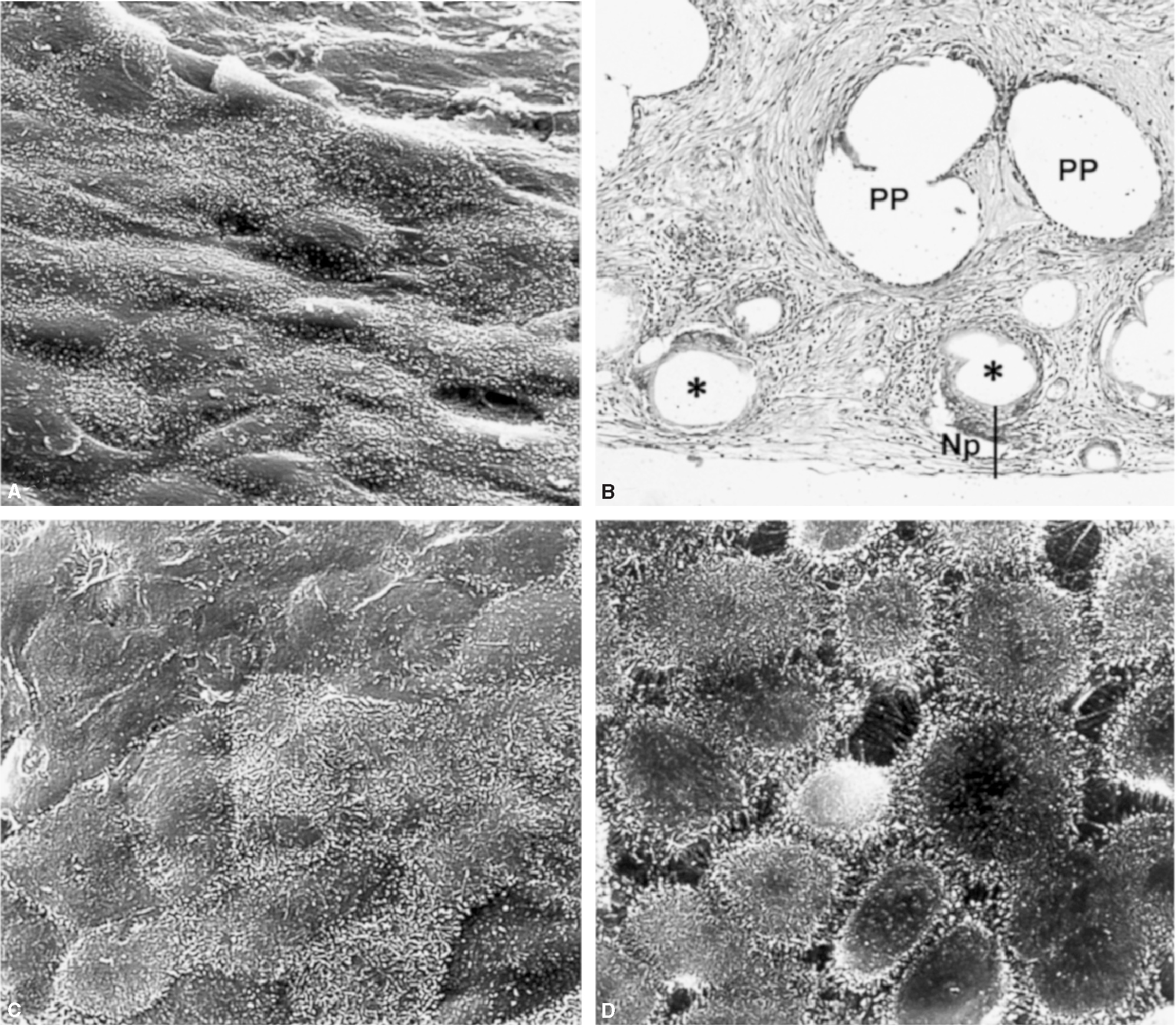
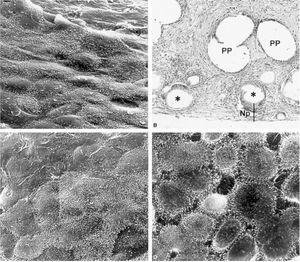
A microscopia óptica, los filamentos de los implantes realizados con Ptx se encontraban completamente infiltrados por un tejido de cicatrización compacto. La lámina absorbible de polietilenglicol/glicerol, que, aunque claramente visible, mostró algunos signos de degradación, aparecía rodeada por numerosas células inflamatorias. El neoperitoneo estaba formado por tejido conectivo laxo, muy vascularizado y organizado de forma paralela a la superficie laminar (fig. 4A).
Fig. 4. A: capa mesotelial formada sobre la vertiente peritoneal de una prótesis de Ptx (31.000). B: imagen a microscopia óptica de un corte transversal de un defecto reparado con Se (x100). C: Se, mesotelio (x1.000). D: células mesoteliales secretoras de un implante de PL-PU99 (x1.000). Np: neoperitoneo; PP: polipropileno; *: restos de ácido hialurónico.
En los implantes realizados con Se, las fibras de colágeno se disponían de forma concéntrica a los filamentos de las prótesis y adquirían un aspecto más desordenado en las zonas que quedaban entre las fibras de la prótesis. A diferencia del Ptx, en este caso el componente absorbible presentaba signos evidentes de absorción, del cual quedaban pequeños restos en los bordes de las cavidades previamente ocupadas por la lámina de hialuronato sódico (fig. 4B y C).
El comportamiento en cuanto a la integración del polipropileno en los implantes de PL-PU99 fue similar al observado en el Se. Sin embargo, la lámina de PU, al carecer de porosidad, no es colonizada por las células y aparecía rodeada por una cápsula de tejido conectivo (fig. 4D).
En todos los grupos, el neoperitoneo formado sobre la prótesis a los 14 días presentaba numerosos vasos sanguíneos y se encontraba tapizado por una monocapa de células mesoteliales. Los valores obtenidos cuando se cuantificó su espesor fueron muy variables: Ptx, 276,89 ± 38,87 µm; Se, 84,49 ± 19,05 µm, y PL-PU, 474,86 ± 47,52 µm, y se observaron diferencias significativas entre todos ellos (p < 0,05).
Discusión
La reparación de hernias incisionales empleando el abordaje laparoscópico requiere la utilización de materiales apropiados con el fin de obtener un óptimo comportamiento en la interfaz peritoneal. Inicialmente, estas reparaciones se han efectuado mayoritariamente mediante prótesis de tipo laminar como el PTFE7,8, aunque en los últimos años se han utilizado también prótesis derivadas de colágeno porcino9; en ambos casos se han obtenido buenos resultados en cuanto a formación adherencial. De hecho, en los pacientes en los que fue necesario realizar una reintervención tras su implante10, la superficie protésica se encontraba bien mesotelizada y desprovista de adherencias.
Actualmente, existen otros materiales protésicos compuestos, que podrían ser útiles en cirugía laparoscópica de la hernia ventral. Este tipo de biomateriales ha demostrado su utilidad en cirugía abierta, cuando es necesario que el biomaterial quede en contacto con el peritoneo visceral11.
Los trabajos de investigación clásicos requieren múltiples animales para testar el comportamiento de un biomaterial a tiempos predeterminados. La laparoscopia permite realizar el estudio evolutivo en un mismo animal, por lo que se puede seguir desde tiempos muy precoces el progreso y la formación adherencial. El primer estudio experimental de este tipo en animal pequeño fue realizado por Baptista et al12.
Durante nuestro estudio laparoscópico, no se produjo morbilidad ni mortalidad en los animales, a pesar de haber empleado presiones intraabdominales de 8 mmHg de CO2. Otros autores trabajan con presiones solamente de 3 mm13 e incluso realizan insuflaciones sin control manométrico con aire ambiente14.
Observamos la presencia de seroma entre el componente laminar de la prótesis de Ptx y PL-PU99 en 2 animales pero no en el Se. En general, a pesar de que las dos partes del biomaterial de las prótesis que llevan una barrera lámina (Ptx y PL-PU99) estén bien selladas, podrían separarse, produciéndose la acumulación de líquido entre sus componentes. Cuando el segundo material es una barrera de tipo químico, como ocurre con el ácido hialurónico del Se, se consigue una impregnación en forma de gel sólido, más resistente a la separación. Sin embargo, este hecho no influye en el proceso de mesotelización, ya que fue homogéneo en los tres materiales.
Un hallazgo que consideramos importante es la evolución en la formación adherencial. En todos los implantes fue visible ya a los 3 días la presencia de adherencias. En algunos implantes hubo un pequeño incremento en la formación adherencial hasta los 7 días, pero no se observaron diferencias significativas entre los 7 y los 14 días en ninguna de las 3 prótesis. De acuerdo con otros autores15, consideramos que los primeros 7 días son clave en la formación adherencial. En nuestro modelo, las adherencias coinciden, en la mayoría de los casos, con las zonas periféricas del implante, donde se encuentra la sutura de polipropileno de fijación de la prótesis. No hemos observado formación adherencial en las zonas centrales de los implantes, por lo que es posible suponer que las adherencias se localizan en las zonas en las que no se ha completado la mesotelización. Aunque no hemos efectuado estudios con un tiempo superior a los 14 días, otros autores no han encontrado un incremento en la formación de adherencias, incluso realizando implantes con prótesis con un alto índice de formación adherencial, como el polipropileno12,14.
Otro hecho destacable es la gran angiogénesis generada en las zonas de adherencias durante los primeros tiempos de estudio. Este hallazgo ya fue comunicado por algunos autores12 y por nosotros mismos16 en otro modelo experimental de formación adherencial. Estudios llevados a cabo por Thaler et al17 han demostrado la influencia del factor angiogénico en la formación de adherencias. Otros autores18, empleando inhibidores de la angiogénesis, han sido capaces de modular la formación adherencial. Probablemente el diseño de materiales a los cuales se incorpore un factor antiangiogénico podría tener un efecto modulador en la formación de adherencias, y con ello mejorar el comportamiento peritoneal.
El espesor del neoperitoneo fue superior en las prótesis de Ptx y PL-PU99, lo que podría explicar por qué la formación adherencial fue significativamente menor que en el Se. Posiblemente, las barreras de poliglicólico y poliuretano sean más estables que la de ácido hialurónico y permitan un mejor depósito mesotelial. De este modo, la prematura degradación del recubrimiento del Se y el menor espesor del neoperitoneo podrían explicar la mayor formación de adherencias. Resultados similares obtuvieron Judge et al19 en un trabajo reciente utilizando Ptx y Se.
En conclusión, después de nuestro estudio podemos afirmar que: a) el comportamiento peritoneal fue excelente en las 3 prótesis compuestas ensayadas, aunque se observó una mayor formación adherencial en los implantes de Se; b) el período crítico en la formación adherencial se produce durante la primera semana, y c) los 3 biomateriales podrían emplearse en la reparación de hernias ventrales utilizando el abordaje laparoscópico.
Correspondencia: Dr. J.M. Bellón.
Departamento de Cirugía. Facultad de Medicina. Universidad de Alcalá.
Ctra. Madrid-Barcelona, Km 33,600. 28871 Alcalá de Henares. Madrid. España.
Correo electrónico: juanm.bellon@uah.es
Manuscrito recibido el 15-6-2007 y aceptado el 25-7-2007.