El envejecimiento global de la población ha propiciado que el paciente con posible indicación quirúrgica acumule más enfermedades crónicas (comorbilidades) con el consiguiente incremento del riesgo de sufrir complicaciones perioperatorias. Una de las complicaciones más frecuentes es el síndrome confusional agudo o delirium, cuyas consecuencias son devastadoras: mayor mortalidad y riesgo de complicaciones médicas durante el ingreso y aumento de riesgo de deterioro funcional, institucionalización y desarrollo de deterioro cognitivo a largo plazo entre otras. Debido a esto, con el objetivo de optimizar los resultados quirúrgicos, es fundamental identificar a los pacientes en riesgo de desarrollar delirium para realizar una correcta prevención así como un precoz tratamiento. En el presente artículo revisamos la evidencia actual sobre el manejo del delirium postoperatorio en el paciente anciano.
With the progressive aging of the population surgical candidates have more comorbidities resulting in a higher risk to develop postoperative complications. One of the most frequent postoperative complications in the elderly is acute confusional state or delirium, which may have devastating consequences: higher mortality, and risk of medical complications during admission and, a higher risk of functional decline, institutionalization, and cognitive impairment at discharge. For all these reasons and with the aim of optimising surgical procedures, it is essential to identify patients at risk of delirium in order to take appropriate preventive action and provide early treatment. In the present article we review the current evidence on the management of postoperative delirium in the elderly.
El rápido envejecimiento de la población ha conducido a que aparezca un nuevo tipo de paciente quirúrgico diferente del tradicional, con la coexistencia de diferentes enfermedades crónicas, numerosos fármacos (polifarmacia) y con menor reserva funcional, lo que le hace más susceptible en situaciones de estrés, aumentando el riesgo de sufrir complicaciones perioperatorias como el delirium o síndrome confusional. Todo lo anterior influirá sobre las decisiones quirúrgicas más allá del mero dato de la edad cronológica y representa un claro desafío para el cirujano1.
El delirium se define como un síndrome confusional agudo con cambios en la atención y la cognición y su presentación clínica varía desde el paciente con una importante agitación psicomotriz hasta aquel en situación letárgica o hipoactiva2. Debido a su fluctuación clínica y la variedad de instrumentos de detección utilizados en los estudios, hay una gran heterogeneidad de los criterios de inclusión de las muestras de pacientes, condicionando esto la investigación epidemiológica. De hecho, cerca del 50% del delirium en pacientes ingresados puede pasar desapercibido tanto a nivel clínico como administrativo3. El delirium postoperatorio (DPO) es muy frecuente en ancianos hospitalizados; su prevalencia es del 37-46% en pacientes quirúrgicos y puede llegar al 80% en UCI4. La aparición de DPO depende del estrés que suponga la intervención quirúrgica. Así, aunque en las intervenciones de cataratas puede ser del 4%, en la cirugía cardíaca puede llegar al 73%. En cirugía electiva ortopédica llega al 15%, y al 26% en cirugía intestinal no urgente5. La aparición del delirium se ha relacionado con una mayor mortalidad6–9, aparición de sepsis10, estancias hospitalarias más largas, aumento de costes11, institucionalización6,12–14, peor recuperación funcional13 y peor calidad de vida15. A largo plazo se asocia con disfunción cognitiva y demencia16–18. De hecho en pacientes con demencia que sufren delirium la velocidad de deterioro cognitivo puede llegar a triplicarse19. El desarrollo de delirium puede convertir a un paciente frágil en dependiente, lo que implica un elevado impacto económico global, con costes similares a la diabetes o las caídas2,20.
La identificación del paciente en riesgo de desarrollar delirium permitirá al cirujano seleccionar al que precisa mayor atención y minimizará las consecuencias postquirúrgicas no deseadas.
Fisiopatología y etiologíaLa fisiopatología del DPO no se conoce en profundidad debido a la gran heterogeneidad en sus mecanismos patogénicos y a la dificultad de disponer de modelos experimentales fiables. En la actualidad, el modelo con mayor capacidad de integrar los diversos factores de riesgo del delirium se apoya en el concepto de «reserva cerebral» como capacidad del sistema nervioso central para responder de manera funcionalmente flexible a las agresiones. Cualquier situación que modifique el metabolismo cerebral puede suponer una modificación neuroinflamatoria, habitualmente asociada a la liberación de citoquinas, medidadores inflamatorios, estrés oxidativo y eventual alteración de la síntesis de neurotransmisores21,22. Este modelo permite «una vía común final» que provoca los síntomas centrales. Las neuronas particularmente sensibles al estrés oxidativo son las colinérgicas, dopaminérgicas, histaminérgicas, noradrenérgicas y serotoninérgicas. Según el neurotransmisor y su ruta de síntesis esto puede condicionar un aumento o disminución de su disponibilidad siendo la situación más frecuente en delirium la hiperdopaminérgica e hipocolinérgica23. Las agresiones o situaciones que pueden modificar el metabolismo cerebral y, con ello, precipitar el desarrollo del DPO son muy variadas pero podemos ver resumidas las principales en la tabla 1.
Principales etiologías del delirium postoperatorio
| Infección |
| Fiebre |
| Inflamación |
| Trauma |
| Disminución del gasto cardíaco (insuficiencia cardiaca, arritmias, hemorragia) |
| Hipoxemia |
| Vascular (ictus, hipertensión arterial) |
| Alteraciones metabólicas o endocrinopatías (Diabetes, uremia, mixedema, tiroides, cushing), deshidratación y alteraciones hidroelectrolíticas |
| Déficit de vitaminas (Tiamina- Wernicke-Korsakoff) |
| Sistema Nervioso Central: epilepsia, tumores, abscesos |
| Desnutrición |
| Dolor |
| Inmovilización |
| Iatrogenia |
| Anemia |
| Modificación del patrón sueño-vigilia |
| Estreñimiento |
| Retención aguda de orina |
| Abstinencia de sustancias (alcohol, benzodiacepinas) |
| Fármacos: sedantes e hipnóticos, antihistamínicos, antiparkinsonianos, antidepresivos tricíclicos, neurolépticos, antiarrítmicos, opiáceos, fentanilo, anticolinérgicos, esteroides, etc. Adición de fármacos con actividad anticolinérgica o actividad en el sistema nervioso central |
En negrita aparecen los desencadenantes más frecuentes en el paciente anciano.
Identificar a tiempo a los ancianos con factores de riesgo para desarrollar delirium permitirá iniciar medidas de soporte con las que se ha demostrado prevenir la aparición y la gravedad del mismo3,21.
En 1993 Inouye creó un modelo de predicción del delirium en pacientes ancianos con dolencias médicas24 y, posteriormente, se han desarrollado diferentes modelos en el paciente quirúrgico12,25–27 como podemos ver en la tabla 2. La heterogeneidad de los factores incluidos recalca la dificultad de generalizar un modelo único.
Resumen de modelos predictivos de delirium postoperatorio
| Estudio | Tipo de patología | Criterios |
| Inouye 199324 | Patología médica | -Gravedad de enfermedad (APACHE II)-MMSE <25-BUN/Creatinina >17-Déficit visual |
| Marcantonio 199412 | Cirugía no cardíaca | -Fármacos preoperatorio-Alcohol y tabaco-Historia de enfermedad aguda o crónica-Enfermedad neurológica o psicológica-Historia de delirium previo |
| Freter 200525 | Cirugía ortopédica programada | -Edad-AVD-Deterioro cognitivo-Déficit sensorial-Abuso de sustancias |
| Kalisvaart 200626 | Fracturas de cadera | -Gravedad de enfermedad (APACHE II)-MMSE <25-Déficit visual-BUN/Creatinina >17 (mejores que este eran la edad y el ingreso urgente) |
| Rudolph 200927 | Cirugía cardíaca | -MMSE (24-27; <24)-Historia de ictus/AIT-GDS >4-Albúmina baja |
APACHE II: escala diseñada para medir la severidad de las enfermedades en pacientes adultos; AVD: actividades de la vida diaria, la dependencia para estas actividades constituye un marcador de mal pronóstico; BUN: nitrógeno ureico en sangre; GDS: Global Deterioration Scale de Reisberg, se utiliza para evaluar la gravedad del deterioro cognitivo; MMSE: MiniMental State Examination o Test de Folstein, es un cuestionario de treinta puntos que se utiliza como screening de deterioro cognitivo.
Es probable que los mejores métodos para predecir el DPO sean los índices de fragilidad, que caracterizan al anciano con un exceso de vulnerabilidad al estrés quirúrgico28 y la realización de una valoración geriátrica integral. Entre los parámetros que cuantifican los índices de fragilidad destacan algunos como niveles de actividad física, fuerza y resistencia o velocidad de marcha28. Algunos trabajos han demostrado la asociación entre fragilidad y riesgo de complicaciones postoperatorias, aunque no existe, por el momento, ningún índice de fragilidad consensuado de manera internacional29. Más allá de la capacidad de predicción de complicaciones, el conocimiento de la fragilidad en el paciente quirúrgico puede ayudar a tomar decisiones, pues estos pacientes tienen una menor expectativa de vida.
Una revisión30 de los diferentes factores de riesgo de DPO los clasifica según 3 variables:
- -
Rapidez con que actúa la etiología del delirium: mayor riesgo de DPO en cirugía urgente26.
- -
Tipo de cirugía: cada tipo de cirugía tiene su propia idiosincrasia y factores implicados como, por ejemplo, los descritos para cirugía cardíaca, cirugía mayor abdominal o urológica. Otro factor es la envergadura del procedimiento que actúa como desencadenante del delirium: es más prevalente el DPO en pacientes tratados con cirugía aórtica que con otras cirugías vasculares31–33.
- -
Características del paciente:
Edad avanzada12,26
Deterioro cognitivo previo1,12,30.
Depresión y optimismo prequirúrgico30
Género másculino34
Aterosclerosis aórtica y coronaria35
Tabaco34
Comorbilidad34
Ingesta preoperatoria de fármacos: más de 336; con actividad en sistema nervioso central37; benzodiacepinas; con efecto anticolinérgico38; resultados conflictivos con estatinas39; exceso de sedación40
Consumo de alcohol12
Situación funcional12
Anemia o leucocitosis36
Estado nutricional36
Alteraciones del sodio, potasio, glucosa o de la proteína C reactiva (PCR)12
Índice de masa corporal bajo41
La valoración global preoperatoria de un paciente con riesgo de desarrollar delirium puede condicionar la decisión de realizar o no una intervención quirúrgica, o de realizarla de manera ambulatoria o mediante ingreso hospitalario.
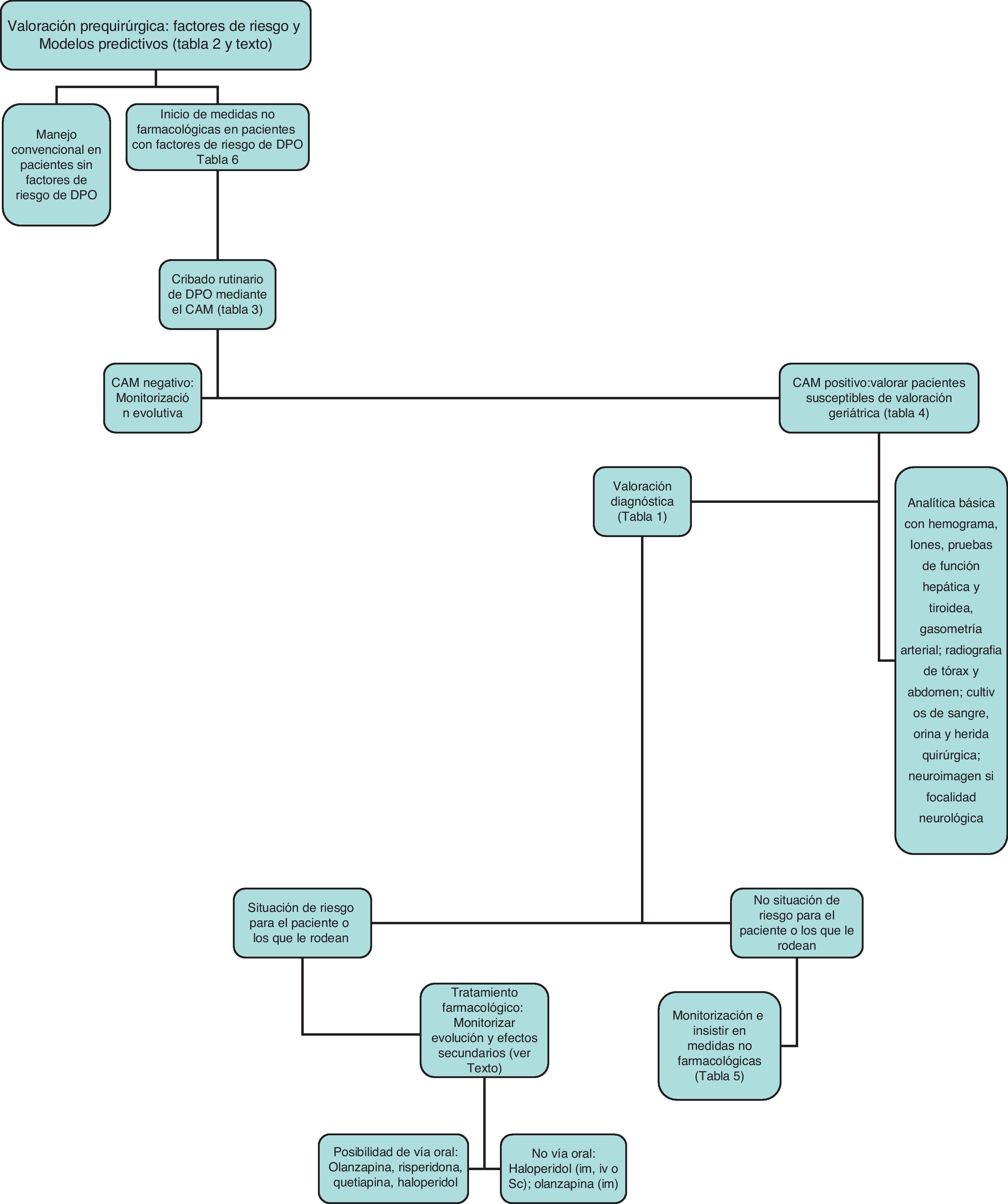
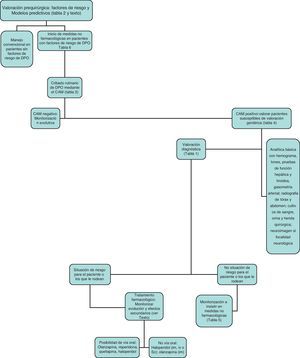
Proponemos el algoritmo diagnóstico-terapéutico de la figura 1 como una aproximación inicial que habrá que individualizar según las diferentes circunstancias.
Aproximación diagnósticaEl delirium es un diagnóstico clínico. Corresponde a una situación cerebral aguda y habitualmente transitoria y fluctuante, que se desarrolla en un corto periodo de tiempo, caracterizada por una alteración del nivel de conciencia y cognitivo, con dificultad para centrar, mantener o modificar la atención. Otros síntomas habituales son déficits cognitivos, alteraciones del sueño o perceptivas, de la actividad psicomotora o neuroconductuales y modificaciones afectivas. Según el nivel de actividad motora42 el más fácil de objetivar es el tipo hiperactivo, habitualmente asociado a agitación psicomotriz, pero el que peor pronóstico tiene y suele ser infradiagnosticado es el hipoactivo (enlentecimiento psicomotor, cambios cognitivos, somnolencia, alteraciones perceptivas). En la mayor parte de las ocasiones suele existir una mezcla de ambos42.
El delirium es una situación de urgencia médica y su diagnóstico precoz nos permitirá un tratamiento rápido e integral, evitando las posibles complicaciones. Por lo tanto, deberíamos intentar que todos los pacientes ancianos con factores de riesgo fueran evaluados sobre la presencia de delirium al menos de manera diaria.
Los primeros criterios diagnósticos se publicaron en el Diagnostic Statistical Manual III (DSM III) en 1980, ajustados en 1987 con el DSM-III-R y en 1994 (DSM-IV). Los criterios actuales son los del DSM-IV-TR43 (tabla 3).
Criterios DSM-IV TR para el diagnóstico de delirium43 y Confusion Assessment Method (CAM)
| DSM-IV TRA. Alteración de conciencia con reducción de la capacidad de focalizar, mantener o cambiar la atención |
| B. Cambios en las funciones cognoscitivas (como déficit de memoria, desorientación, alteraciones de lenguaje) o presencia de una alteración perceptiva que no se explica por la existencia de una demencia previa o en desarrollo |
| C. La alteración se presenta en un corto período de tiempo (habitualmente en horas o días) y tiende a fluctuar a lo largo del día |
| D. Demostración a través de la historia, de la exploración física y de las pruebas de laboratorio de que la alteración es un efecto fisiológico directo de una enfermedad médica, por intoxicación o abstinencia de sustancias o debido a múltiples etiologías |
| CAM |
| 1. Comienzo agudo y curso fluctuante |
| ¿Ha observado un cambio agudo en el estado mental del paciente? |
| Si la contestación es No, no seguir el cuestionario |
| 2. Alteración de la atención |
| ¿El paciente se distrae con facilidad o tiene dificultad para seguir una conversación? |
| Si la contestación es No, no seguir el cuestionario |
| 3. Pensamiento desorganizado |
| ¿El paciente manifiesta ideas o conversaciones incoherentes o confunde a las personas? |
| 4. Alteración del nivel de conciencia |
| ¿Está alterado el nivel de conciencia del paciente (vigilante, letárgico, estuporoso)? |
| Para el diagnóstico de delirium son necesarios los dos primeros criterios y por lo menos uno de los dos últimos. |
Para confirmar los criterios diagnósticos establecidos previamente utilizaremos una serie de instrumentos cuya elección variará según nuestra disciplina médica y el tiempo disponible. Hasta hace poco existía cierta heterogeneidad en dichos instrumentos pero actualmente el más utilizado es el Confusion Assessment Method (CAM) o el Confusion Assessment Method-Intensive Care Unit (CAM-ICU) para valorar pacientes en cuidados intensivos44. El CAM se diseñó en 1990 para facilitar el diagnóstico de delirium en un hospital general a profesionales no especializados en psiquiatría, a partir de los criterios DSM-III-R. Ha sido traducido a diez idiomas, téoricamente cuesta unos cinco minutos realizarlo, tiene una sensibilidad del 94-100%, especificidad del 90-95% y su validación al español ha demostrado igualmente fiabilidad, fácil manejo, adecuado valor predictivo y validez convergente45 (tabla 3). Se aconseja un entrenamiento previo y hay un manual para facilitar su utilización (http://elderlife.med.yale.edu/pdf/The%20Confusion%20Assessment%20Method.pdf).
El CAM-ICU es una herramienta útil en el paciente en cuidados intensivos46. Combina la valoración del nivel de consciencia-sedación con una evaluación de la función mental, atención, pensamiento desorganizado y alteración del nivel de consciencia. Para valorar el grado de sedación el CAM-ICU utiliza la puntuación del Richmond Agitation and Sedation Score, escala de 10 puntos que proporciona niveles de sedación y agitación47. El beneficio del CAM-ICU es que proporciona una valoración breve y sencilla que puede ser cumplimentada por médicos y enfermeras y también ha sido validada para el español48.
La aplicación de estos criterios diagnósticos lleva a entender como una dicotomía la presencia o ausencia del síndrome, cuando la realidad es que existe una solución de continuidad desde el paciente sin clínica al que presenta todos los criterios diagnósticos. Algunos autores prefieren decantarse por una cuantificación más gradual, que a su vez permite una monitorización evolutiva desde el inicio del cuadro clínico. Uno de estos instrumentos es el Delirium Rating Scale Revised-98 (DRS-R-98), validada para el español por Fonseca et al.49.
Algunos trabajos realizados en ámbitos quirúrgicos diferencian como entidad distinta del delirium la disfunción cognitiva postoperatoria (DFCPO), que puede ocurrir hasta en el 75% de los pacientes sometidos a cirugía cardíaca al alta hospitalaria y puede persistir hasta en un tercio a los seis meses. La disfunción cognitiva postoperatoria se caracteriza por un declinar en la función cognitiva tales como memoria, capacidad de concentración y procesamiento de la información50. También se asocia a mayor estancia en intensivos y en planta51, mayor dependencia tras el alta, mayores dificultades en la rehabilitación y más reingresos. No se saben las causas de la DFCPO pero la edad, el nivel educativo, deterioro cognitivo previo, abuso de alcohol y gravedad de enfermedades coexistentes son factores de riesgo reconocidos52.
Otra entidad diferenciada es el delirium subsindrómico, es decir, aquel cuadro de delirium en el que no llegan a cumplirse todas las premisas para el diagnóstico. Es una entidad también prevalente y con importantes consecuencias53–55.
Diagnóstico etiológicoUna vez confirmado el diagnóstico de delirium lo más importante es descartar la etiología orgánica causante del cuadro clínico (tabla 1). Los pasos iniciales incluyen una historia clínica completa y una exploración física con valoración cognitiva. Cuando hacen falta pruebas adicionales, hay que individualizar cada paciente pero de manera global podemos resumir las pruebas en cuatro áreas:
- -
Pruebas de laboratorio: descartar alteraciones metabólicas, anemia, electrolitos, glucosa, gasometría arterial, calcio, fosfato y magnesio.
- -
Infección: análisis de orina con cultivo, radiografía de tórax para descartar neumonía, hemocultivos, cultivos de la herida quirúrgica. En ancianos, podemos tener casos de infección oculta sin las respuestas fisiológicas habituales como fiebre y leucocitosis. Un parámetro analítico útil para diagnóstico y monitorización de procesos infecciosos o inflamatorios es la PCR.
- -
Revisión de fármacos: cualquier fármaco introducido previamente al DPO será considerado como potencial causa de dicho cuadro hasta que no se demuestre lo contrario. Además, puede existir un efecto aditivo de fármacos con efecto anticolinérgico, algunos de los cuales son de uso habitual como el levofloxacino.
- -
Abstinencia de alcohol o de fármacos: requiere un tratamiento específico. Los bebedores habituales deben recibir tiamina, para el manejo del síndrome de Korsakof.
- -
Neuroimagen: en caso de focalidad neurológica56
Con frecuencia la causa del delirium es compleja y multifactorial. Se han descrito una serie de situaciones (tabla 4) en donde podría ser especialmente beneficiosa la colaboración con un servicio médico sensibilizado con el diagnóstico y tratamiento del delirium, como los servicios de geriatría.
Características clínicas de los pacientes quirúrgicos que pueden beneficiarse de una valoración y seguimiento geriátrico
| Edad >75 años |
| Deterioro cognitivo o demencia |
| Episodios previos de delirium |
| Comorbilidad (presencia de dos o más enfermedades) |
| Riesgo anestésico alto (Indice ASA III-IV) |
| Polifarmacia (especialmente si tiene prescritos fármacos con efectos sobre el sistema nervioso central) |
| Alteración de la movilidad o deterioro funcional |
| Déficits sensoriales |
| Problemática social |
| Reingresos repetidos |
| Estancia prolongada en cuidados intensivos |
La mayor parte de los episodios de delirium tienen un origen multifactorial, así que para optimizar su manejo debemos desarrollar estrategias utilizando múltiples componentes. Un trabajo español de la Dra. Vidán57 demostró que una intervención multifactorial no farmacológica integrada en la práctica clínica habitual disminuye la aparición de delirium en los pacientes ancianos, mejora la calidad de los cuidados y puede llevarse a cabo sin recursos adicionales en un sistema público.
A nivel médico la intervención estandarizada más conocida es el programa Hospital Elder Life Program (HELP). Este programa incluye las siguientes medidas: orientación, nutrición e hidratación apropiadas, ritmo sueño-vigilia, alteraciones sensoriales (visión y audición) y movilidad. En el paciente quirúrgico anciano se recomienda valorar 10 dominios: oxígeno, líquidos y electrolitos, dolor, disminución de fármacos con efecto a nivel del sistema nervioso central, función intestinal y vesical, nutrición, movilización precoz, prevención de complicaciones postoperatorias, estímulos medioambientales apropiados y tratamiento de síntomas del delirium58.
En torno a un 30-40% de los episodios de delirium se pueden prevenir mediante medidas no farmacológicas59, pero es fundamental la adherencia a las recomendaciones para su efectividad. La participación de especialistas en geriatría en colaboración con los cirujanos responsables, una ubicación seleccionada para pacientes susceptibles al DPO y la educación del personal que atiende han demostrado su eficacia58–60.
La prevención debería iniciarse ya desde la primera consulta mediante la identificación de factores de riesgo y también en el quirófano mediante el mantenimiento de la estabilidad hemodinámica, oxigenación adecuada, equilibrio ácido-base, electrolitos y dosificación farmacológica apropiada. En la tabla 5 podemos ver resumidas las medidas no farmacológicas más aconsejadas en la literatura. Hay que destacar la importancia de un buen manejo analgésico61, una correcta hidratación y nutrición, cambios posturales y movilización, profilaxis de trombosis venosa profunda, retirada de catéteres y restricciones físicas, el tratamiento del estreñimiento y las náuseas. La movilización precoz y la fisioterapia pueden ser estrategias muy eficaces en algunas cirugías62.
Estrategias no farmacológicas
| Medidas generales |
| Movilización precoz y fisioterapia, fomentando la independencia para las actividades del autocuidado |
| Respetar el ciclo sueño-vigilia (adecuar toma de medicaciones, estimulación diurna) |
| Evitar restricciones físicas |
| Retirada precoz de catéteres, oxigenoterapia, sueros |
| Presencia familiar |
| Personal sanitario entrenado en la reorientación del paciente y en la educación familiar |
| Lugar apropiado: con luz diurna y oscuro durante la noche, sin ruido excesivo durante el día y muy silencioso durante la noche, con objetos familiares o que ayuden a reorientarle (calendarios, fotos, relojes…) |
| Uso de dispositivos visuales y/o auditivos habituales |
| Evitar el desarrollo de complicaciones médicas |
| Monitorización de signos vitales, balance de líquidos, oxigenación |
| Tratar de forma precoz la deshidratación, la insuficiencia cardiaca y las alteraciones electrolíticas |
| Tratar de forma adecuada el dolor |
| Tratamiento de anemia, hipoxia e hipotensión |
| Prevenir aspiraciones (postura adecuada y correcta textura de líquidos) |
| Vigilancia de infecciones: área quirúrgica, urinarias, respiratorias, partes blandas |
| Asegurar una correcta nutrición, con suplementación si es necesario |
| Vigilar el desarrollo de retención urinaria |
| Tratamiento y prevención del estreñimiento |
Fuente: modificada de Fricchione et al.23
Se ha intentado prevenir la aparición de delirium con diferentes fármacos como el haloperidol63, risperidona64, gabapentina65, dexmedotimidina66 o melatonina67, en base al posible papel de la transmisión colinérgica en las funciones cognitivas. Aunque no se llegó a reducir la incidencia de DPO, en algunos casos sí se disminuyó la duración y gravedad63. Otros fármacos que puntualmente han demostrado éxito son los inhibidores colinesterásicos, pero dos ensayos controlados aleatorizados que valoraban el uso preventivo del donepezilo no hallaron diferencias significativas en pacientes con cirugía ortopédica68,69 y los que han probado con rivastigmina tampoco han tenido resultados alentadores70,71. De momento, hasta que no haya mayor evidencia, no se aconseja el uso rutinario de fármacos para la prevención del DPO.
Tratamiento farmacológicoAntes de iniciar cualquier tratamiento farmacológico para el DPO es importante recordar que la mera presencia de delirium no es una indicación para la prescripción de sedantes o antipsicóticos. Actualmente no existe ningún consenso internacional que nos indique el tratamiento farmacológico idóneo. Los diferentes trabajos al respecto presentan numerosas limitaciones (escasa aleatorización, pequeños tamaños muestrales, pocos ensayos controlados, no se monitorizan los efectos adversos y escasa validez externa en el paciente anciano complejo). Por otra parte es difícil evaluar los efectos farmacológicos en el contexto de una entidad con curso fluctuante y ante la cual el propio fármaco puede interferir en la interpretación de los resultados. En ausencia de controles no se sabe si la mejoría es por curación de la enfermedad o efecto farmacológico, y hasta el año 2010 apenas existían ensayos controlados con placebo así que las diferentes revisiones fluctuaban entre la predilección por los neurolépticos atípicos (como risperidona)72, haloperidol73–75 o la similitud de ambos en términos de eficacia76.
La tendencia actual parece indicar una efectividad similar de ambos tipos de neurolépticos a expensas de una menor incidencia de efectos secundarios con los atípicos. En la más reciente de las guías internacionales, la National Institute for Health and Clinical Excellence (NICE)77, se recomienda dar un tratamiento breve de una semana o menos de haloperidol u olanzapina a la menor dosis posible y con un incremento progresivo de la dosis según los síntomas. El inicio de tratamiento farmacológico requiere haber documentado bien la conducta, descartando causas corregibles, intentando una aproximación ambiental, psicológica u ocupacional, y demostrando que la intervención es realmente necesaria y no por conveniencia. El proceso de prescripción es complejo e incluye elegir fármaco, dosis, cronología, y monitorización de eficacia y efectos secundarios entre los que destacan la aparición de sintomatología extrapiramidal, modificación del intervalo QT, efectos anticolinérgicos, hiperglucemia, síndrome neuroléptico maligno, caídas o neumonía78, entre otros. El fármaco debe emplearse durante el menor tiempo posible, con revisiones periódicas valorando la eficacia y la posibilidad de reducir las dosis. Las medidas deben ser recogidas en la historia clínica, y discutidas cuando sea posible con el paciente, pero habitualmente con sus familiares.
El haloperidol es el fármaco de elección de las diferentes asociaciones23 por su afinidad D2 con pocos efectos anticolinérgicos79,80. Algunos trabajos han asociado su utilización a menor mortalidad en pacientes ventilados81 y debido a su estructura butirofenona, puede minimizar el estrés oxidativo cerebral y puede proteger contra la lesión neuronal mediada por glutamato23,82. Su uso endovenoso teóricamente causa menos efectos extrapiramidales83. En el anciano se aconseja 0,25-0,5mg cada 4 horas pudiendo repetirse la dosis cada 30 minutos hasta que el paciente se calme. Si no remite incluso se puede usar una perfusión de 5-10mg/hora y siempre con reducción progresiva y al final, paso a vía oral. No se han fijado dosis máximas pero se han descrito incluso dosis de 1.000mg ev sin riesgos84. Puede haber hipotensión si hay poco volumen y reducir el umbral epileptógeno. No se asocia a depresión respiratoria y se tolera bien en EPOC.
Numerosos autores sugieren la utilización de neurolépticos atípicos por vía oral como risperidona (0,5mg cada 12 h inicialmente), olanzapina (2,5-5mg cada 24 h) o quetiapina (12,5-25mg cada 12 h) con ajustes progresivos, pero este manejo por desgracia no siempre es factible o pragmático; sí es útil en delirium leve-moderado pero a veces hace falta un fármaco rápido, seguro y por vía parenteral que asegure que el paciente no se hace daño a sí mismo o a los que le rodean. Los antipsicóticos típicos y atípicos han estado bajo el punto de mira por la posibilidad de incremento de la mortalidad en ancianos85. A pesar de ello siguen siendo importantes en el manejo farmacológico actual, aunque dados los hallazgos es importante establecer un diálogo con los familiares que valore los beneficios y los riesgos de iniciar el tratamiento farmacológico.
Las benzodiacepinas en principio están contraindicadas66,81,86 pero si existe una agitación muy severa podemos usarlas como coadyuvante parenteral. También podemos plantear su uso en pacientes con abstinencia de sedantes o alcohol, enfermos de párkinson o con síndrome neuroléptico maligno, siempre teniendo en cuenta la posibilidad de un efecto paradójico.
Por otra parte, el exceso de sedación durante la intervención quirúrgica puede ser un factor de riesgo muy importante para DPO, y sus implicaciones son sustanciales pues la sedación es un procedimiento habitual, y controlar la profundidad de dicha sedación sería una manera simple de reducir la incidencia de delirium40. En algún trabajo los pacientes con sedación ligera tuvieron una incidencia 50% inferior de DPO (se pudo prevenir 1 caso de delirium cada 3,5-4,7 pacientes manejados con sedación ligera). Sin embargo algún trabajo reciente afirma que la anestesia general no tiene efectos diferentes a la regional en la incidencia de DPO87.
Es conveniente realizar una valoración cognitiva y funcional antes de procedimientos quirúrgicos que precisan sedación. Tradicionalmente la valoración sobre la indicación y seguridad de los procesos de sedación se ha enfocado casi siempre en el riesgo cardiorrespiratorio, pero en los ancianos es útil añadir el riesgo cognitivo a la ecuación pues nos identificará con mayor precisión al anciano vulnerable.
ConclusionesDebemos ser conscientes de la gran importancia del DPO, complicación frecuente y habitualmente infradiagnosticada en los pacientes ancianos. La identificación de los pacientes más vulnerables a su aparición nos ayudará a implementar medidas inicialmente no farmacológicas profilácticas. De la misma manera que nos preocupamos por la situación hemodinámica o cardiorrespiratoria preoperatorias, debemos preocuparnos de la situación cognitiva en estos pacientes. Existen una serie de instrumentos diagnósticos sencillos, entre los que destaca el CAM. Una vez realizado el diagnóstico es fundamental la identificación de causas orgánicas potencialmente tratables. En algunas circunstancias el paciente puede beneficiarse de ser valorado de manera multidisciplinar por algún geriatra que apoye al cirujano. A nivel farmacológico se distinguen dos situaciones. Cuando el paciente provoque riesgo para sí mismo o para los que le rodeen y precise tratamiento parenteral el fármaco más aconsejado es el haloperidol. Cuando el grado de agitación es moderado podemos utilizar neurolépticos atípicos como risperidona, olanzapina o quetiapina, teóricamente con menos efectos extrapiramidales que el haloperidol. El anciano quirúrgico es por naturaleza vulnerable, y las consecuencias del DPO se extienden a largo plazo más allá del ingreso que motivó la cirugía por lo que es necesaria la implementación de medidas destinadas a su manejo óptimo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.