Aunque existen estrategias definidas en el manejo de ciertos cánceres hereditarios (mama, ovario, colon y recto, y endometrio),el manejo de pacientes portadores de mutaciones con riesgo aumentado de padecer cáncer es un problema mayor no establecido.
Las mutación germinal en el gen TP53, resulta en una condición rara hereditaria conocida como síndrome de Li-Fraumeni (SLF)1.
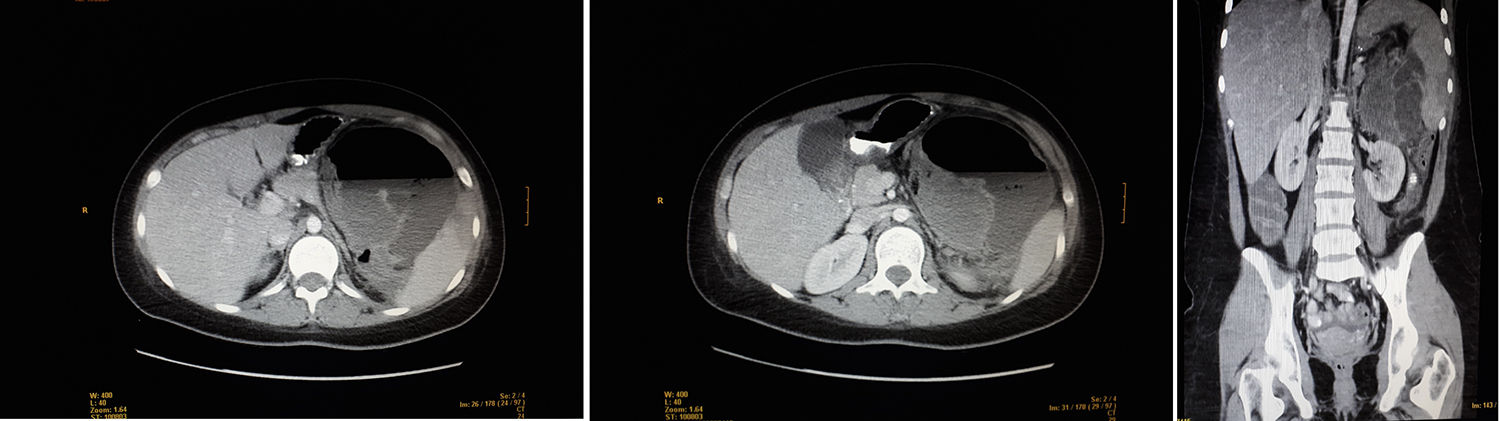
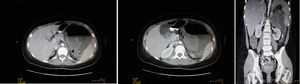
Presentamos el caso de una mujer de 21 años con dolor abdominal en hipocondrio izquierdo y fiebre. A los 11 años fue diagnosticada de osteosarcoma de húmero proximal derecho, sin metástasis. Recibió quimioterapia protocolo SEOP 2001 (ifosfamida días 1-5 y adriamicina 25mg/m2 días 1-3) pre y poscirugía con desarticulación interescápulotorácica derecha. Neuroma residual con seguimiento anual hasta julio 2017. Abuelo materno fallecido por cáncer de pulmón (69 años) y paterno por cáncer de próstata (78 años). Destacaba a la exploración física un abdomen distendido, doloroso en hipocondrio izquierdo con masa empastada y sin defensa abdominal. Analítica con leucocitosis, neutrofilia y PCR 340. La TAC mostraba una masa heterogénea de 10×15cm en hipocondrio izquierdo, ampliamente necrosada/abscesificada, con nivel hidroaéreo, la cual desplazaba estructuras vecinas. Esplenomegalia con áreas sugestivas de infartos. Hígado sin lesiones focales. Riñones sin hallazgos. No adenopatías de tamaño patológico, con moderado líquido libre intraperitoneal.
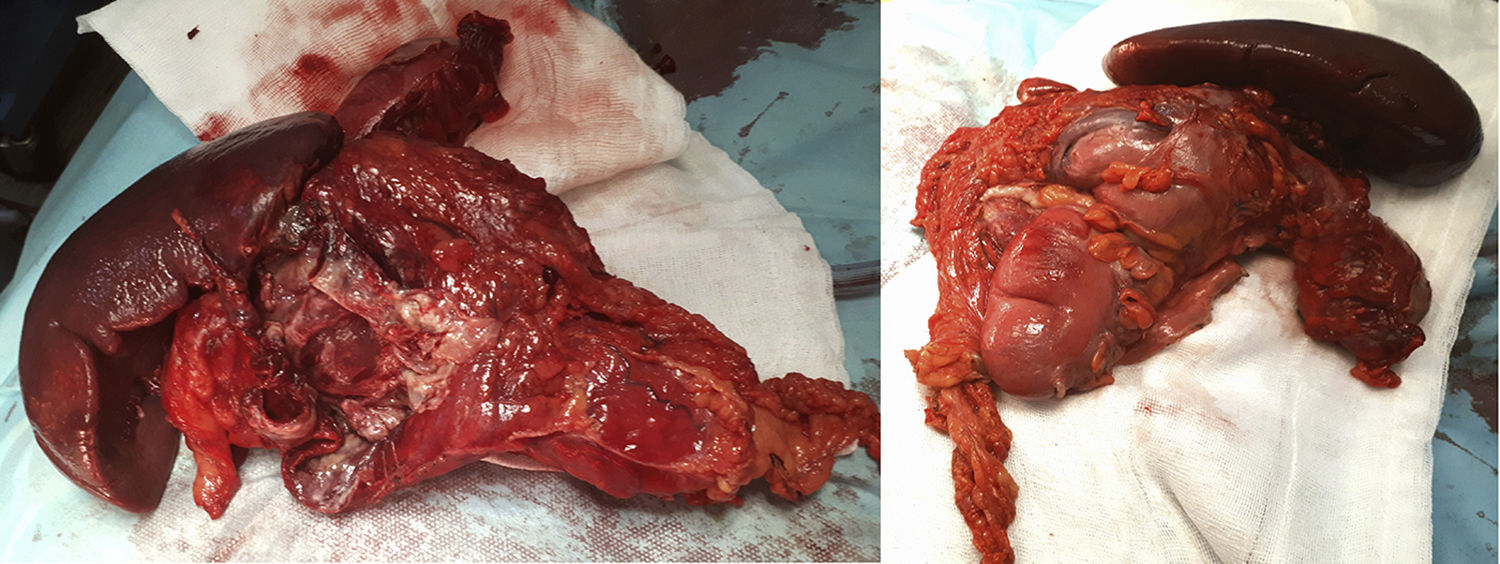
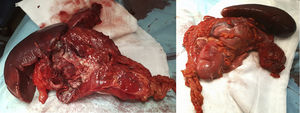
La cirugía identificó una peritonitis purulenta de 2,5l con una masa dependiente de colon transverso distal empotrada anteriormente al hilio esplénico. A nivel posterior contactaba con la cola del páncreas y con la curvatura mayor gástrica hasta fundus gástrico. No se palparon LOES hepáticas. Tras hemicolectomía izquierda y esplenectomía con reconstrucción primaria del tránsito colónico, la paciente recuperó el tránsito en el quinto día postoperatorio siendo dada de alta tras ampliar el estudio hospitalario mediante RMN cerebral, mamaria y estudio genético en Centro Nacional de Investigaciones Oncológicas (fig. 1).
La anatomía patológica identificó un tumor del estroma gastrointestinal (GIST), fusocelular multifocal de bajo grado, de 5×3cm,con los bordes quirúrgicos libres, sin afectación y sin invasión linfovascular ni perineural. Con menos de 50 mitosis por campo de gran aumento (G1). Sin evidencia de necrosis. La citología peritoneal fue negativa para malignidad. El panel de IHQ: CD117: positivo (++); Dog1: positividad focal; CKAE1/AE3: negativa; S100: negativa (−); CD34: positiva (+); Ki-67: proliferativo en aproximadamente 10-15% de celularidad, y actina: negativa (−) (fig. 2).
El cáncer pediátrico debe situarnos en la hipótesis de un síndrome de predisposición de cáncer hereditario en la familia, sobre todo con antecedentes familiares o con anomalías concurrentes congénitas. Las condiciones asociadas con mayor riesgo de cáncer en la infancia incluyen: genodermatosis (neurofibromatosis tipo 1 y esclerosis tuberosa), síndromes de sobrecrecimiento (síndrome de Beckwith-Wiedemann y síndrome de Proteus) y síndromes de cáncer del adulto con un incremento del riesgo a padecer cáncer en la infancia y adolescencia (SLF y síndrome de Li-Fraumeni Like (SFLL)2.
El SLF es un síndrome de predisposición de cáncer, con herencia autosómica dominante, cuyos individuos están en riesgo aumentado de desarrollar múltiples tumores primarios, siendo hasta el 83% el riesgo de padecer un segundo tumor primario si la primera neoplasia fue diagnosticada entre los 0 y 19 años3.
Existen 2 formas de presentación, el SLF y SFLL4. La definición clásica de SLF, necesita un diagnóstico de sarcoma antes de los 45 años, junto a un familiar de primer grado con cualquier cáncer antes de los 45 años, así como un familiar de primer o segundo grado con cualquier cáncer antes de los 45 o un sarcoma diagnosticado a cualquier edad5.
Los criterios de inclusión fueron modificados en los últimos 30 años Birch, Eeles 1 y 2, Chompret en 2001. En 2009 se redefinieron los criterios de Chompret: paciente con cáncer del espectro de SLF (sarcoma, mama, tumor sistema nervioso central, leucemia, carcinoma broncoalveolar) antes de los 46 años y familiar de primer o segundo grado con un tumor del espectro de SLF (excepto cáncer de mama si el paciente lo padeció previamente) antes de los 56 años o múltiples tumores. También se define como un paciente con múltiples tumores, siendo al menos 2 del espectro de SLF, ocurriendo el primero antes de los 46 años, o un carcinoma adrenocortical o carcinoma del plexo coroideo a cualquier edad o cáncer de mama antes de los 36 años sin mutación de BRCA1 o BRCA21.
En 1990 se observaron formas inactivas del gen TP53 en formas esporádicas de muchos tumores asociados al SLF, descubriéndose una asociación definitiva entre TP53 y SLF6.
En las células germinales, existen más de 250 mutaciones en el gen TP537. Una mutación del gen TP53 puede identificarse en pacientes con ausencia de historia familiar, por insuficiente historia familiar, mosaicismo de células germinales o por mutación de novo del gen TP538.
Los criterios clínicos del SLF/SLFL pueden estimar la probabilidad de mutación de células germinales en el gen TP53: 70% de las familias con los criterios clásicos del SLF, 32% criterios de Chompret, 25% Chompret modificados, 25% criterios de Birch, 14% Eeles 1 y 8% en los criterios de Eeles 29,10.
El desarrollo de nuevos marcadores clínicos en estudio en portadores de mutaciones germinales del TP53 (disminución de la longitud telomérica), así como el uso cada vez habitual de test genéticos múltiples, permitirá seguir ampliando en el futuro los nuevos fenotipos fuera de la clásica descripción del SLF7.