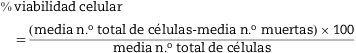El trasplante celular hepático (TCH) se basa en el empleo de células hepáticas adultas, hepatocitos humanos, viables y metabólicamente funcionales.
El TCH consta de 3 pasos: el aislamiento del hepatocito del hígado no válido para trasplante hepático, la preparación de las suspensiones celulares y, finalmente, su implante en el receptor. La obtención de los hepatocitos se realiza mediante digestión hepática con colagenasa a 37°C. Tras el aislamiento, las células pueden congelarse o administrarse en fresco. La criopreservación permite realizar el procedimiento de forma programada.
Los aspectos clave del implante celular son la vía de infusión, el número de células por infundir, el número de infusiones y la viabilidad celular. La implantación es mediante catéter para infusión en la vena porta o la arteria esplénica.
El TCH permite utilizar los órganos desechados para trasplante convencional, y se tratan varios pacientes con hepatocitos del mismo donante.
Hepatic cell transplantation consists of grafting already differentiated cells such as hepatocytes. Human hepatocytes are viable and functionally active.
Liver cell transplantation is carried out by means of a 3-step method: isolation of hepatocytes from donor liver rejected for orthotopic transplantation, preparing a cell suspension for infusion and, finally, hepatocytes are implanted into the recipient. There are established protocols for the isolation of human hepatocytes from unused segments of donor livers, based on collagenase digestion of cannulated liver tissue at 37°C.
The hepatocytes can be used fresh or cryopreserved. Cryopreservation of isolated human hepatocytes would then be available for planned use.
In cell transplant, the important aspects are: infusion route, number of cells, number of infusions and viability of the cells. The cells are infused into the patient through a catheter inserted via portal vein or splenic artery.
Liver cell transplantation allows liver tissue to be used that would, otherwise, be discarded, enabling multiple patients to be treated with hepatocytes from a single tissue donor.
En la actualidad, el único tratamiento efectivo existente para el fallo hepático terminal es el trasplante hepático (TH) ortotópico. A pesar del constante aumento del número de TH, la lista de espera continúa creciendo. Pese a la ampliación de los criterios de selección de donantes, los resultados obtenidos no son satisfactorios. Esto ha motivado que se hayan puesto en marcha distintas alternativas al TH convencional como tratamiento de las enfermedades hepáticas crónicas o terminales con el fin de sustituirlo o bien como puente hasta la obtención del órgano1–6.
De entre los procedimientos propuestos, el más satisfactorio por los resultados obtenidos es el trasplante celular hepático (TCH) o trasplante de hepatocitos humanos, ya que permitiría mantener las funciones hepáticas hasta la obtención del órgano y en determinados casos lograr la regeneración hepática. Los resultados publicados indican que puede ser una técnica útil, siempre y cuando dispongamos de hepatocitos humanos de calidad con elevada viabilidad y metabólicamente funcionantes1,2,6–13.
Para llevar a cabo esta iniciativa terapéutica, es necesaria la obtención de los órganos descartados para implante, la identificación de los pacientes candidatos al tratamiento, la obtención, el procesamiento, la conservación y, finalmente, la implantación de los hepatocitos aislados en los pacientes subsidiarios de este tipo de tratamiento.
El TCH contempla el trasplante de hepatocitos como principal célula deficitaria en caso de mala función hepática. Se trata de utilizar las células adultas totalmente diferenciadas (los hepatocitos) sobre la base de la capacidad del hepatocito trasplantado para desarrollar todas las funciones del hígado sano y la gran capacidad de regeneración que posee el hígado2,14,15. El principal problema actual del TCH es la falta de fuentes adecuadas de hepatocitos.
Trasplante celular hepático. Unidad de Terapia Celular HepáticaLa obtención de los hepatocitos humanos es un proceso complejo por la escasez de fuentes aptas para el aislamiento celular, la infraestructura necesaria para llevar a cabo este aislamiento y la conservación de los hepatocitos así como la labilidad de las células para su mantenimiento e identificación en el receptor.
El TCH se lleva a cabo en la Unidad de Terapia Celular Hepática (UTCH) del Hospital La Fe de Valencia, cuyas instalaciones están acreditadas conforme a la normativa europea EN-ISO 14.644 sobre salas limpias y locales anexos, y se valida la sala limpia como ISO clase 6 y las zonas anexas como ISO clase 7.
Su actividad clínica se concentra en los pacientes con hepatopatía subsidiarios del TCH. Esta Unidad en colaboración con la Organización Nacional de Trasplantes realiza la obtención de injertos descartados para trasplante.
El aislamiento, la caracterización y la criopreservación de las células hepáticas humanas se realizan bajo condiciones de buena práctica de producción (good manufacturing practices), y se establecen procedimientos optimizados para obtener hepatocitos humanos de máxima calidad.
Metodología del trasplante celular hepáticoBásicamente, la realización del TCH consta de 3 fases: el aislamiento de los hepatocitos de los hígados rechazados para trasplante de órgano sólido, la preparación de las suspensiones celulares y su implante en el receptor. Tras el aislamiento, las células pueden congelarse y almacenarse (criopreservación celular), y se realiza análisis bacteriológico y control de calidad. El implante de los hepatocitos en el receptor se efectúa habitualmente mediante infusión en la vena porta o la arteria esplénica, y puede realizarse de forma programada.
1. Fuentes de obtención de hepatocitosActualmente el principal problema para la realización del TCH es la falta de fuentes adecuadas de hepatocitos humanos viables. Los hepatocitos se obtienen a partir de los órganos no válidos para trasplante por esteatosis superior al 40–50%1, tiempo de isquemia prolongado, lesión traumática del injerto9, desgarro capsular10,16, incompatibilidad de grupo sanguíneo17 y lesión vascular o biliar. Ocasionalmente se han infundido hepatocitos fetales11.
Las nuevas fuentes de obtención de hepatocitos incluyen tejido hepático resultante de reducciones hepáticas, split, así como el segmento iv tras split para 2 receptores12,13,18,19, injertos de donantes a corazón parado y donantes con arteriosclerosis. Otras fuentes propuestas son el tejido hepático procedente de resecciones hepáticas por enfermedad benigna o tras resección de tumor colorrectal20 (fig. 1).
La UTCH ha aislado 13 órganos descartados para TH, pero aptos para TCH. Los hepatocitos se aislaron a partir de donantes con arteriosclerosis, serología vírica dudosa no confirmada, donante a corazón parado, split, fibrosis hepática y anoxia cerebral en recién nacido.
2. Aislamiento de hepatocitosBerry y Friend (1969) fueron los primeros en desarrollar el procedimento para el aislamiento de hepatocitos de rata mediante la perfusión del hígado in situ con colagenasa, y sentaron las bases de los protocolos actuales. La colagenasa es una enzima proteolítica que permite la digestión del tejido hepático y el aislamiento de sus componentes celulares18,21–28.
Inicialmente investigamos, en biopsias quirúrgicas procedentes de los hígados preservados con Celsior®, la influencia sobre el rendimiento del aislamiento y la calidad de los hepatocitos de factores tales como el tiempo de isquemia fría y la esteatosis hepática determinada por estudio anatomopatológico. Tanto la viabilidad celular como el rendimiento presentaron un descenso a medida que aumentaba el tiempo de isquemia fría y la esteatosis29–32.
Sobre la base de estos resultados, tratamos de optimizar el proceso de aislamiento y cultivo de hepatocitos a partir de los hígados enteros (1,5–3,5kg) o los lóbulos completos (0,5–1kg) descartados para trasplante, por esteatosis u otra causa, y se realizaron inicialmente 5 aislamientos32 y posteriormente 3 más hasta un total de 8 (tabla 1). Todos los injertos se perfundieron con Celsior®, dado que en nuestra experiencia su uso produce una mayor viabilidad de las células en el proceso de aislamiento de hepatocitos humanos en comparación con otros líquidos de preservación31. Los órganos con mayor esteatosis (≥40%) presentaron menor rendimiento celular en el proceso de aislamiento. Los injertos desechados de donantes de edad avanzada mostraban una tendencia a una menor viabilidad (tabla 1). En general, el rendimiento del proceso de disgregación en el hígado o los lóbulos enteros es inferior al obtenido con biopsias quirúrgicas del tejido hepático con esteatosis, aunque hay que destacar mayor rendimiento en las muestras de menor peso (un lóbulo) (tabla 1). Esto podría atribuirse a los problemas que inicialmente presentaba el proceso de digestión del injerto.
Aislamiento de hepatocitos a partir de los órganos enteros o splits descartados para trasplante hepático convencional
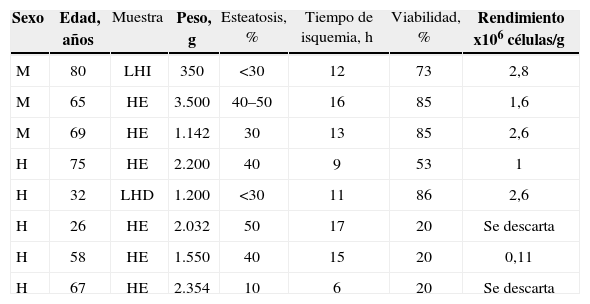
| Sexo | Edad, años | Muestra | Peso, g | Esteatosis, % | Tiempo de isquemia, h | Viabilidad, % | Rendimiento x106 células/g |
| M | 80 | LHI | 350 | <30 | 12 | 73 | 2,8 |
| M | 65 | HE | 3.500 | 40–50 | 16 | 85 | 1,6 |
| M | 69 | HE | 1.142 | 30 | 13 | 85 | 2,6 |
| H | 75 | HE | 2.200 | 40 | 9 | 53 | 1 |
| H | 32 | LHD | 1.200 | <30 | 11 | 86 | 2,6 |
| H | 26 | HE | 2.032 | 50 | 17 | 20 | Se descarta |
| H | 58 | HE | 1.550 | 40 | 15 | 20 | 0,11 |
| H | 67 | HE | 2.354 | 10 | 6 | 20 | Se descarta |
H: hombre; HE: hígado entero; LHD: lóbulo hepático derecho; LHI: lóbulo hepático izquierdo; M: mujer.
Del total de los órganos desestimados para implante, 13 se han remitido a la UTCH para aislamiento de hepatocitos. Los criterios que se exigen para aceptar estos injertos para el aislamiento celular son similares a los exigidos para la donación en el TH. Se consideran donantes aptos para TCH todos aquellos injertos rechazados para TH, sin límite de edad, que no presenten sepsis ni antecedentes de neoplasia, con serología negativa para hepatitis C, B, VIH, HTLV y lúes, consentimiento familiar para emplear el órgano con fin investigador, esteatosis inferior o igual al 30%, no presentar enfermedad de origen hepático (cirrosis, colestasis y hemofilia) y un tiempo de isquemia fría inferior a 6h.
La esteatosis cuando es superior o igual al 30% invalida el tejido para el aislamiento celular. Nuestra experiencia nos ha permitido demostrar que, comparado con el hígado normal, los hepatocitos del hígado con esteatosis presentan baja viabilidad, menor rendimiento del proceso de aislamiento (hepatocitos viables obtenidos/g de tejido procesado), son muy frágiles para soportar la crioconservación y las posibilidades de injertarse con éxito son menores, por lo que actualmente no son órganos aptos para tratamiento celular21,30–32, y es un criterio de exclusión.
De los 13 donantes (8 mujeres y 5 hombres), se realizó el aislamiento en 3 splits, en 2 órganos completos y en el resto de los casos se procedió a la división del órgano en los 2 lóbulos, derecho e izquierdo y segmento iv para su mejor perfusión. El porcentaje de esteatosis se determinó por estudio anatomopatológico, y el tiempo de isquemia en todos ellos fue inferior a 4h. La viabilidad celular se sitúo entre el 70–89%, con un rendimiento de 1–17×106 células/g (tabla 2).
Aislamiento de hepatocito en los órganos no válidos para trasplante hepático ortotópico
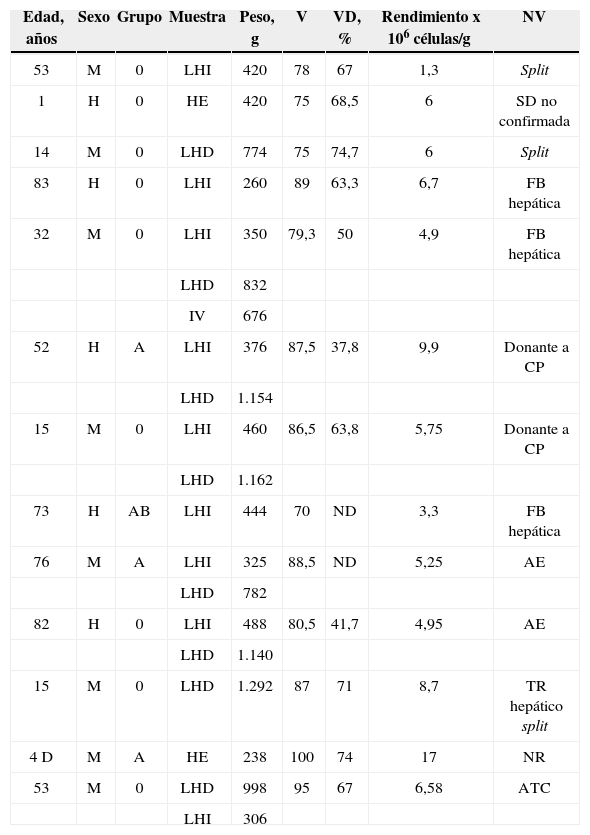
| Edad, años | Sexo | Grupo | Muestra | Peso, g | V | VD, % | Rendimiento x 106 células/g | NV |
| 53 | M | 0 | LHI | 420 | 78 | 67 | 1,3 | Split |
| 1 | H | 0 | HE | 420 | 75 | 68,5 | 6 | SD no confirmada |
| 14 | M | 0 | LHD | 774 | 75 | 74,7 | 6 | Split |
| 83 | H | 0 | LHI | 260 | 89 | 63,3 | 6,7 | FB hepática |
| 32 | M | 0 | LHI | 350 | 79,3 | 50 | 4,9 | FB hepática |
| LHD | 832 | |||||||
| IV | 676 | |||||||
| 52 | H | A | LHI | 376 | 87,5 | 37,8 | 9,9 | Donante a CP |
| LHD | 1.154 | |||||||
| 15 | M | 0 | LHI | 460 | 86,5 | 63,8 | 5,75 | Donante a CP |
| LHD | 1.162 | |||||||
| 73 | H | AB | LHI | 444 | 70 | ND | 3,3 | FB hepática |
| 76 | M | A | LHI | 325 | 88,5 | ND | 5,25 | AE |
| LHD | 782 | |||||||
| 82 | H | 0 | LHI | 488 | 80,5 | 41,7 | 4,95 | AE |
| LHD | 1.140 | |||||||
| 15 | M | 0 | LHD | 1.292 | 87 | 71 | 8,7 | TR hepático split |
| 4 D | M | A | HE | 238 | 100 | 74 | 17 | NR |
| 53 | M | 0 | LHD | 998 | 95 | 67 | 6,58 | ATC |
| LHI | 306 |
AE: arteriosclerosis; ATC: aneurisma tronco celíaco; CP: corazón parado; D: días; FB: fibrosis; H: hombre; HE: hígado entero; LHD: lóbulo hepático derecho; LHI: lóbulo hepático izquierdo; M: mujer; ND: no descongelado; NR: no hay receptor; NV: no válido; SD: serología dudosa; TR: traumatismo; V: viabilidad; VD: viabilidad tras descongelación.
Nuestro laboratorio posee un protocolo estandarizado de aislamiento de hepatocitos a partir de biopsias hepáticas quirúrgicas, protocolo que se ha optimizado y se ha adaptado para realizar aislamientos a gran escala a partir de los órganos descartados para trasplante o de fragmentos del hígado procedentes de hepatectomía23.
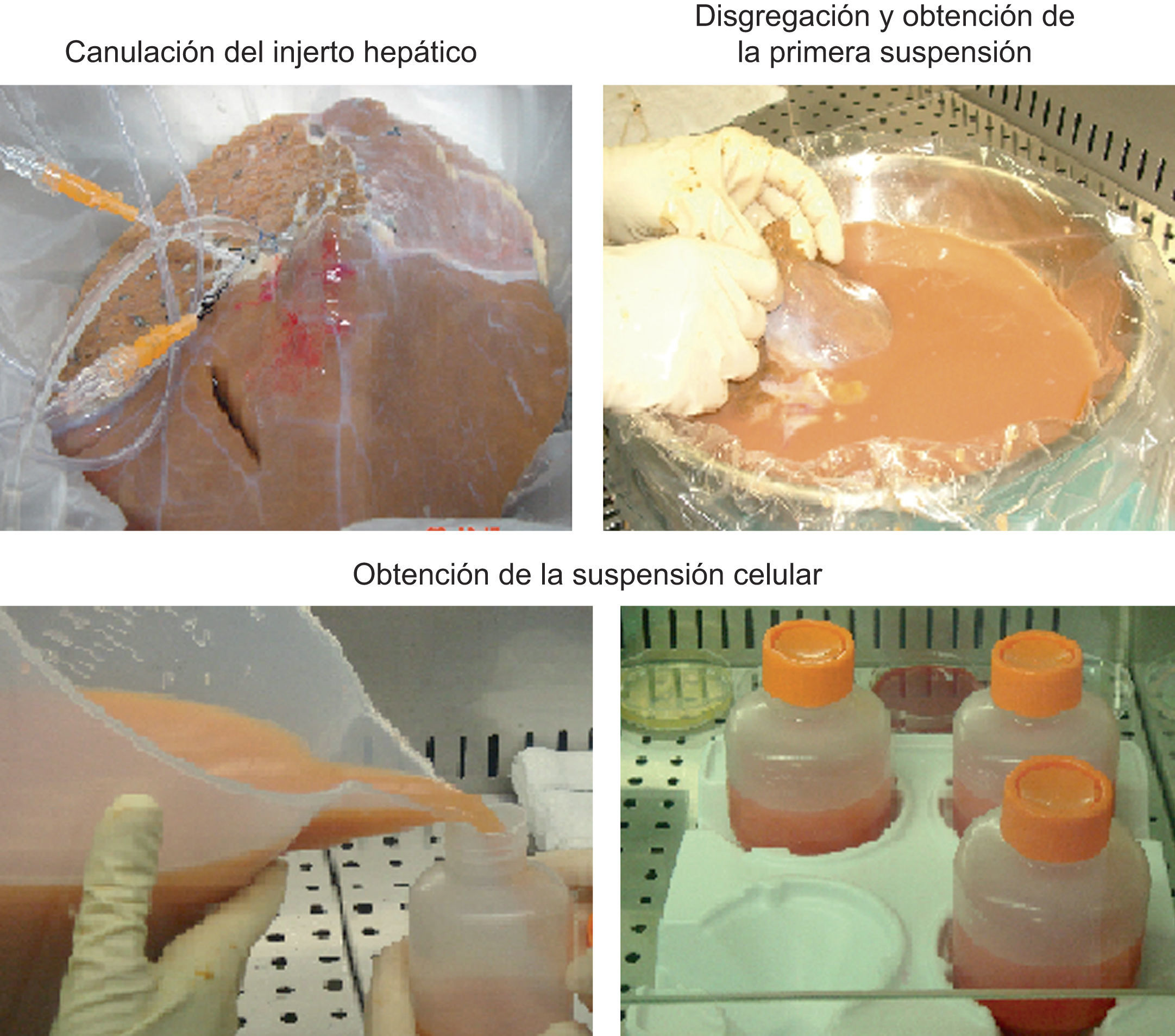
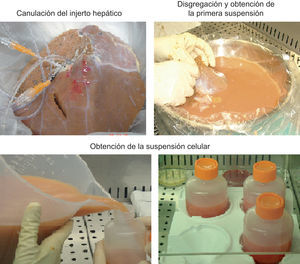
La perfusión enzimática se realiza previa canulación de la arteria hepática y la vena porta del tejido hepático desechado. Si es factible, canulamos la vía biliar. En los primeros aislamientos realizamos la perfusión del órgano completo; sin embargo, la digestión del tejido hepático era incompleta. Esto motivó un cambio en el sistema de perfusión, y dividió el parénquima hepático en el lóbulo derecho e izquierdo, para lo que se realizó primero la perfusión de un lóbulo y a continuación la del otro (fig. 1).
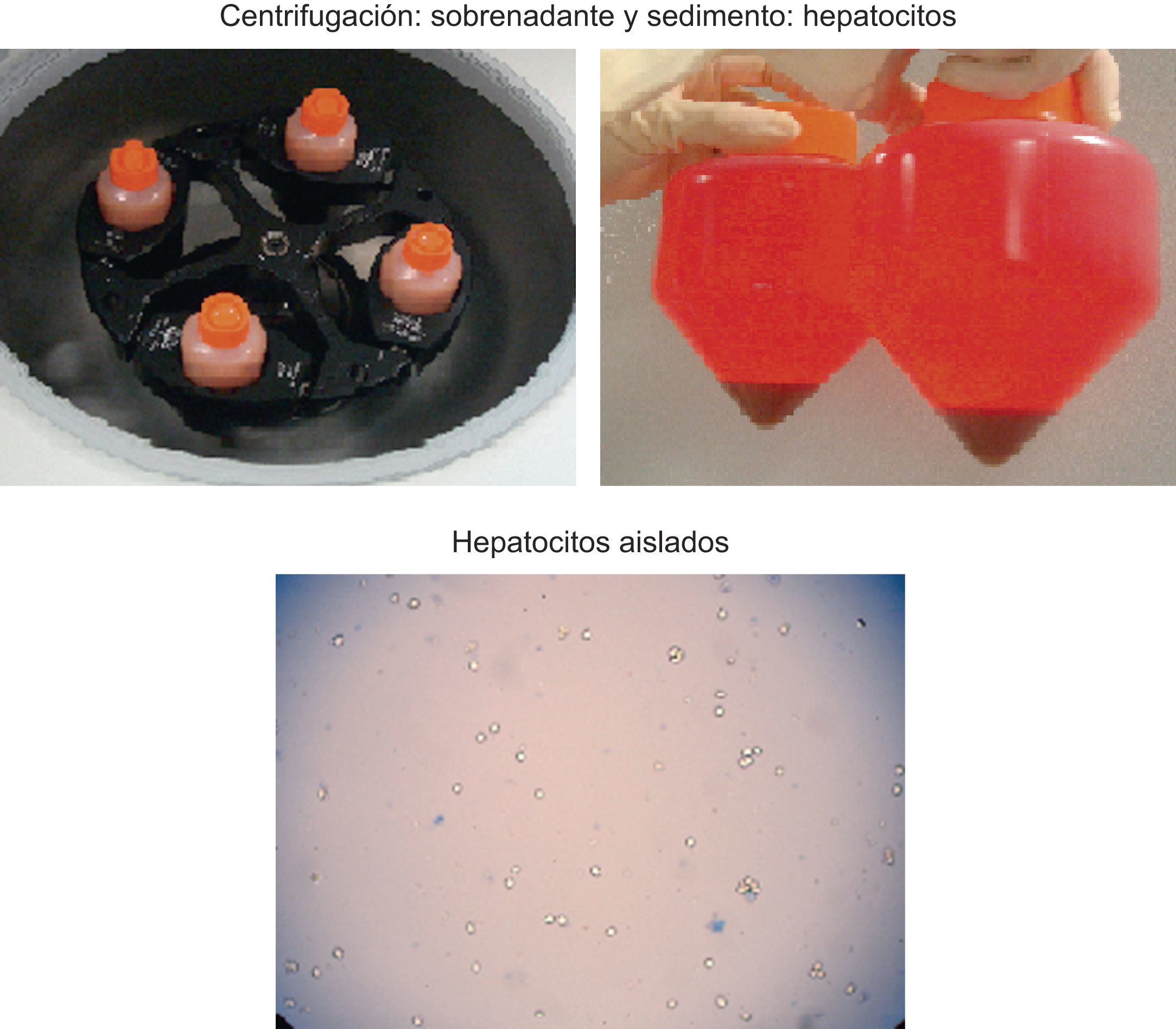
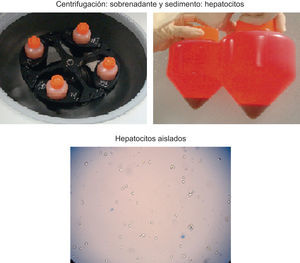
La digestión enzimática consta de 2 etapas: una primera etapa de perfusión no recirculante del tejido hepático con solución salina de Krebs-Ringer tamponada con HEPES (20mmol, pH7,4), exenta de calcio, pero que contiene EGTA (0,5mmol) para lavar el tejido de la sangre y debilitar las uniones intercelulares; una segunda etapa de perfusión recirculante, se utiliza la misma solución salina sin EGTA y contiene 5mmol de Cl2Ca y el 0,05% de colagenasa para conseguir la digestión completa del parénquima hepático25,26. Ambas etapas se realizan a 37°C26. Se procede a la disgregación mecánica del tejido hepático para obtener una suspensión de hepatocitos en solución de Krebs-Ringer que se filtra (fig. 1). Esta suspensión celular se lava varias veces, se centrifuga, se desecha el sobrenadante y se resuspende el sedimento celular. Finalmente, se determina la viabilidad mediante el colorante azul de tripán, el rendimiento y la funcionalidad de las células mediante estudio metabonómico de enzimas de biotransformación de fases i y ii, capacidad de ureogénesis y número total de células33 (fig. 2). Se obtienen entre 6×106 y 2×107 hepatocitos vivos/g de hígado30,31,34, e influyen las condiciones de obtención del tejido en los resultados del procedimiento34.
La solución de preservación empleada, la logística para procesar un injerto entero en el menor tiempo posible, la variabilidad de la actividad específica de la colagenasa, la necesidad de mantener el tejido a 37°C durante la perfusión con colagenasa y la digestión incompleta del tejido han sido aspectos clave del proceso que se han ido optimizando. Nuestros estudios recientes muestran que la fuente del tejido hepático, el tiempo de isquemia así como el líquido de perfusión (Celsior®/Wisconsin) utilizado influyen en el rendimiento y la calidad del hepatocito obtenido31,32.
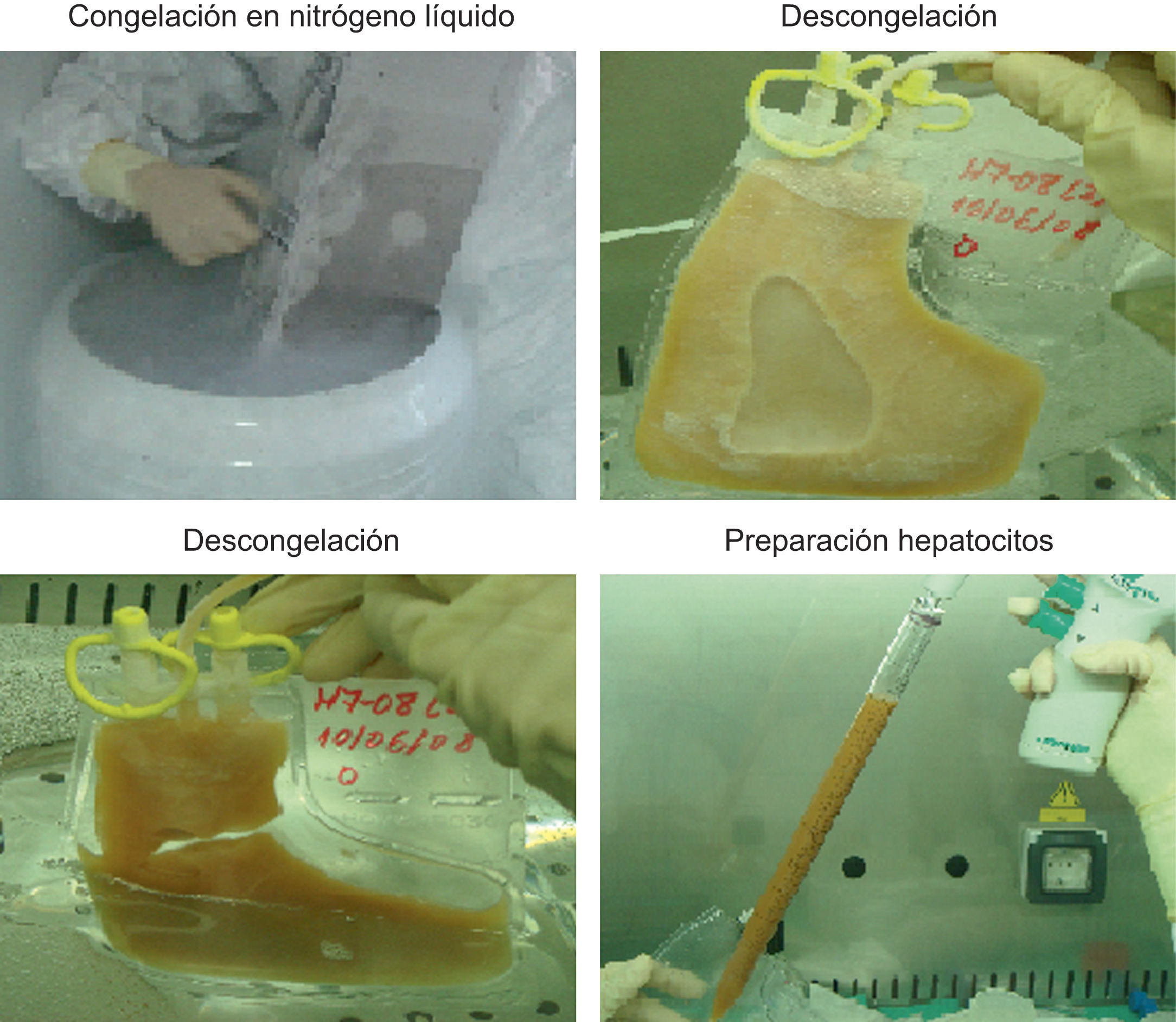
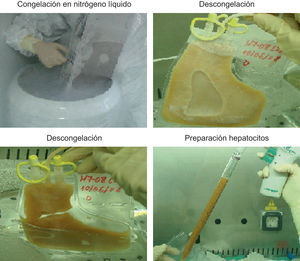
4. Preparación de suspensiones celulares para implanteTras el aislamiento de hepatocitos, las células se resuspenden, bien en el medio de infusión adecuado33 para trasplantarse en fresco o bien en el medio de congelación si se crioconservan para utilizarse posteriormente18,25,30 (fig. 3). La criopreservación de los hepatocitos obtenidos permite realizar el trasplante de forma semiprogramada. Se remiten muestras para estudio microbiológico a fin de descartar cualquier contaminación en el proceso de obtención celular, con adición de antibióticos de forma profiláctica.
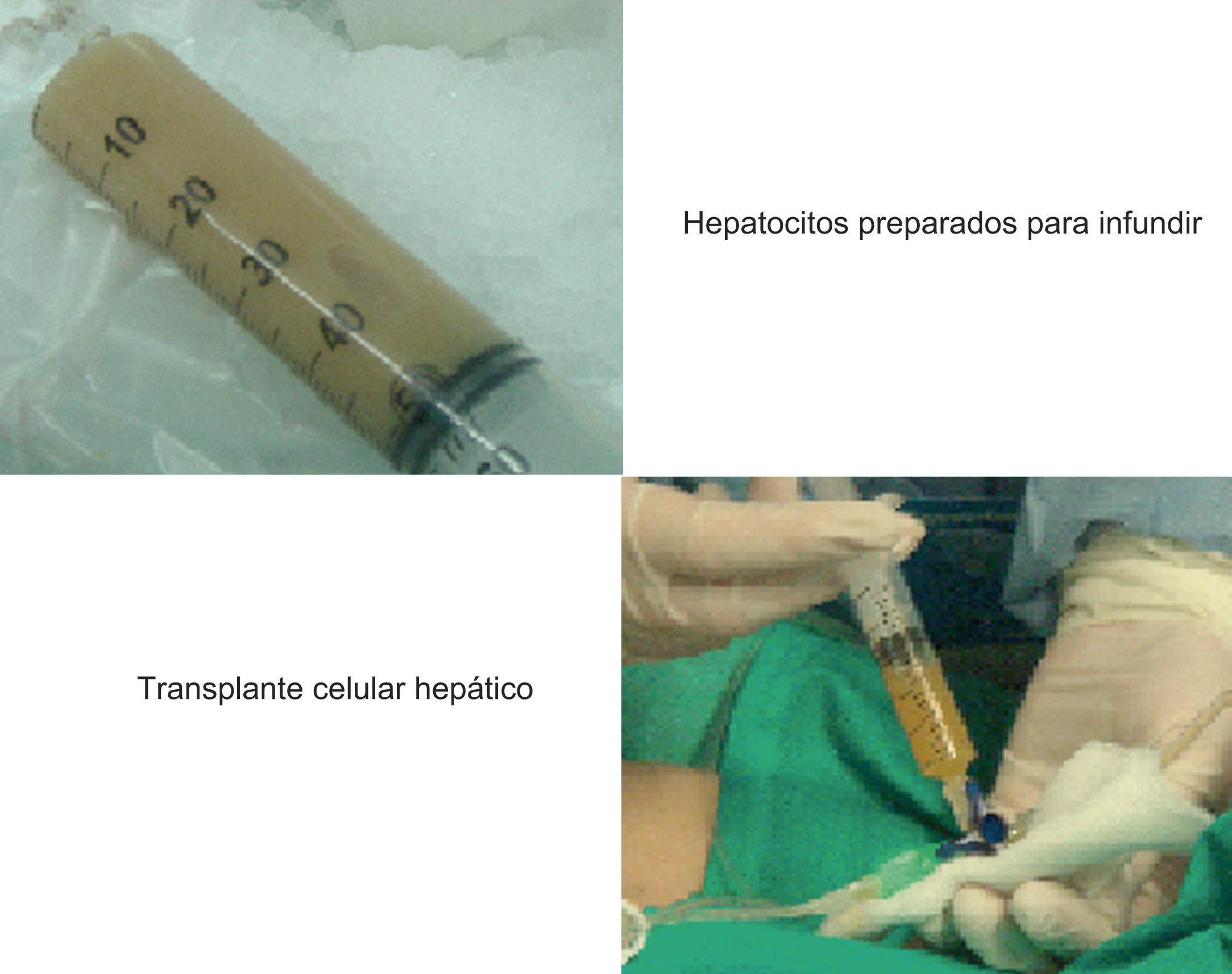
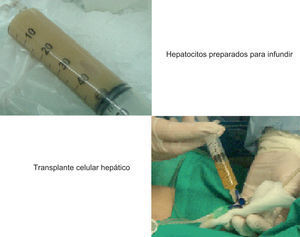
5. Implante de hepatocitos/infusión de hepatocitosEl trasplante celular requiere la infusión de los hepatocitos humanos en suspensión en un período que oscila entre minutos y horas (fig. 4). La composición del medio de infusión y la duración y el almacenamiento del hepatocito influyen en la calidad de las células obtenidas. Habitualmente, la composición del medio de infusión se basa en un buffer de proteínas plasmáticas con agentes anticoagulantes y glucosa en condiciones de hipotermia. La adición de N-acetil-cisteína ha demostrado que disminuye el estrés oxidativo y disminuye la apoptosis27.
Los aspectos clave a la hora de definir la técnica de implante son 4: la vía de infusión, el número de células por infundir, el número de infusiones y la viabilidad de las células.
Viabilidad y funcionalidadLa mayoría de los autores determinan la viabilidad mediante el test de exclusión del azul de tripán, que mide la integridad de la membrana celular21,27. Las células vivas no captan el azul de tripán, mientras que las células muertas son permeables al colorante y se tiñen de azul. Se calcula el porcentaje de viabilidad mediante la siguiente fórmula:
Se recomienda para el uso clínico una viabilidad superior al 60%, y es necesario evaluar la calidad del hepatocito27. Para ello, en nuestra Unidad realizamos determinación de la capacidad metabólica, medida de la actividad biotransformadora y medida de la expresión funcional de genes hepáticos36,37. Las suspensiones celulares se testan para micoplasma, endotoxinas, bacterias y hongos21,24,25.
En nuestra UTCH hemos establecido criterios para realizar el control de calidad funcional de los hepatocitos (recién aislados o crioconservados) de forma que en un tiempo razonable (1h) se pueda comprobar su idoneidad para trasplante celular. Se procede a la determinación de la actividad de 5 isoenzimas del citocromo P450 (CYP1A2, CYP2A6, CYP3A4, CYP2C9 y CYP2E1) y enzimas de conjugación de fase ii (UGT y SULT) mediante la incubación con un cocktail de sustratos específicos desarrollado recientemente en nuestro laboratorio, y análisis por HPLC/MS/MS (o espectrometría de masas)38. Se determina su capacidad ureogénica mediante la medición de la conversión de amonio en urea. En un futuro próximo pretendemos realizar un estudio metabonómico y determinar un número importante de metabolitos celulares.
Número de célulasDe los estudios en animales se deduce que la masa celular requerida para solventar un fallo enzimático es significativamente menor que la masa necesaria para tratar un daño agudo o crónico39. Sin embargo, los datos publicados por Sokal recientemente no avalan este concepto2.
En líneas generales, el número de células trasplantadas frescas o criopreservadas representa entre un 5–10% de la teórica masa hepática (200–400×106células/kg de peso corporal)2,6–10. El efecto clínico y metabólico duradero aparece entre las 4–8 semanas tras la infusión, y se mantiene hasta 26 semanas después del trasplante celular2.
Aproximadamente el 5–10% de la masa celular hepática se trasplanta en las metabolopatías congénitas2,6–9,17,40; en el paciente con cirrosis o fallo hepático fulminante, la masa celular utilizada es menor por el riesgo de trombosis portal aumentado, y se establece un límite máximo de 30–100×106células/kg de peso corporal2. De ahí la necesidad de buscar rutas de administración alternativas que incluirían la arteria esplénica o la vía intraperitoneal.
Tras la infusión celular, el porcentaje de las células hepáticas que se injertan es limitado, posiblemente debido a la apoptosis originada por la pérdida de adherencia celular. Por esto, en nuestra opinión, el número de células infundidas estará en relación con el peso estimado del hígado.
Vía de infusiónHasta el momento actual, las vías generalmente utilizadas para el trasplante celular han sido 3: a través de la vena porta, intraesplénica y vía intraperitoneal2,7,8,40–44.
Los hepatocitos infundidos al llegar a los espacios portales los obstruirían, originarían fenómenos de isquemia-reperfusión, ocasionarían un aumento de la permeabilidad sinusoidal y permitirían el acceso de las células al lobulillo hepático. Al mismo tiempo, la isquemia-reperfusión origina liberación de citocinas y estimulación de las células de Kupffer que podría originar la destrucción y la fagocitosis de los hepatocitos infundidos. En casos de cirrosis hepática, la existencia de la hipertensión portal facilita la migración de los hepatocitos infundidos a localizaciones extrahepáticas45.
En los adultos y los casos de hepatopatía crónica o FHF, el bazo se considera el sitio de elección. El acceso por la arteria esplénica mediante un catéter colocado a través de la arteria femoral, para implante en el bazo, resulta una combinación de hepatización esplénica y migración de los hepatocitos hasta el lecho hepático1,3,4,8,10,11. La infusión celular por punción directa en el bazo conlleva un importante riesgo de hemorragia, aunque facilita la integración y la supervivencia del hepatocito46.
En los niños con errores congénitos del metabolismo se prefiere un abordaje portal mediante un port-a-cath en la porta o mesentérica superior o a través de un acceso percutáneo2,7,9,15,17,41,42.
Otros lugares de infusión son la cavidad peritoneal, el páncreas y el parénquima pulmonar, aunque al parecer los hepatocitos sobreviven poco tiempo.
Es necesario el control de la presión portal durante la infusión mediante la realización de un eco-Doppler, dado que ésta suele experimentar un aumento pasajero durante la infusión, y prevenir así las complicaciones hemorrágicas e infecciosas.
6. Eficiencia del injerto celularTras la infusión celular en el receptor, el porcentaje de las células hepáticas que se implantan es limitado, y contrastan con la elevada viabilidad obtenida tras el aislamiento. Esta discordancia podría estar relacionada con la presencia de apoptosis, la apoptosis originada como consecuencia de la pérdida de adherencia celular denominada anoikis, y se caracteriza por la liberación del citocromo C desde la mitocondria, la condensación de la cromatina, la activación de caspasas y la formación de cuerpos apoptóticos, y está implicada en la muerte del hepatocito aislado y criopreservado30,47.
Estos fenómenos de apoptosis se han detectado a los 15min del aislamiento de los hepatocitos humanos mediante el test de TUNEL y anexina con citometría de flujo, de forma que la presencia de apoptosis podría explicar la discrepancia entre el test de azul de tripán y la eficiencia del cultivo celular que indica que las células no son capaces de adherirse, ya que son apoptoicas30,48.
Crioconservación de hepatocitos: posibilidad de un tratamiento celular programadoEl desfase de tiempo entre la obtención de hepatocitos y su utilización hace que se puedan perder muchos recursos por la falta de métodos para su conservación durante períodos de tiempo prolongados.
La opción de congelar las células hepáticas aisladas posibilita realizar el trasplante celular en un momento óptimo, y se dispone de un remanente de células que posibilita repetir infusiones de forma periódica.
La congelación celular constituye la mejor estrategia para criopreservar las células, y existen factores clave en el proceso de congelación.
La velocidad de congelación constituye un factor muy importante; si la velocidad con la que se congelan las células es lenta, el hepatocito puede sufrir un proceso de deshidratación, pero si es muy rápida, el agua intracelular no llega a salir y se congela. Consecuencia de esto es la formación de cristales que junto con las fluctuaciones de volumen celular ocasionarán daño en la membrana celular y rotura de la célula y causarán necrosis celular.
Se ha identificado la apoptosis como la causa más importante de muerte celular inducida por la criopreservación27,30. Fisher encuentra que la viabilidad del hepatocito disminuye significativamente dentro de los 60min de la congelación, y describe menor daño celular en hepatocitos de los hígados con función normal que en los procedentes de los hígados con esteatosis superior al 40–50%49.
La densidad celular y el volumen de las células almacenadas influyen también en la viabilidad celular tras la descongelación. Se ha demostrado una mayor viabilidad si se congelan entre 106–107 células, y se obtiene mejor viabilidad con el empleo de dimetilsufóxido.
En los protocolos de congelación, la disminución de la temperatura se realiza gradualmente al bajar 1 g/min hasta alcanzar temperaturas de −140°C antes de transferir las células a nitrógeno líquido21. El daño causado por la congelación se traduce en una disminución en la viabilidad celular (hasta un 50%) y la pérdida de funcionalidad21,50, y plantea la necesidad de buscar nuevos métodos de criopreservación18.
Pese a obtener resultados positivos tras la criopreservación, algunos autores prefieren usar células en fresco, aunque no existen estudios comparativos de ambas posibilidades.
Protocolo de crioconservaciónPara crioconservar los hepatocitos, se utiliza como medio de congelación solución de Wisconsin (UW) con el 10% de dimetilsufóxido como agente crioprotector.
La congelación de la suspensión se realiza en bolsas de 250ml; se congelan 50ml en cada bolsa con una densidad celular de 20 millones de células/ml mediante un congelador biológico de descenso programado de la temperatura (CM-2000, Carburos Metálicos) hasta alcanzar −140°C. Posteriormente las células se almacenan en nitrógeno líquido a −196°C10,12,35.
Por cada bolsa preparada, se congelan 2 crioviales a fin de poder caracterizar funcionalmente las células de forma previa a la descongelación.
La descongelación de las células se hace mediante inmersión de las bolsas en el baño termometrado a 37°C. A continuación, se procede a la dilución del medio de criopreservación con un medio adecuado, centrifugación a −4°C durante 5min y eliminación del sobrenadante. El sedimento celular se resuspende en un volumen adecuado de medio para infundir al paciente y se determina la viabilidad celular (fig. 3).
De los 13 aislamientos realizados en la UTCH, la viabilidad, que tras el aislamiento se situaba entre el 78–89%, descendió en todos los casos en porcentajes cercanos al 20% (tabla 2), y se conservó su viabilidad y funcionalidad durante períodos de tiempo prolongados al congelarlas en nitrógeno líquido33.
ConclusiónEl éxito del tratamiento celular está condicionado por la disponibilidad de las células hepáticas viables y funcionales en número y calidad funcional suficientes. Los hígados que no se utilizan para TH ortotópico constituyen la fuente principal de tejido para obtención de los hepatocitos. Es preciso adecuar el proceso de aislamiento de hepatocitos a partir de los hígados enteros o los lóbulos hepáticos y determinar las condiciones óptimas de utilización del tejido hepático para aislamiento y cultivo de hepatocitos así como la calidad de los hepatocitos aislados.
Pese al avance alcanzado en la criopreservación de los hepatocitos humanos, es necesario optimizar los protocolos de congelación/descongelación para disponer de bancos de hepatocitos viables y funcionales que permitan un mejor aprovechamiento y el uso programado de los escasos recursos existentes.
En los últimos años se ha intentado desarrollar modelos celulares hepáticos que permitan superar la escasez de hepatocitos y constituir una alternativa para tratamiento celular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.