Introducción
A principios de la década de los ochenta, Schaldenbrand y Appelman1 aplicaron el término "tumor estromal" para referirse colectivamente a un grupo de neoplasias mesenquimales que recibían diferentes denominaciones, sin aparentar una diferenciación neurogénica o miogénica franca. Gradualmente, el término GIST (tumores gastrointestinales estromales) fue ganando aceptación, reflejando tanto la incertidumbre acerca de su verdadero origen como las dificultades ocasionalmente asociadas con la predicción de su comportamiento biológico. Los GIST son los tumores mesenquimales más frecuentes del tracto gastrointestinal y la mayoría se localiza en el estómago, seguido del intestino delgado.
Las células de los GIST muestran características similares a las de las células intersticiales de Cajal, que desempeñan un papel neuromotor en la regulación de la motilidad intestinal normal, caracterizándose por la expresión de KIT (tirosincinasa). En la actualidad se utiliza un marcador inmunohistoquímico (CD117) de manera sistemática para distinguir entre los GIST y otras neoplasias mesenquimales que afectan al tracto gastrointestinal (tumores no-GIST). Se acepta una sobreexpresión de la proteína KIT (CD117) como marca fundamental en tumores provenientes de las células intersticiales de Cajal y parece claro que la positividad a CD117 es diagnóstico en este tipo de lesiones en un 95% de los casos2, con un mejor rendimiento que otros tipos de marcadores como el CD34, cuya positividad es del 60%. Un 5% de los GIST es negativo para c-KIT y, de ellos, un 90% tiene mutaciones de KIT o de PDGFRA.
El objetivo del trabajo es presentar una amplia serie de GIST de localización gástrica y discutir aspectos de diagnóstico, tratamiento y pronóstico.
Pacientes y método
Entre julio de 1996 y junio de 2004 se ha tratado en nuestro Servicio a 18 pacientes con el diagnostico de GIST de localización gástrica, 12 mujeres y 6 varones, con una edad media de 63 años (rango, 33-84 años). En todos los pacientes se llegó al diagnóstico de GIST, confirmado por anatomía patológica, sobre la base de estudios inmunohistoquímicos que incluyeron: vimentina positiva, actina negativa, proteína S-100 negativa y, desde el año 2001, positividad de CD34 y CD117 (de forma retrospectiva se confirmó positividad a CD117 en los casos anteriores a esta fecha). Se han analizado los siguientes aspectos:
1. Clínica.
2. Métodos diagnósticos (gastroscopia, tránsito baritado esófago gastroduodenal [TEGD], ecografía, tomografía computarizada [TC], punción-aspiración con aguja fina [PAAF], inmunohistoquímica).
3. Localización del tumor.
4. Tratamiento quirúrgico realizado.
5. Factores pronósticos del tumor: tamaño del tumor, número de mitosis/50 hpf (campos de alta resolución), factor de proliferación celular Ki67 y aparición de necrosis tumoral.
6. Morbimortalidad.
7. Clasificación pronóstica de los tumores (Miettinen et al, 20023): a) probablemente benignos; b) probablemente malignos, y c) bajo potencial maligno o pronóstico incierto.
8. Seguimiento (controles al mes, a los 3 y 6 meses y, después anualmente mediante la realización de radiografía de tórax, endoscopia, ecografía abdominal y/o TC).
9. Recidiva.
Resultados
La localización de los tumores fue la siguiente: 7 en el tercio gástrico proximal (cerca del cardias en 4 casos), 7 en el cuerpo gástrico y 4 en el cuerpo gástrico distal. Se observó ulceración de la mucosa en 16 casos (88,9%).
Clínicamente predominaron signos y síntomas de hemorragia digestiva alta, objetivándose melenas en 6 pacientes y hematemesis en 4. Se observó dolor abdominal en 7 de pacientes, palpación de masa en 2 e intolerancia alimentaria en 1.
En los datos analíticos, lo único llamativo fue una anemia severa, con cifras de hematocrito < 25%, en 7 pacientes (39%). Como pruebas diagnósticas se utilizaron la endoscopia alta en 14 pacientes, la ecografía abdominal en 7, la TC con contraste por vía oral e intravenosa en 15 y el tránsito baritado en 3, consiguiéndose el diagnóstico preoperatorio de probable GIST gástrico en 13 de los casos con intervención programada y en 3 de los urgentes. La confirmación anatomopatológica preoperatoria sólo se obtuvo en los 5 pacientes en los que se realizó una PAAF dirigida de la masa.
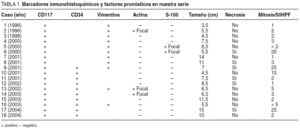
Todas las piezas fueron estudiadas por el servicio de anatomía patológica de nuestro hospital mediante estudios de inmunohistoquímica, utilizándose en los 8 primeros pacientes criterios de vimentina positiva, actina negativa y S-100 negativa por no disponer hasta el año 2001 de CD34 y CD117. En el resto, y siempre con los marcadores actina y S-100 negativos, se utilizó también el criterio de positividad para CD34 y CD117 (tabla 1). Los criterios pronósticos valorados en cada tumor se recogen en la tabla 1; cabe destacar el tamaño del tumor, con una media de 7 cm (rango 3,5-15), el número de mitosis que indicó un posible mal pronóstico en 5 casos y la necrosis tumoral que estuvo presente en la tercera parte de los casos. La clasificación pronóstica de los tumores fue: 2 casos probablemente benignos, 8 probablemente malignos y 8 de bajo potencial maligno o pronóstico incierto.
Se intervino de forma electiva a 14 pacientes, uno de ellos por un hallazgo casual al efectuar una laparatomía tras el diagnóstico de neoplasia de páncreas avanzada. En otros 4 casos la cirugía fue realizada con urgencia: en 2 por cuadro de hemoperitoneo y shock hipovolémico tras rotura de la tumoración, en 1 por hemorragia digestiva alta masiva, y en 1 por un cuadro de colecistitis aguda (en el que se encontró el GIST de forma casual).
El tratamiento quirúrgico realizado fue el siguiente: resección gástrica subtotal en 3 casos, resección gástrica atípica en 10 pacientes (este tipo de resección también se realizó en los 4 pacientes con la tumoración cercana al cardias) y gastrectomía parcial distal de extensión variable en 5. No había infiltración de estructuras vecinas. La estancia media postoperatoria fue de 7,1 días (rango, 6-15). La morbilidad postoperatoria fue baja y consistió en intolerancia oral por paresia gástrica en 3 casos, íleo postoperatorio en 2, infección de la herida quirúrgica en 2 y neumonía en 1. Una paciente falleció en el postoperatorio por un infarto agudo de miocardio masivo (5,6%).
El seguimiento medio fue de 37,5 meses (rango, 2-96) y durante éste no se detectó recidiva del GIST en ninguno de los pacientes, con controles clínicos y radiológicos normales. Sólo ha fallecido 1 paciente (5,9%), el cual había sido intervenido con diagnóstico de neoplasia de páncreas. Una paciente con diagnóstico de síndrome de Carney está siendo tratado en el servicio de oncología con imatinib mesilate tras la aparición y la exéresis de paragangliomas cervicales y pélvicos.
Discusión
Los GIST son las neoplasias de origen mesenquimal más frecuentes del tubo digestivo. Sobreexpresan el producto del gen c-Kit (tirosincinasa), detectable por inmunotinción mediante el anticuerpo CD117. Constituyen una entidad clínica relativamente "nueva" (aún hoy algunas publicaciones los confunden con los leiomiomas y leiomiosarcomas) y es necesaria la cooperación entre patólogos, cirujanos, radiólogos y oncólogos para un correcto diagnóstico y tratamiento y una adecuada aplicación pronóstica.
Son tumores que se presentan con una incidencia anual de 20 casos por cada millón de habitantes4. Es más frecuente en varones entre la quinta y la séptima décadas, con presentación localizada en el 60-70% de los casos. Se presentan de forma esporádica, aunque hay casos hereditarios raros. Pueden relacionarse con el síndrome de Carney5, como en una de nuestras pacientes, y a veces se asocian también con la neurofibromatosis tipo I. Su localización mayoritaria es el estómago (60-70%) seguida, en orden decreciente, por el intestino delgado (25-35%), el colon-recto (5%), el esófago (< 2%) y más raramente el epiplón, el mesenterio y el retroperitoneo. Con frecuencia se detectan de manera casual en exploraciones complementarias, laparoscopias y laparotomías6.
Macroscópicamente, crecen en el espesor de la pared respetando la mucosa, con medidas que oscilan entre 1 y 32 cm, con un media de 5 cm. Microscópicamente constituyen lesiones seudoexpansivas e infiltrantes, con crecimiento fascicular, de células fusiformes o epitelioides y estroma variable. Otros rasgos son: necrosis, hemorragia, fenómenos inflamatorios y trombos intravasculares.
En las últimas tres décadas se ha debatido mucho acerca de su nomenclatura, su origen celular, su diagnóstico y su pronóstico. Desde 1940 eran consideradas como neoplasias de músculo liso (leiomiomas, leiomiosarcomas, leiomioblastomas, etc.)7. Con la llegada de la microscopia electrónica se describen tumores de este grupo sin evidencia ultraestructural de diferenciación de músculo liso. Posteriormente, con la inmunohistoquímica, muchas lesiones pierden la inmunofenotipificación de diferenciación de músculo liso y Mazur y Clark8 en 1983, designan genéricamente a estas lesiones como "tumores de la estroma".
A comienzos de la década de los noventa se habla de GIST de origen muscular, de origen neurógeno y otros mixtos, e incluso de GIST sin un origen claro. Finalmente se definen dos corrientes: una circunscribe dentro de los GIST a todas las neoplasias mesenquimales del tracto digestivo, sin buscar diferencias inmunohistoquímicas, incluidos los verdaderos leiomiomas y los schwannomas; la segunda intenta identificar estrictamente a un grupo de tumores mesenquimales con propiedades histopatológicas comunes que excluya los leiomiomas y schwannomas (tras observar que había tumores que mostraban inmunopositividad a CD34). Sin embargo, no más del 60-70% de los GIST son CD34+ y, además, algunos schwannomas y leiomiomas eran CD34+. Los estudios posteriores se centraron en la búsqueda de un marcador que pudiera identificar tumores de la estroma no miogénicos y no schwannomas.
La inmunorreactividad de KIT (CD117) define a un grupo de tumores mesenquimales que muestran diferenciación hacia las células intersticiales de Cajal (pacemaker cells), que forman la interfase entre la inervación autonómica de la pared intestinal y el músculo liso propiamente dicho. La gran mayoría de los tumores mesenquimales cae dentro de esta categoría histogenética2,3. Nuestra serie ha sido en su totalidad CD117 positiva, incluso 1 caso con diagnóstico inicial de leiomioma en el que, tras aplicar retrospectivamente el CD117, se ha comprobado que se trataba de un GIST.
Actualmente, la definición operativa de los GIST se basa en la expresión de la proteína CD117, codificada por el protooncogén c-KIT (receptor de membrana con actividad tirosincinasa). Son tumores CD117 positivos (95%) y CD34+ (60-70%) y pueden ser de forma focal y raramente actina positivos (30-40%), S-100 positivos (5%) y muy raramente desmina positivos (2-4%). Un 5% de los GIST son CD117 negativos en relación con mutaciones en el protooncogén c-KIT.
Clínicamente, los GIST pueden cursar con hemorragia gastrointestinal por ulceración de la mucosa (20-50%); así, en nuestra serie, la anemia ha sido un dato predominante que incluso ha ocasionado en 1 paciente una hemorragia digestiva masiva. Aparecen molestias abdominales en el 50-70% y más raramente masas palpables. Los tumores pediculados y los pilóricos pueden manifestarse como una obstrucción pilórica. La rotura intraabdominal del tumor puede constituir una urgencia quirúrgica (hemoperitoneo o peritonitis), como ocurrió en 2 de nuestros pacientes. En el 18% de los pacientes el diagnóstico está en relación con la presencia de enfermedad metastásica6, aunque esta circunstancia no se ha observado en nuestra serie.
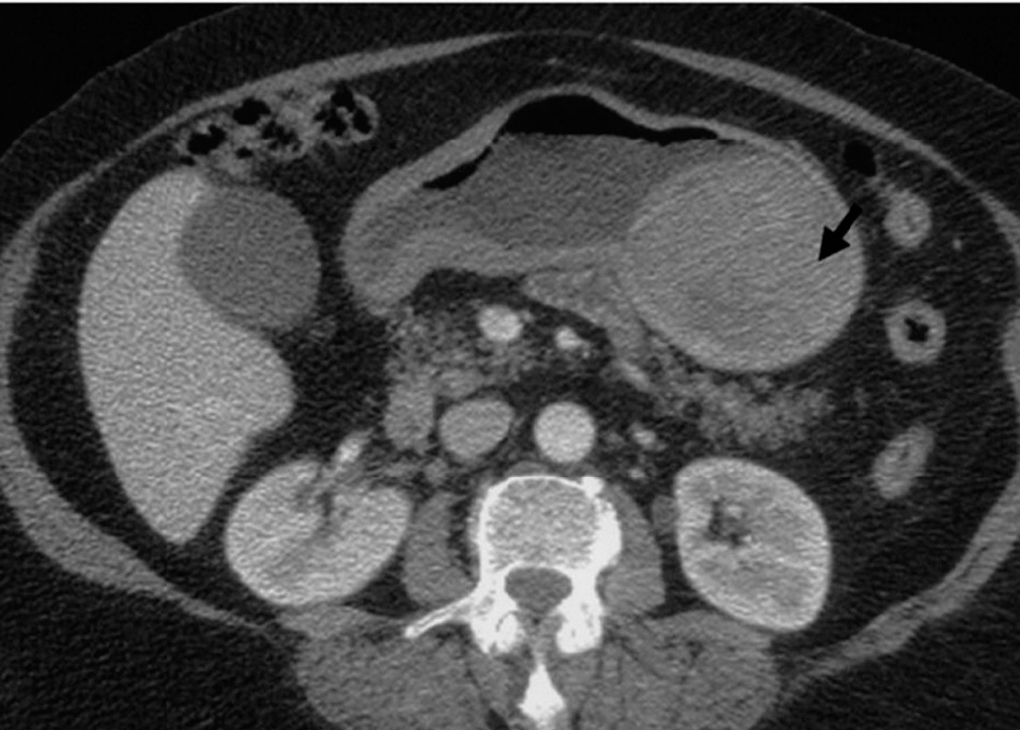
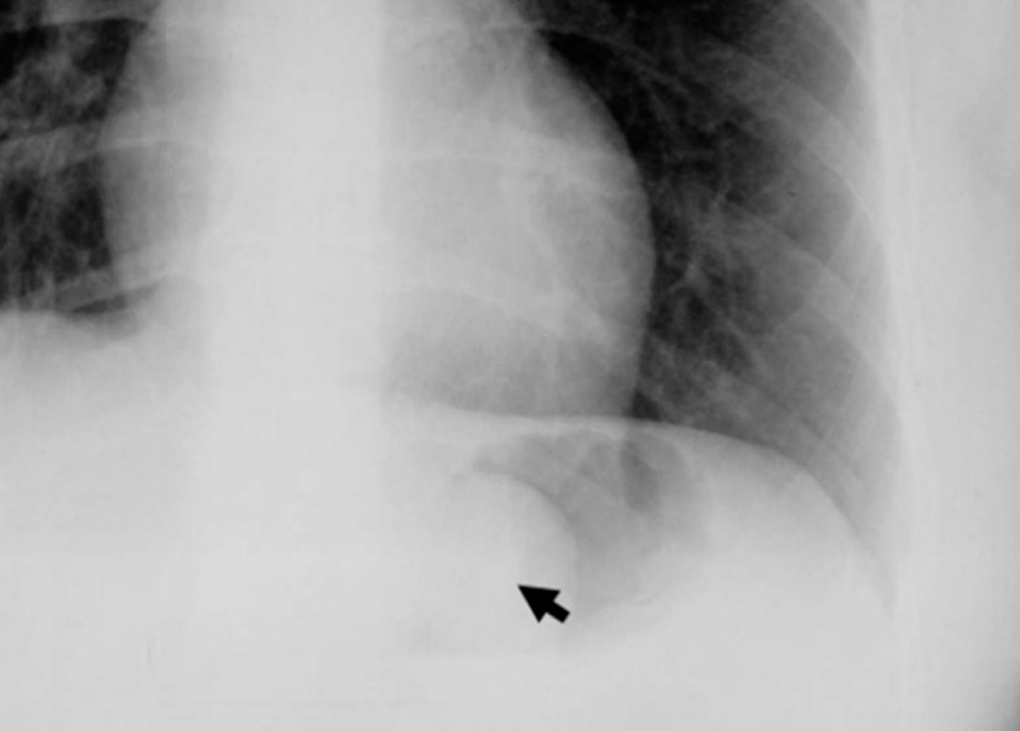
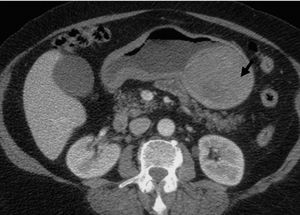
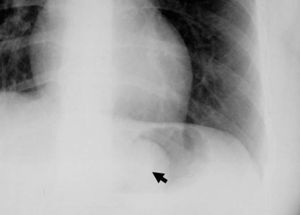
El diagnóstico se inicia con la sospecha clínica y la analítica es de poca utilidad. Las pruebas de imagen fundamentales son la ecografía y la TC (fig. 1) (con contraste por vía oral e intravenosa), aunque en ocasiones pueden ser útiles la radiología simple (fig. 2), la radiología contrastada (TEGD) y la resonancia magnética. En nuestra serie, la ecografía y la TC mostraron una sensibilidad diagnóstica parecida. La gastroscopia revela una tumoración submucosa y, aunque habitualmente no es útil, la biopsia endoscópica puede sugerir un tumor estromal, si bien la sonoendoscopia puede mejorar su rendimiento en la evaluación preoperatoria de estas lesiones. Con la PAAF dirigida por imagen se puede llegar al diagnóstico de GIST por estudios preoperatorios de inmunohistoquímica, como ocurrió en 5 de nuestros pacientes, aunque la NCCN GIST Task Force Report recomienda no realizar una biopsia preoperatoria ante un tumor fácilmente resecable, ya que podría causar hemorragia y puede aumentar el riesgo de diseminación. Estaría quizá justificada en tumores localmente avanzados en los que pueda haber dudas diagnósticas y se plantee la indicación del tratamiento con imatinib.
Fig. 1. GIST gástrico evidenciado en una tomografía computarizada abdominal (flecha).
Fig. 2. Tumoración gástrica estromal en el fundus, visible en la radiología simple de abdomen (flecha).
El diagnóstico diferencial anatomopatológico incluye también otras neoplasias mesenquimales (no GIST) con perfiles inmunohistoquímicos diferentes (tabla 2), como leiomiomas, leiomiosarcomas, schwannomas, melanoma metastásico y liposarcoma desdiferenciado; en estos dos últimos casos es particularmente difícil porque tienen una morfología parecida y son CD117 positivos.
El tratamiento es quirúrgico e implica la resección de toda la enfermedad visible, con la extirpación completa con su seudocápsula, con margen de tejidos blandos y pared normal, y es necesaria la resección en bloque cuando haya invasión de tejidos adyacentes6,9,10, lo que no ocurrió en ninguno de nuestros pacientes (pese al gran tamaño de alguno de los tumores). La rotura se asocia a una mayor posibilidad de siembra peritoneal11, si bien en las 2 pacientes tratadas por nosotros con rotura del tumor este hecho no se ha constatado es su seguimiento. No es de utilidad la linfadenectomía12 y no se ha practicado en ninguno de nuestros pacientes. El abordaje laparoscópico puede ser una opción válida en el tratamiento de estos tumores.
Son tumores resistentes al tratamiento quimioterápico y radioterápico13, si bien en la actualidad es posible utilizar el imatinib mesilato (inhibidor selectivo de las tirosincinasas), que no altera la estructura de los vasos, no los lesiona y provoca la involución de las células intersticiales, que pierden su actividad c-Kit14,15. Se postula su uso como tratamiento adyuvante y/o neoadyuvante ante GIST de gran tamaño inicialmente irresecables y en aquellos casos en los que la cirugía es dificultosa para conseguir una resección completa de la enfermedad, pero con resultados anatomopatológicos de la pieza negativos para células tumorales16,17. En nuestra serie se ha utilizado en el caso de la paciente afectada del síndrome de Carney.
En cuanto al pronóstico, los GIST son tumores potencialmente agresivos que metastatizan en el hígado, el peritoneo o el pulmón hasta en un 38% de los pacientes18, incluso 30 años después del diagnóstico. La capacidad de recidiva se cifra en un 50-60% de los casos9. El GIST metastásico es siempre fatal y se presenta con diseminación abdominal, preferentemente hepática y peritoneal, la supervivencia a los 5 años es del 54%19 y se observa respuesta a la quimioterapia en menos del 5% de los casos. El criterio más fiable, en cuanto a su potencial maligno, sería la presencia de metástasis peritoneales o mesentéricas durante la cirugía, o invasión de los órganos vecinos. Un factor pronóstico médico-dependiente es la radicalidad quirúrgica9 y, así, se distinguen los R0 (tumores resecados sin evidencia de tumor macroscópico ni microscópico en los bordes), R1 (tumores con evidencia de tumor microscópico) y R2 (evidencia de tumor macroscópico). Otros criterios se-rían los protooncogenes y el factor de proliferación celular Ki67, si bien aún no está demostrado. Otros elementos que se deben valorar junto con lo anterior son la localización del tumor, el tamaño, la necrosis tumoral o el número de mitosis3,11,13,18,20.
Según Miettinen et al3 (2002), el pronóstico de los GIST sería el siguiente:
1. Probablemente benignos: los intestinales < 2 cm y con no más de 5 mitosis/50 HPF. Los gástricos < 5 cm y con no más de 5 mitosis/50 HPF.
2. Probablemente malignos: los intestinales > 5 cm o con más de 5 mitosis/50 HPF. Los gástricos > 10 cm o con más de 5 mitosis/50 HPF.
3. De pronóstico incierto o de bajo potencial maligno: los de tamaño intermedio y con no más de 5 mitosis/50 HPF.
Es preciso avanzar en el conocimiento íntimo de estas neoplasias y alcanzar criterios diagnósticos unificados de consenso, insistiendo en la necesidad de colaboración entre anatomopatólogos y clínicos, ya que probablemente se trata de un grupo heterogéneo de tumores, lo que conlleva implicaciones pronósticas y terapéuticas. Es previsible que, en un futuro próximo, el desarrollo y la aplicación sistemática de técnicas de patología molecular tengan una incidencia importante en este sentido.
Correspondencia: Dr. J.G. Martín-Lorenzo.
Servicio de Cirugía General y Aparato Digestivo.
Hospital General Universitario J.M. Morales Meseguer.
Infanta Cristina, 1, esc. 3, 2.° A. 30007 Murcia. España.
Correo electrónico: juang.martin@carm.es
juang.martin@ono.com
Manuscrito recibido el 27-12-2004 y aceptado el 27-9-2005.