La enfermedad tiroidea nodular posee el potencial de desarrollar malignidad. El objetivo es evaluar la importancia de la resonancia magnética ponderada por difusión cervical (IRM-DP) para la detección de nódulos tiroideos malignos.
MétodoEl grupo de estudio lo constituyen los pacientes intervenidos por enfermedad tiroidea, en los que preoperatoriamente se les realizó 3 métodos diagnósticos: biopsia guiada por PAAF, US e IRM-DP. El grupo de estudio total se dividió en 2 subgrupos, de acuerdo con la evaluación postoperatoria patológica final de los nódulos en 2 grupos: «grupo benigno» y «grupo de malignidad». Se evaluaron 65nódulos tiroideos operados, en 58 pacientes. Los parámetros preoperatorios, (datos demográficos, los hallazgos ecográficos, los resultados de la biopsia por aspiración con aguja fina y los valores del coeficiente de difusión aparente (CDA) de los nódulos en IRM-DP), se compararon con los resultados de los exámenes patológicos postoperatorios.
ResultadosEl «grupo benigno» lo constituyen 50 (76,9%) nódulos, mientras que 15 (23,1%) nódulos constituyeron el «grupo de malignidad». Los valores mínimos, máximos y medios de CDA de los nódulos fueron significativamente más bajos en el grupo con malignidad (p <0,05). El mejor valor de corte para el valor medio de CDA fue 1,33 × 10-3 mm2/s, con una sensibilidad del 66,67%, una especificidad del 89,13%, un valor predictivo positivo del 53,63% y un valor predictivo negativo del 89,13%. Un valor medio de CDA igual o inferior a 1,33 × 10-3 mm2/s se asoció a un riesgo 9 veces mayor de malignidad (p<0,01, odds ratio: 9,111, intervalo de confianza del 95%: 2,49-33,21).
ConclusionesEl valor de CDA detectado en IRM-DP cervical puede considerarse como un parámetro predictivo para la detección de cáncer de tiroides.
Nodular thyroid disease possesses the potential to harbor malignancy. Our aim was to evaluate the significance of cervical diffusion-weighted magnetic resonance imaging (DW-MRI) for the detection of malignant thyroid nodules.
MethodsSixty-five thyroid nodules from 58 patients who had undergone surgery were evaluated. Preoperative parameters, demographic data, ultrasound findings, fine-needle aspiration biopsy results and apparent diffusion coefficient (ADC) values of the nodules at DW-MRI were compared with the results from postoperative pathology examinations.
ResultsThe “benign group” included 50 (76.9%) nodules, while 15 (23.1%) nodules constituted the “malignancy group”. Minimum, maximum and mean ADC values of the nodules were significantly lower in the malignancy group (p < 0.05). The best cutoff value for the mean ADC value was 1.33 × 10-3 mm2/s, with a sensitivity of 66.67%, a specifity of 89.13%, a positive predictive value of 53.63% and a negative predictive value of 89.13%. A mean ADC value equal to or lower than 1.33 × 10-3 mm2/s was associated with 9 times higher risk of malignancy (odds ratio: 9.111, 95% confidence interval: 2.49-33.21).
ConclusionsThe ADC value detected by cervical DW-MRI can be considered a predictive parameter for the detection of thyroid cancer.
La enfermedad tiroidea nodular es una condición clínica común que afecta aproximadamente del 2 al 7% de la población y posee el potencial de desarrollar malignidad1. Actualmente, ninguna de las herramientas de diagnóstico es capaz de excluir definitivamente la malignidad tiroidea.
La ultrasonografía (US) constituye la modalidad de diagnóstico inicial más usada para la evaluación de la enfermedad tiroidea nodular2. La estructura, las dimensiones, la ecogenicidad y la presencia de calcificaciones de un nódulo pueden ser visualizadas por medio de la US tiroidea. La biopsia por aspiración con aguja fina (PAAF) se realiza en nódulos que presenten hallazgos ecográficos sospechosos, con el fin de identificar o descartar su malignidad3. Aunque el enfoque de dicho diagnóstico de rutina es satisfactorio para el seguimiento de la mayoría de los casos, la biopsia por PAAF no logra discriminar la benignidad o malignidad de lesiones foliculares y células oxifílicas4-6.
La resonancia magnética (RM) es una modalidad de diagnóstico radiológico transversal que utiliza fuertes campos magnéticos y ondas de radio. Los tejidos blandos se evalúan anatómicamente a través de imágenes potenciadas de T1, mientras que las imágenes potenciadas de T2 son útiles para la detección de señales de intensidad patológica7,8. El material de contraste también puede usarse para resaltar los hallazgos patológicos.
La RM ponderada por difusión (IRM-DP) deriva su contraste de imagen a partir de las diferencias de movimiento de las moléculas de agua entre los tejidos.
El grado de restricción a la difusión de agua del tejido biológico se correlaciona inversamente con la celularidad tisular y la integridad de las membranas celulares9,10. El movimiento de las moléculas de agua está más restringido en los tejidos con una alta densidad celular asociada a numerosas membranas celulares intactas (es decir, tejido tumoral)11. Por el contrario, en áreas de baja celularidad o donde se ha roto la membrana celular, el movimiento de las moléculas de agua está menos restringido.
El coeficiente de difusión aparente (CDA) se define como la medida de la magnitud de la difusión (de las moléculas de agua) dentro de los tejidos. El CDA se calcula para cada píxel de la imagen y se muestra como un mapa paramétrico. Al dibujar regiones de interés (RDI) en estos mapas, los valores de CDA de los diferentes tejidos se pueden derivar11,12. Las áreas de difusión restringida en zonas altamente celulares muestran valores bajos del CDA en comparación con las áreas menos celulares, que proporcionan valores más altos del CDA11.
Aunque las IRM-DP no son rutinariamente usadas en la evaluación diagnóstica de las enfermedades tiroideas, existen estudios que revelan que esta modalidad de imágenes puede proporcionar información sobre el potencial maligno de un nódulo tiroideo6,13-15.
El objetivo es evaluar el valor diagnóstico de las IRM-DP y del CDA para la detección de nódulos malignos en la enfermedad tiroidea nodular.
MétodosEl grupo de estudio lo constituyen los pacientes intervenidos por enfermedad tiroidea, en los que preoperatoriamente se les realizó 3métodos diagnósticos: biopsia guiada por PAAF, US e IRM-DP. El grupo de estudio total se dividió en 2subgrupos, de acuerdo con la evaluación postoperatoria patológica final de los nódulos en 2grupos: «grupo benigno» y «grupo de malignidad».
Los criterios de exclusión fueron: pacientes intervenidos para completar tiroidectomía, o cirugía por enfermedad tiroidea nodular recurrente, casos con IRM de baja calidad, presencia de antecedentes de radioterapia en el cuello o antecedentes de cirugía de cuello.
Se registraron los parámetros del grupo de estudio que incluyen los datos demográficos de los pacientes, hallazgos ecográficos, resultados de la citopatología de PAAF y los valores del CDA de los nódulos en IRM-DP. Este estudio fue aprobado por el Comité de Ética de nuestra institución, así como los formularios de consentimiento informado fueron firmados por todos los pacientes.
El estudio de IRM se realizó con una unidad de RM de 1,5 T (GE Signa HDxt, GE Healthcare, General Electric Company, Reino Unido). Los pacientes se colocaron en posición supina y las imágenes obtenido con una bobina de matriz que se coloca alrededor del cuello. La secuencia de giro de la US se utilizó para obtener imágenes axiales ponderadas en T1 (TR: 560, TE: 10ms) y ponderadas en T2 (TR: 3.000, TE: 100ms) para la evaluación de la anatomía relevante y para determinar los componentes quísticos. Se eligió para estas secuencias un grosor de sección de 3mm y un espacio de intersección de 1mm, con un campo de visión (CDV) de 15cm. Las imágenes ponderadas por difusión se obtuvieron usando una secuencia de formación de imágenes ecoplanas de toma única (TR: 5.000, TE: 60ms), con un valor b de 1.000 s/mm2, grosor de corte de 2-4mm, un CDV de 26cm y tamaño de matriz de 192 × 256. Los valores de CDA de los nódulos se calcularon por el mismo radiólogo, ciego a los resultados de la citolopatología de aspiración con aguja fina (AAF). En las secuencias ponderadas en T1 y T2, las RDI, tanto para los nódulos como para los tejidos tiroideos normales extranodulares, fueron dibujados por el radiólogo teniendo cuidado de excluir grandes áreas quísticas, si están presentes. Las RDI ubicadas en los nódulos y las áreas normales de los tejidos tiroideos se midieron entre 25-50 mm2. Después de la determinación de las RDI, los valores mínimos, máximos y medios de CDA se calcularon automáticamente mediante el software del sistema.
Se obtuvieron comparaciones de los valores mínimos, máximos y medios de CDA entre nódulos malignos y benignos, o entre los nódulos patológicos y los tejidos tiroideos normales extranodulares, con el fin de obtener los resultados del estudio.
La prueba U de Mann-Whitney, la prueba de chi cuadrado de Pearson, la prueba exacta de Fisher, la prueba de Fisher-Freeman-Halton y la corrección de Yates fueron utilizadas para el análisis estadístico. Las diferencias se consideraron estadísticamente significativas cuando p <0,05.
ResultadosEl grupo de estudio consistió en 65nódulos tiroideos de 58pacientes tratados mediante cirugía tiroidea. Cincuenta y dospacientes (87,9%) eran mujeres y 7 (12,1%) eran hombres. La edad promedio fue de 49 ± 12 años (rango: 18-71). De acuerdo con las evaluaciones patológicas finales de las muestras postoperatorias, el «grupo benigno» consistió en 50 nódulos (76,9%), mientras que 15nódulos (23,1%) constituyeron el «grupo de malignidad».
El tamaño medio de los nódulos fue de 27,00 ± 8,80 (rango: 10-56) mm. Según los resultados de la biopsia preoperatoria de US y la PAAF, 44nódulos (67,7%) se determinaron benignos, mientras que 9(13,8%) fueron cáncer o neoplasia folicular/de células de Hurthle, 7 (10,8%) fueron atipia de significado indeterminado y 5nódulos (7,7%) fueron determinados como citopatología no diagnóstica.
Todos los pacientes fueron tratados mediante cirugía tiroidea debido a hallazgos sospechosos en la US (es decir, nódulo sólido con márgenes irregulares, tamaño aumentado de los nódulos, hipoecogenicidad, presencia de calcificaciones, etc.) o resultados de la biopsia por PAAF. La distribución de los procedimientos quirúrgicos entre todo el grupo de estudio se resume en la tabla 1.
Distribución de los procedimientos quirúrgicos en el grupo de estudio
| Procedimiento quirúrgico | n | % |
|---|---|---|
| Tiroidectomía total bilateral | 29 | 50 |
| Tiroidectomía total unilateral | 20 | 34,4 |
| Tiroidectomía unilateral total y contralateral subtotal | 4 | 6,89 |
| Tiroidectomía bilateral casi total | 4 | 6,89 |
| Tiroidectomía total bilateral y disección radical del cuello modificada | 1 | 1,72 |
No se detectaron diferencias estadísticamente significativas entre el grupo benigno y el grupo con malignidad en relación con la citología no diagnóstica, la citología benigna o la atipia de importancia indeterminada obtenida mediante biopsias por PAAF preoperatorias (p> 0,05). Las tasas de los resultados de PAAF preoperatorios que revelaron cáncer o neoplasia folicular/de células de Hurthle fueron significativamente más altas en el grupo con malignidad en comparación con el grupo benigno (p = 0,001; p <0,01). Las comparaciones entre los resultados de la biopsia PAAF preoperatoria y los resultados del examen patológico final postoperatorio de todos los nódulos en el grupo de estudio se resumen en la tabla 2.
Comparación de los resultados de la biopsia por aspiración con aguja fina con la media patológica postoperatoria
| Resultados patológicos | p | |||
|---|---|---|---|---|
| Biopsia por aspiración con aguja fina | Categoría de diagnóstico de acuerdo con el sistema Bethesda | Espécimen postoperatorio | ||
| Benigno (n = 50) | Maligno (n = 15) | |||
| n (%) | n (%) | |||
| Citopatología no diagnóstica | I | 4 (8,0) | 1 (6,7) | 1,000 |
| Benigno | II | 37 (74,0) | 7 (46,7) | 0,062 |
| Atipia de significado indeterminado | III | 7 (14,0) | 0 (0,0) | 0,188 |
| Neoplasia folicular/de células de Hurthle o maligna | IV, V | 2 (4,0) | 7 (46,7) | 0,001* |
Test exacto de Fisher.
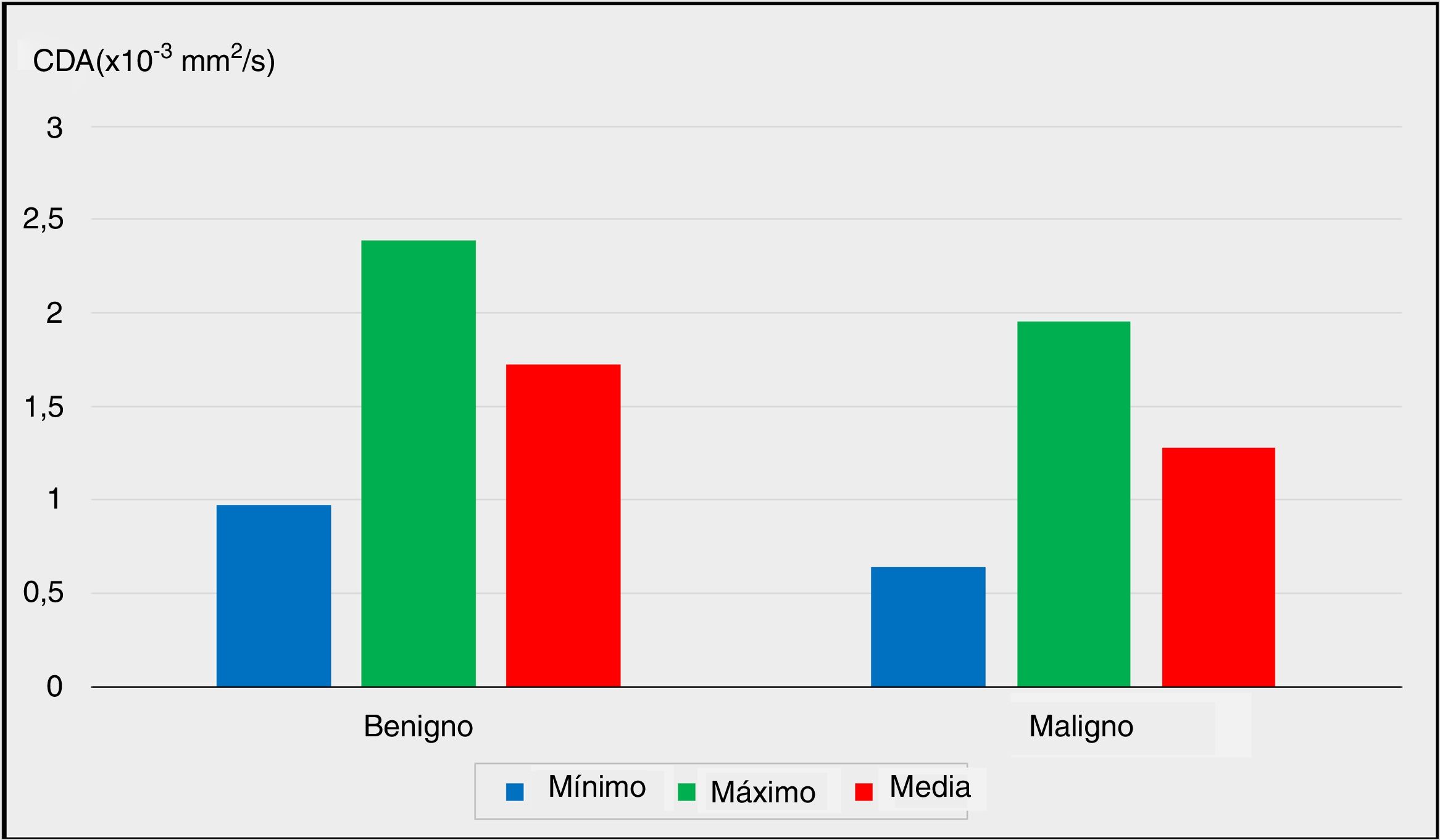
Los hallazgos IRM-DP preoperatorios se evaluaron radiológicamente para calcular los valores del CDA de los nódulos. Los valores mínimos y máximos del CDA de los nódulos fueron significativamente más bajos en el grupo con malignidad en comparación con el grupo benigno (p = 0,011 y p = 0,013, p <0,05 y p <0,05, respectivamente).
La comparación de los valores medios del CDA entre los grupos benignos y malignos reveló un nivel avanzado de significación (p = 0,001). El valor medio del CDA de los nódulos fue significativamente menor en el grupo con malignidad (p <0,01).
Las comparaciones de los valores medios de CDA de los tejidos tiroideos normales extranodular del mismo lóbulo tiroideo que albergaban el nódulo no revelaron diferencias estadísticamente significativas entre el grupo benigno y el grupo con malignidad (p = 0,213, p> 0,05).
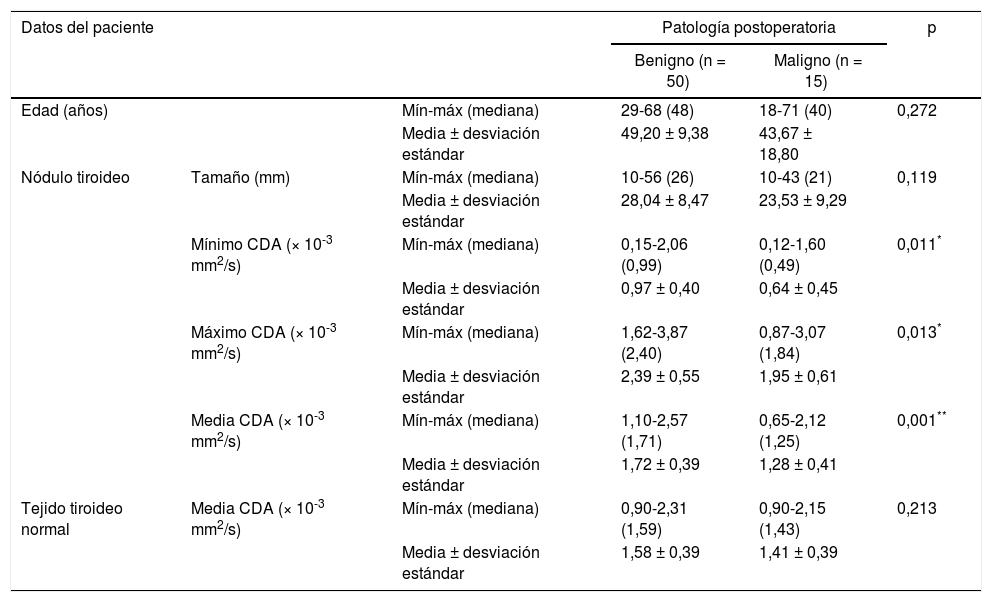
Las comparaciones de edad, tamaño de nódulo y valores de CDA entre el grupo benigno y el grupo con malignidad se resumen en la tabla 3.
Comparaciones de la edad, el tamaño del nódulo y los valores del CDA entre los grupos benignos y malignos
| Datos del paciente | Patología postoperatoria | p | |||
|---|---|---|---|---|---|
| Benigno (n = 50) | Maligno (n = 15) | ||||
| Edad (años) | Mín-máx (mediana) | 29-68 (48) | 18-71 (40) | 0,272 | |
| Media ± desviación estándar | 49,20 ± 9,38 | 43,67 ± 18,80 | |||
| Nódulo tiroideo | Tamaño (mm) | Mín-máx (mediana) | 10-56 (26) | 10-43 (21) | 0,119 |
| Media ± desviación estándar | 28,04 ± 8,47 | 23,53 ± 9,29 | |||
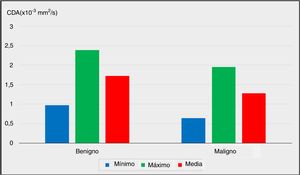
| Mínimo CDA (× 10-3 mm2/s) | Mín-máx (mediana) | 0,15-2,06 (0,99) | 0,12-1,60 (0,49) | 0,011* | |
| Media ± desviación estándar | 0,97 ± 0,40 | 0,64 ± 0,45 | |||
| Máximo CDA (× 10-3 mm2/s) | Mín-máx (mediana) | 1,62-3,87 (2,40) | 0,87-3,07 (1,84) | 0,013* | |
| Media ± desviación estándar | 2,39 ± 0,55 | 1,95 ± 0,61 | |||
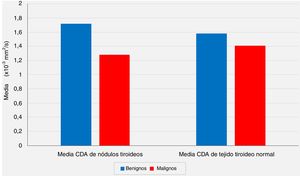
| Media CDA (× 10-3 mm2/s) | Mín-máx (mediana) | 1,10-2,57 (1,71) | 0,65-2,12 (1,25) | 0,001** | |
| Media ± desviación estándar | 1,72 ± 0,39 | 1,28 ± 0,41 | |||
| Tejido tiroideo normal | Media CDA (× 10-3 mm2/s) | Mín-máx (mediana) | 0,90-2,31 (1,59) | 0,90-2,15 (1,43) | 0,213 |
| Media ± desviación estándar | 1,58 ± 0,39 | 1,41 ± 0,39 | |||
U test de Mann-Whitney.
CDA: coeficiente de difusión aparente; máx: máximo; Mín: mínimo.
Las comparaciones de los valores mínimos, máximos y medios del CDA entre el grupo benigno y el grupo con malignidad se representan en la figura 1 (p <0,05, p <0,05 y p <0,01, respectivamente).
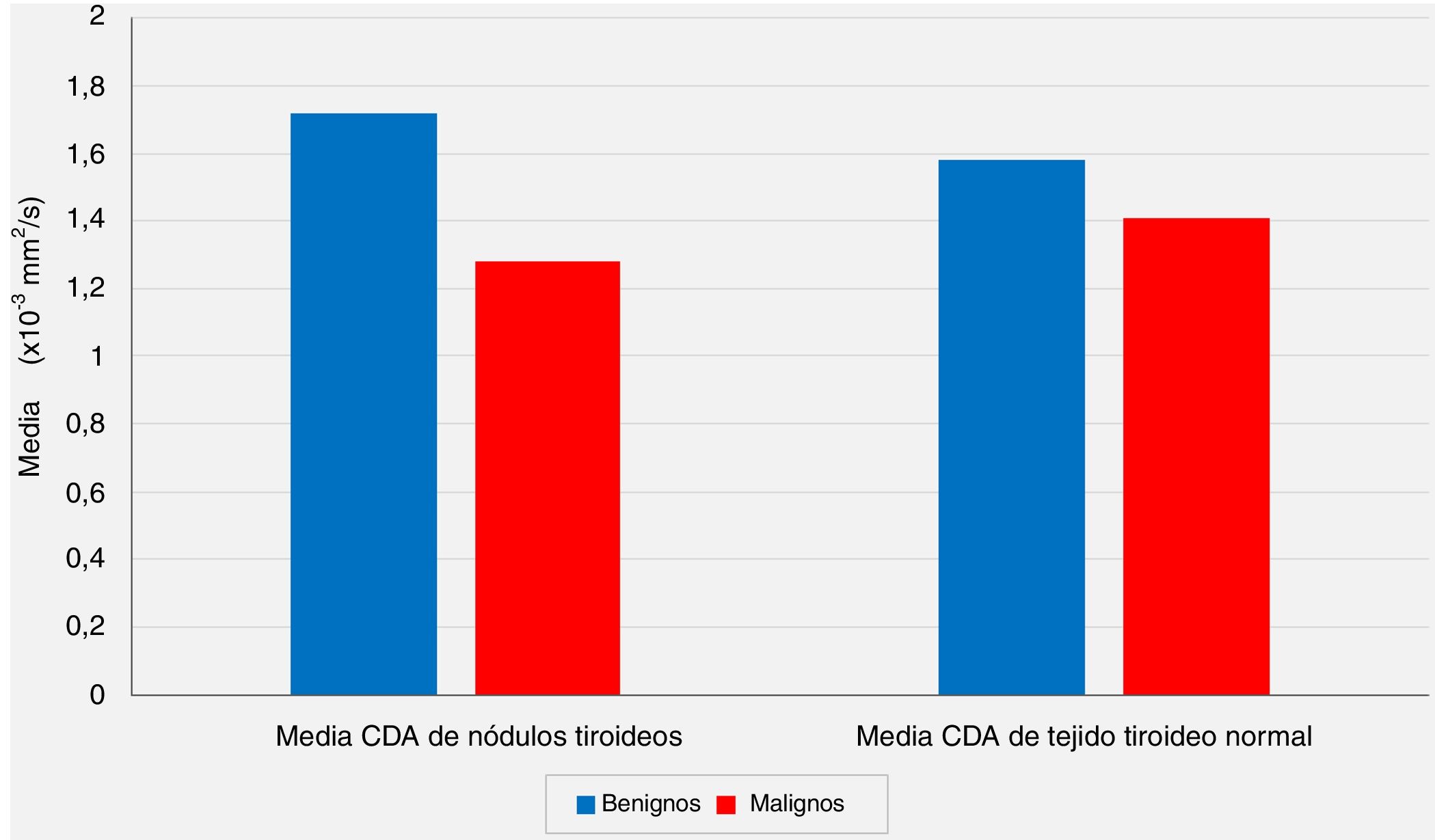
A pesar de la diferencia significativa entre los 2grupos con respecto a los valores medios del CDA de los nódulos, las comparaciones de los valores medios del CDA de los tejidos tiroideos normales extranodulares del mismo lóbulo tiroideo que alberga el nódulo no revelaron diferencias estadísticamente significativas entre el grupo benigno y el grupo con malignidad (p <0,05 y p> 0,05, respectivamente) (fig. 2).
La relación de los valores medios del coeficiente de difusión aparente (CDA) de los nódulos tiroideos y los valores medios de CDA de los tejidos tiroideos normales extranodulares con los resultados de las evaluaciones patológicas postoperatorias (p <0,05 y p> 0,05, respectivamente).
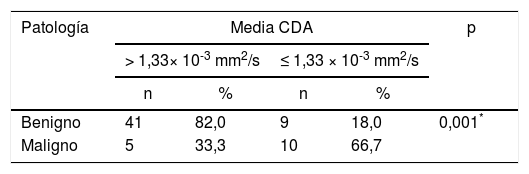
De acuerdo con los resultados postoperatorios de la enfermedad final, el mejor punto de corte para el valor del CDA medio se calculó como 1,33 × 10-3 mm2/s, con una sensibilidad del 66,67%, una especificidad del 89,13%, un valor predictivo positivo del 53,63% y un valor predictivo negativo de 89,13%. La odds ratio para los resultados patológicos se encontró como 9,111 (intervalo de confianza del 95%: 2,49-33,21). Se determinó que la detección de una media del CDA ≤ 1,33 × 10-3 mm2/s se asoció a un riesgo 9veces mayor de malignidad (p = 0,001, p <0,01) (tabla 4).
El valor de corte para el coeficiente de difusión aparente (CDA) fue de 1,33 × 10-3 mm2/s según los cálculos y se detectó un riesgo significativamente mayor de malignidad con valores iguales o inferiores a este nivel
| Patología | Media CDA | p | |||
|---|---|---|---|---|---|
| > 1,33× 10-3 mm2/s | ≤ 1,33 × 10-3 mm2/s | ||||
| n | % | n | % | ||
| Benigno | 41 | 82,0 | 9 | 18,0 | 0,001* |
| Maligno | 5 | 33,3 | 10 | 66,7 | |
Corrección de continuidad de Yates.
Dado que la enfermedad tiroidea nodular es una condición clínica común, su diagnóstico y tratamiento sigue siendo un tema importante1,16.
La US constituye la herramienta de diagnóstico más utilizada para la detección de la enfermedad tiroidea nodular y la biopsia por PAAF guiada por la US se realiza para una evaluación adicional de los nódulos tiroideos2,4,17-19. En su estudio de 6.226 pacientes, Airmkachi et al. han dado sensibilidad y tasas de especificidad del 93 y el 96%, respectivamente, para las biopsias de PAAF20. En nuestra serie, las tasas de resultados por PAAF que revelan citología benigna, atipia de significado indeterminado y citología no diagnóstica no revelaron ninguna diferencia significativa entre los grupos benignos y malignos (p> 0,05). Por otro lado, el número de nódulos determinados con cáncer o neoplasia folicular/de células de Hurthle mediante PAAF preoperatoria fue significativamente mayor en el grupo con malignidad (p <0,01). Consideramos que las variabilidades en los resultados de PAAF se deben a la cantidad limitada de pacientes en nuestro grupo de estudio, que consistió en pacientes específicos que habían sido evaluados por US e IRM-DP de manera preoperatoria.
La RM también se ha utilizado para el diagnóstico de neoplasias tiroideas. En la RM dinámica, se comparan las imágenes tomadas antes y después de la administración del contraste, y las interpretaciones se realizan de acuerdo con los patrones de lavado. La RM dinámica brinda información adecuada sobre la glándula tiroides y los tejidos blandos del cuello. En su estudio sobre 57 nódulos tiroideos de 26 pacientes, Tunca et al. evaluaron los hallazgos dinámicos con contraste de RM de los nódulos14. Ocho nódulos se detectaron como malignos de acuerdo con los resultados de la enfermedad postoperatoria y los hallazgos de la RM de todos estos nódulos malignos revelaron patrones de lavado significativamente retrasados (p <0,01). Tunca et al. afirmaron que, en los casos en que otros métodos de diagnóstico terminaron siendo no concluyentes, la RM dinámica con contraste fue significativamente superior a la biopsia PAAF guiada por US para la evaluación de los nódulos tiroideos14.
En su estudio sobre 42nódulos tiroideos de 38pacientes, Nakahira et al. investigaron la eficacia de las IRM-DP para distinguir los nódulos tiroideos malignos6. Encontraron que el valor medio del CDA para los nódulos benignos fue 1,93 ± 0,37 × 10-3 mm2/s y el valor medio del CDA para los nódulos malignos fue 1,20 ± 0,25 × 10-3 mm2/s. Llegaron a la conclusión de que el valor medio del CDA de los nódulos malignos fue significativamente menor que los nódulos benignos (p <0,01)6. En otro estudio, el-Hariri et al. evaluaron 56nódulos tiroideos de 37 pacientes con bocio nodular a través de las IRM-DP, y encontraron que el valor medio del CDA era 1,85 ± 0,24 × 10-3 mm2/s para el grupo de nódulos benignos, mientras que este valor se calculó para ser 0,89 ± 0,27 × 10-3 mm2/s para el grupo de nódulos malignos, una vez más, lo que demuestra que el valor medio del CDA de los nódulos malignos fue significativamente menor (p <0,01)15.
En nuestra serie, según las IRM-DP preoperatorias, el valor medio del CDA para el grupo benigno se calculó como 1,72 ± 0,39 × 10-3 mm2/s, mientras que este valor fue de 1,28 ± 0,41 × 10-3 mm2/s para el grupo maligno, y el análisis estadístico mostró que el valor medio del CDA de los nódulos fue significativamente menor en el grupo con malignidad en comparación con el grupo benigno (p <0.01). Por otro lado, las comparaciones de los valores medios del CDA de los tejidos tiroideos normales extranodular del mismo lóbulo tiroideo que albergaban el nódulo no revelaron diferencias estadísticamente significativas entre el grupo benigno y el grupo con malignidad (p> 0,05). Sin embargo, aunque no es estadísticamente significativo, el valor medio del CDA de los nódulos benignos (1,72 ± 0,39 × 10-3 mm2/s) es más alto que el CDA medio del tejido tiroideo normal extranodular del mismo lóbulo (1,58 ± 0,39 × 10-3 mm2/s), y el valor medio del CDA de los nódulos malignos (1,28 ± 0,41 × 10-3 mm2/s) es menor que el tejido tiroideo normal extranodular del mismo lóbulo (1,41 ± 0,39 × 10-3 mm2/s) se consideraron hallazgos notables.
En su serie de 42 nódulos tiroideos, Nakahira et al. informaron de que el mejor valor de corte para ubicar el CDA era 1,60 × 10-3 mm2/s para distinguir los nódulos malignos de los nódulos tiroideos benignos, con una sensibilidad del 94,73%, una especificidad del 82,60%, un valor predictivo positivo del 81,82% y un valor predictivo negativo del 95,00%6. Del mismo modo, el-Hariri et al. evaluaron 56nódulos tiroideos en su estudio y afirmaron que calculaban que el mejor valor de corte para el CDA era 1,5 × 10-3 mm2/s15. En nuestra serie, de acuerdo con los resultados postoperatorios de la enfermedad final, el mejor punto de corte para el valor CDA medio se calculó como 1,33 × 10-3 mm2/s, con una sensibilidad del 66,67%, una especificidad del 89,13%, un valor predictivo positivo del 53,63% y un valor predictivo negativo del 89,13%. Se determinó que la detección de una media del CDA ≤ 1,33 × 10-3 mm2/s se asoció a un riesgo 9veces mayor de malignidad (p <0,01, odds ratio: 9,111, intervalo de confianza del 95%: 2,49-33,21).
En conclusión, como una modalidad no invasiva y de bajo costo, la US sigue siendo el primer paso, siempre fundamental, para la evaluación de los nódulos tiroideos. Sin embargo, el examen ultrasonográfico por sí solo es inadecuado para alcanzar el diagnóstico definitivo en la mayoría de los casos y, por esta razón, la biopsia por PAAF guiada por US y la evaluación citológica están indicadas en la mayoría de los casos que presentan hallazgos sospechosos a nivel de US. Aunque los resultados citopatológicos se obtienen a través de la PAAF, estos resultados pueden no reflejar siempre las características del tejido tiroideo en general. Todavía existen controversias en cuanto a la evaluación y el manejo de nódulos tiroideos diagnosticados con atipia de significado indeterminado, o citopatología indeterminada como resultados de biopsias de PAAF3. En estos casos, otras modalidades de imágenes, tales como RM e IRM-DP con mediciones de CDA pueden ayudar al médico a través de la evaluación de los nódulos tiroideos, y pueden evitar biopsias PAAF repetidas. En el presente estudio, según los resultados de IRM-DP cervical, los valores medios de CDA se detectaron significativamente menores para los nódulos malignos, y una media CDA ≤ 1,33 × 10-3 mm2/s se asoció a un riesgo 9veces mayor de malignidad.
El valor de CDA determinado en IRM-DP cervical puede considerarse como un parámetro predictivo para la detección de cáncer de tiroides.
Declaración de autoresDe acuerdo con los hallazgos del presente estudio, los autores concluyen que el valor del CDA determinado en la resonancia magnética ponderada por difusión cervical (DW-MRI) se puede considerar como un parámetro predictivo para la detección de nódulos tiroideos malignos. Dichos hallazgos representan un avance diagnóstico significativo en la cirugía endocrina del cáncer de tiroides.
La aprobación para este estudio se obtuvo del Comité de Ética de la Escuela de Medicina de la Universidad Medeniyet de Estambul, del Hospital de Capacitación e Investigación Goztepe, y se obtuvieron los formularios de consentimiento informado firmados por todos los pacientes. Cada uno de los procedimientos seguidos se realizaron de acuerdo con los estándares éticos del comité responsable de experimentación humana (institucional y nacional) y a la Declaración de Helsinki de 1975, revisada en 2008.
Además, todos los autores declaran que no existe una fuente de financiación, y que no tienen ningún incentivo financiero comercial directo o indirecto asociado a la publicación de este artículo. Los autores también confirman que este manuscrito no ha sido publicado y no está bajo consideración simultánea de otra revista o publicación electrónica.
Conflicto de interesesOzgür Ekinci, Sumeyra Emine Boluk, Tunc Eren, Ibrahim Ali Ozemir, Salih Boluk, Artur Salmaslioglu, Metin Leblebici y Orhan Alimoglu declaran no tener ningún conflicto de intereses.
Los autores desean agradecer a Bulent Tasel, MD Universidad Medeniyet de Estanbul, Hospital de Capacitación e Investigación de Göztepe, Departamento de Radiología, Estambul, por las evaluaciones radiológicas, y a la Sra. Emire Bor, especialista en Bioestadística, EMPIAR Statistics, Estambul, Turquía, por el análisis estadístico de este estudio.