El sistema de clasificación ganglionar más utilizado en el cáncer gástrico es el TNM. No obstante presenta limitaciones, como la «migración de estadificación» en los casos con linfadenectomías subóptimas, por ello se han planteado distintos sistemas. Asimismo, el objetivo fue valorar la influencia del ratio nodal medido en terciles [RNt] como factor pronóstico, y compararlo con los sistemas TNM (7.ª ed.) y log odds of positive lymph nodes [LODDS].
Material y métodosSe trata de un estudio retrospectivo y unicéntrico sobre 199 pacientes con neoplasia gástrica intervenidos con intención curativa entre 2010 y 2014. Se realizó un análisis univariante y multivariante de cada sistema, y se compararon las tasas de supervivencia global [SG] obtenidas mediante test ROC.
ResultadosLos factores pronóstico que mostraron significación estadística en el análisis multivariante fueron: RNt2 (HR 2,87) y RNt3 (HR 7,29); LODDS 2 (HR 1,55), LODDS3 (HR 2,6) y LODDS4 (HR 4,9); pN2 (HR 1,84) y pN3 (HR 2,91). La SG a 5 años fue del 75,8, 61,4, 25,8 y 3,84% para RNt0, RNt1, RNt2 y RNt3; 72,4, 60, 29,1 y 13,9% para LODDS1, LODDS2, LODDS3 y LODDS4; y 77,6, 59,4, 28,8 y 25,5% para pN0, pN1, pN2 y pN3, respectivamente. Los 3 sistemas se comportaron como buenos predictores, con áreas bajo la curva >0,75.
ConclusiónEl RNt fue un factor pronóstico independiente para la estimación de la supervivencia en el cáncer gástrico. Además, la facilidad de su cálculo en la práctica clínica podría disminuir el efecto de migración de estadificación.
In the gastric cancer the most widely used classification is the AJCC TNM system. However, it presents limitations, such as staging migration in cases with suboptimal lymphadenectomies. The nodal ratio has been proposed as an alternative system, proving to be a good prognostic predictor of survival. The aim was to assess the influence of the nodal ratio measured in tertiles [tNR] as a prognostic factor and compare with the TNM systems (7th ed.) and log odds of positive lymph nodes [LODDS].
Material and methodsRetrospective and single-center study on 199 patients operated on with curative intent between 2010 and 2014. For each system an univariate and multivariate analysis was performed and the overall survival rates [OS] were compared by the ROC test.
ResultsThe prognostic factors that showed statistical significance in the multivariate analysis were: tNR2 (HR 2.87) and tNR 3 (HR 7.29); LODDS 2 (HR 1.55), LODDS3 (HR 2.6) and LODDS4 (HR 4.9); pN2 (HR 1.84) and pN3 (HR 2.91). The 5-year OS was 75.8, 61.4, 25.8 and 3.84% for tNR0, tNR1, tNR2 and tNR3; 72.4, 60, 29.1 and 13.9% for LODDS1, LODDS2, LODDS3 and LODDS4; and 77.6, 59.4, 28.8 and 25.5% for pN0, pN1, pN2 and pN3, respectively. The three systems behaved as good predictors, with areas under the curve >0.75.
ConclusiontNR was an independent prognostic factor for estimating survival in gastric cancer. Furthermore, the ease of its calculation in clinical practice could reduce the effect of staging migration.
La afectación ganglionar es uno de los factores pronósticos más importantes en el cáncer gástrico. La categoría patológica N [pN] es la más empleada en su estadificación1, sin embargo, su limitación principal es la influencia por el número de ganglios resecados. Así, algunos casos con linfadenectomías subóptimas (menos de 15 ganglios analizados) pueden comportar un efecto de «migración de estadificación»2,3.
El ratio nodal [RN], número de ganglios metastásicos entre el total de ganglios resecados, se ha planteado como una alternativa a la clasificación ganglionar según el sistema Tumor-Nódulo-Metástasis [TNM], por su buen valor predictivo y su facilidad de aplicación4,5.
Por otra parte, el sistema logarítmico log odds of positive lymph nodes [LODDS], que se basa en el logaritmo de los ganglios positivos entre los ganglios negativos analizados, se ha mostrado como el mejor predictor pronóstico para estimar la supervivencia de este cáncer4, aunque su aplicación clínica es poco reproducible debido a la complejidad de su cálculo e interpretación: log (pnod+0,5)/(tnod−pnod+0,5), donde pnod hace referencia al número de ganglios positivos y tnod al total de ganglios resecados. Se añade +0,5 tanto al numerador como al denominador para evitar resultados que tiendan al infinito6.
El objetivo del trabajo fue valorar la influencia del RN como factor pronóstico en el cáncer gástrico, y compararlo con el sistema de estadificación clásico (categoría pN del TNM) y el LODDS.
Material y métodosLa metodología se fundamentó en la elaboración de un estudio retrospectivo sobre una serie prospectiva y unicéntrica de los pacientes que fueron intervenidos con intención curativa por neoplasia gástrica entre el 1 de enero del 2010 y el 31 de diciembre del 2014, con seguimiento hasta el 31 de diciembre de 2019. Se excluyeron los pacientes con enfermedad metastásica en el análisis anatomopatológico (pM+) y los fallecidos en los primeros 120 días postoperatorios.
Se llevó a cabo una recogida retrospectiva de datos basada en la revisión de las historias clínicas, analizando las variables sometidas a estudio: demográficas, quirúrgicas, anatomopatológicas y de seguimiento prospectivo.
Todos los pacientes con diagnóstico de neoplasia gástrica fueron evaluados por un comité multidisciplinar. Se indicó la gastrectomía total o parcial de manera individualizada en función de la extensión, histología y localización del tumor. Se realizó de manera estandarizada linfadenectomía sobre el territorio D2, adecuando su extensión al territorio D1 ante pacientes de edad avanzada o con comorbilidades.
Los tumores fueron clasificados según el sistema TNM vigente durante el periodo de estudio American Joint Committee on Cancer (AJCC), 7.ª Ed., 2010. Todos los pacientes fueron revalorados por el servicio de oncología médica para estimar la necesidad de tratamientos adyuvantes. Se estableció un seguimiento conjunto entre los servicios de cirugía del aparato digestivo y oncología médica, planteado con una periodicidad de 6 meses durante 5 años, con control analítico y radiológico y/o gastroscópico alterno. Los pacientes que presentaron recurrencia de la enfermedad fueron sometidos a un seguimiento individualizado que se prolongó en el tiempo hasta su sobrevida, fallecimiento o curación.
Los puntos de corte del RN se establecieron en terciles a fin de homogeneizar el número de pacientes incluidos en cada subgrupo. El sistema LODDS se basó en la clasificación propuesta por Jian-Hui, et al.: LODDS1<−1,5, −1,5<LODDS2<−1, −1<LODDS3<0 y LODDS4>04.
Se obtuvo el consentimiento informado en todos los casos intervenidos para el uso de la información derivada de su asistencia con fines docentes o investigadores. El estudio fue aprobado por el Comité Ético de Investigación Clínica de la OSI Ezkerraldea-Enkarterri-Cruces (CEIC E20/14).
Análisis estadísticoLas variables cuantitativas se describieron usando la mediana y el rango o la media y su desviación estándar, mientras que las variables cualitativas se describieron como porcentajes. Se determinó la supervivencia global (SG) a 5 años, que fue definida como el intervalo temporal entre la fecha de la intervención y la fecha del éxitus o del último seguimiento. Se presentaron los porcentajes de los supervivientes a 5 años y se compararon con los porcentajes de los fallecidos a 5 años, mediante el test de Chi-cuadrado. Se realizaron curvas de Kaplan-Meier para comparar la SG en función de cada clasificación ganglionar: 1) RN expresado en terciles (RNt): RNt0=0; RNt1>0≤0,33; RNt2>0,33≤0,66; y RNt3>0,66; vs. 2) Clasificación TNM (AJCC, 7.ª Ed., 2010): pN0=0 ganglios, pN1=1-2; pN2=3-6; pN3>6); vs. 3) Sistema LODDS: LODDS1<−1,5, −1,5<LODDS2<−1, −1<LODDS3<0 y LODDS4>0. Se practicó un análisis univariante de las categorías de cada clasificación y un análisis multivariante con modelos de regresión de Cox, añadiendo estas mismas variables y la edad (≤65 o>65 años), así como la localización (según la gastroscopia) y el T patológico (según el TNM) como variables de ajuste. Para medir la capacidad de discriminación de los modelos se realizó el cálculo del área bajo la curva (area under curve [AUC]), además de comparar cuál de los modelos discriminaba mejor mediante el cálculo de la diferencia de AUC (Δ AUC).
Para el estudio de los requisitos a tener en cuenta en los sistemas de clasificación, se analizaron: 1) La monotonicidad, evaluando el incremento proporcional que han obtenido el hazard ratio (HR]) o el riesgo relativo en el análisis multivariante; 2) La homogeneidad, analizando la amplitud del intervalo de confianza, y 3) La diferenciación, cuantificada mediante la superposición de los intervalos de supervivencia de cada estadio según las gráficas de Kaplan-Meier2.
Todos los análisis fueron realizados con el programa estadístico R (versión 4.0.1): A language and environment for statistical computing. R Foundation for Statistical Computing, Viena, Austria. Se consideró la significación estadística para valores p<0,05.
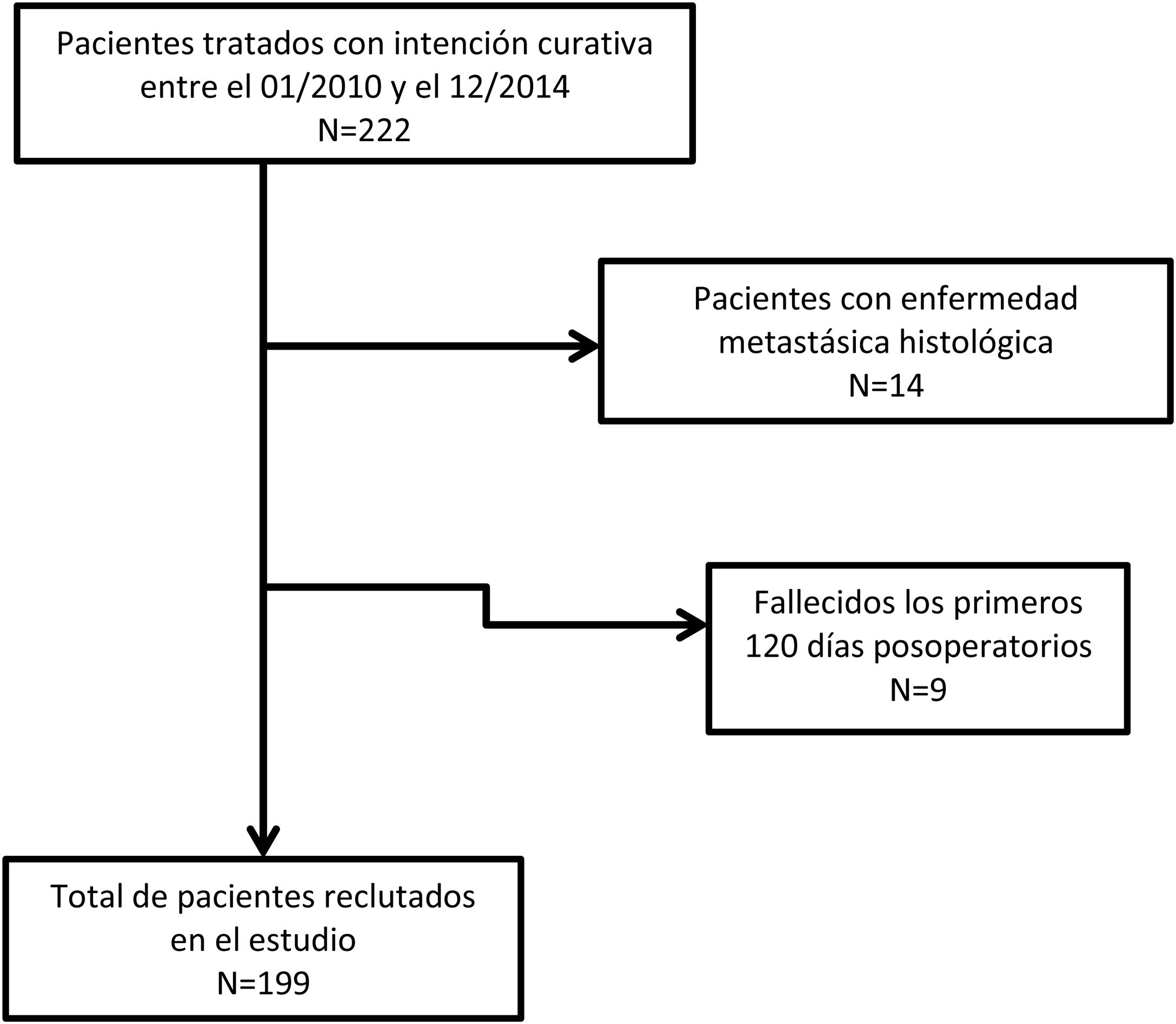
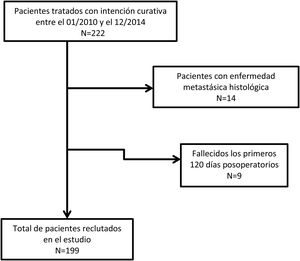
ResultadosUn total de 222 pacientes fueron intervenidos con intención curativa. Se excluyeron 14 sujetos por presencia de pM+, y 9 por fallecimiento en los primeros 120 días desde la intervención o por pérdida de seguimiento (fig. 1).
Finalmente, 199 pacientes se incluyeron en el estudio. Los principales datos demográficos y aspectos anatomopatológicos se muestran en la tabla 1. Contaron con linfadenectomías de ≥15 ganglios 109 pacientes (55,9%), mientras que en 86 casos la resección ganglionar se consideró subóptima (44,1%). En el análisis univariante, mostraron significación estadística como factor pronóstico para la supervivencia: la edad >65 años, la histología difusa, los tumores moderadamente y pobremente diferenciados o indiferenciados, las categorías T3-4, las categorías pN2-3, el RNt 2-3 y el LODDS 3-4 (tabla 2).
Datos demográficos y aspectos anatomopatológicos
| Variables | Pacientes (%) |
|---|---|
| Edad categórica | |
| ≤65 años | 76 (38,2) |
| >65 años | 123 (61,8) |
| Sexo | |
| Varón | 134 (67,3) |
| Mujer | 65 (32,7) |
| Localización (gastroscopia) | |
| 1/3 superior | 39 (19,6) |
| Cuerpo | 54 (27,1) |
| Antro | 106 (53,3) |
| Histología Lauren | |
| Adenocarcinoma intestinal | 82 (42,7) |
| Difuso | 63 (32,8) |
| Indeterminado | 47 (24,5) |
| Grado de diferenciación | |
| Bien diferenciado | 47 (25,7) |
| Moderadamente diferenciado | 45 (24,6) |
| Pobremente diferenciado o indiferenciado | 91 (49,7) |
| T patológico (TNM) | |
| <pTisp/T1 | 25 (12,6) |
| pT2 | 40 (20,1) |
| pT3 | 94 (47,2) |
| pT4 | 40 (20,1) |
| N patológico (TNM) | |
| pN0 | 58 (28,6) |
| pN1 | 37 (18,9) |
| pN2 | 52 (26,5) |
| pN3a/pN3b | 51 (26,0) |
| RNt | |
| RNt0 | 58 (29,1) |
| RNt1 | 57 (28,6) |
| RNt2 | 58 (29,1) |
| RNt3 | 26 (13,1) |
| LODDS | |
| LODDS1 | 87 (45,1) |
| LODDS2 | 15 (7,77) |
| LODDS3 | 55 (28,5) |
| LODDS4 | 36 (18,7) |
| Ganglios resecados | |
| <15 ganglios | 86 (44,1) |
| >15 ganglios | 109 (55,9) |
| Linfadenectomía | |
| D1 | 124 (63,6) |
| D2 | 71 (36,4) |
LODDS: log odds of positive lymph nodes; RNt: ratio nodal expresado en terciles; pN: categoría patológica N; RN: ratio nodal; TNM: sistema tumor-nódulo-metástasis.
Estudio univariante de la supervivencia de los sistemas de clasificación de diseminación linfática
| Supervivencia global | |
|---|---|
| Variables | HR (IC 95%) valor de p |
| Edad categórica | |
| ≤65 años | Ref. |
| >65 años | 1,54 (1,05-2,24) 0,027 |
| Sexo | |
| Varón | Ref. |
| Mujer | 0,93 (0,63-1,35) 0,689 |
| Localización (gastroscopia) | |
| Tercio superior | Ref. |
| Cuerpo | 0,59 (0,35-1,00) 0,049 |
| Antro | 0,67 (0,43-1,05) 0,080 |
| Histología Lauren | |
| Adeno. intestinal | Ref. |
| Difuso | 1,61 (1,05-2,47) 0,028 |
| Indeterminado | 1,32 (1,05-2,47) 0,243 |
| Grado de diferenciación | |
| Bien diferenciado | Ref. |
| Moderadamente dif. | 1,86 (1,02-3,38) 0,041 |
| Pobremente dif. o indif. | 2,56 (1,52-4,32) <0,001 |
| T patológico (TNM) | |
| <pTis/pT1 | Ref. |
| p T2 | 1,48 (0,60-3,64) 0,389 |
| pT3 | 3,74 (1,71-8,17) 0,001 |
| pT4 | 7,93 (3,49-18,0) <0,001 |
| N patológico (TNM) | |
| pN0 | Ref. |
| pN1 | 1,55 (0,82-2,93) 0,181 |
| pN2 | 3,21 (1,88-5,49) <0,001 |
| pN3a/pN3b | 4,41 (2,59-7,50) <0,001 |
| RNt | |
| RNt0 | Ref. |
| RNt1 | 1,25 (0,71-2,21) 0,433 |
| RNt2 | 3,66 (2,21-6,06) <0,001 |
| RNt3 | 10,3 (5,66-18,8) <0,001 |
| LODDS | |
| LODDS1 | Ref. |
| LODDS2 | 1,48 (0,65-3,34) 0,349 |
| LODDS3 | 3,38 (2,14-5,34) <0,001 |
| LODDS4 | 5,98 (3,64-9,85) <0,001 |
| Ganglios resecados | |
| <15 ganglios | Ref. |
| >15 ganglios | 0,81 (0,56-1,16) 0,241 |
| Linfadenectomía | |
| D1 | Ref. |
| D2 | 0,97 (0,65-1,44) 0,877 |
HR: hazard ratio; IC 95%: intervalo de confianza del 95%; LODDS: log odds of positive lymph nodes; RNt: ratio nodal expresado en terciles; pN: categoría patológica N; RN: ratio nodal; TNM: sistema tumor-nódulo-metástasis.
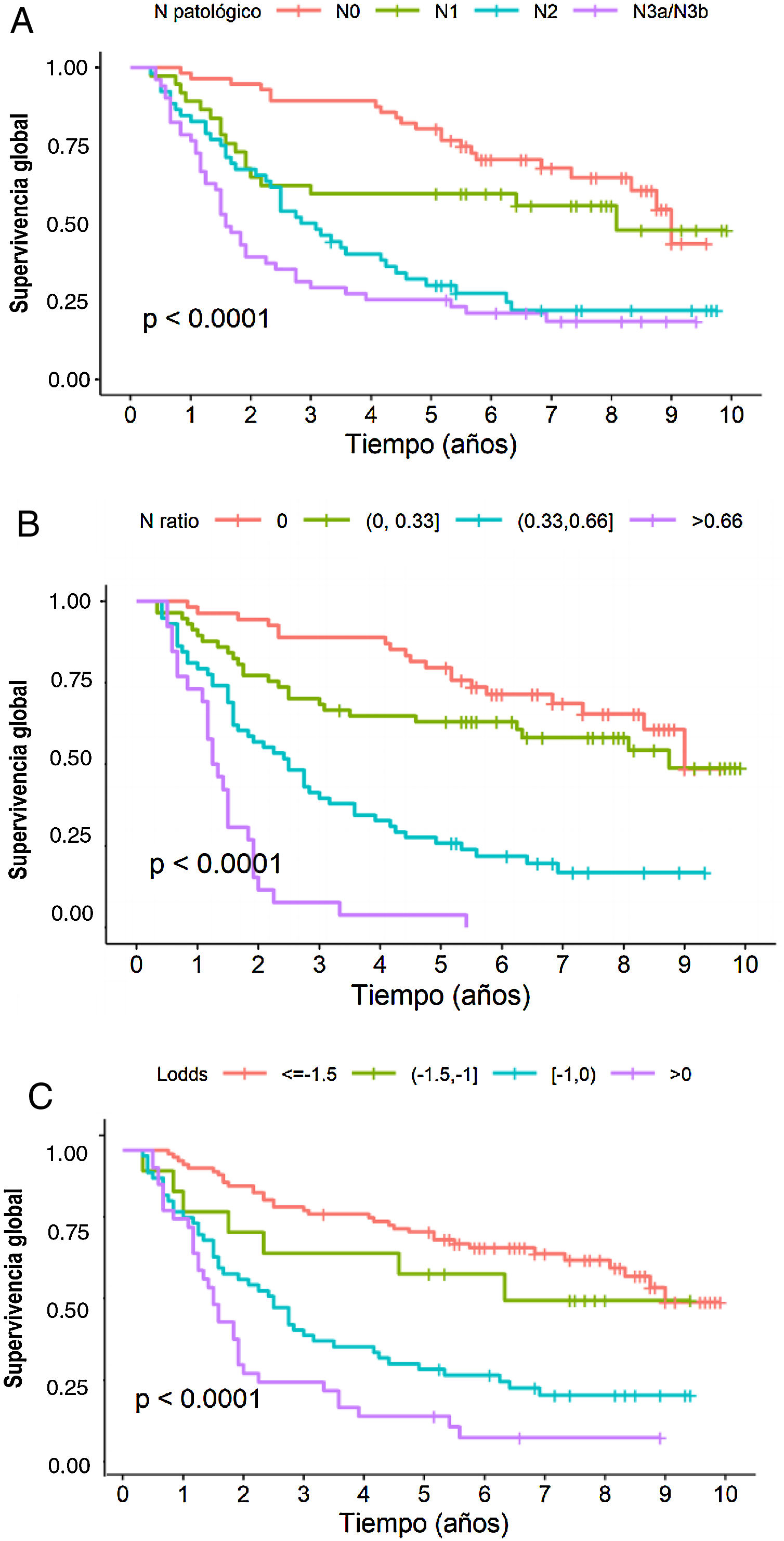
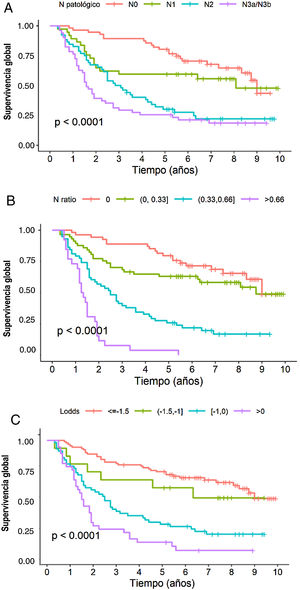
En el análisis multivariante, el sistema RNt se mostró como factor pronóstico independiente con respecto a la supervivencia: HR para RNt2: 2,87 (1,57-5,25) y HR para RNt3: 7,29 (3,6-14,73) (tabla 3). La estimación de la SG a 5 años fue del 75,8% para RNt0; 61,4% para RNt1; 25,8% para RNt2 y 3,84% para RNt3 (fig. 2A).
Estudio multivariante de la supervivencia global de los sistemas de estadificación ganglionar
| Variables | Un análisis multivariante | 2 análisis multivariante | 3 análisis multivariante |
|---|---|---|---|
| HR (IC 95%) valor de p | HR (IC 95%) valor de p | HR (IC 95%) valor de p | |
| Edad | 1,82 (1,22-2,71) 0,004 | 1,80 (1,21-2,68) 0,004 | 1,86 (1,24-2,79) 0,003 |
| Localización | |||
| Cuerpo | 0,52 (0,31-0,90) 0,019 | 0,71 (0,41-1,22) 0,214 | 0,51 (0,29-0,89) 0,018 |
| Antro | 0,75 (0,47-1,19) 0,22 | 0,90 (0,56-1,44) 0,66 | 0,79 (0,5-1,26) 0,326 |
| pT2 | 1,1 (0,44-2,76) 0,844 | 0,93 (0,36-2,42) 0,888 | 0,93 (0,36-2,37) 0,874 |
| pT3 | 2,15 (0,91-5,05) 0,08 | 2 (0,84-4,75) 0,116 | 2,03 (0,9-4,59) 0,09 |
| pT4a/T4b | 4,22 (1,67-10,65) 0,002 | 3,61 (1,43-9,09) 0,006 | 4,12 (1,71-9,91) 0,002 |
| N pato. (TNM) | |||
| pN0 | Ref. | ||
| pN1 | 1,41 (0,72-2,74) 0,313 | ||
| pN2 | 1,84 (1-3,38) 0,05 | ||
| pN3a/pN3b | 2,91 (1,59-8,33) <0,001 | ||
| RNt | |||
| RNt0 | Ref. | ||
| RNt1 | 1,11 (0,59-2,11) 0,739 | ||
| RNt2 | 2,87 (1,56-5,25) <0,001 | ||
| RNt3 | 7,29 (3,6-14,73) <0,001 | ||
| LODDS | |||
| LODDS1 | Ref. | ||
| LODDS2 | 1,55 (0,66-3,64) 0,315 | ||
| LODDS3 | 2,6 (1,6-4,2) <0,001 | ||
| LODDS4 | 4,9 (2,86-8,38) <0,001 | ||
HR: hazard ratio; IC 95%: intervalo de confianza del 95%; LODDS: log odds of positive lymph nodes; RNt: ratio nodal expresado en terciles; pN: categoría patológica N; RN: ratio nodal; TNM: sistema tumor-nódulo-metástasis.
El sistema LODDS también se mostró como factor pronóstico independiente en el análisis multivariante de supervivencia (tabla 3): HR para LODDS2: 1,55 (0,66-3,64), LODDS3: 2,6 (1,6-4,2) y LODDS4: 4,9 (2,86-8,38). Así, la supervivencia a 5 años fue del 72,4% para LODDS1, 60% para LODDS2, 29,1% para LODDS3 y 13,9% para LODDS4 (fig. 2B).
De igual manera, la categoría pN del sistema clásico TNM, se mostró como factor pronóstico independiente en el análisis multivariante de supervivencia (tabla 2): HR para pN2: 1,84 (1-3,38) y HR para pN3: 2,91 (1,59-8,33). La supervivencia a 5 años según este sistema fue del 77,6% para pN0, 59,4% para pN1, 28,8% para pN2 y 25,5% para pN3 (fig. 2C).
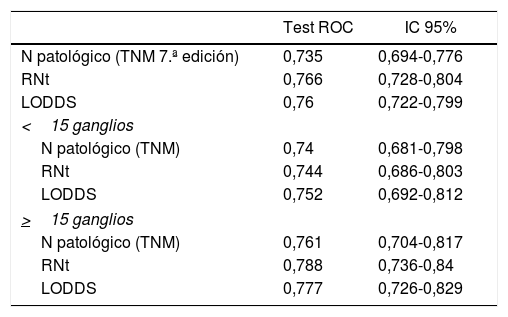
En la presente cohorte, los 3 sistemas de valoración de la afectación ganglionar pueden considerarse buenos predictores pronósticos según las curvas ROC, con AUC próximos a 0,75 (tabla 4). En la valoración concreta de los casos con linfadenectomías subóptimas, el sistema LODDS fue el que mejor puntuación obtuvo, con un AUC=0,752. Asimismo, los sistemas RNt y la categoría pN del TNM mostraron valores similares: AUC=0,744 y 0,74, respectivamente (tabla 4). Del mismo modo, los 3 modelos se compararon mediante el cálculo de la Δ AUC, como se muestra en la tabla 4.
Comparación del valor pronóstico de los diferentes sistemas de estadificación y comparativa entre los 3 sistemas mediante el cálculo de la Δ AUC
| Test ROC | IC 95% | |
|---|---|---|
| N patológico (TNM 7.ª edición) | 0,735 | 0,694-0,776 |
| RNt | 0,766 | 0,728-0,804 |
| LODDS | 0,76 | 0,722-0,799 |
| <15 ganglios | ||
| N patológico (TNM) | 0,74 | 0,681-0,798 |
| RNt | 0,744 | 0,686-0,803 |
| LODDS | 0,752 | 0,692-0,812 |
| >15 ganglios | ||
| N patológico (TNM) | 0,761 | 0,704-0,817 |
| RNt | 0,788 | 0,736-0,84 |
| LODDS | 0,777 | 0,726-0,829 |
| Sistema pN (TNM) | RN | LODDS |
|---|---|---|
| pN (TNM) | p=0,675 | p=0,351 |
| RN | Δ=0,005 | p=0,543 |
| LODDS | Δ=0,013 | Δ=0,008 |
AUC: area under curve; IC 95%: intervalo de confianza del 95%; LODDS: log odds of positive lymph nodes; RNt: ratio nodal expresado en terciles; pN: categoría patológica N; ROC: receiver operating characteristic curve; RN: ratio nodal; TNM: sistema tumor-nódulo-metástasis.
Por último, en lo que respecta a la monotonicidad, a la homogeneidad y a la capacidad de diferenciación, los resultados fueron los siguientes: 1) Monotonicidad de la categoría pN del TNM: pN1=HR1,84, pN2=HR2,75, pN3=HR6,23; del RNT (RNt0=HR0,9, RNt1=HR2,36, RNt3=HR6,17); y del LODDS: LODDS2=HR1,55, LODDS3=HR2,6, LODDS4=HR4,9; 2) Homogeneidad del sistema TNM: pN0=28,6%, pN1=18,9%, pN2=26,5% y pN3=26,0%; del RNt RNt0=29,1%, RNt1=28,6%, RNt3=13,1%; y del LODDS: LODDS1=45,1%, LODDS2=7,77%, LODDS3=28,5%, LODDS4=18,7%, y 3) Capacidad de discriminación, que se muestra en la figura 2.
DiscusiónLa diseminación ganglionar es uno de los factores pronósticos con mayor importancia en el cáncer gástrico, condicionando un gran impacto en la supervivencia. Según la última edición de las guías de práctica clínica de la National Comprehensive Cancer Network (NCCN) se recomienda realizar de forma estandarizada la linfadenectomía D26. Sin embargo, diversos estudios muestran que en grandes cohortes tanto occidentales como asiáticas, este tipo de resección ganglionar solamente se realizó en el 29 y 60,2% de los casos, respectivamente7,8. Esto conlleva, en muchas ocasiones, una tasa de resección linfática subóptima (<15 ganglios), acorde con la presentada en nuestro centro (55,9%).
El sistema de estadificación más utilizado a nivel internacional es el TNM de la AJCC. En el presente estudio se muestran los datos utilizando la 7.ª edición, vigente en el periodo que se intervinieron los pacientes sometidos a estudio, siendo la estadificación ganglionar la siguiente: pN0 en casos sin afectación ganglionar, pN1 1-2 ganglios positivos, pN2 3-6 ganglios positivos y pN3>6 ganglios positivos. Cabe destacar que en dicha edición la categoría pN3 no realizaba una adecuada discriminación de la enfermedad ganglionar. Con el objetivo de disminuir dicha limitación, en 2018 se comenzó a utilizar la 8.ª edición, la cual subdivide el grupo pN3 en pN3a para los casos con 7-15 ganglios afectados y en pN3b para casos con 15 o más ganglios afectados1. No obstante, el actual sistema TNM aún presenta varias limitaciones, especialmente en los casos con linfadenectomías subóptimas, lo que puede implicar un efecto de «migración de estadificación» y, por consiguiente, disminuir su valor pronóstico9.
En cambio, el RN, al analizar los ganglios positivos entre el total de resecados, se ve menos afectado por la extensión de las linfadenectomías, lo que determinaría con mayor exactitud la afectación ganglionar, contribuyendo a minimizar la «migración de estadificación». Por otra parte, también aportaría mayor precisión como factor pronóstico independiente2,3,10,11. De hecho, en el estudio de cohortes publicado por Kong SH et al., comunicaron que el RN les pareció el mejor sistema predictor del pronóstico3. Sin embargo, la gran heterogeneidad en sus diferentes categorías, así como la ausencia del teórico beneficio en los pacientes con gradación N0, impedirían su consideración general como alternativa a la categoría pN del TNM, siendo RN0 igual que pN0. Es decir, su capacidad de discriminación disminuye cuando el RN es de 0 o 1, obteniendo el mismo RN los pacientes con 0/0 o 0/30 y 3/3 o 30/30 ganglios positivos12,13. Por dichas limitaciones se planteó el LODDS, sistema asimismo empleado previamente en los cánceres de colon y de mama14,15, y que también se ha planteado como una alternativa en la estadificación del cáncer gástrico16. Hui J et al., determinaron la superioridad del LODDS frente al RN y la categoría pN, al igual que Sun Z et al., que demostraron el beneficio del mismo como factor pronóstico en el cáncer gástrico17. Todo ello presenta mayor relevancia clínica en tumores con más carga ganglionar, como los de histología difusa. En la reciente publicación de Pengfei G et al., afirman que cuando el valor del RN se delimita entre 0,2 y 0,8 ambos sistemas (RN y LODDS) son similares, sin embargo, a medida que se acerca el valor del RN al valor absoluto de 0 o 1, el valor del LODDS es heterogéneo, lo que implica la capacidad de discriminación del LODDS en pacientes con el mismo RN12.
En el presente estudio se han comparado los 3 sistemas clasificatorios con el objetivo de determinar cuál sería el más adecuado en función de su teórico valor pronóstico. Los 3 sistemas obtuvieron resultados similares en el análisis univariante, y se comportaron como factores pronósticos independientes en el análisis multivariante. Cabe señalar que los sistemas RNt y LODDS demostraron ser mejores que la categoría pN en los casos con linfadenectomías subóptimas (el 44,1% de los sujetos estudiados), con un AUC más favorable para el LODDS. En cambio, la aplicabilidad de este último es tediosa y de difícil interpretación17 y, por tanto, poco factible y utilizado en la práctica clínica habitual, lo cual no ocurre con el cálculo del RN.
Así mismo, para que un sistema de estadificación sea adecuado se considera que debería cumplir con varios requisitos: 1) Monotonicidad, es decir, que a medida que aumenta el estadio de la enfermedad disminuye la supervivencia; 2) Homogeneidad, con supervivencias similares dentro de cada categoría y 3) Diferenciación, o distinción de supervivencia entre los diferentes grupos de pacientes18.
Tras analizar nuestros datos, hemos advertido que el TNM se trata de un sistema con monotonicidad y homogeneidad, pero con poca capacidad de discriminación, superponiéndose la curva de supervivencia de pN2 y pN3 a los 5 años. El RNt en cambio, se ha mostrado como el sistema con la distribución más homogénea, con monotonicidad, con adecuada discriminación y sin superposición de las gráficas de Kaplan-Meier. En tercer lugar, el LODDS, resultó ser un sistema con monotonicidad y con capacidad de discriminación, pero no obtuvo una distribución homogénea en la muestra. Por otra parte, fue el sistema que presentó el valor ROC más elevado (AUC: 0,734), lo que sugiere que podría ser el más específico para estimar el pronóstico del cáncer gástrico. No obstante, su cálculo e interpretación es complejo, tanto en la práctica clínica como en investigación. Sin embargo, el RN es un sistema más simple y más difundido entre los profesionales, siendo ambos válidos como factores pronósticos independientes12. De hecho, aunque en nuestra cohorte hemos obtenido AUC similares para el TNM y RN, en diferentes estudios, entre ellos un metaanálisis publicado en 2018 por Zhu J et al., se recomienda el uso del RN como factor pronóstico en la estadificación ganglionar del cáncer gástrico19. El beneficio de su aplicación, más sencillo que el sistema LODDS12,13, reside en que su correcta interpretación puede disminuir el efecto de la «migración de estadificación», que en ocasiones acontece en los pacientes con linfadenectomías insuficientes que son estadificados mediante el sistema clásico TNM5–9.
Entre las limitaciones del estudio cabe mencionar que se trata de una serie unicéntrica con carácter retrospectivo, lo cual puede repercutir negativamente en lo que a evidencia científica de mayor nivel se refiere. Además, otro problema que se presenta es la elección correcta de los puntos de corte para definir los distintos subgrupos pronósticos.
Para finalizar, podemos concluir que la afectación ganglionar determinada mediante el RN expresado en terciles se ha mostrado como un factor pronóstico independiente para la estimación de la supervivencia en nuestra cohorte de pacientes intervenidos por cáncer gástrico, especialmente en casos con linfadenectomías subóptimas. No obstante, es necesario realizar más investigaciones prospectivas y randomizadas para tratar de evaluar la eficacia de los diferentes sistemas de estadificación ganglionar, y valorar la factibilidad de su aplicabilidad, e incluso la posibilidad de su inclusión dentro del sistema TNM. Para ello, podría ser de interés la creación de registros prospectivos auditados, como el del grupo European Registry of Cancer Care (EURECCA)20.
FinanciaciónNo se han recibido apoyos para la realización del estudio en forma de becas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.