Los xenotrasplantes podrían proveer un suministro ilimitado de órganos y resolver la actual escasez de estos para trasplantes.
Para que los xenotrasplantes se conviertan en una realidad en la práctica clínica, se deben resolver las barreras inmunológicas, fisiológicas y el riesgo de xenozoonosis que estos poseen.
Desde el punto de vista inmunológico, en los últimos 30 años se han realizado grandes avances en la producción de cerdos transgénicos, con lo que se ha logrado evitar el rechazo hiperagudo. Acerca de la xenozoonosis, la mayor atención ha sido dirigida al riesgo de transmisión de retrovirus endógenos porcinos; sin embargo, en la actualidad, se considera que el riesgo es muy bajo y que la transmisión inevitable no debería impedir el xenotrasplante clínico. En cuanto a las barreras fisiológicas, se han obtenido resultados alentadores y se espera que las barreras que aún faltan por corregir se solucionen por medio de las modificaciones genéticas.
Xenotransplantation could provide an unlimited supply of organs and solve the current shortage of organs for transplantation.
To become a reality in clinical practice, the immunological and physiological barriers and the risk of xenozoonosis that they possess should be resolved.
From the immunological point of view, in the last 30 years a significant progress in the production of transgenic pigs has prevented the hyperacute rejection.
About xenozoonosis, attention has been focused on the risk of transmission of porcine endogenous retroviruses; however, today, it is considered that the risk is very low and the inevitable transmission should not prevent the clinical xenotransplantation.
Regarding the physiological barriers, encouraging results have been obtained and it's expected that the barriers that still need to be corrected can be solved in the future through genetic modifications.
Los xenotrasplantes son el trasplante de células, tejidos u órganos entre especies filogenéticamente diferentes1.
El principal problema actual en los trasplantes de órganos es la brecha que existe entre el número de órganos disponibles para trasplantar cada año y el número de pacientes en espera de un injerto. Según la Organización Mundial de la Salud (OMS) más de 114.000 trasplantes de órganos se llevan a cabo anualmente en el mundo, número que es <10% de las necesidades mundiales2.
La ventaja que tendrían los xenotrasplantes es la de proveer una fuente animal fácilmente disponible (cerdo) y conseguir un suministro ilimitado de órganos «donantes». Éticamente, los cerdos representan una opción aceptable como fuente de órganos alternativa3. No obstante, inmunológicamente es menos deseable que los primates no humanos (PNH), esto debido a la distancia genética entre los cerdos y los humanos.
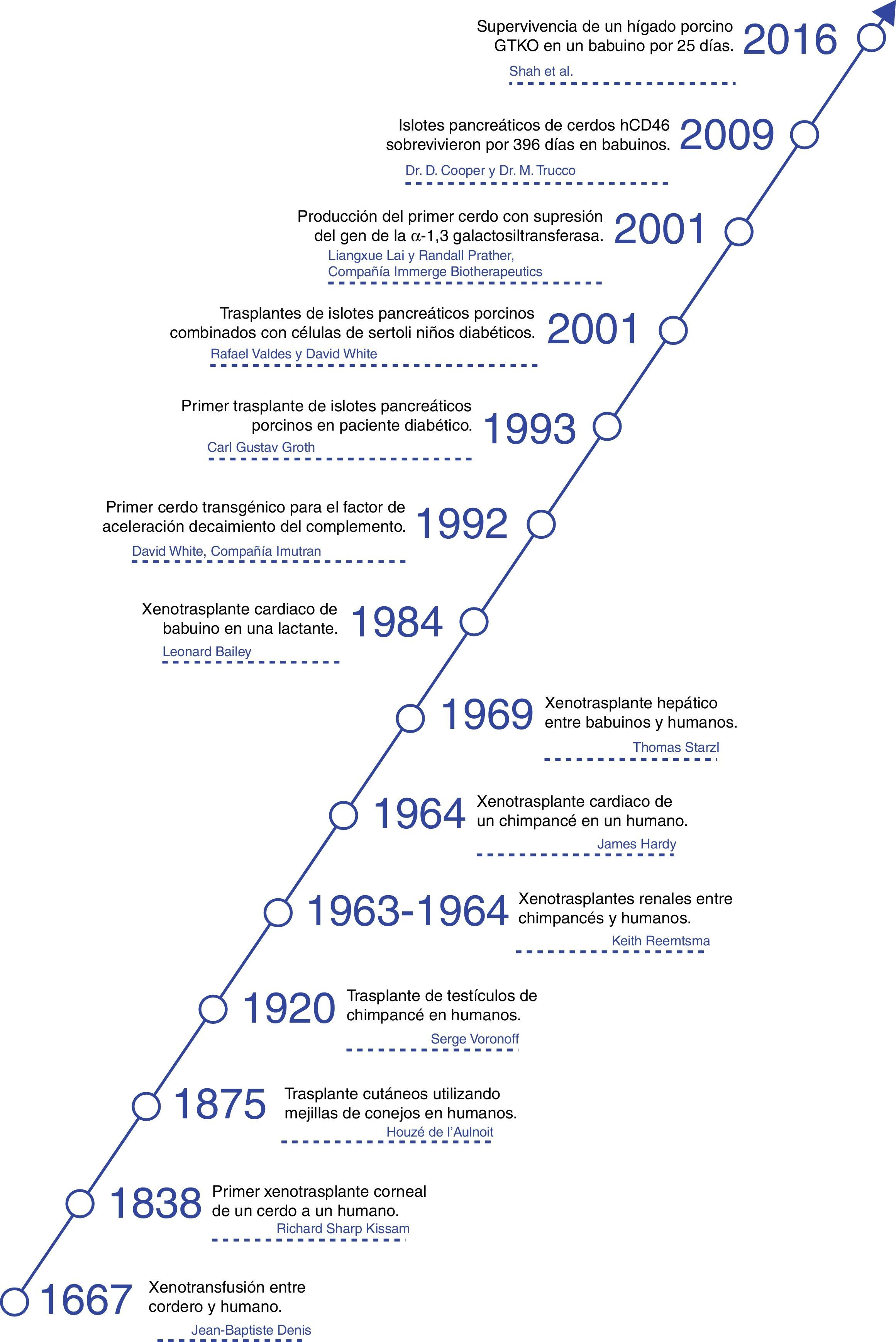
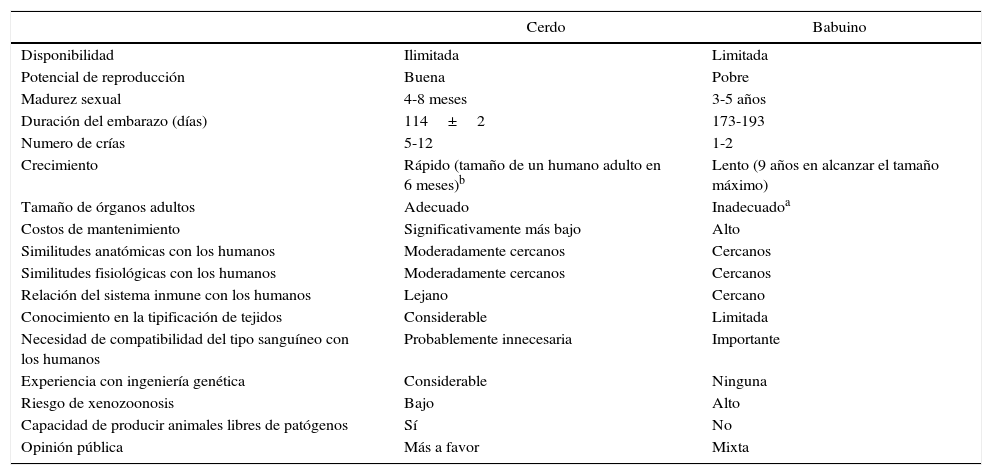
HistoriaLos xenotrasplantes han llamado la atención de la humanidad a lo largo de la historia y sorprendentemente, ha habido un gran número de intentos clínicos desde hace más de 300 años4.
La primera descripción documentada de una transfusión en un hombre fue una xenotransfusión realizada en 1667 por Jean Baptiste Denis. Este transfundió sangre de un cordero a un joven5 y lo curó de una fiebre alta. Realizó más xenotransfusiones con las cuales obtuvo resultados mixtos que llevaron a que la xenotransfusión fuera prohibida en Francia por varios años6.
En 1920 Serge Voronoff trasplantó a un significativo número de hombres testículos de chimpancé7. Los informes de complicaciones fueron infrecuentes y, a pesar de no haberse encontrado ningún efecto benéfico, muchos de los hombres reportaban un «notable rejuvenecimiento».
Entre 1963 y 1964 el Dr. Keith Reemtsma llevó a cabo 13 trasplantes renales de PNH en humanos8. La mayoría de los pacientes fallecieron en las siguientes semanas debido a rechazo o a complicaciones infecciosas. Uno de los pacientes vivió 9 meses, hasta que sufrió un fallecimiento repentino; en la autopsia no se evidenciaron signos de rechazo y se consideró que probablemente había fallecido por un trastorno hidroelectrolítico.
En 1969, Thomas Starzl llevo a cabo xenotrasplantes hepáticos entre babuinos y pacientes jóvenes sin lograr supervivencias a largo plazo. Cuando el tacrolimus se sumó al arsenal terapéutico, él y su equipo en los años 90 realizaron 2xenotrasplantes de hígado de babuino: uno de estos pacientes logró sobrevivir 70 días9.
James Hardy realizó el primer xenotrasplante cardiaco de chimpancé en 1964 en un paciente moribundo al que no se le logró identificar un donante humano fallecido. El corazón no resultó ser suficiente para apoyar la circulación y el paciente falleció a las pocas horas10.
En 1977, Barnard et al. llevaron a cabo 2xenotrasplantes cardiacos heterotópicos de un chimpancé y un babuino11,12. El más conocido de los xenotrasplantes cardiacos vino en 1984, cuando Leonard Bailey trasplantó el corazón de un babuino en una lactante. El procedimiento fue técnicamente exitoso, sin embargo, hubo rechazo del injerto y la paciente murió 20 días después13.
En 1993 Carl Gustav Groth trasplantó islotes de cerdo en un paciente diabético. Sin embargo, a pesar de que se documentó péptido C en la sangre del paciente, lo que indica que algunos islotes sobrevivieron, no se obtuvo ningún beneficio clínico14.
En el 2001 Rafael Valdes y David White realizaron trasplantes de islotes de cerdos combinados con células de Sertoli testiculares en niños con diabetes mellitus de tipo 115. Durante el seguimiento de más de un año, una niña de 17 años no requirió insulina ni otros medicamentos (fig. 1).
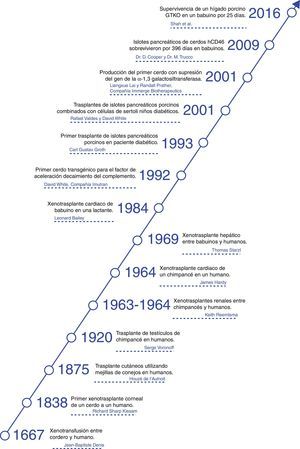
Animales utilizadosA pesar de que desde el punto de vista inmunológico, los PNH serían preferibles como fuente de órganos para los seres humanos, en la práctica los PNH son demasiado pequeños para proporcionar órganos adecuados en humanos adultos3. Por otra parte, se han planteado inquietudes acerca de la transmisión de agentes infecciosos de PNH a los seres humanos, sobre todo porque la mayoría de los PNH son capturados en la naturaleza o han sido alojados en colonias de pocas generaciones y adicionalmente, hay falta de experiencia en la modificación genética de estos (tabla 1).
Ventajas y desventajas del cerdo como potencial fuente de órganos y células para humanos, en comparación con los babuinos
| Cerdo | Babuino | |
|---|---|---|
| Disponibilidad | Ilimitada | Limitada |
| Potencial de reproducción | Buena | Pobre |
| Madurez sexual | 4-8 meses | 3-5 años |
| Duración del embarazo (días) | 114±2 | 173-193 |
| Numero de crías | 5-12 | 1-2 |
| Crecimiento | Rápido (tamaño de un humano adulto en 6 meses)b | Lento (9 años en alcanzar el tamaño máximo) |
| Tamaño de órganos adultos | Adecuado | Inadecuadoa |
| Costos de mantenimiento | Significativamente más bajo | Alto |
| Similitudes anatómicas con los humanos | Moderadamente cercanos | Cercanos |
| Similitudes fisiológicas con los humanos | Moderadamente cercanos | Cercanos |
| Relación del sistema inmune con los humanos | Lejano | Cercano |
| Conocimiento en la tipificación de tejidos | Considerable | Limitada |
| Necesidad de compatibilidad del tipo sanguíneo con los humanos | Probablemente innecesaria | Importante |
| Experiencia con ingeniería genética | Considerable | Ninguna |
| Riesgo de xenozoonosis | Bajo | Alto |
| Capacidad de producir animales libres de patógenos | Sí | No |
| Opinión pública | Más a favor | Mixta |
El tamaño de ciertos órganos, por ejemplo el corazón, podría ser inadecuado para el trasplante en un humano adulto.
Algunas razas de cerdos miniatura tienen aproximadamente el 50% del peso de los cerdos domésticos al momento del nacimiento y alcanzan la madurez sexual y un peso máximo de aproximadamente el 30% de las razas estándar.
Fuente: Extraído de Cooper y Bottino69.
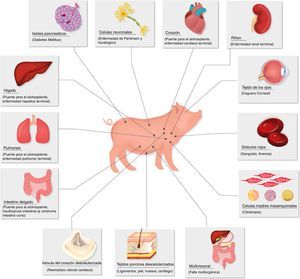
Ahora la atención está dirigida a los cerdos como fuente potencial de órganos y células, campo en el que se han realizado grandes avances en los últimos 30 años. En 1992 se logró la producción de la primera cerda transgénica para el factor de aceleración de decaimiento del complemento (hDAF)16. Posteriormente, en el 2001 se logró inhibir el gen de la α1,3-galactosiltransferasa (GTKO) y con esto se ha logrado reducir el rechazo hiperagudo de los xenotrasplantes (fig. 2).
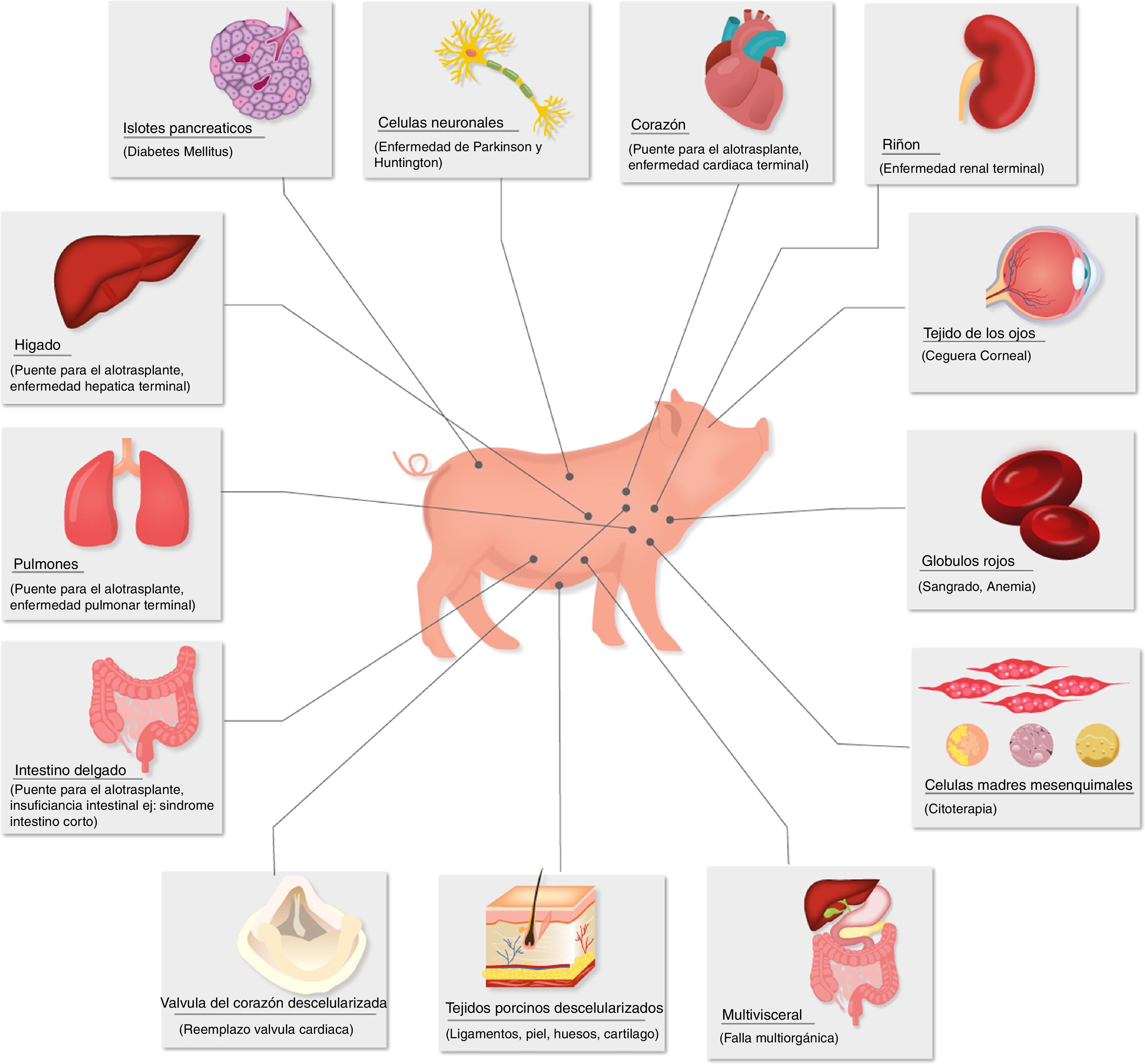
Enfermedades para las que el xenotrasplante podría ser una terapia alternativa.
Fuente: Extraída de Ekser et al.73.
Recientemente se han introducido nuevas técnicas genéticas como son las nucleasas del tipo activadores de transcripción (TALEN)17 y las repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas asociada a la proteína 9 (CRISPR/Cas9)18,19, las cuales se han convertido en las herramientas moleculares más utilizadas en la edición genética. Se estima que en la actualidad existen 40 tipos diferentes de cerdos genéticamente modificados a nivel mundial, con algunos que expresan hasta 5o 6modificaciones20 (tabla 2).
Cerdos genéticamente modificados actualmente disponibles para la investigación en xenotrasplantes
| Regulación del complemento por medio de la expresión de un gen regulador del complemento humano |
| CD46 (proteína cofactor de membrana) |
| CD55 (factor acelerador de la degradación) |
| CD59 (protectina) |
| Deleción o supresión de antígenos Gal o noGal |
| Expresión del gen de la H-transferasa humana (expresión del antígeno del grupo sanguíneo O) |
| Endobetagalactosidasa C (reducción de la expresión del antígeno Gal) |
| Inactivación del gen de la α1,3-galactosiltransferasa (GTKO) |
| Inactivación del gen del ácido N-acetilneuramínico citidina monofosfato (NeuGcKo) |
| Inactivación del gen del β1,4 N-acetilglucosaminiltransferasa |
| Expresión del gen de la N-glucosalminiltranferasa III (GnT-III) |
| Expresión del receptor 1 de factor de necrosis tumoral α |
| Supresión de la respuesta inmune celular por la expresión o regulación de genes |
| CIITA-DN (supresión del CMH de clase II lo que resulta en supresión de los antígenos leucocitarios de clase II) |
| Supresión del CMH de clase I |
| HLA-E/microglobulina humana- β2 (inhibición de las células natural killer humanas y la citotoxicidad por macrófagos) |
| Ligandos FAS humanos (CD95L) |
| CTLA4-Ig porcino (antígeno 4 del linfocito T citotóxico o CD152) |
| TRAIL humano (ligando inductor de apoptosis relacionada con el factor de necrosis tumoral) |
| Expresión o deleción de genes anticoagulantes o antiinflamatorios |
| Deficiencia del factor de von Willebrand (mutación natural) |
| Inhibidor humano del factor tisular (TFPI) |
| Trombomodulina humana |
| Receptor humano endotelial de proteína C (EPCR) |
| CD39 humano (ectonucleósido trifosfato difosfohidrolasa-1) |
| Expresión de genes anticoagulantes, antiinflamatorios y antiapoptosis |
| A20 humano (factor de necrosis tumoral α inductor de proteína 3) |
| Hemooxigenasa-1 humana (HO-1) |
| CD47 humano (interacción especie-específica con SIRP α inhibiendo la fagocitosis) |
| Supresión del gen del receptor porcino de asialoglicoproteína 1 (ASGR1-KOO) (disminución de la fagocitosis de plaquetas) |
| Proteína humana reguladora de señal-α (SIRPα) (Disminución de la fagocitosis plaquetaria por autorreconocimiento) |
| Prevención de la activación de retrovirus endógenos porcinos (PERV) PERV siRNA |
CMH: complejo mayor de histocompatibilidad,
Fuente: Extraído de Cooper y Bottino69.
Anatómicamente, el corazón del cerdo es similar, mas no es idéntico al humano. Fisiológicamente, el gasto cardiaco y el volumen sistólico son comparables entre las 2especies21. La presión arterial media, la frecuencia cardiaca y el flujo sanguíneo son casi idénticos. La postura, erecta, de los humanos, a diferencia de los cerdos, tiene un impacto evolutivo en la estructura de las válvulas del corazón; sin embargo, se ha demostrado que es un problema insignificante en estudios entre porcinos y PNH22.
Existe un potencial de acción diferente entre los cardiomiocitos que se relaciona con las diferencias morfológicas en el nodo auriculoventricular entre especies, lo que podría resultar en un aumento de la arritmogenicidad en un corazón porcino trasplantado en un humano. Sin embargo, las observaciones en PNH no han demostrado que esto sea un problema23.
La anatomía del riñón porcino es muy similar a la del humano. La capacidad máxima de concentración (1.080 mOsm/l) y la tasa de filtración glomerular (126-175ml/h) de los riñones porcinos son similares a las de los humanos21. A pesar de que el potasio en los cerdos es ligeramente mayor, los demás electrólitos séricos, la creatinina y el nitrógeno ureico son similares. Los riñones porcinos han demostrado mantener una homeostasis, un balance electrolítico y una osmolaridad adecuada en PNH.
La anatomía hepática porcina es ligeramente diferente a la humana. El cerdo tiene 3 lóbulos (derecho, medio e izquierdo). El lóbulo medio se divide a su vez por una fisura umbilical profunda que se extiende casi hasta el hilio. La vena cava inferior es intraparenquimatosa y corre hasta el lóbulo caudado. Existen similitudes en la función hepática porcina y la humana24, sin embargo, los cerdos tienen niveles altos de fosfatasa alcalina, lactato deshidrogenasa y gamma glutamiltransferasa.
Los estudios realizados por Ekser et al.25 y Kim et al.26 indican que el hígado porcino puede funcionar adecuadamente en PNH.
A pesar de que la experiencia con xenotrasplantes de pulmones porcinos es limitada, en gran parte debido a la grave y temprana vasoconstricción que se produce en los pulmones trasplantados, el pulmón porcino ha demostrado proporcionar una adecuada oxigenación e intercambio gaseoso en los PNH27.
La insulina porcina difiere de la humana solo por un aminoácido y ha sido utilizada durante muchos años en los pacientes con diabetes mellitus de tipo 1.
En la actualidad se le ha prestado especial atención al trasplante de islotes de Langerhans como fuente de insulina para pacientes con diabetes mellitus28–30 y tanto los islotes de cerdos no modificados como los de cerdos transgénicos han demostrado que mantienen la normoglucemia en monos diabéticos por periodos de más de un año31.
La córneas porcinas cuentan con un poder de refracción, tamaño y resistencia a la tracción similares a las humanas32. La córnea es un tejido inusual en términos de sus características inmunológicas; por ejemplo, es avascular, tiene expresión débil de antígenos del complejo mayor de histocompatibilidad y tiene presencia de moléculas inmunomoduladoras en el humor acuoso33. No obstante, a pesar de estas características ventajosas, la antigenicidad de la córnea del cerdo ha sido un obstáculo para el xenotrasplante34. Recientemente, un grupo chino ha logrado resultados alentadores usando córneas porcinas decelularizadas como injertos en queratoplastia lamelar anterior para tratar úlceras corneales en humanos35. Con estos avances, así como con el progreso de los inmunosupresores y la disponibilidad de cerdos transgénicos, el xenotrasplante de córnea clínico puede ser una solución cercana para resolver la escasez de estas34.
Barreras inmunológicasRechazo hiperagudoCuando se trasplanta un órgano porcino en un humano o en un PNH se produce una respuesta inmune inmediata conocida con rechazo hiperagudo. Esta se ha definido como la destrucción del injerto en menos de 24h, sin embargo, generalmente sucede en la primera hora.
Esta es debido a la unión de los anticuerpos (AC) antiporcinos preformados a las células endoteliales del injerto. El depósito de AC inicia una respuesta mediada por el complemento con lesión del endotelio, lo que resulta en la trombosis, hemorragia intersticial y edema, con posterior disfunción del injerto36.
Posteriormente se determinó que los AC se unen al epítopo de carbohidrato, galactosa–α1,3-galactosa (Gal), expresado en el endotelio vascular porcino. Este oligosacárido está presente en otros mamíferos, exceptuando a los humanos y los primates.
Estos AC se producen como respuesta a los virus y microorganismos que expresan Gal y colonizan el tracto gastrointestinal de los primates.
Rechazo agudo humoral y respuesta inmune adaptativaA pesar de que el rechazo hiperagudo se prevenga, una reacción similar se genera días o semanas después. Esta también es debida al depósito de AC y complemento que activa el endotelio y, además, hay infiltración de células de la inmunidad innata (polimorfonucleares, macrófagos, células natural killers) lo que en conjunto destruye el tejido37.
Si la terapia inmunosupresora es inadecuada, se desarrolla un respuesta de AC preformados dependientes de células T, lo que resulta en altos niveles de IgG antiporcinos38. La unión de esos AC con el endotelio vascular genera cambios histopatológicos indistinguibles del rechazo agudo37.
Sorprendentemente, el rechazo celular agudo, como se ve en la mayoría de los trasplantes, casi nunca se ha presentado en los xenotrasplantes de cerdos a PNH. Esto probablemente sea debido a que la respuesta humoral es más rápida y solapa la respuesta celular39.
Disfunción de la coagulaciónLa alteración de la coagulación en los vasos del injerto juega un papel importante en su fracaso. La alteración de la coagulación resulta en una microangiopatía trombótica, en el que la vasculatura del órgano se ocluye de forma constante por trombos, y da como resultado necrosis isquémica de los tejidos40.
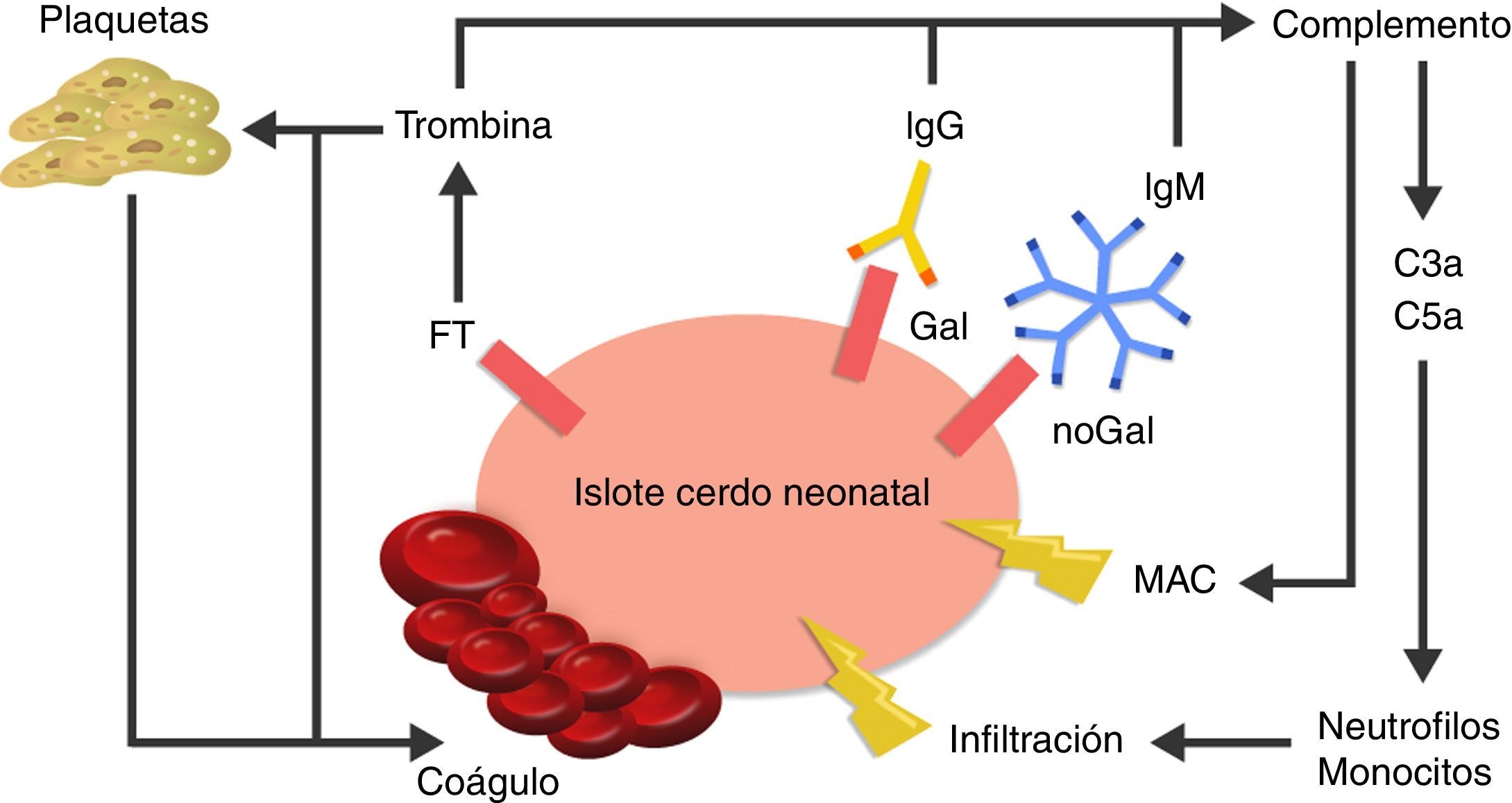
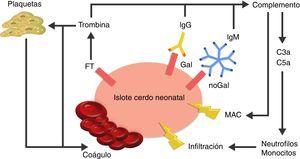
La causa de la microangiopatía trombótica es la activación de las células endoteliales vasculares por los AC, el complemento o las células de la respuesta inmune innata, las cuales cambian el fenotipo de las células de un estado anticoagulante a un estado procoagulante41 (fig. 3).
Visión esquemática de la respuesta inmediata posterior al xenotrasplante.
La expresión del factor tisular y la unión de anticuerpos a antígenos Gal y noGal en los islotes porcinos neonatales lleva a la activación del complemento y de la cascada de la coagulación. Se genera formación de coágulos y daño directo de la membrana celular a través del complejo de ataque a membrana (MAC), así como reclutamiento de macrófagos y monocitos a través de los quimioatrayentes C3a y C5a.
FT: factor tisular.
Fuente: Extraído de van der Windt et al.28.
El rechazo crónico se ha documentado en xenotrasplantes cardiacos de cerdos que han funcionado más de 3 meses en babuinos37 y se evidencia con cambios histopatológicos similares a los que aparecen después de un alotrasplante.
Inducción de toleranciaLa meta tanto en los xenotrasplantes como en los alotrasplantes es lograr la «tolerancia inmunológica», en la que el sistema inmune del receptor se manipula para lograr que el cuerpo acepte las células o el órgano trasplantado sin esfuerzo ni intentos de rechazo. Los esfuerzos en este sentido se han realizado a través de la inducción de quimerismo en las células hematopoyéticas42 o mediante el trasplante de timo porcino43, pero hasta la fecha no han tenido éxito44.
Riesgo de infecciónEl término «xenozoonosis» es utilizado para referirse a la posibilidad de la aparición de nuevos agentes patógenos en los xenotrasplantes.
El riesgo infeccioso del xenotrasplante clínico es desconocido debido a la falta de ensayos clínicos. Basado en la experiencia con los alotrasplantes humanos, se ha asumido el potencial riesgo de infección por la transmisión a través de los xenoinjertos45. El riesgo se amplificó ante el peligro de la transmisión de infecciones zoonóticas de los animales (porcinos) a los receptores humanos, para las cuales no contamos con herramientas de diagnóstico y cuyo comportamiento en el receptor inmunosuprimido es impredecible.
Los resultados de ensayos clínicos como el de Wynyard et al.46 indican que los episodios de transmisión son infrecuentes y que pueden ser irreconocibles entre las infecciones que se prevé se van a producir en los receptores inmunosuprimidos47. Además, un progreso significativo se ha realizado en el estudio de la microbiología de los xenotrasplantes, sobre todo en el screening de los animales fuente de los ensayos clínicos y en el momento se cuenta con múltiples pruebas microbiológicas.
Tanto los cerdos como los humanos poseen retrovirus en su genoma, llamados en el cerdo retrovirus porcinos endógenos (PERV). Estos son el resultado de la infección por retrovirus de células germinales del cerdo, de manera que entran a formar parte del código genético y son transmitidos de una generación a otra.
La preocupación por la transmisión de retrovirus en los xenotrasplantes se debe a la posibilidad de transmisión «silenciosa» que puede causar alteración de la regulación de los genes, oncogénesis o recombinación genética.
Se han identificado 3subgrupos de gammarretrovirus (PERV A-B-C) que poseen potencial infeccioso48. De estos, el PERV A y B tienen la capacidad de infectar células porcinas y células humanas en cultivos in vitro, mientras que PERV C solo infecta células porcinas.
No hay evidencia de infección por retrovirus en las células humanas in vivo pero parece que podrían ser susceptibles a ciertos agentes antivirales49.
El enfoque para garantizar la seguridad de los xenotrasplantes clínicos se ha derivado del enfoque que se hace en los alotrasplantes humanos. No obstante, en ambos casos la prevención absoluta de la transmisión de la infección con el trasplante no es posible. El screening para todos los potenciales patógenos es imposible. En el xenotrasplante clínico el nivel de seguridad se ha desarrollado más allá del disponible para los alotrasplantes. Se cuenta con una producción porcina que asegura el nacimiento de lechones completamente libres de patógenos específicos y que pueden ser probados de forma rutinaria para una batería extensa de patógenos humanos.
Soluciones a las barrerasRespuesta inmune innataYa que los factores asociados con el rechazo hiperagudo del xenoinjerto son similares a los del rechazo de los aloinjertos ABO-incompatibles, se empleó la plasmaféresis para depletar el receptor de anticuerpos anticerdo y, después, se intentó agotar específicamente los anticuerpos anti-Gal por medio de columnas de inmunoafinidad50. No obstante, estos manejos conseguían solo un éxito parcial, ya que retrasaban el rechazo, pero los injertos se perdían cuando se recuperaban los niveles de anticuerpos.
Otro enfoque era administrar un agente que inhibiera el complemento tal como el factor del veneno de cobra, sin embargo, este aumentaba la supervivencia del injerto, pero solo tenía un efecto temporal51.
Posteriormente, cuando la modificación genética porcina fue posible, se propuso un enfoque diferente para evitar el rechazo por medio de proteínas reguladoras del complemento. Ejemplos de estas son el factor de aceleración de decaimiento del complemento (CD55 o DAF) o la proteína cofactor de membrana (MCP o CD46)52.
Cuando se estableció la importancia de Gal en el rechazo, se apuntó a atacar al gen que produce la enzima que une el Gal a las terminales de las cadenas de oligosacáridos, llamada α1,3-galactosiltransferasa: fue en el 2001 cuando se produjo el primer cerdo con supresión de este gen (GTKO) y hasta ahora los estudios muestran protección del rechazo hiperagudo53.
Respuesta inmune adaptativaLa respuesta de células T a un aloinerto o un xenoinjerto se compone de una respuesta a los antígenos del injerto, pero también requiere una segunda respuesta, conocida como la coestimulación. La prevención de la coestimulación resulta en la inhibición de las células T54.
A pesar de que altas dosis de inmunosupresión convencional han retrasado el rechazo de los injertos, se ha asociado con una alta incidencia de complicaciones infecciosas. Una aproximación más exitosa se ha generado con la ingeniería genética de los cerdos transgénicos para el agente estimulador de células T (CTLA4-Ig)55, pero debido a los altos niveles de inmunosupresión que produce, impide la supervivencia a largo plazo. Los esfuerzos posteriores se han dirigido a expresar CTLA4-Ig en tejidos seleccionados.
Blancos noGalcAun cuando las respuestas innata y adaptativa son controladas gracias a la combinación de ingeniería genética y a un régimen inmunosupresor adecuado, sigue existiendo en bajo grado la activación de células endoteliales vasculares del injerto debido a la unión de AC con otros antígenos porcinos.
Los seres humanos tenemos al menos otros 2AC naturales, llamadas ácido N-glicolilneuramínico (NeuGc) y el b1,4N-acetilgalactosaminiltransferasa56,57. La reciente producción de cerdos en los que se ha eliminado el gen que codifica para el NeuGc ha permitido el inicio de estudios in vitro, que se encuentran en proceso58,59.
Disfunción de la coagulaciónSe han realizado esfuerzos para controlar este problema por medio de la administración de anticoagulantes o agentes antitrombóticos al receptor, con resultados parcialmente exitosos. La evidencia señala que el aumento en la inmunosupresión es más efectivo que los agentes anticoagulantes.
Adicionalmente este problema se está tratando de solucionar por medio de la manipulación genética en el intento de desarrollar cerdos que expresen proteínas reguladoras de la coagulación como la trombomodulina (TBM), el receptor endotelial de proteína C (CD39) o el inhibidor del factor tisular. Esto generaría un equilibrio procoagulante y anticoagulante con aumento en la supervivencia del tejido60.
Estudios en la actualidadIslotes pancreáticosEn el 2009 van der Windt et al.61 investigaron si la expresión transgénica de una proteína reguladora del complemento humano (hCD46) en islotes porcinos mejoraría el resultado de los xenotrasplantes de islotes en monos macacos con diabetes inducida con estreptozotocina. Después del trasplante de islotes de cerdos sin modificaciones genéticas (n=2) o de cerdos GTKO (n=2), los islotes sobrevivieron un máximo de 46 días. El trasplante de cerdos hCD46 resultó en la supervivencia del injerto y normoglucemia los 3 meses de seguimiento del experimento y uno de ellos por más de un año.
RiñónHigginbotham et al. estudiaron la importancia de los niveles de AC antiporcinos preformados previos al xenotrasplante62. Utilizaron 34 Macacos rhesus para medir los niveles de AC antiporcinos y los trasplantaron con riñones de cerdos GTKO/CD55. Todos los animales recibieron depleción de células T seguida de terapia de inmunosupresión con bloqueo de la coestimulación (anti-DC154m Ab o belatacept), micofenolato y esteroides. Los animales con los títulos más altos tuvieron rechazo dentro de la primera semana. Los PNH con títulos más bajos tratados con AC anti-CD154 mostraron una supervivencia del injerto renal prolongada (>133, >126 vs. 14, 21 días respectivamente). Los macacos con supervivencia del xenoinjerto prolongada tuvieron una función renal normal, sin evidencia de rechazo en la biopsia del día 100.
Iwase et al. reportaron una supervivencia de un xenotrasplante renal prolongada63. Realizaron un trasplante renal de un cerdo GTKO/CD45/CD55/TBM/EPCR/CD39 a un babuino, el cual sobrevivió 136 días con una creatinina sérica estable (0,6-1,06mg/dL) hasta el final.
HígadoEl xenotrasplante hepático ha tenido poca atención debido a la coagulopatía letal que acompaña el trasplante de hígado porcino en PNH64, la cual ha demostrado ser insuperable25.
Un estudio de Ramírez et al.65, en el que se trasplantaron 5hígados porcinos en babuinos (3 de cerdos no modificados y 2 de cerdos transgénicos para hDAF), mostró que aquellos babuinos que recibieron hígados de cerdos no modificados tuvieron una supervivencia menor a 12 h, mientras que los que recibieron hígados transgénicos para hDAF lograron sobrevivir 4 y 8 días, sin evidencia de rechazo hiperagudo. La muerte al día 8 fue por sepsis y coagulopatía y al otro animal se le hizo eutanasia al día 4 por un episodio de vómito y aspiración; sin embargo, se evidenció una producción adecuada de factores de coagulación y niveles de proteínas durante la sobrevida y en la autopsia no se encontraron signos de rechazo en el xenoinjerto.
En el 2010 Ekser et al. reportaron xenotrasplantes hepáticos en babuinos usando hígados de cerdos genéticamente modificados (GTKO n=2 y DC46 n=8) asociados a regímenes inmunosupresores comunes25. De los 10 babuinos, 6 sobrevivieron por 4-7 días. En todos los casos la función hepática fue adecuada. El principal problema que impedía la prolongación de la supervivencia fue la trombocitopenia intensa que se desarrolló después de la primera hora de reperfusión que llevó a sangrado espontáneo.
Recientemente Shah et al. reportaron su experimento histórico en el que superaron la coagulopatía y lograron la supervivencia de 25 días de un PNH que recibió un xenoinjerto ortotópico de hígado porcino GTKO66. Tras el xenotrasplante se realizó administración de factores de coagulación exógenos y se logró controlar la coagulopatía, mantener la circulación de plaquetas y prevenir la microangiopatía trombótica. Se hizo eutanasia del PNH al día 25 por colestasis y hemolisis; en la biopsia post morten hubo evidencia de necrosis focal hepática del 30% y leve congestión; sin embargo, los tractos portales estaban intactos, sin evidencia de rechazo, inflamación ni microangiopatía trombótica. Este experimento proporciona la primera evidencia de que un xenotrasplante hepático porcino podría dar soporte durante un periodo prolongado67.
CorazónMuhammad et al.23 trasplantaron corazones heterotópicos de cerdos genéticamente modificados en babuinos. Dividieron en grupos de cerdos GTKO/hCD46 (grupo A, B, C) y otros que adicionalmente expresaban el gen regulador de la trombomodulina humana (hTBM) (grupo D). Los injertos del grupo D (n=5) llevan una sobrevida de más de 200 días y continúan en seguimiento por más de un año (fig. 4).
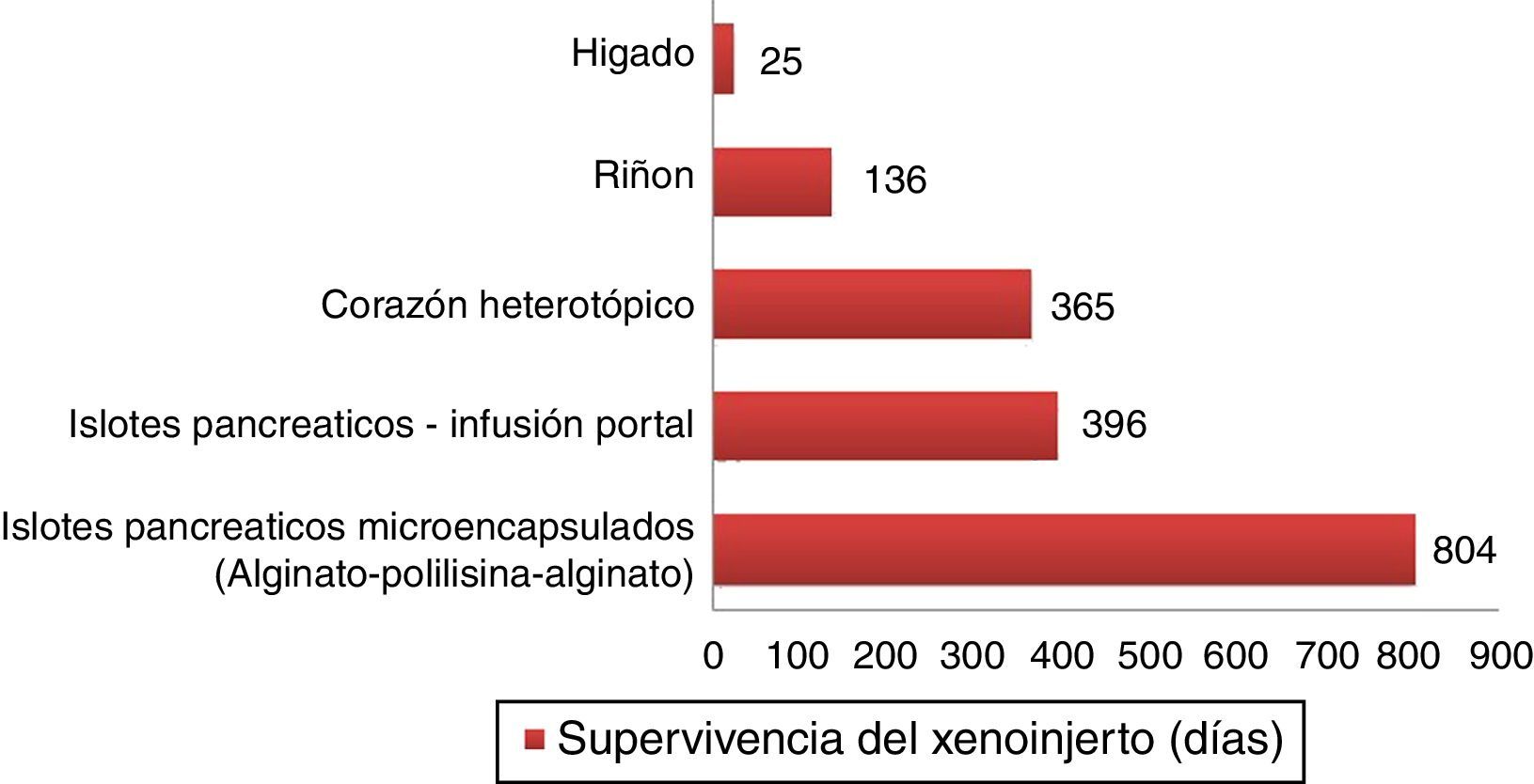
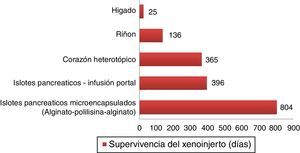
Supervivencias más largas de xenoinjertos porcinos en primates no humanos.
Islotes pancreáticos microencapsulados de cerdos no modificados lograron sobrevivir 804 días con retrasplante y 250 días sin un nuevo trasplante72. Islotes pancreáticos de cerdos hCD46 sobrevivieron 396 días en babuinos61. Corazones heterotópicos de cerdos GTKO/hCD46/hTBM lograron una supervivencia de más de un año23. Riñones de cerdos GTKO/CD46/CD55/TBM/EPCR/CD39 lograron una supervivencia de 136 días con una creatinina estable63. Un xenoinjerto ortotópico de hígado porcino GTKO logró supervivencia de 25 días en un babuino con administración continua de factores de coagulación exógenos postrasplante66.
La escasez de órganos es un problema innegable en el trasplante de órganos. Incluso si somos capaces de aumentar significativamente los índices de donación, los alotrasplantes nunca serán capaces de proporcionar suficientes islotes para todos los pacientes diabéticos del mundo. El xenotrasplante es una realidad cercana que se podría iniciar a través de los xenotrasplantes celulares o como un «puente» para el alotrasplante68.
Los xenotrasplantes de cerdos a PNH han progresado muchísimo y probablemente los primeros ensayos clínicos de xenotrasplantes de órganos completos deban ser en pacientes con insuficiencia renal. Estos pacientes podrían ser seleccionados al tener un alto grado de sensibilización de HLA69, lo que impide que obtengan fácilmente un aloinjerto, o se podría elegir a aquellos pacientes que ya no cuentan con accesos óptimos para continuar con la diálisis.
Acerca de la seguridad frente a las zoonosis, la mayor atención se ha dirigido al riesgo de transmisión de PERV. En la actualidad, se considera que el riesgo es muy bajo y que la transmisión inevitable no debería impedir el xenotrasplante clínico70.
Cuando todas las barreras patobiológicas se hayan superado, será mucho más fácil estudiar las diferencias fisiológicas que puedan limitar la eficacia de los xenotrasplantes71. Por ejemplo, a pesar de que algunos de los productos del hígado porcino parecen funcionar adecuadamente en PNH24, es poco probable que estos hígados cumplan con todas las necesidades metabólicas del receptor humano. En estos casos, la ingeniería genética del cerdo fuente podría corregir las diferencias.
Los expertos esperan que en los próximos 5 años las barreras que aún quedan se solucionen con la introducción de la ingeniería genética de cerdos, la cual cada vez logra más rapidez y facilidad para hacer modificaciones genómicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Autoría/colaboradoresA.M. Aristizabal ha contribuido con la concepción y diseño de la revisión, con la escritura del manuscrito y el diseño de diagramas y figuras.
L.A. Caicedo ha realizado la revisión crítica del contenido y la aprobación de la versión final del manuscrito.
J.M. Martínez y M. Moreno han realizado la escritura del manuscrito.
G. Echeverri ha contribuido con la concepción y diseño de la revisión, con el diseño de diagramas, figuras y el concepto general. También ha participado en la revisión crítica del contenido y en la aprobación de la versión final del manuscrito.