El vaciamiento gástrico lento (VGL) es una de las complicaciones más frecuentes tras la duodenopancreatectomía cefálica. El objetivo del actual estudio es analizar los factores de riesgo de su aparición.
MétodosAnálisis de factores de riesgo de VGL sobre una base de datos prospectiva de 390 pacientes intervenidos entre 2013 y 2021. Se realizó un estudio retrospectivo comparativo entre pacientes con y sin VGL y posteriormente un estudio de factores de riesgo de VGL mediante modelos de regresión logística univariante y multivariante.
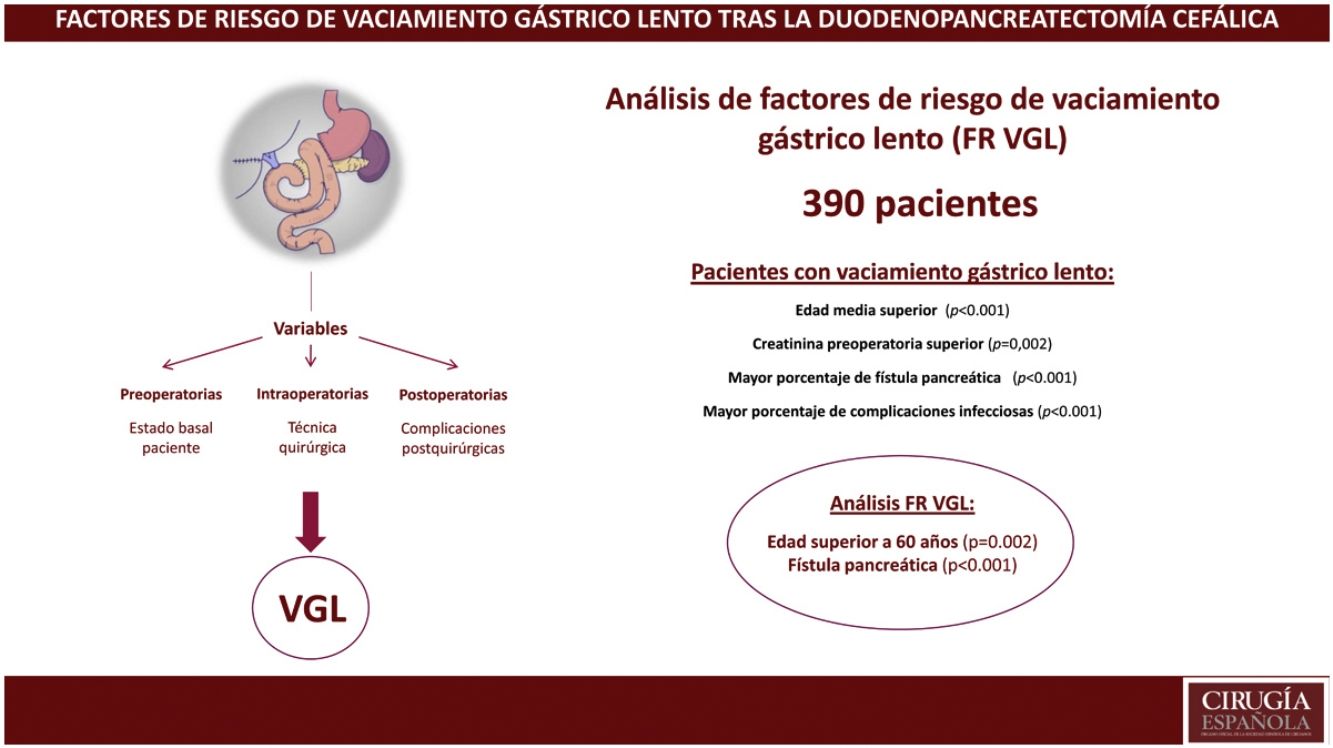
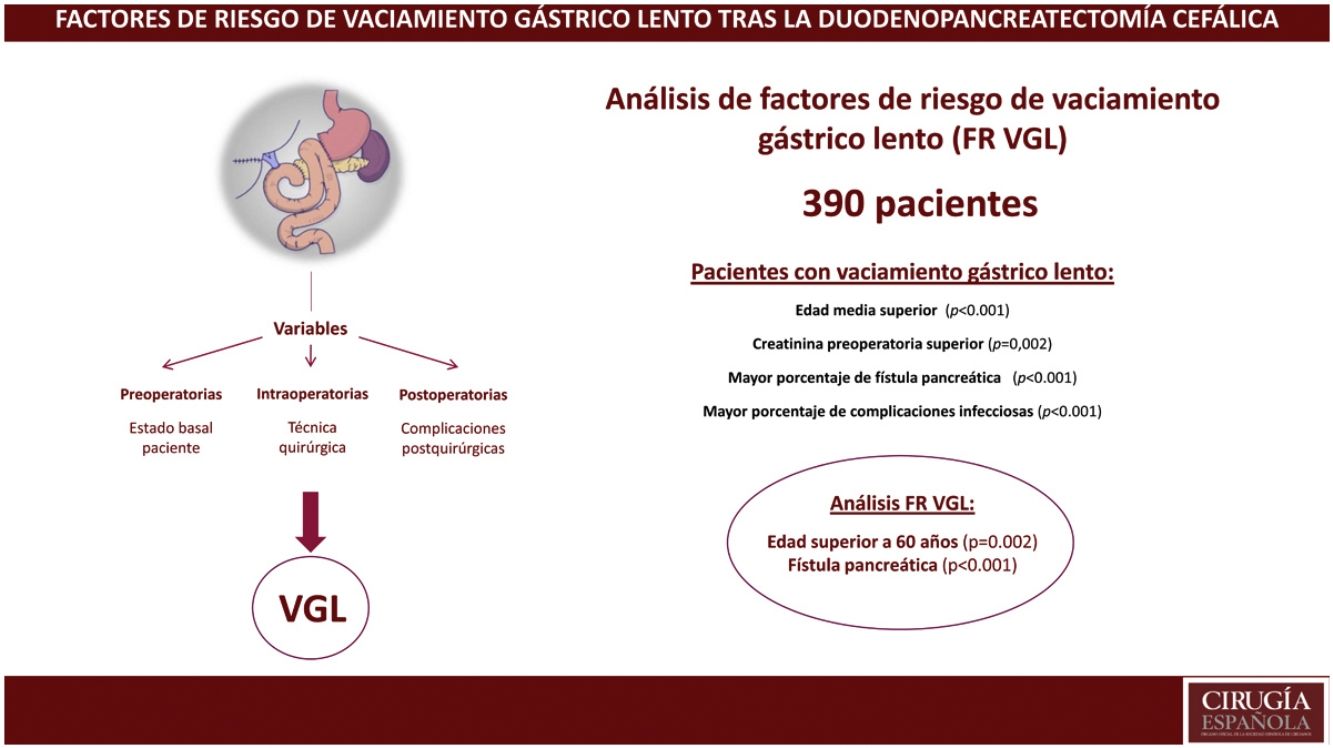
ResultadosLa incidencia de VGL en el global de la serie fue del 28%. Un 63% de los pacientes presentaron alguna complicación y la mortalidad postoperatoria fue del 3,1%. Se evidenció que la edad mediana (73 años vs. 68 años, p<0,001) y la creatinina preoperatorias (75 vs. 68.5, p<0,001) eran superiores en el grupo VGL. El estudio de factores de riesgo evidenció que la edad superior a 60 años (p=0,002) y la fístula pancreática (p<0,001) eran factores de riesgo de VGL.
ConclusionesLa presencia de fístula pancreática se confirma como factores de riesgo de VGL tras la duodenopancreatectomía. Además, se demuestra que la edad superior a 60 años es un factor de riesgo de VGL.
Delayed gastric emptying is one of the most frequent complications after pancreatoduodenectomy.
MethodsWe performed an analysis of risk factors for delayed gastric emptying on a prospective database of 390 patients operated on between 2013 and 2021. A comparative retrospective study was carried out between patients with and without delayed gastric emptying and subsequently a study of risk factors for delayed gastric emptying using univariate and multivariate logistic regression models.
ResultsThe incidence of delayed gastric emptying in the overall series was 28%. The morbidity of the group was 63% and postoperative mortality was 3.1%. Focusing in delayed gastric emptying, it was shown that the median age (73 years vs. 68 years, p<0.001) and preoperative creatinine (75 vs. 65.5, p<0.001) were higher in the group with this complication. The study of risk factors showed that age over 60 years (p=0.002) and pancreatic fistula (p<0.001) were risk factors for delayed gastric emptying.
ConclusionsThe presence of pancreatic fistula is confirmed as risk factor for slow gastric emptying after pancreaticoduodenectomy. In addition, age over 60 years is shown to be a risk factor for slow gastric emptying.
El vaciamiento gástrico lento (VGL) sigue siendo una de las complicaciones más frecuentes tras la duodenopancreatectomía cefálica (DPC), con una incidencia entre un 13,5% y más del 40%1–4.
Diversos detalles técnicos en la fase de resección de pancreatoduodenectomía, como la realización de una DPC tipo Whipple versus DPC con preservación del píloro5,6, la extensión de linfadenectomía7 o la división de la vena gástrica izquierda8, han sido investigados como factores de riesgo de VGL. Asimismo, varias modificaciones en la técnica quirúrgica en la fase de reconstrucción se han propuesto para reducir el VGL tras la DPC. Estos incluyen la realización de la anastomosis gastroentérica de forma antecólica9, la reconstrucción Billroth I para la anastomosis gastroentérica10 o enteroenterostomía de Braun11.
Se han propuesto algunas características del paciente como factores asociados a VGL. Sin embargo, hay escasa evidencia científica sobre el análisis de factores de riesgo de dicha complicación1,3,4,12. Recientemente, la publicación de dos series con más de 10.000 pacientes ha puesto de manifiesto que la edad avanzada podría ser un factor de riesgo de VGL, hecho todavía por corroborar12,13.
Ante la preocupación en la literatura mundial al respecto, nuestro grupo ha investigado acerca de dicho problema postoperatorio desde hace años5,14. Fruto de ello hemos estandarizado nuestra técnica quirúrgica con la realización de antrectomía y practicando una gastroenteroanastomosis antecólica. Ahora bien, a pesar del esfuerzo de los cirujanos pancreáticos, el VGL sigue siendo un problema relevante, sin entender en ocasiones cuál es su etiología.
En el estudio actual queremos ahondar en las causas que generan el VGL tras la DPC, y poder poner solución si la hubiera. Nuestra hipótesis es que, tal y como es sabido, la presencia de fístula pancreática puede relacionarse con VGL. Sin embargo, no sabemos qué variables preoperatorias son relevantes en este aspecto, y cómo puede trascender el estado nutricional en la aparición de dicha complicación. Así pues, el objetivo de este estudio es analizar en profundidad los factores de riesgo de VGL tras la DPC.
MétodosEntre 2013 y 2021 registramos de forma prospectiva los pacientes a los que se realizó una DPC en nuestro centro. Todas las cirugías las realizaron un equipo experimentado en cirugía pancreática. Se incluyeron todos los pacientes intervenidos, cualquiera que fuese la indicación, incluyendo también aquellos casos con cáncer de páncreas que durante el acto quirúrgico implicara la ampliación del margen. Los datos se introdujeron en una base de datos prospectiva incluyendo datos preoperatorios clínicos y de laboratorio, datos intraoperatorios, anatomopatológicos, y de morbilidad postoperatoria.
Las complicaciones postoperatorias registradas fueron definidas de acuerdo con los criterios y definiciones del ISGPS15. Se definió el VGL y los grados de VGL de acuerdo con los criterios del ISGPS16.
Se definió conducto pancreático estrecho aquel con un diámetro menor o igual a 3mm. La fístula pancreática se definió por la salida de líquido de drenaje rico en amilasa a partir del tercer día postoperatorio, y clasificados según el Grupo de Estudio Internacional de Fístula Pancreática15. La fístula pancreática tipo B y la tipo C se han agrupado en nuestro estudio como fístula pancreática clínicamente relevante. La morbilidad postoperatoria abarcó la aparición de cualquier complicación durante la estancia hospitalaria. En el postoperatorio y durante el ingreso se definieron las complicaciones según la clasificación de Clavien-Dindo17. La mortalidad perioperatoria se definió como la muerte durante el mismo ingreso hospitalario o los 90 días posteriores a la cirugía si el paciente fue dado de alta antes. Los reingresos se registraron los primeros 90 días después de la cirugía.
En el protocolo de nuestro centro el estudio y la valoración preoperatoria de los pacientes se realiza por parte del equipo de cirugía digestiva. En la analítica preoperatoria se incluyeron, entre otros, la bilirrubina en sangre y la albúmina. El drenaje biliar preoperatorio no se realizó de forma sistemática, sino que únicamente se indicó en aquellos pacientes con dudas sobre el manejo final o con una demora prevista de la cirugía de más de 2 semanas.
La DPC se realizó siguiendo la técnica previamente descrita18,19. La intervención quirúrgica se inició con una laparoscopia exploradora, convirtiendo a laparotomía en caso de ausencia de enfermedad a distancia. Se realizó una laparotomía subcostal derecha, con exploración minuciosa y sistemática de la cavidad abdominal. En caso de evidenciar signos de extensión de la enfermedad se realizó biopsia preoperatoria, contraindicando la resección en caso de positividad de la misma y practicando una derivación bilio-digestiva. Todos los pacientes fueron resecados con intención curativa. La técnica realizada fue la DPC, con una linfadenectomía incluyendo el tejido linfático peripancreático y periduodenal. La cirugía se inició con colecistectomía, linfadenectomía del hilio hepático y sección de la vía biliar; para continuar con la movilización del duodeno y colon derecho. Tras la sección de estómago y yeyuno proximal, y descruzar el intestino, se disecó el páncreas uncinado hasta finalizar la linfadenectomía de la porción derecha de la arteria mesentérica superior, y finalizar la DPC. Se remitió la pieza de resección a estudio por congelación para analizar el margen del cuello pancreático. En caso de colangiocarcinoma distal, se remetió una sección de margen del conducto hepático proximal para estudio en fresco. La afectación del mismo obligó a ampliar la resección de la vía biliar, con un nuevo análisis y resección de conducto hepático hasta la bifurcación de la vía biliar. El estudio anatomopatológico fue realizado por una misma patóloga con un interés especial en la patología, en todos los casos. La inclusión de la pieza siguió un protocolo de los márgenes de resección, con análisis del margen retroperitoneal y del margen de sección del cuello pancreático, así como el análisis de los territorios ganglionares. En nuestra experiencia no se hallaron diferencias entre preservación pilórica y antrectomía en cuanto al VGL5, por lo que a partir del año 2011 todos los pacientes fueron sometidos a DPC con antrectomía. La reconstrucción se practicó con un asa intestinal única a la cual se anastomosó el páncreas, vía biliar y duodeno consecutivamente. La anastomosis pancreático-yeyunal realizada fue ducto-mucosa termino-lateral como primera elección, y termino- terminal introducida en caso de presentar ducto fino. Finalmente, se colocaron dos drenajes aspirativos cercanos a las anastomosis pancreático-yeyunal y biliodigestiva.
Asimismo, incluimos los pacientes que formaron parte del estudio aleatorizado PAUDA trial14, tanto grupo estudio (reconstrucción en Y de Roux) y grupo control (reconstrucción en Billroth II). En el citado estudio, que incluye 80 pacientes, se descartó que la realización de una gastroenteroanastomosis en Y de Roux disminuyera la incidencia de VGL y al realizar un estudio de factores de riesgo de dicha complicación se asociaron a mayor incidencia de la misma la hiperbilirrubinemia y la hipoalbuminemia. En el presente estudio se realiza un estudio de factores de riesgo de VGL en un grupo mayor de pacientes y sin tener en cuenta el tipo de reconstrucción intestinal realizada, ya que la misma había sido valorada en un ensayo clínico aleatorizado anterior.
En cuanto al manejo postoperatorio, los pacientes fueron remitidos a la Unidad de Reanimación Posquirúrgica sin sondaje nasogástrico. Iniciaron dieta hídrica a las 12h de la intervención14. Se pautó de forma sistemática antiemético (ondansetron 4mg cada 8h) añadiendo metoclopramida (10mg cada 8h) en caso de presentar náuseas. La analgesia durante las primeras 48h se basó en metamizol (2g cada 8h) y paracetamol (1g cada 8h). Se realizó análisis de amilasas de los drenajes quirúrgicos de forma sistemática entre el 3.er y 4.o día postoperatorio. La analgesia de rescate se basó en morfina endovenosa controlada por el paciente (PCA) a dosis de 0,5mg por bolus, con un máximo de 24mg/4h. Tras las primeras 48h se realizó la retirada de PCA incluyendo metamizol (2g cada 8h) y paracetamol (1g cada 8h) endovenosos.
En caso de no presentar incidencias destacables en el postoperatorio, el paciente fue dado de alta a la planta de hospitalización, donde se progresó dieta siguiendo el protocolo ERAS de nuestro centro. En caso de VGL el manejo se basó en la dieta absoluta, colocación de sonda nasogástrica y administración de antieméticos. No se realizó de forma rutinaria ninguna prueba diagnóstica, pero se realizó estudio endoscópico y radiológico en aquellos pacientes con VGL grado B o C. También se realizó tratamiento de las complicaciones asociadas en caso de existir.
Análisis estadísticoSe ha realizado un estudio retrospectivo basado en una recogida de datos prospectiva. Para cada variable realizamos un estudio descriptivo inicial con medidas de asociación según aparición de VGL: para las variables categóricas usamos números absolutos y porcentajes, así como la prueba de χ2 o prueba exacta de Fisher; para las variables cuantitativas calculamos medianas y rangos intercuartílicos, así como la t-Student o U de Mann-Whitney. Para el análisis de factores de riesgo de VGL se diseñó un modelo de regresión logística multivariable tomando las variables con valor de p<0,2 en el modelo univariable, así como las que se consideraron clínicamente relevantes. El análisis estadístico se realizó con Stata 13.0 (StataCorp, Texas, EE.UU.).
Finalmente, se realizó un estudio de factores de riesgo de VGL mediante modelos de regresión de logística univariante. Para el análisis multivariante se seleccionaron las variables significativas en el estudio univariante, variables demográficas (edad y sexo), así como las variables preoperatorias y postoperatorias que clínicamente se consideraron relacionadas con el VGL. Un valor de p<0,050 se consideró estadísticamente significativo. Los análisis estadísticos se realizaron utilizando el software SPSS® versión 18 (IBM, Armonk, Nueva York, EE.UU.).
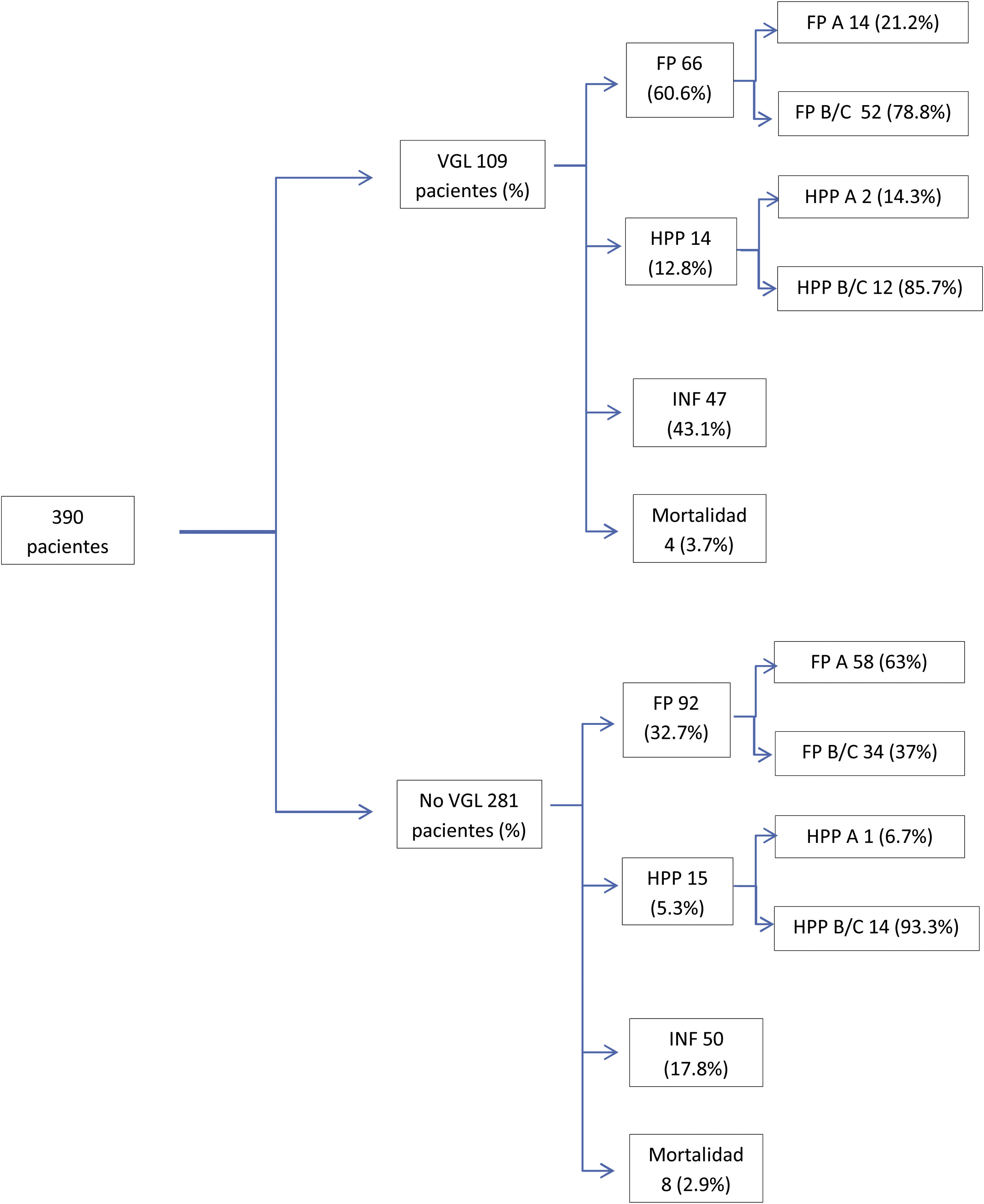
ResultadosDurante el período de estudio se intervinieron 390 pacientes, con una edad mediana de 69 (61-75) años, un 62% eran hombres. En cuanto a la evolución postoperatoria, 245 pacientes (63%) presentaron algún tipo de complicación, y en el global del grupo se observó una mortalidad postoperatoria del 3,1% (tabla 1, fig. 1). Las causas de fallecimiento fueron la insuficiencia respiratoria en 4 pacientes, la asociación de fístula pancreática y hemorragia en 4 pacientes más y la trombosis del injerto venoso en un paciente con consecuente isquemia intestinal que requirió hemicolectomía derecha. Los 3 pacientes restantes fallecieron por aplasia medular de origen desconocido en un caso, isquemia arterial de extremidad inferior y accidente cerebrovascular hemorrágico en otro paciente y por último un infarto agudo de miocardio en el tercero.
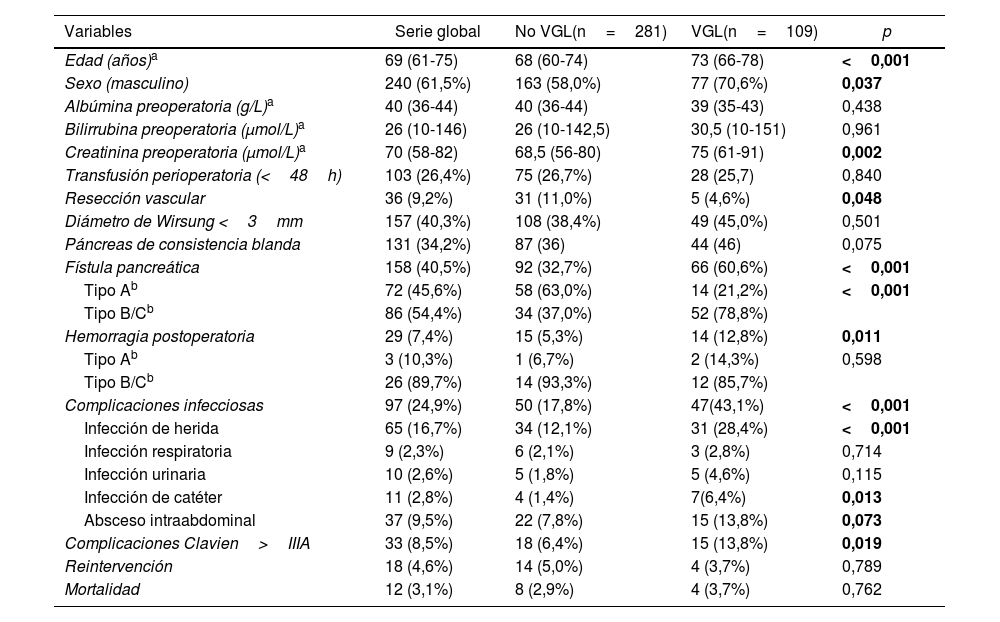
Datos demográficos y variables preoperatorias y postoperatorias
| Variables | Serie global | No VGL(n=281) | VGL(n=109) | p |
|---|---|---|---|---|
| Edad (años)a | 69 (61-75) | 68 (60-74) | 73 (66-78) | <0,001 |
| Sexo (masculino) | 240 (61,5%) | 163 (58,0%) | 77 (70,6%) | 0,037 |
| Albúmina preoperatoria (g/L)a | 40 (36-44) | 40 (36-44) | 39 (35-43) | 0,438 |
| Bilirrubina preoperatoria (μmol/L)a | 26 (10-146) | 26 (10-142,5) | 30,5 (10-151) | 0,961 |
| Creatinina preoperatoria (μmol/L)a | 70 (58-82) | 68,5 (56-80) | 75 (61-91) | 0,002 |
| Transfusión perioperatoria (<48h) | 103 (26,4%) | 75 (26,7%) | 28 (25,7) | 0,840 |
| Resección vascular | 36 (9,2%) | 31 (11,0%) | 5 (4,6%) | 0,048 |
| Diámetro de Wirsung <3mm | 157 (40,3%) | 108 (38,4%) | 49 (45,0%) | 0,501 |
| Páncreas de consistencia blanda | 131 (34,2%) | 87 (36) | 44 (46) | 0,075 |
| Fístula pancreática | 158 (40,5%) | 92 (32,7%) | 66 (60,6%) | <0,001 |
| Tipo Ab | 72 (45,6%) | 58 (63,0%) | 14 (21,2%) | <0,001 |
| Tipo B/Cb | 86 (54,4%) | 34 (37,0%) | 52 (78,8%) | |
| Hemorragia postoperatoria | 29 (7,4%) | 15 (5,3%) | 14 (12,8%) | 0,011 |
| Tipo Ab | 3 (10,3%) | 1 (6,7%) | 2 (14,3%) | 0,598 |
| Tipo B/Cb | 26 (89,7%) | 14 (93,3%) | 12 (85,7%) | |
| Complicaciones infecciosas | 97 (24,9%) | 50 (17,8%) | 47(43,1%) | <0,001 |
| Infección de herida | 65 (16,7%) | 34 (12,1%) | 31 (28,4%) | <0,001 |
| Infección respiratoria | 9 (2,3%) | 6 (2,1%) | 3 (2,8%) | 0,714 |
| Infección urinaria | 10 (2,6%) | 5 (1,8%) | 5 (4,6%) | 0,115 |
| Infección de catéter | 11 (2,8%) | 4 (1,4%) | 7(6,4%) | 0,013 |
| Absceso intraabdominal | 37 (9,5%) | 22 (7,8%) | 15 (13,8%) | 0,073 |
| Complicaciones Clavien>IIIA | 33 (8,5%) | 18 (6,4%) | 15 (13,8%) | 0,019 |
| Reintervención | 18 (4,6%) | 14 (5,0%) | 4 (3,7%) | 0,789 |
| Mortalidad | 12 (3,1%) | 8 (2,9%) | 4 (3,7%) | 0,762 |
VGL: vaciamiento gástrico lento.
Evolución clínica de los pacientes con y sin VGL (las complicaciones asociadas no son excluyentes, los pacientes pueden presentar más de una complicación).
FP: fístula pancreática; FP A: fístula pancreática tipo A; FP B/C: fístula pancreática tipo B/C; HPP: hemorragia pospancreatectomía; HPP A: hemorragia pospancreatectomía tipo A; HPP B/C: hemorragia pospancreatectomía tipo B/C; INF: complicaciones infecciosas; VGL: vaciamiento gástrico lento.
La presencia de fístula pancreática fue del 40,5%, y las complicaciones hemorrágicas del 7,4%. En cuanto a las complicaciones infecciosas se identificaron en 97 pacientes (25%), siendo las más relevantes la infección de herida que apareció en un 17% de los enfermos. La infección de catéter se produjo en un 2,8% de pacientes y el absceso intraabdominal en un 9,5% de los pacientes. Se ha completado el estudio realizando un análisis bivariante para relacionar las complicaciones infecciosas en los pacientes con o sin drenaje biliar preoperatorio. Se ha observado una tendencia mayor a las complicaciones infecciosas en general y en cada una de ellas en los pacientes no portadores de drenaje (tabla 2).
Complicaciones infecciosas, vaciamiento gástrico lento y drenaje biliar
| Drenaje biliar No(n=261) | Drenaje biliar Sí(n=129) | p | |
|---|---|---|---|
| Vaciamiento gástrico lento (n=109) | 76 (70%) | 33 (30%) | 0,464 |
| Complicaciones infecciosas (n=97) | 74 (76%) | 23 (24%) | 0,024 |
| Infección herida quirúrgica (n=65) | 48 (74%) | 17 (26%) | 0,194 |
| Infección respiratoria (n=9) | 8 (89%) | 1 (11%) | 0,156 |
| Infección urinaria (n=10) | 9 (90%) | 1 (1%) | 0,116 |
| Infección catéter (n=11) | 8 (73%) | 3 (27%) | 0,678 |
| Absceso intraabdominal (n=37) | 28 (76%) | 9 (24%) | 0,234 |
Registramos un 28% de VGL, evidenciando que la edad media y la creatinina preoperatorias eran superiores en el grupo con VGL respecto al resto. En cuanto a las complicaciones postoperatorias, en el grupo VGL se evidenciaba un mayor porcentaje de fístula pancreática y de complicaciones infecciosas en general e infección de herida. En el grupo de pacientes que presentaron VGL como complicación el número de pacientes portadores de drenaje biliar era menor que los pacientes no portadores del mismo (tabla 2).
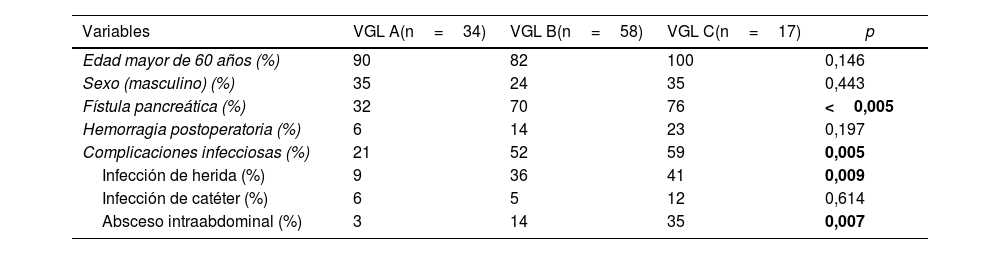
Al analizar el grado de VGL, el 31% fueron tipo A, el 53% tipo B y el 16% tipo C. Evidenciamos que los pacientes con VGL grado C se asociaron con otras complicaciones severas, como fístula pancreática o complicaciones infecciosas, infección de herida y absceso intraabdominal (tabla 3).
Características basales y grados de VGL
| Variables | VGL A(n=34) | VGL B(n=58) | VGL C(n=17) | p |
|---|---|---|---|---|
| Edad mayor de 60 años (%) | 90 | 82 | 100 | 0,146 |
| Sexo (masculino) (%) | 35 | 24 | 35 | 0,443 |
| Fístula pancreática (%) | 32 | 70 | 76 | <0,005 |
| Hemorragia postoperatoria (%) | 6 | 14 | 23 | 0,197 |
| Complicaciones infecciosas (%) | 21 | 52 | 59 | 0,005 |
| Infección de herida (%) | 9 | 36 | 41 | 0,009 |
| Infección de catéter (%) | 6 | 5 | 12 | 0,614 |
| Absceso intraabdominal (%) | 3 | 14 | 35 | 0,007 |
VGL: vaciamiento gástrico lento. En negrita, estadísticamente significativo.
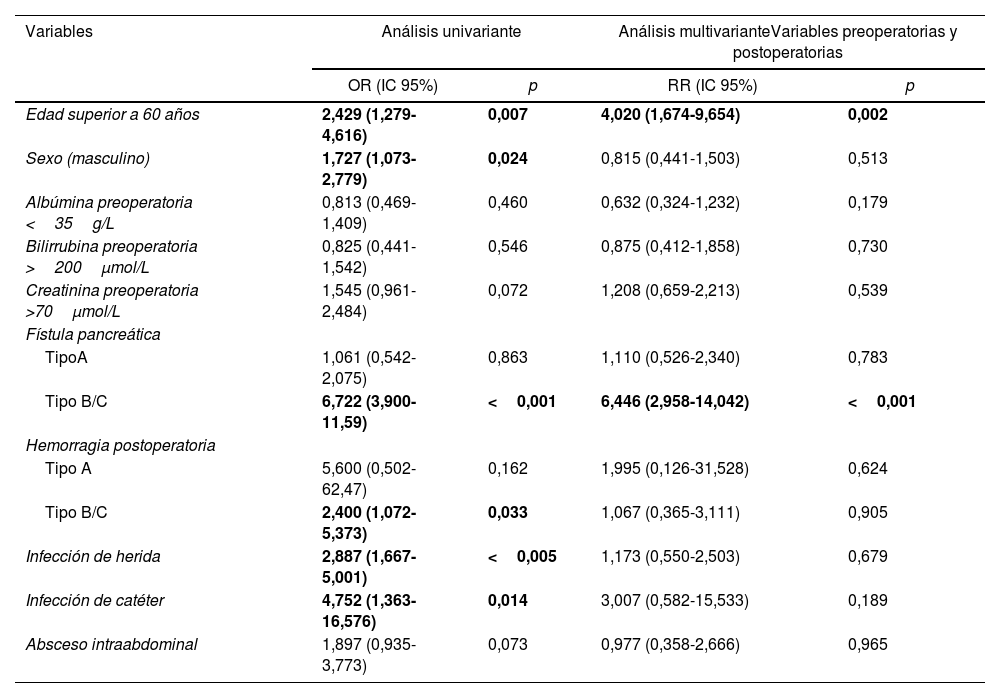
Se realizó un modelo multivariante de factores de riesgo incluyendo variables preoperatorias y postoperatorias (tabla 4). El estudio de factores de riesgo de VGL evidenció que la edad superior a 60 años y la fístula pancreática eran factores de riesgo de VGL.
Variables relacionadas con el vaciamiento gástrico lento
| Variables | Análisis univariante | Análisis multivarianteVariables preoperatorias y postoperatorias | ||
|---|---|---|---|---|
| OR (IC 95%) | p | RR (IC 95%) | p | |
| Edad superior a 60 años | 2,429 (1,279-4,616) | 0,007 | 4,020 (1,674-9,654) | 0,002 |
| Sexo (masculino) | 1,727 (1,073-2,779) | 0,024 | 0,815 (0,441-1,503) | 0,513 |
| Albúmina preoperatoria <35g/L | 0,813 (0,469-1,409) | 0,460 | 0,632 (0,324-1,232) | 0,179 |
| Bilirrubina preoperatoria >200μmol/L | 0,825 (0,441-1,542) | 0,546 | 0,875 (0,412-1,858) | 0,730 |
| Creatinina preoperatoria >70μmol/L | 1,545 (0,961-2,484) | 0,072 | 1,208 (0,659-2,213) | 0,539 |
| Fístula pancreática | ||||
| TipoA | 1,061 (0,542-2,075) | 0,863 | 1,110 (0,526-2,340) | 0,783 |
| Tipo B/C | 6,722 (3,900-11,59) | <0,001 | 6,446 (2,958-14,042) | <0,001 |
| Hemorragia postoperatoria | ||||
| Tipo A | 5,600 (0,502-62,47) | 0,162 | 1,995 (0,126-31,528) | 0,624 |
| Tipo B/C | 2,400 (1,072-5,373) | 0,033 | 1,067 (0,365-3,111) | 0,905 |
| Infección de herida | 2,887 (1,667-5,001) | <0,005 | 1,173 (0,550-2,503) | 0,679 |
| Infección de catéter | 4,752 (1,363-16,576) | 0,014 | 3,007 (0,582-15,533) | 0,189 |
| Absceso intraabdominal | 1,897 (0,935-3,773) | 0,073 | 0,977 (0,358-2,666) | 0,965 |
En negrita, estadísticamente significativo.
La presencia de complicaciones intraabdominales se ha relacionado con VGL1,20. Nuestro grupo demostró en un estudio aleatorizado previamente publicado que dos variables preoperatorias, la hiperbilirrubinemia y la hipoalbuminemia, se hallaban implicadas en el VGL14. Un estudio adicional no publicado sobre este ensayo clínico aleatorizado demostró además la edad avanzada como factor de riesgo de VGL. Así, deberemos valorar detenidamente a los pacientes antes de realizarles una cirugía pancreática.
Noorani et al. en 2016 publicaron un análisis de factores de riesgo de VGL tras cirugía pancreática correlacionando la edad avanzada (edad superior a 72 años) con VGL21. Posteriormente, en una revisión sobre más de 10.000 pacientes, Ellis et al.12 demostraron que la edad superior a 75 años fue un factor de riesgo de VGL en ausencia de fístula pancreática o infección intraabdominal (p=0,003). En nuestra experiencia, los mayores de 60 años presentaron mayor incidencia de VGL. Coincidiendo con nuestros resultados, un trabajo reciente concluye que la edad se relaciona con el riesgo de VGL tras DPC13. En este estudio se analizan los factores de riesgo de dicha complicación en una cohorte retrospectiva con 10.249 de una base de datos nacional (The American College of Surgeons National Surgical Quality Improvement Program), y la edad superior a 65 años demostró ser factor de riesgo en el análisis multivariante. Algunos autores han evidenciado una actividad fúndica deteriorada en pacientes con edad avanzada al ingerir alimentos líquidos22, cuestión que puede correlacionarse con nuestro hallazgo clínico. Así pues, en nuestra opinión, la cirugía pancreática en el paciente añoso puede indicarse de forma personalizada, teniendo en cuenta que la edad avanzada es un factor que puede comportar mayor morbilidad asociada. Por último, estudios retrospectivos descartaron la edad avanzada como factor relevante en la aparición de VGL1,23,24. Como vemos, no hay unanimidad respecto al papel de la edad en el VGL, motivo por el cual es un dato que deberá ser refrendado en estudios posteriores.
Es conocida la relación entre la presencia de fístula pancreática y VGL1,2,4,25, ya que la motilidad gástrica se ve afectada por la sepsis y la inflamación peripancreática cercanas. Se apunta al efecto perjudicial del jugo pancreático en la motilidad gástrica25. En este sentido, la reconstrucción antecólica de la gastroenteroanastomosis ha demostrado un beneficio en cuanto al VGL, al separar físicamente las suturas gástrica y pancreática9. La presencia de un absceso intraabdominal tras la DPC se ha relacionado con el VGL1,2,20. Incluso se ha demostrado que la presencia de complicaciones infecciosas son un factor de riesgo de VGL2,20. Sin embargo, otras complicaciones infecciosas, como la infección de herida, han sido menos estudiadas en relación con el VGL. Parmar et al.2, en su artículo, demuestran que además de la sepsis o el shock séptico, la dehiscencia de herida quirúrgica se correlaciona con el VGL. En nuestra serie también hemos hallado que diversas complicaciones infecciosas como la infección de herida, de catéter, o el absceso intraabdominal podrían empeorar el tránsito digestivo ya que han sido más frecuentes en el grupo con VGL, pese a no demostrar significación estadística en el análisis multivariante.
En relación con las complicaciones infecciosas, diversos gérmenes han sido correlacionados con complicaciones posquirúrgicas tras la DPC. Así, el aislamiento de alguno de ellos se ha apuntado como la causa, y no la consecuencia de la complicación, una hipótesis difícil de entender, pero que está tomando forma. En este sentido, algunos autores han demostrado que la determinación de Enterococcus faecium en el drenaje quirúrgico se asocia a fístula pancreática de forma significativa; dichos autores elaboran la hipótesis que dicho germen podría facilitar la degradación de colágeno cercana a la sutura pancreática, y favorecer la fístula pancreática26. En un estudio reciente, Coppola et al.27 analizaron la microbiología de la vía biliar en el acto operatorio. Demostraron que el aislamiento de Escherichia coli se asoció con mayor VGL como una complicación única. Dichos autores señalan que E. coli puede producir y/o consumir neurotransmisores, incluido el ácido gamma-aminobutírico, principal neurotransmisor inhibidor de la motilidad intestinal y el vaciamiento gástrico. Coppola et al. defienden que la presencia de E. coli podría implicar mal funcionamiento gástrico27. En cuanto a la infección de herida y sus implicaciones, Fong et al.28 aconsejan realizar cultivos intraoperatorios de la bilis obtenida de forma sistemática. En su estudio, demuestran relación entre los gérmenes obtenidos de los cultivos de bilis intraoperatorios y los gérmenes que provocaron infección de herida. No tenemos una explicación clara para justificar la correlación entre la infección de herida y el vaciamiento gástrico retardado, pero hipotéticamente se apunta que la presencia de determinados gérmenes en la herida quirúrgica podría agravar o causar el VGL. Un estudio detallado de la flora microbiológica contaminante en cada una de las complicaciones infecciosas y su repercusión sobre el vaciamiento gástrico sería una de las vías de interés en estudios posteriores.
La principal limitación del estudio es la falta de análisis de la flora microbiana presente en las infecciones registradas, y la falta de registro de la gravedad de la infección de herida. Otra limitación es el análisis retrospectivo de una base de datos prospectiva, que siempre disminuye el valor científico del estudio.
En conclusión, la fístula pancreática se confirma como factor de riesgo de VGL tras la DPC. Además, se demuestra que la edad superior a 60 años es un factor de riesgo de VGL.
FinanciaciónNo se ha recibido financiación por el trabajo realizado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría agradecer a Fundación IDIBELL y al Programa CERCA/Generalitat de Catalunya por el soporte institucional.