El objetivo del estudio fue analizar los resultados del tratamiento quirúrgico de las neoplasias neuroendocrinas (NNE) ampulares mediante Ampulectomía transduodenal (ATD) y duodenopancreatectomía cefálica (DPC), en un centro de referencia en patología hepatobiliopancreática.
MétodoEstudio retrospectivo, observacional, incluyendo los pacientes intervenidos de NNE de páncreas y/o duodenales en una unidad de referencia en patología hepatobilipancreática y registrados prospectivamente entre el 1 de enero de 1993 y el 30 de septiembre de 2021. Para aquellos parámetros no presentes, se realizó una búsqueda retrospectiva. Se analizaron datos demográficos, clínicos, analíticos y anatomopatológicos. Se realizó un análisis descriptivo. La supervivencia global y libre de enfermedad se calculó mediante curvas de Kaplan-Meier y el test de log-rank.
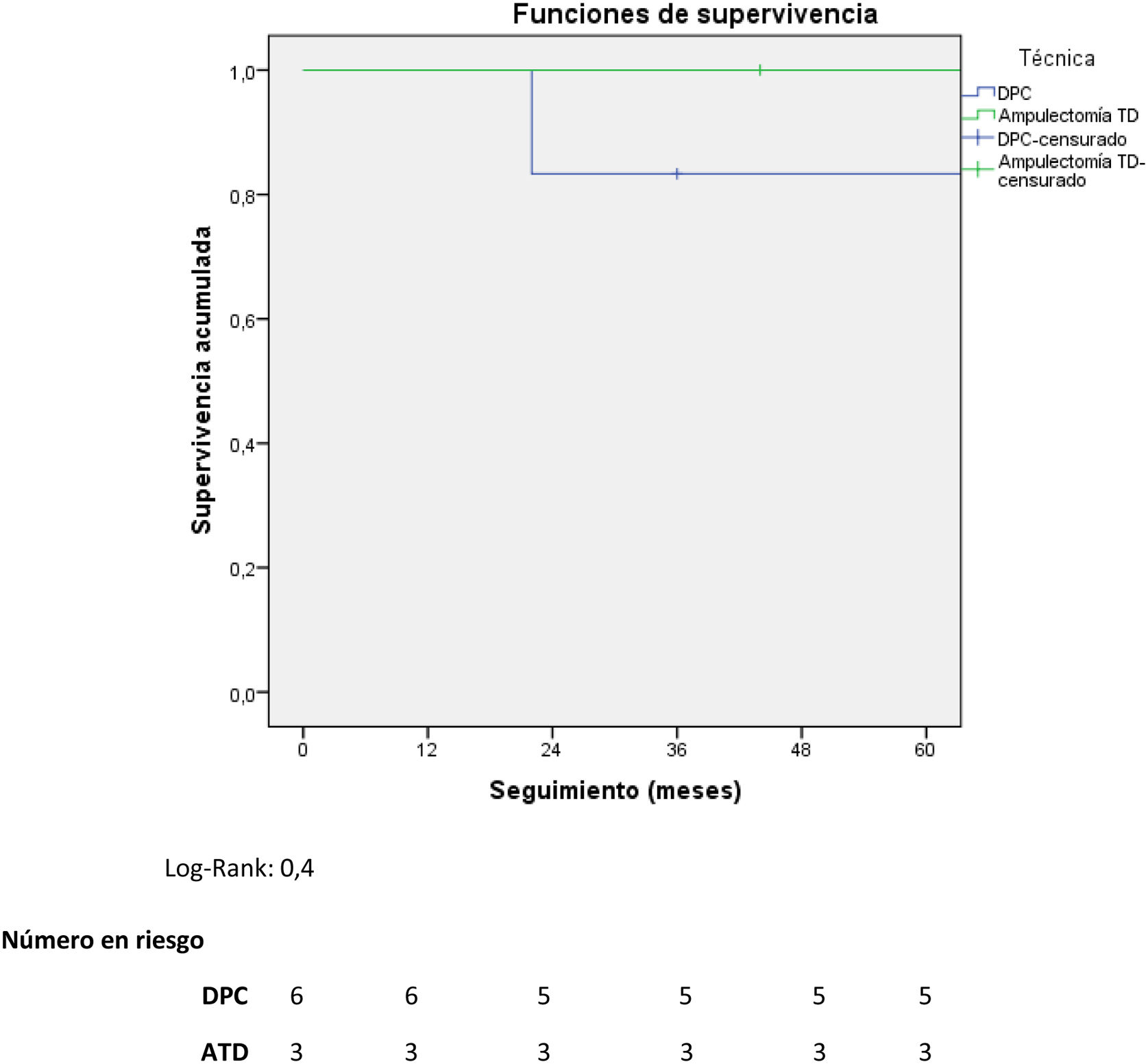
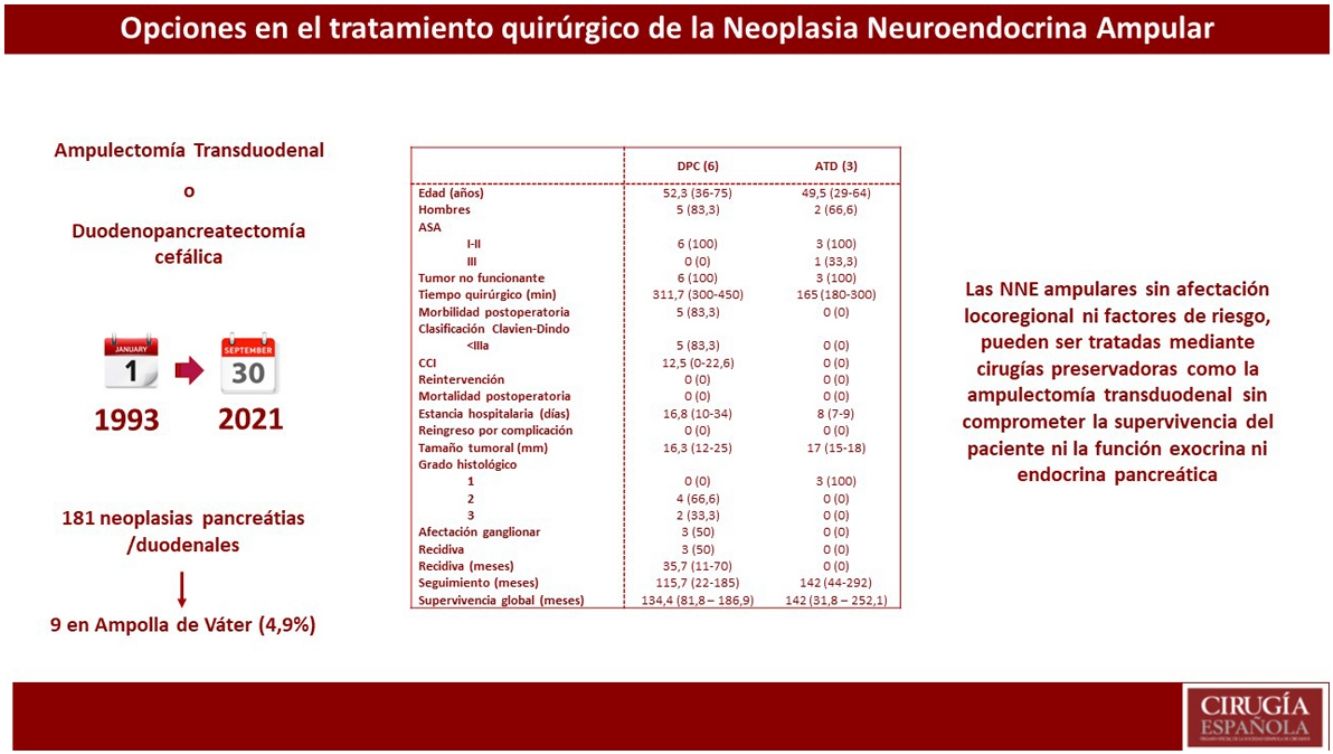
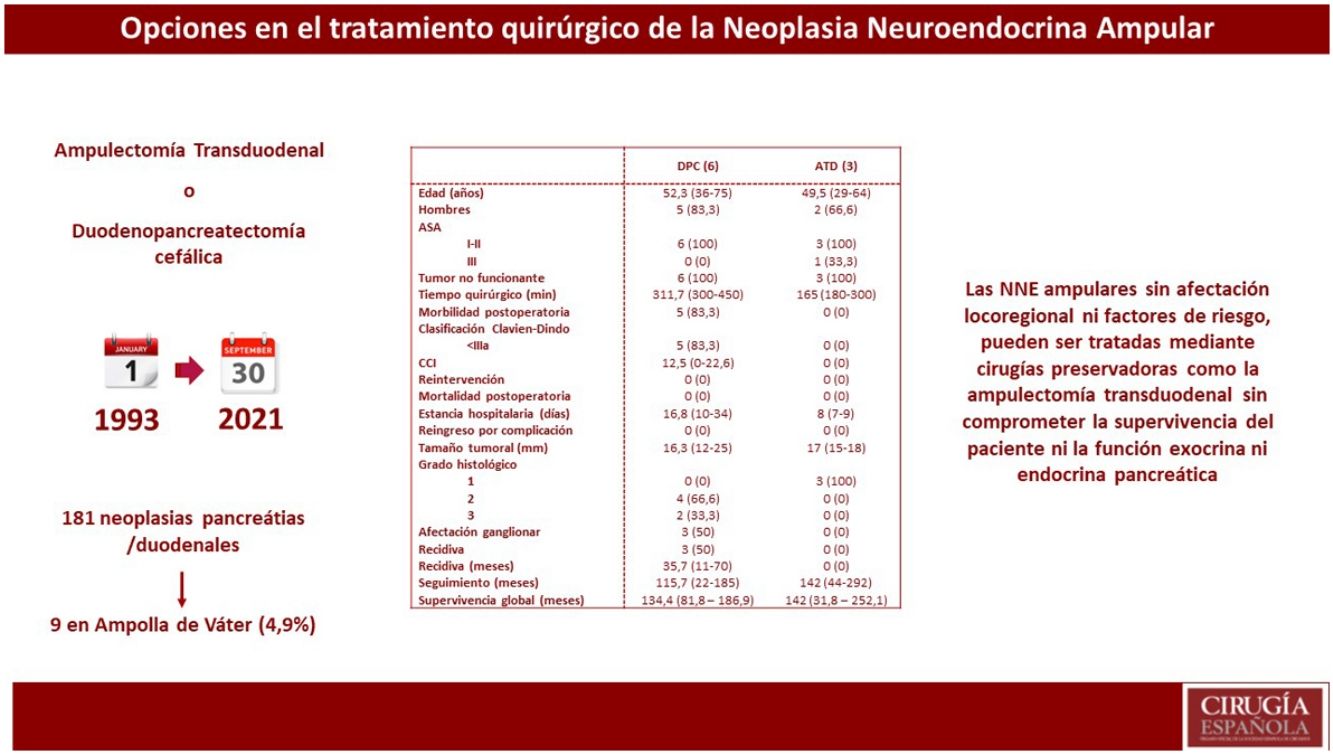
ResultadosDe 181 pacientes intervenidos de NNE de páncreas y/o duodenales, solo nueve se localizaban en la ampolla de Váter, lo que representa 4,9% de todos los NNE pancreáticos y/o duodenales. Se realizó DPC en seis pacientes, mientras que a tres se les practicó ATD. Se observó mayor tiempo quirúrgico y más complicaciones en el grupo DPC. No hubo diferencias en la estancia hospitalaria. La supervivencia global y libre de enfermedad a cinco años del grupo DPC respecto a la ATD fue de 83,3 vs. 100% y del 50 vs. 100%, respectivamente.
ConclusionesLas NNE ampulares sin afectación locorregional ni factores de riesgo, pueden ser tratadas mediante cirugías preservadoras como la ATD.
The main objective of this study was to analyse the results of the surgical treatment of ampullary neuroendocrine tumours (NET) based on transduodenal ampullectomy and pancreatoduodenectomy, in a reference centre in hepatobiliopancreatic pathology.
MethodRetrospective, observational study, including all patients operated on for pancreatic and/or duodenal NET in a reference unit of hepatobiliopancreatic pathology and prospectively registered between January 1st, 1993 and September 30th,2021. For those parameters not present, retrospective research was performed. Demographic, clinical, analytical and pathological data were analysed. A descriptive study was carried out. Overall and disease-free survival was calculated using Kaplan-Meier curves and the Log-Rank test.
ResultsOf 181 patients operated on for pancreatic and/or duodenal NET, only 9 were located in the ampulla of Vater, which represents 4.9% of all pancreatic and/or duodenal NET. Pancreatoduodenectomy (PD) was performed in 6 patients, while 3 patients underwent transduodenal ampullectomy (TDA). Longer surgical time and more postoperative complications were observed in the PD group. There were no differences in hospital stay. Overall and disease-free survival at 5 years in the PD group compared to ATD was 83.3% vs. 100% and 50% vs. 100%, respectively.
ConclusionsAmpullary NET without locorregional involvement or risk factors, can be treated by conservative surgeries such as transduodenal ampullectomy.
Las neoplasias neuroendocrinas (NNE) tienen su origen en las células del sistema neuroendocrino, repartidas en todo el organismo. La afectación más común es la del tracto gastrointestinal1. La afectación de la ampolla de Váter por este tipo de tumores es extremadamente rara y aunque su estimación es difícil, ya que la mayoría de la evidencia publicada son series de casos2–5 y revisiones retrospectivas6, oscila alrededor de 6% de las NNE pancreáticoduodenales5.
El pronóstico de las NNE ampulares tiende a ser peor que las NNE duodenales, ya que suelen tener mayor diseminación ganglionar y ello hace que la supervivencia libre de enfermedad sea más reducida7. En cuanto al tratamiento, según las recomendaciones de la European Neuroendocrine Tumor Society (ENETS)8, los tumores < 1 cm se pueden beneficiar de tratamientos endoscópicos, mientras que en aquellos > 1 cm no existe un consenso sobre el tratamiento ideal. Las opciones quirúrgicas incluyen la duodenopancreatectomía cefálica (DPC) y la ampulectomía transduodenal (ATD).
Ante la falta de evidencia clara acerca del mejor abordaje quirúrgico en las NNE ampulares, el objetivo del presente estudio es analizar los resultados de la cirugía conservadora mediante ATD y de la DPC en las NNE ampulares en un centro de referencia en patología hepatobiliopancreática.
MétodoEstudio retrospectivo, observacional, realizado en el Hospital Universitari de Bellvitge (Hospitalet de Llobregat, Barcelona), incluyendo todos los pacientes intervenidos de NNE de páncreas y/o duodenales y registrados en una base de datos prospectiva de la Unidad de Cirugía Pancreática, entre el 1 de enero de 1993 y el 30 de septiembre de 2021. Para aquellos parámetros no presentes, se ha realizado una búsqueda retrospectiva. Al tratarse de un estudio retrospectivo, no se requiere de consentimiento informado. El presente estudio ha sido aprobado por el Comité de Ética de nuestro centro (Número de referencia de manuscrito PR281/22 y Acta 20/22).
Recogida de datosSe han analizado los siguientes datos: sexo, edad, método diagnóstico, clasificación de American Society of Anesthesiology (ASA), marcadores tumorales preoperatorios (cromogranina A), tratamiento quirúrgico (DPC o ATD), complicaciones posoperatorias a 90 días, así como su gravedad según la clasificación de Clavien-Dindo et al. 9, complicaciones posoperatorias específicas de la cirugía pancreática (fístula pancreática, retraso vaciamiento gástrico y sangrado postoperatorio) según la definición del International Study Group of Pancreatic Surgery (ISGPS)10–12, reintervención, anatomía patológica definitiva, tamaño tumoral, grado histológico según la clasificación de la Organización Mundial de la Salud (OMS) para NNE13, estancia hospitalaria, reingreso hospitalario a 90 días, tratamiento adyuvante, recidiva y mortalidad. La supervivencia global y supervivencia libre de enfermedad se calculó a partir de la fecha de la cirugía.
Estudio preoperatorio y seguimientoEn todos los pacientes se realizó un estudio preoperatorio exhaustivo mediante: tomografía computarizada (TC) toraco-abdominal, marcadores tumorales (cromogranina A, CA 19.9), perfil hepático completo, papiloscopia y ecoendoscopia para valorar las características de la ampolla de Váter y adenopatías locorregionales (Imagen 1) y realizar biopsias. En aquellos pacientes con duda diagnóstica (neoplasia ampular vs. coledocolitiasis vs. tumoración en cabeza de páncreas), se completó estudio con colangioresonancia magnética y octreoscan. En aquellos pacientes con ictericia o colangitis, se intentó evitar el drenaje preoperatorio de la vía biliar, con el objetivo de evitar complicaciones pre y posoperatorias14,15, así como riesgo de recurrencia16.
Todos los pacientes fueron valorados y discutidos de forma individual en sesión clínico-radiológica donde, de forma multidisciplinar, se decidió el tratamiento a realizar.
El seguimiento postoperatorio se realizó según las recomendaciones de la ENETS17.
Técnica quirúrgicaEn aquellos pacientes con tumores sin sospecha preoperatoria de infiltración locorregional, sin afectación ganglionar ni pobre diferenciación en la biopsia preoperatoria, se optó por realizar un tratamiento conservador mediante ATD con reimplantación de la vía biliar y del conducto pancreático principal (Imagen 2). En estos casos, se realizó un muestreo ganglionar intraoperatoria y un estudio anatomopatológico intraoperatorio de la pieza de resección para valorar la afectación de los márgenes quirúrgicos y verificar la buena diferenciación de la neoplasia. En caso de afectación de márgenes en el estudio intraoperatorio, se optó por realizar DPC.
En los pacientes con tumores con sospecha de afectación locorregional o ganglionar, se optó por un tratamiento más agresivo, mediante DPC según técnica de Whipple y reconstrucción en asa de Child.
Objetivo principalEl objetivo principal de este trabajo consiste en analizar de forma descriptiva los resultados del tratamiento quirúrgico de las NNE ampulares mediante ATD y DPC, en un centro de referencia y de alto volumen en patología hepatobiliopancreática.
Objetivo secundarioEl objetivo secundario consiste en determinar si el tratamiento mediante ATD en pacientes con NNE ampular, es una técnica segura y con resultados oncológicos aceptables.
Análisis estadísticoLos datos se expresan en frecuencias y porcentajes para las variables categóricas y como media (mínimo-máximo) para las variables continuas. Se realizó un estudio descriptivo de los pacientes intervenidos mediante DPC y ATD. Se ha elaborado una tabla-resumen con las características principales de cada uno de los pacientes. El cálculo de la supervivencia global y supervivencia libre de enfermedad se ha realizado mediante las curvas de Kaplan-Meier. Se ha utilizado el programo estadístico SPSS (SPSS Inc, Chicago, IL, USA) versión número 25.
ResultadosSe registraron 181 pacientes intervenidos de NNE de páncreas y/o duodenales, de los cuales 141 eran no funcionantes y 40 funcionantes. De todos estos pacientes, solo en nueve se localizaban en la ampolla de Váter, lo que representa 4,9% de todos los NNE pancreáticos y/o duodenales.
Estudio descriptivo globalEn la tabla 1, se describen las principales variables estudiadas en cada uno de los pacientes. La mayoría eran varones (77,7%) y con una edad media de 51,2 años (29-75). De los pacientes de la muestra, 88,8% presentó una clasificación de ASA I-II. Todos los pacientes incluidos mostraron tumores no funcionantes. Los síntomas iniciales más habituales fueron la colestasis (44%) y la ictericia (22%). El diagnóstico preoperatorio anatomopatológico se obtuvo en ocho pacientes mediante papiloscopia con biopsia. Cabe destacar que se describió la presencia de un foco de 1% de adenocarcinoma en un paciente.
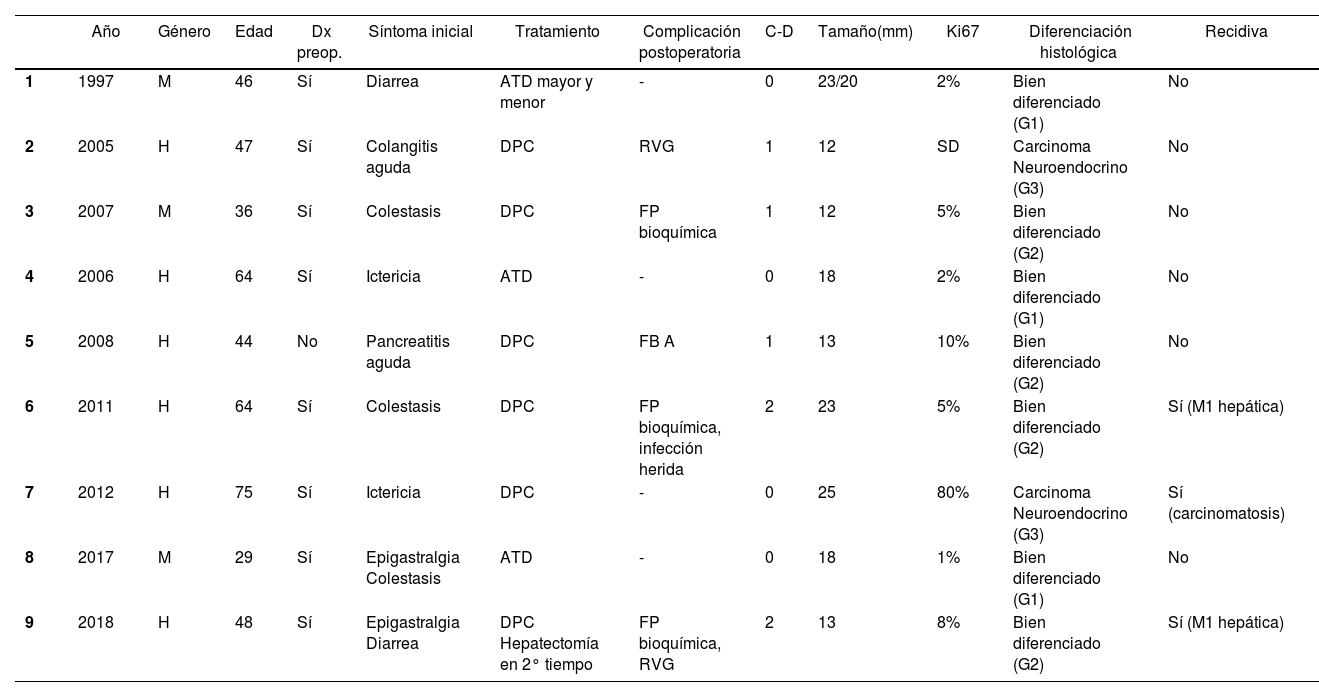
Resumen de las principales variables clínicas de los pacientes con NNE ampular
| Año | Género | Edad | Dx preop. | Síntoma inicial | Tratamiento | Complicación postoperatoria | C-D | Tamaño(mm) | Ki67 | Diferenciación histológica | Recidiva | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1997 | M | 46 | Sí | Diarrea | ATD mayor y menor | - | 0 | 23/20 | 2% | Bien diferenciado (G1) | No |
| 2 | 2005 | H | 47 | Sí | Colangitis aguda | DPC | RVG | 1 | 12 | SD | Carcinoma Neuroendocrino (G3) | No |
| 3 | 2007 | M | 36 | Sí | Colestasis | DPC | FP bioquímica | 1 | 12 | 5% | Bien diferenciado (G2) | No |
| 4 | 2006 | H | 64 | Sí | Ictericia | ATD | - | 0 | 18 | 2% | Bien diferenciado (G1) | No |
| 5 | 2008 | H | 44 | No | Pancreatitis aguda | DPC | FB A | 1 | 13 | 10% | Bien diferenciado (G2) | No |
| 6 | 2011 | H | 64 | Sí | Colestasis | DPC | FP bioquímica, infección herida | 2 | 23 | 5% | Bien diferenciado (G2) | Sí (M1 hepática) |
| 7 | 2012 | H | 75 | Sí | Ictericia | DPC | - | 0 | 25 | 80% | Carcinoma Neuroendocrino (G3) | Sí (carcinomatosis) |
| 8 | 2017 | M | 29 | Sí | Epigastralgia Colestasis | ATD | - | 0 | 18 | 1% | Bien diferenciado (G1) | No |
| 9 | 2018 | H | 48 | Sí | Epigastralgia Diarrea | DPC Hepatectomía en 2° tiempo | FP bioquímica, RVG | 2 | 13 | 8% | Bien diferenciado (G2) | Sí (M1 hepática) |
H: hombre; M: mujer; DPC: duodenopancreatectomía cefálica; ATD: ampulectomía transduodenal; C-D: clasificación de Clavien-Dindo; Dx preop: diagnóstico preoperatorio; FP: fuga pancreática; FB: fuga biliar; RVG: retraso vaciamiento gástrico; SD: sin datos.
En cuanto al tratamiento quirúrgico, se realizó DPC en seis pacientes: cinco pacientes por sospecha de infiltración locorregional o presencia de afectación ganglionar y un paciente por la presencia de afectación de márgenes intraoperatorios durante ATD. En cambio, en tres pacientes se realizó una ATD. Asimismo, en uno de los pacientes se detectaron metástasis hepáticas sincrónicas en el momento del diagnóstico preoperatorio; en este caso, se realizó en primer lugar tratamiento del tumor primario mediante DPC y en un segundo tiempo el tratamiento de las metástasis hepáticas, mediante hepatectomía derecha.
La media de tiempo quirúrgico fue de 253 minutos (180-450), 311 minutos en el grupo DPC y 165 en el grupo ATD. En cuanto a la morbilidad posoperatoria, cinco pacientes (55,5%) presentaron algún tipo de complicación, siendo todas ellas Clavien-Dindo I-II. La fuga pancreática bioquímica estuvo presente en dos pacientes (22,2%) y la de tipo B en uno (11,1%). La fístula biliar tipo A se produjo en un paciente (11,1%) y el retraso de vaciamiento gástrico tipo A en dos pacientes (22,2%). No se registraron complicaciones por sangrado, reintervenciones ni mortalidad en los 90 primeros días.
La media de la estancia hospitalaria fue de 16 días (7-36) y no se registraron reingresos. A nivel anatomopatológico, la media del tamaño tumoral fue de 16,5 mm (12-25) y el tipo histológico fue bien diferenciado en siete pacientes y de carcinoma neuroendocrino en dos pacientes. Cabe destacar que, a nivel inmunohistoquímico, tres pacientes presentaban expresión hormonal de somatostatina y un paciente de gastrina, siendo los parámetros analíticos preoperatorios de gastrina y somatostatina normales.
Estudio descriptivo según resultados de cada técnica quirúrgicaEn la tabla 2 se muestran los resultados de los pacientes sometidos a DPC y los tratados mediante ATD.
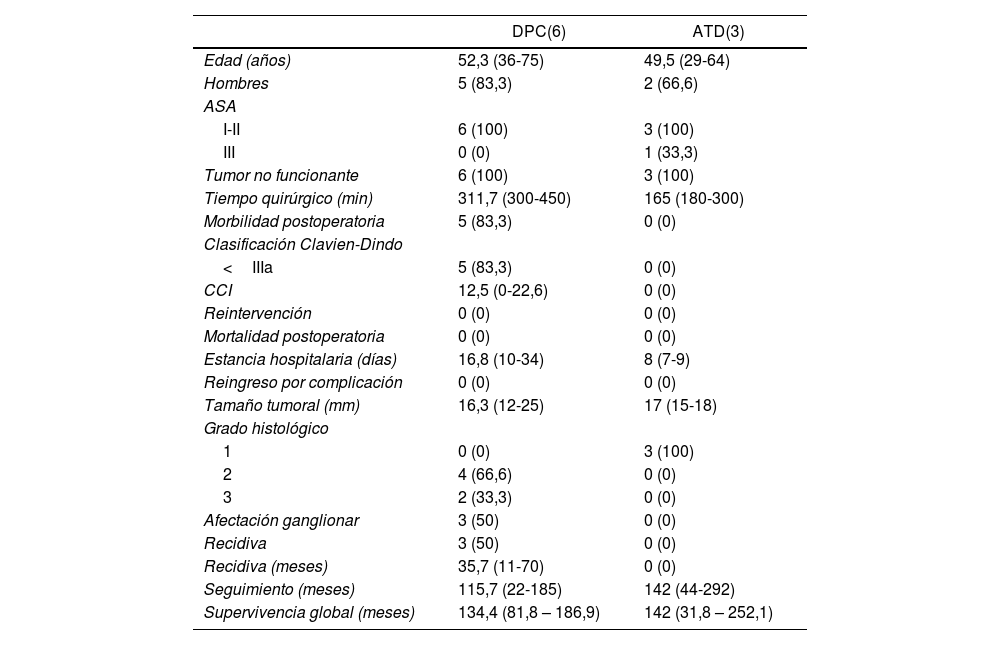
Análisis descriptivo según el tipo de tratamiento quirúrgico recibido (DPC y ATD)
| DPC(6) | ATD(3) | |
|---|---|---|
| Edad (años) | 52,3 (36-75) | 49,5 (29-64) |
| Hombres | 5 (83,3) | 2 (66,6) |
| ASA | ||
| I-II | 6 (100) | 3 (100) |
| III | 0 (0) | 1 (33,3) |
| Tumor no funcionante | 6 (100) | 3 (100) |
| Tiempo quirúrgico (min) | 311,7 (300-450) | 165 (180-300) |
| Morbilidad postoperatoria | 5 (83,3) | 0 (0) |
| Clasificación Clavien-Dindo | ||
| <IIIa | 5 (83,3) | 0 (0) |
| CCI | 12,5 (0-22,6) | 0 (0) |
| Reintervención | 0 (0) | 0 (0) |
| Mortalidad postoperatoria | 0 (0) | 0 (0) |
| Estancia hospitalaria (días) | 16,8 (10-34) | 8 (7-9) |
| Reingreso por complicación | 0 (0) | 0 (0) |
| Tamaño tumoral (mm) | 16,3 (12-25) | 17 (15-18) |
| Grado histológico | ||
| 1 | 0 (0) | 3 (100) |
| 2 | 4 (66,6) | 0 (0) |
| 3 | 2 (33,3) | 0 (0) |
| Afectación ganglionar | 3 (50) | 0 (0) |
| Recidiva | 3 (50) | 0 (0) |
| Recidiva (meses) | 35,7 (11-70) | 0 (0) |
| Seguimiento (meses) | 115,7 (22-185) | 142 (44-292) |
| Supervivencia global (meses) | 134,4 (81,8 – 186,9) | 142 (31,8 – 252,1) |
Se observó un tiempo operatorio más prolongado en los pacientes sometidos a DPC. Las complicaciones posoperatorias se produjeron en el grupo de DPC, siendo todas ellas de tipo I-II según la clasificación de Clavien-Dindo. En cuanto a la estancia hospitalaria tiende a ser menor en el grupo de ATD. En el tamaño tumoral definitivo destaca que 33,3% de los pacientes sometidos a DPC presentaron un grado histológico de la OMS tipo 3 (carcinoma neuroendocrino), y afectación ganglionar en tres pacientes (50% de la muestra), con una media de dos ganglios afectos. En una paciente afecta de Neurofibromatosis, se detectó somatostatinoma tanto en la papila mayor como en la menor, correspondiendo con el síndrome de Von Recklinghausen18 y realizándose ampulectomía mayor y menor mediante abordaje transduodenal.
La supervivencia libre de enfermedad a cinco años fue de 50% en el grupo de la DPC y de 100% en el grupo ATD. La recidiva se produjo en dos pacientes en forma de metástasis hepáticas (siendo uno de ellos el paciente al que se le había practicado hepatectomía por presencia de metástasis hepáticas sincrónicas) y en un paciente en forma de carcinomatosis. Todos ellos recibieron tratamiento de la recidiva: en los pacientes con metástasis hepáticas se optó por embolización arterial y por ablación con radiofrecuencia; el paciente con carcinomatosis se trató mediante quimioterapia sistémica.
En cuando a la supervivencia global de toda la muestra, fue de 90% a cinco años. Si analizamos la supervivencia global según el tipo de tratamiento recibido, tiende a ser menor en el grupo de la DPC respecto a la ATD (83,3 vs. 100% a cinco años) (fig. 1). La única muerte registrada se produjo en el grupo de DPC a los 22 meses de seguimiento, en contexto de recidiva en forma de carcinomatosis y después de iniciar tratamiento quimioterápico sistémico. El resto de los pacientes de ambos grupos siguen vivos a día de hoy.
Finalmente, durante el seguimiento se ha estudiado la función endocrina y exocrina pancreática mediante niveles plasmáticos de glucemia y elastasa fecal junto a la historia clínica (esteatorrea, dolor abdominal tras la ingesta, mal digestión), respectivamente. No se objetivó insuficiencia pancreática endocrina ni exocrina en ninguno de los pacientes sometidos a ATD.
DiscusiónEn este estudio se presenta una serie de nueve casos de NNE ampular, tratados en un centro de referencia en patología hepatobiliopancreática, observándose que aquellos pacientes con NNE ampulares sin invasión locorregional ni afectación ganglionar, pueden ser tratados mediante cirugía conservadora, permitiendo un buen control local y sistémico de la enfermedad, siendo la supervivencia global y libre de enfermedad a cinco años de 100%. Estos resultados se asemejan a los publicados por otros grupos previamente5. Por contra, aquellos pacientes de nuestra serie tratados mediante DPC, hasta en 50% de los casos presentaron afectación ganglionar, traduciéndose en recidiva de la enfermedad en todos ellos. Cabe destacar también que aquellos pacientes que presentaron afectación ganglionar son los que presentaron mayor tamaño tumoral (25, 23 y 13 mm).
El diagnóstico preoperatorio de las NNE ampulares suele ser difícil, ya que requiere de alta sospecha clínica debido a sus múltiples manifestaciones clínicas5 o al tratarse de neoplasias funcionantes17. Las pruebas diagnósticas por excelencia y consideradas como el «gold standard» por la ENETS8 son la endoscopia digestiva alta y la ecoendoscopia con biopsia, mientras que, en el estudio de extensión, la TC y la RMN tienen un papel relevante. Otras pruebas diagnósticas a tener presente son el octreoscan (111Indium-prentreotide) y la tomografía por emisión de positrones con fluorodesoxiglucosa (18FDG-PET). Aunque en las recomendaciones de la ENETS8 no queda definido su papel, el octreoscan ha mostrado en estudios comparativos una sensibilidad diagnóstica de 77 vs. 72% del 18FDG-PET. Dicha sensibilidad aumenta hasta 80% en NNE bien diferenciadas (73% en NNE pancreáticas y 81% en NNE gastrointestinales) vs. 60% de 18FDG-PET. En cambio, en los tumores pobremente diferenciados, el 18FDG-PET consigue una sensibilidad cercana a 100 vs. 57% del octreoscan19. Asimismo, disponemos de otros trazadores nucleares que permiten aumentar la detección de las NNE, como es el PET-Galio (68Ga-DOTA-DPhe,1Tyr3-octreótide)19,20, que en nuestra serie se realizó en tres pacientes, siendo diagnóstico en dos de ellos. De este modo, consideramos que, en caso de necesitar completar el estudio de extensión o duda diagnóstica, es preferible utilizar el PET-Galio antes que el octreoscan.
El uso de la biopsia preoperatoria en nuestra muestra se realizó en prácticamente todos los casos (8/9), siendo diagnóstica en todas ellas. Estos resultados son similares a los publicados por otros grupos, donde la biopsia preoperatoria oscila entre 75-100%16,21,22. Consideramos que un estudio exhaustivo preoperatorio con técnicas de imagen para descartar enfermedad locorregional, una biopsia preoperatoria para identificar los tumores bien diferenciados, así como un estudio intraoperatorio meticuloso para descartar metástasis ganglionares, es imprescindible para indicar una cirugía conservadora, como se describe en recomendaciones internacionales publicadas recientemente23.
En cuanto al tratamiento de las NNE ampulares, existen varias opciones a tener en cuenta. Algunas recomendaciones se basan en el tamaño del tumor para plantear un tratamiento endoscópico vs. quirúrgico8, aunque no existe un consenso definido. Las NNE ampulares han mostrado tener mayor tamaño, mayor grado histológico y estadio más avanzado que las NNE duodenales6, lo que se traduce en una peor supervivencia24. Por otra parte, en contra de la concepción basada en el tamaño tumoral, Ruff et al.24 y Schmocker et al.6, han publicado recientemente que únicamente el grado histológico del tumor tiene relación con la supervivencia global. De esta manera, Ruff et al. encontraron que los pacientes con tumores T1 ampulares tenían hasta 21% de afectación ganglionar, mientras que los T1 duodenales tenían solo 6,7% de afectación ganglionar. En esta línea, con el objetivo de mejorar la supervivencia global y libre de enfermedad, la ENETS recomienda tratamiento adyuvante con esquemas basados en cisplatino y etopósido en las NNE G3 y metastásicas, mientras que en aquellos pacientes con afectación ganglionar (independientemente del grado histológico), no queda claramente definido. Según concluyen Zhai et al.25, los pacientes que mejor responden a tratamientos adyuvantes son aquellos con NNE pancreáticas pobremente diferenciadas o con un grado de indiferenciación, independientemente del estadiaje TNM.
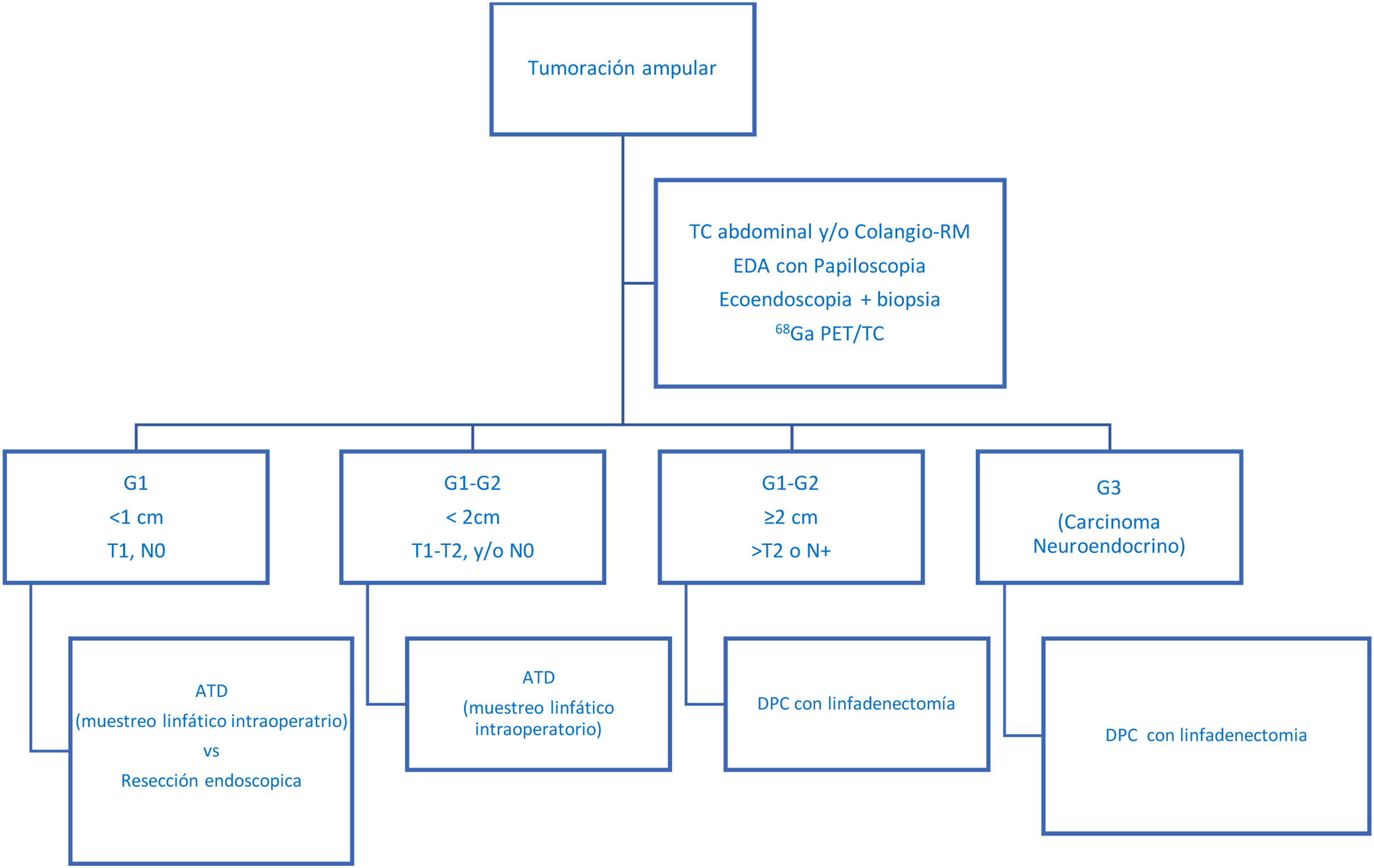
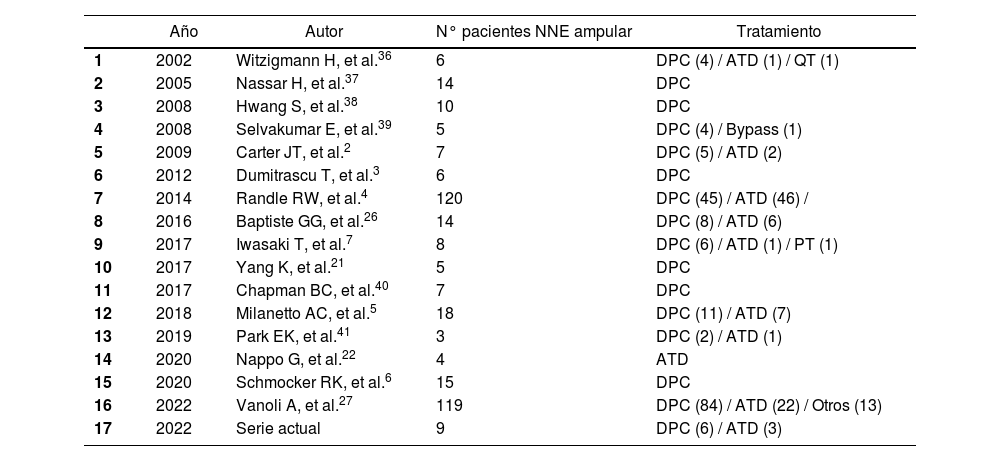
En los últimos años se han publicado series históricas que comparan DPC vs. ATD4,26, con una supervivencia global posoperatoria similar entre ambos tratamientos, aunque algunos autores concluyeron que la ATD no permitía realizar un buen control oncológico de la enfermedad26, ya que tendía a infraestadiar a los pacientes. En este sentido, se han publicado opciones intermedias, como el muestreo ganglionar intraoperatorio del nivel 137; de esta forma, en caso de afectación ganglionar se realizaría DPC, mientras que, si el muestreo fuera negativo, se podría realizar una resección local (en la tabla 3 se presenta resumen de las series más relevantes publicadas hasta el momento). En nuestra experiencia, realizamos sistemáticamente muestreo ganglionar intraoperatorio, aunque los pacientes habían sido estudiados de una forma exhaustiva preoperatoriamente. Así, en ningún caso del grupo ATD se ha registrado recidiva locorregional. Es probable que ello se deba a la meticulosa selección de los pacientes, lo cual permite individualizar el tratamiento según las características de cada uno. En la figura 2 presentamos nuestro algoritmo diagnóstico-terapéutico, que se asemeja al propuesto por Milanetto et al.5 y que va en la línea de las series más amplias publicadas27, donde definimos los criterios que consideramos que se deberían seguir para plantear un tratamiento más agresivo (DPC) o bien una cirugía ahorradora de parénquima (ATD).
Listado de las referencias bibliográficas con las series más relevantes publicadas en donde se ha realizado tratamiento quirúrgico de NNE ampular
| Año | Autor | N° pacientes NNE ampular | Tratamiento | |
|---|---|---|---|---|
| 1 | 2002 | Witzigmann H, et al.36 | 6 | DPC (4) / ATD (1) / QT (1) |
| 2 | 2005 | Nassar H, et al.37 | 14 | DPC |
| 3 | 2008 | Hwang S, et al.38 | 10 | DPC |
| 4 | 2008 | Selvakumar E, et al.39 | 5 | DPC (4) / Bypass (1) |
| 5 | 2009 | Carter JT, et al.2 | 7 | DPC (5) / ATD (2) |
| 6 | 2012 | Dumitrascu T, et al.3 | 6 | DPC |
| 7 | 2014 | Randle RW, et al.4 | 120 | DPC (45) / ATD (46) / |
| 8 | 2016 | Baptiste GG, et al.26 | 14 | DPC (8) / ATD (6) |
| 9 | 2017 | Iwasaki T, et al.7 | 8 | DPC (6) / ATD (1) / PT (1) |
| 10 | 2017 | Yang K, et al.21 | 5 | DPC |
| 11 | 2017 | Chapman BC, et al.40 | 7 | DPC |
| 12 | 2018 | Milanetto AC, et al.5 | 18 | DPC (11) / ATD (7) |
| 13 | 2019 | Park EK, et al.41 | 3 | DPC (2) / ATD (1) |
| 14 | 2020 | Nappo G, et al.22 | 4 | ATD |
| 15 | 2020 | Schmocker RK, et al.6 | 15 | DPC |
| 16 | 2022 | Vanoli A, et al.27 | 119 | DPC (84) / ATD (22) / Otros (13) |
| 17 | 2022 | Serie actual | 9 | DPC (6) / ATD (3) |
DPC: duodenopancreatectomía cefálica; ATD: ampulectomía transduodenal; PT: pancreatectomía total; QT: quimioterapia. Se han incluido aquellos estudios con una n>2, donde se defina claramente la localización ampular de la NNE y en los que se haya detallado el tratamiento quirúrgico realizado.
Propuesta de algoritmo diagnóstico-terapéutico para las neoplasias neuroendocrinas ampulares no diseminadas. Adaptado de Millaneto AC. et a.l5.
EDA: endoscopia digestiva alt; DPC: duodenopancreatectomía cefálica.
Las ventajas de realizar una ATD vienen determinadas sobre todo por la elevada morbilidad que presenta la DPC, la cual está presente en alrededor de 50% de los pacientes26, siendo en un 20-30% en forma de complicación grave (Clavien-Dindo > IIIa). Por el contrario, la ATD muestra una tasa de complicaciones globales del 44%, siendo las complicaciones graves (Clavien-Dindo > IIIa) de 14%22. En nuestra serie, no se registraron complicaciones graves en ninguno de los dos grupos y cuando se produjo complicación, esta tuvo lugar en el grupo de la DPC. Asimismo, cabe destacar la insuficiencia pancreática exocrina y endocrina que aparece como consecuencia de resecciones pancreáticas amplias (DPC), siendo la tasa de insuficiencia pancreática alrededor del 4028-45%29. Éstas, afectan a la calidad de vida de los pacientes debido a esteatorrea, malnutrición y a la presencia de diabetes de «novo». En este sentido, las cirugías preservadoras de parénquima (ATD) han surgido y evolucionado como alternativas a las técnicas estándares de resección pancreática, ya que permiten mantener la anatomía del tracto digestivo alto. Su principal objetivo es la preservación del duodeno y la vía biliar principal y así, reducir la morbilidad a largo plazo. En nuestra serie, se ha realizado un seguimiento tanto de la función endocrina como exocrina pancreática de los pacientes sometidos a ATD y en ninguno de ellos se ha detectado disfunción.
Consideramos que los buenos resultados presentados en este estudio se deben probablemente a la alta especialización del equipo quirúrgico, al elevado número de procedimientos de alta complejidad que se realizan y a una selección meticulosa de los pacientes.
En nuestra serie, todas las cirugías están realizadas mediante abordaje abierto, pero cada vez existe más evidencia acerca de los beneficios del abordaje mínimamente invasivo, tanto laparoscópico como robótico, en la cirugía hepatobiliopancreática30. Así, tenemos grupos nacionales e internacionales con amplia experiencia en cirugía hepatobiliopancreática, que ya presentan casos de ATD laparoscópica31 o mediante plataforma robótica32, con muy buenos resultados y que creemos que son la línea a seguir, siempre que las condiciones del paciente lo permitan.
Otra vía de abordaje terapéutico, y que está en auge hoy en día, es la resección endoscópica. A pesar de los avances en las técnicas endoscópicas, las series publicadas de ampulectomía endoscópica en NNE ampulares son muy escasas y con un número reducido de pacientes33–35. La mayoría de ellas, son en pacientes con tumores < 2 cm, pero aun así, presentan un 44% de resecciones R135 y tasas de recidiva que llegan al 16%34. A pesar de tratarse de un procedimiento menos agresivo, las complicaciones no son despreciables, oscilando entre 38 y 66%34,35, siendo la más habitual el sangrado postprocedimiento. En la actualidad, cabe destacar que se ha iniciado el estudio Endoscopic Papillectomy vs. Surgical Ampullectomy vs. Pancreaticoduodenectomy for Ampullary Neoplasm - A Pancreas20007EPC Study (ESAP), que pretende comparar el tratamiento endoscópico vs. ampulectomía vs DPC en los tumores ampulares de cualquier tipo histológico. Sus resultados nos ayudarán en un futuro próximo a definir mejor los criterios e indicaciones de cada uno de estos tratamientos.
Las limitaciones de este estudio están con relación al bajo número de pacientes, así como a su carácter retrospectivo. Asimismo, dado el bajo número de pacientes y la minuciosa selección preoperatoria, hace que los dos grupos no se puedan comparar entre sí, por lo que solo se pueden aportar datos descriptivos.
Para concluir, podemos decir que las NNE ampulares de pequeño tamaño sin afectación locorregional ni factores de riesgo, pueden ser tratadas mediante cirugías preservadoras de parénquima, como la ATD, sin comprometer la supervivencia del paciente ni la función exocrina ni endocrina pancreática.
Contribución de los autores(1) concepción y el diseño del estudio: Juan Fabregat; (2) adquisición de datos: Jaume Tur-Martínez, Lluis Secanella, Nuria Pelaez, Maria Sorribas; (3) análisis y la interpretación de los datos: Jaume Tur-Martínez, Teresa Serrano, Juan Fabregat; (4) borrador del artículo: Jaume Tur-Martínez; (4) revisión crítica del contenido intelectual: Juan Fabregat, Lluis Secanella, Juli Busquets, Joan Gornals (4) aprobación definitiva de la versión que se presenta: Jaume Tur-Martínez, Juan Fabregat, Juli Busquets.
FinanciaciónPara realizar el presente estudio no se ha recibido ningún tipo de financiación.
Conflicto de interesesLos resultados de este estudio han sido presentados como Trabajo Final de Máster por parte de Jaume Tur-Martínez, en el Máster Semipresencial en Cirugía Hepatobiliopancreática y Trasplante (Instituto de Formación de la Universitat de Barcelona).