El síndrome de poliposis serrada (SPS) es una entidad rara caracterizada por la presencia de múltiples pólipos de histología hiperplásica en el colon y un riesgo aumentado de presentar y desarrollar cáncer colorrectal (CCR).
ObjetivoEvaluar las características clínicas y fenotípicas de los sujetos que reúnen alguno de los 3 criterios de la OMS para el diagnóstico de SPS, diagnosticados y seguidos en nuestro hospital.
Pacientes y métodosSe revisan los pacientes con SPS durante 2005-2012, periodo en el que se realizan 24.208 colonoscopias. Se analizan edad, sexo, historia familiar de CCR (APC/MYH), fenotipo proximal/mixto/distal, indicación de colonoscopia, número, tamaño, localización de los pólipos hiperplásicos, presencia de pólipos mixtos/adenomatosos, CCRI, seguimiento y tratamiento endoscópico/quirúrgico.
ResultadosSe han recogido 23 casos (19 hombres). El promedio de edad fue 51 años. El 34% presentaba antecedentes familiares de CCR o pólipos. El fenotipo distal (48%) fue más frecuente. El 73% presentaba pólipos adenomatosos sincrónicamente, y el 26% un CCR. El 57% eran pacientes asintomáticos. Se realizó cirugía en 9 casos (6 por cáncer y 3 por poliposis, y 14 con polipectomías sucesivas y observación). Un total de 11 pacientes (47%) presentaron lesiones recurrentes/persistentes tras el tratamiento quirúrgico/endoscópico inicial.
ConclusiónEl SPS es un síndrome heterogéneo, variable en tipo, tamaño, distribución y número de pólipos, siendo más frecuente en varones fumadores con fenotipo distal. La mayoría de los pacientes presentan además pólipos adenomatosos de manera sincrónica. Estos pacientes requieren una evaluación organizada multidisciplinar.
Serrated polyposis síndrome (SPS) is a rare entity characterized by the presence of multiple hyperplastic polyps in the colon and an increased risk of presentation and development of colorectal cancer (CRC).
ObjetiveTo evaluate the clinical and phenotypical characteristics of patients that present one of the 3 WHO criteria for the diagnosis of SPS diagnosed and treated a tour hospital.
Patients and methodsPatients with the diagnosis of SPS during 2005-2012 were revised; 24.208 colonoscopies were performed during this period. Age, sex, family history of CRC (APC/MYH), proximal/mixed/distal phenotype, indication for colonoscopy, number, size, location of the hyperplastic polyps, presence of mixed/adenomatous polyps, CRCI, follow-up and endoscopio/surgical treatment.
ResultsA total of 23 cases were included (19 male). The median age was 51. A total of 34% had a prior family history of CRC or polpyps. Distal phenotype was more frequent (48%). Another 73% presented synchronous adenomatous polyps, and 26% a CRC. A total of 57% were asymptomatic. Surgery was performed in 9 cases (6 for cancer and 3 for polyposis), and 14 were treated by polypectomy and observation. Eleven patients (47%) presented recurrent/persistent lesions after initial surgical/endoscopic treatment.
ConclusionSPS is an heterogeneous síndrome that is variable in the type, size, distribution and number of polyps, and is more common in male smokers with a distal phenotype. The majority of patients also present synchronous adenomatous polyps. These patients require an organized multidisciplinary evaluation.
El cáncer colorrectal (CCR) afecta hoy día a un 6% de la población general. Su incidencia prevista para la población española en el año 2015 será de 30.230 personas, convirtiéndose en el tipo de cáncer más frecuente, por delante, en términos globales, del cáncer de pulmón y mama1. Actualmente es la segunda causa de muerte por cáncer en España2, responsable del 12,7% de mortalidad en varones y del 15% en mujeres3.
La secuencia adenoma-carcinoma es considerada la principal vía de carcinogénesis en el CCR. Los pólipos adenomatosos pueden progresar hacia la malignización a través de la llamada «vía tradicional» de carcinogénesis, donde la pérdida de la heterocigosidad o pérdida alélica en los genes APC y P53 y la inestabilidad cromosómica resultante son su característica principal. Es la vía de carcinogénesis en el 70-80% de los CCR4,5.
Los pólipos hiperplásicos (PH) se consideraron lesiones benignas, sin riesgo de malignización, sin embargo en las últimas 2 décadas se han descrito subtipos de estos pólipos, en conjunto denominados ahora pólipos serrados (PS) por el aspecto en «dientes de sierra» de la arquitectura epitelial de las criptas, que sí presentan potencial carcinogénico. Se describen 2 subtipos de «vía serrada» de carcinogénesis6,7: a) la vía serrada a partir del adenoma serrado sésil, típicamente del colon proximal, cuya alteración molecular inicial es la activación de la vía de señalización de las MAPK cinasas por una mutación del protooncogén BRAF, dando lugar al fenotipo CpG island methyllator phenotype (CIMP-high) caracterizado por la metilación y subsiguiente silenciación de la región promotora de genes supresores como el MLH1 y la inestabilidad de microsatélites (IMS) resultante; y b) la «vía serrada alternativa», probablemente a través del adenoma serrado tradicional, aunque peor definida que la anterior, y caracterizada por la mutación en el gen KRAS, dando lugar a un fenotipo metilador más atenuado (CIMP-low) con silenciación de la región promotora del gen MGMT. Las vías serradas podrían ser el origen de hasta un 30% de los CCR6,7.
El síndrome de poliposis hiperplásica o, mejor, de poliposis serrada (SPS), es una entidad poco conocida, infrecuente, con una base genética desconocida aunque con características propias de las enfermedades con predisposición hereditaria8–10, como son la multiplicidad de lesiones poliploides serradas en el colon, la edad relativamente temprana de diagnóstico y la mayor prevalencia de historia familiar de CCR. Los pacientes con este síndrome presentan un alto riesgo (25-40%) de desarrollar CCR10–13 y se han descrito tanto casos esporádicos como hereditarios9–11. Parece existir, asimismo, un mayor índice de cáncer extracolónico14–16. El SPS abarca probablemente un grupo heterogéneo de pacientes con distintos fenotipos, sin que hasta la fecha se haya descrito un mayor riesgo de desarrollo de CCR en función del fenotipo15,16.
El objetivo de este estudio es evaluar las características fenotípicas y clínicas de una serie de pacientes que cumplen los criterios de SPS.
Material y métodosEn la tabla 1 se recogen los criterios clínicos, expuestos por Burt y Jass y aceptados por la OMS en el año 200017 y redefinidos en Berlín en el año 201018 para el diagnóstico del SPS. Para el diagnóstico clínico de SPS se requiere el cumplimiento de alguno de los 3 supuestos.
Criterios de la OMS para el diagnóstico de SPS
| 1. Al menos 5 pólipos proximales al sigma, siendo 2 de ellos iguales o mayores a 10 mm |
| 2. Cualquier número de pólipos serrados proximales al sigma en un individuo con antecedentes familiares de primer grado de SPH |
| 3. Más de 20 pólipos serrados de cualquier tamaño distribuidos a lo largo del colon |
OMS: Organización Mundial de la Salud; SPS: síndrome de poliposis serrada.
Para el presente trabajo se revisaron retrospectivamente los pacientes diagnosticados de SPS durante los años 2005-2012. En este tiempo se realizaron 24.208 colonoscopias en el hospital, tanto a pacientes asintomáticos procedentes del programa poblacional de sistema de cribado de sangre oculta en heces llevado a cabo en nuestra comunidad, como a pacientes de riesgo, con antecedentes familiares de CCR, o a pacientes sintomáticos (rectorragias, dolor abdominal o alteraciones del ritmo intestinal).
Un total de 23 pacientes cumplían criterios de la OMS, siendo diagnosticados de SPS, y fueron incluidos en nuestro estudio.
Para determinar las distintas características fenotípicas de estos pacientes se analizaron los datos relativos a sus características demográficas (edad, sexo, momento del diagnóstico), clínicas (síntomas, historia familiar de CCR o SPS, hábito tabáquico, otras neoplasias asociadas), endoscópicas (número de pólipos, localización, tamaño, presencia de pólipos adenomatosos sincrónicos o CCR), patrón fenotípico (proximal [es decir proximales al ángulo esplénico], distal [en colon descendente, sigma y recto] o mixto [localización predominante en el lado izquierdo pero con más de 3 pólipos de cualquier tamaño o uno mayor a 1cm en el lado derecho]) y anatomopatológicas (PH, adenoma sésil serrado, adenoma serrado tradicional y carcinoma). En ciertos casos se realizó análisis genético para descartar otras poliposis debidas al gen APC o la poliposis asociada a MYH. Por último, se registró el tratamiento recibido, tanto endoscópico como quirúrgico, y su seguimiento.
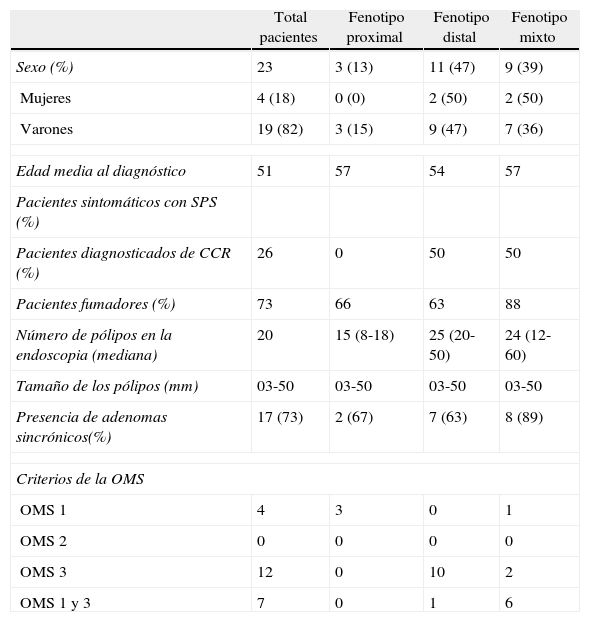
ResultadosObservamos 23 casos que reunían alguno de los 3 criterios de la OMS para el diagnóstico clínico de SPS. En la tabla 2 se exponen las características epidemiológicas, clínicas y fenotípicas de la serie de pacientes con SPS.
Características clínicas y endoscópicas de los pacientes con SPS
| Total pacientes | Fenotipo proximal | Fenotipo distal | Fenotipo mixto | |
| Sexo (%) | 23 | 3 (13) | 11 (47) | 9 (39) |
| Mujeres | 4 (18) | 0 (0) | 2 (50) | 2 (50) |
| Varones | 19 (82) | 3 (15) | 9 (47) | 7 (36) |
| Edad media al diagnóstico | 51 | 57 | 54 | 57 |
| Pacientes sintomáticos con SPS (%) | ||||
| Pacientes diagnosticados de CCR (%) | 26 | 0 | 50 | 50 |
| Pacientes fumadores (%) | 73 | 66 | 63 | 88 |
| Número de pólipos en la endoscopia (mediana) | 20 | 15 (8-18) | 25 (20-50) | 24 (12-60) |
| Tamaño de los pólipos (mm) | 03-50 | 03-50 | 03-50 | 03-50 |
| Presencia de adenomas sincrónicos(%) | 17 (73) | 2 (67) | 7 (63) | 8 (89) |
| Criterios de la OMS | ||||
| OMS 1 | 4 | 3 | 0 | 1 |
| OMS 2 | 0 | 0 | 0 | 0 |
| OMS 3 | 12 | 0 | 10 | 2 |
| OMS 1 y 3 | 7 | 0 | 1 | 6 |
OMS: Organización Mundial de la Salud; SPS: síndrome de poliposis serrada.
La edad media del diagnóstico fue de 51 años (18-80 años). De los 23 casos, 19 eran hombres (82%), sin observar diferencias de edad según cumplían un criterio u otro de diagnóstico de la OMS o del fenotipo. Todos los pacientes cumplían los criterios diagnósticos 1, 3 o ambos; ninguno tenía familiares de primer grado con SPS (criterio 2). Los 3 patrones fenotípicos relativos a la localización de los pólipos serrados en el colon se correlacionan con las definiciones diagnósticas de la OMS, como era de esperar, y sus frecuencias relativas se señalan en la tabla de resultados, donde podemos observar asimismo la relación entre la localización, el número y tamaños de los pólipos con el fenotipo.
En las colonoscopias realizadas la incidencia anual de SPS fue del 0,08%. Trece (57%) de los pacientes diagnosticados eran asintomáticos y fueron diagnosticados bien tras realizar el cribado poblacional, bien por antecedentes familiares de neoplasia colorrectal. Diez pacientes (43%) presentaban síntomas que aconsejaron realizar colonoscopia.
Seis pacientes (26%) fueron diagnosticados de cáncer colorrectal sincrónicamente al SPS, todos ellos varones. La mitad de estos pacientes muestra el fenotipo distal y la otra mitad el fenotipo mixto. La localización más frecuente fue el colon izquierdo (4 casos). El 66% de los pacientes diagnosticados de CCR presentaban síntomas, en contraposición con el 33% de los pacientes con SPS sin CCR (y fenotipo distal o mixto) que también los presentaban. La incidencia de fumadores fue muy elevada, tanto en los pacientes con CCR (100%) como con SPS sin CCR (73%). Se observaron 4 casos de cáncer extracolónico de diversos orígenes (parótida, endometrio, tumor urotelial y esofágico); en 3 de ellos se evidenció también la presencia de adenomas sincrónicos en colon, aunque ninguno presentaba CCR asociado.
Inicialmente todos los PS fueron diagnosticados histológicamente como PH, sin especificar subtipos. Solo tras revisión de las piezas quirúrgicas, y tras reuniones con los patólogos, se pudieron reclasificar algunas de estas lesiones. El adenoma serrado tradicional, más frecuente en los de fenotipo mixto o distal, presentaba menos problemas de identificación que la distinción entre el pólipo hiperplásico y el adenoma serrado sésil, que es más elusiva. Por otra parte no se identificaron alteraciones microscópicas específicas en los carcinomas asociados al SPS con respecto a los carcinomas «esporádicos».
Un 73% de los pacientes con SPS presentaban pólipos adenomatosos de manera sincrónica con los PS. En los casos estudiados existe una mayor relación entre el fenotipo mixto y la presencia de adenomas sincrónicos. En 5 pacientes con poliposis atenuada con presencia de PS y otros adenomatosos se realizó un estudio genético de los genes APC y MYH para descartar una poliposis adenomatosa familiar o una poliposis recesiva asociada al MYH. En todos los casos de SPS con CCR, también se observó la presencia de adenomas colónicos sincrónicos (3-4 adenomas de media).
En 9 casos (39%) fue necesaria la intervención quirúrgica por no ser posible resecar la totalidad de los pólipos mediante colonoscopia. Se realizaron 5 colectomías subtotales, 2 colectomías derechas, una hemicolectomía derecha con sigmoidectomía sincrónica (por doble tumor) y una colectomía izquierda ampliada a colon transverso. El resto de pacientes ha sido tratado mediante polipectomías endoscópicas y seguimiento.
En el seguimiento de los pacientes operados, un paciente (con un carcinoma de sigma previo) desarrolló un carcinoma T1 metácrono de recto realizándose un extirpación local mediante transanal endoscopic operation (TEO); en otros 2 casos se extirparon endoscópicamente nuevos PH en recto. De los 14 pacientes seguidos por endoscopia, 8 pacientes (57%) precisaron nuevas polipectomías por persistencia o recurrencia de PS (ninguno de ellos mayor de 10mm), incluyendo 3 de estos pacientes con adenomas tubulares sincrónicos.
DiscusiónLos criterios diagnósticos del SPS, aunque consensuados17,18, son cuantitativamente arbitrarios, y quizá restrictivos, lo que puede dar lugar a un infradiagnóstico de la enfermedad. Frecuentemente estos pólipos se pasan por alto en la colonoscopia19, dados su pequeño tamaño, morfología inocente y mala contabilización, además de la dificultad para definir y clasificar después los distintos subtipos anatomopatológicos de las lesiones serradas20. En la presente serie la prevalencia anual del SPS fue del 0,08%. Este dato coincide con otras series en las que se incluyen casos sintomáticos y de cribado, como en el nuestro19. Sin embargo, es difícil saber si esta incidencia es la representativa de la población general, debido a que la aceptación a participar en el cribado no es completa y a que se incluyen además colonoscopias a pacientes de riesgo que pueden sobrerrepresentar la incidencia general.
El SPS en el presente estudio fue más frecuente en varones, si bien en otras series no se muestra variabilidad entre ambos sexos11,14,15, con edades entre 18 y 80 años (con una media de 51 años, como en la presente serie), sin diferencias entre los fenotipos del SPS. Los fenotipos más frecuentes del SPS que encontramos fueron el distal (con múltiples pólipos de pequeño tamaño) y el mixto (con numerosos pólipos en el lado izquierdo asociados a pocos pólipos pero de mayor tamaño en el derecho, o [menos frecuentemente] con varios pólipos en el lado derecho y menores en el izquierdo). El fenotipo proximal fue el menos frecuente, mostrando un patrón de pólipos que son menores en número pero mayores en cuanto al tamaño y en los que el adenoma serrado sésil es más relevante.
En global observamos una prevalencia de CCR sincrónico del 26% en los casos de SPS, acorde con la literatura (18-40%)9,10,21. Nuestra casuística es escasa para relacionar los fenotipos con el riesgo de presentar o desarrollar un CCR. Aunque en el presente estudio no observamos CCR sincrónico asociado un fenotipo proximal, existe evidencia de que las lesiones serradas mayores de 10mm (en especial los adenomas serrados sésiles) constituyen un factor de riesgo para el desarrollo o presencia de un CCR proximal22,23, no así las lesiones menores de 5mm23.
La prevalencia de cáncer extracolónico encontrada (17%) en la presente serie es similar a otras reportadas, si bien ninguno presentaba un CCR sincrónico, algo sí descrito en la literatura11,16.
Aunque en los 3 fenotipos se encontraron pólipos adenomatosos sincrónicos, es en el fenotipo mixto donde se observa una mayor presencia coincidente de adenomas. Estos datos concuerdan con estudios previos publicados que informan de porcentajes entre 69 y 88% de presencia de adenomas9–11,15.
El patrón de herencia del SPS es desconocido, pero se ha señalado que sería compatible con una herencia autosómica recesiva12,24,25, aunque ciertos factores ambientales, como el tabaquismo21, podrían modular las diferencias fenotípicas del SPS a través de la hipermetilación de los promotores de genes supresores de tumores, y según la mutación BRAF o KRAS diferirían las características de los pólipos8,13,15,24,25. Los pólipos, pequeños, localizados en el colon distal parecen relacionarse con la mutación KRAS, y los pólipos en colon proximal de mayor tamaño, con la mutación BRAF8,24,25. Teniendo en cuenta los pacientes con el fenotipo mixto, es posible que ambas mutaciones coexistan en algunos casos.
La frecuente existencia de pólipos adenomatosos en los pacientes con SPS hace que pueda resultar difícil diferenciar una poliposis adenomatosa atenuada de una SPS. Ante la presencia de una poliposis se deben realizar varias polipectomías/biopsias en distintas localizaciones del colon para su estudio histológico y correcta caracterización a cargo de un patólogo experto. La comunicación con los patólogos resulta fundamental, teniendo en cuenta las dificultades que encontramos para identificar histológicamente los distintos subtipos de las lesiones serradas. Aun en ausencia de historia familiar directa y, en casos de duda, se debe hacer un estudio genético del gen APC, por las implicaciones familiares y terapéuticas que conlleva y que son bien conocidas. La presencia de un KRAS o BRAF mutado puede resultar también de utilidad, así como el estudio del MYH, aunque más difícil de realizar26. Los pacientes con poliposis adenomatosa recesiva por mutación del MYH presentan también un riesgo elevado de cáncer colorrectal y de cáncer extracolónico27. Las implicaciones de estos estudios en lo referente a la colectomía profiláctica son también pertinentes.
El tratamiento del SPS, quirúrgico o endoscópico, debe adaptarse al fenotipo de los pacientes. Es posible el tratamiento completo y el seguimiento de los pacientes con SPS mediante colonoscopia27, aunque en más de un tercio de los casos ha sido necesaria la cirugía por la imposibilidad de extirpación y vigilancia. Se recomienda la escisión total de las lesiones, sobre todo las mayores de 5mm y localizadas en colon proximal; para las lesiones menores de 5mm y localizadas en el recto son suficientes las biopsias o fulguración28. La cirugía estaría indicada en casos de pólipos de gran tamaño que no se pueden extirpar mediante la colonoscopia o por la multiplicidad de estos. A pesar del aumento de la incidencia de CCR, no creemos que esté justificado realizar una colectomía subtotal en todos los casos de SPS en que se precisa tratamiento quirúrgico. La colectomía derecha estaría justificada en lesiones inextirpables del colon derecho, aun en presencia de PH en recto o sigma, siempre y cuando se pueda realizar un correcto seguimiento. Por otra parte, el fenotipo mixto sí que puede precisar una colectomía subtotal para controlar el gran número de pólipos distribuidos en todo el colon. El fenotipo distal no manejable endoscópicamente pero con pólipos derechos extirpados puede tratarse con una colectomía izquierda y seguimiento posterior.
El riesgo de lesión metácrona hace que se deba planificar un seguimiento endoscópico, habiéndose aconsejado realizarlo a intervalos inferiores a los que se realizan tras la extirpación de pólipos o resección de cánceres esporádicos, debido a que la velocidad de la carcinogénesis de la vía serrada parece más rápida que en la vía convencional15,19. La recomendación para el seguimiento de los pacientes con SPS es por colonoscopia anual y de manera indefinida28–30. Se recomienda la realización de colonoscopia cada 5 años a los familiares de primer grado (independientemente de la presencia de CCR) a partir de 40-55 años o 5 años antes del diagnóstico del familiar afecto28–30.
En conclusión, el SPS es un síndrome heterogéneo, variable en tipo, tamaño, distribución y número de pólipos, siendo más frecuente en varones fumadores con fenotipo distal. La mayoría de los pacientes presentan además pólipos adenomatosos de manera sincrónica. Estos pacientes requieren una evaluación organizada multidisciplinar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.