La cirugía mínimamente invasiva permite el tratamiento de los tumores de la unión esofagogástrica en condiciones de seguridad, reduciendo las complicaciones respiratorias y parietales y mejorando la recuperación postoperatoria, manteniendo además los principios de la cirugía oncológica que permitan obtener unos resultados óptimos de efectividad a largo plazo. Para ello, es necesario un volumen de actividad suficiente y avanzar en la curva de aprendizaje de forma tutelada, para poder garantizar una resección R0 y una linfadenectomía adecuada. La mínima invasión no puede ser un objetivo en sí misma.
En caso de gastrectomía total, el riesgo de afectación del margen proximal obliga a verificarlo mediante biopsia intraoperatoria, sin descartar la cirugía abierta de entrada. Por su parte, la esofagectomía mínimamente invasiva se ha ido imponiendo progresivamente. Su principal dificultad, la anastomosis intratorácica, puede realizarse mediante una sutura laterolateral mecánica o manualmente asistida por robot, gracias a la visión tridimensional y a la versatilidad del instrumental.
Minimally invasive surgery provides for the treatment of esophagogastric junction tumors under safe conditions, reducing respiratory and abdominal wall complications. Recovery is improved, while maintaining the oncological principles of surgery to obtain an optimal long-term outcome. It is important to have a sufficient volume of activity to progress along the learning curve with close expert supervision in order to guarantee R0 resection and adequate lymphadenectomy. Minimal invasiveness ought not become an objective in itself.
Should total gastrectomy be performed, the risk of a positive proximal margin makes intraoperative biopsy compulsory, without ruling out a primary open approach. Meanwhile, minimally invasive esophagectomy has been gaining ground. Its main difficulty, the intrathoracic anastomosis, can be safely carried out either with a mechanical side-to-side suture or a robot-assisted manual suture, thanks to the 3-D vision and versatility of the instruments.
La elección de la vía de abordaje en el tratamiento quirúrgico de los tumores de la unión esofagogástrica (UEG) exige la combinación de varias pruebas preoperatorias, tales como:
- ∘
La endoscopia con visión de la unión en retroflexión.
- ∘
El tipo histológico y la presencia de esófago de Barrett, en cuyo caso el tumor debe clasificarse como esofágico.
- ∘
La PET/TC.
- ∘
Si es preciso, la ecoendoscopia y el tránsito alto con contraste.
El fin es determinar si se trata de una lesión predominantemente esofágica o gástrica, a pesar de las dificultades añadidas por una lesión voluminosa o la presencia de una hernia de hiato, y conocer su patrón de diseminación ganglionar.
El objetivo del tratamiento quirúrgico es conseguir una resección R0 con margen proximal y distal de unos 5cm y margen circunferencial superior a 1mm1, añadiendo una linfadenectomía que permita una estadificación adecuada (al menos 15 ganglios linfáticos) y un potencial beneficio terapéutico2–4, por lo que el abordaje debe adaptarse a cada paciente5.
La vía transtorácica parece ineludible en caso de invasión esofágica superior a 2-3cm6,7, afectación ganglionar mediastínica4,8, lesiones avanzadas7,9 o «bulky» o dificultad para obtener un margen proximal adecuado10.
La mayor morbimortalidad y la repercusión sobre la calidad de vida asociadas a una disección más extensa deben tenerse en cuenta, razón por la que algunos autores proponen el manejo de las lesiones dudosas o en enfermos añosos como un cáncer gástrico11, o la vía transhiatal para pacientes con función pulmonar deteriorada.
En centros experimentados, las complicaciones pulmonares del abordaje torácico son similares7,12, así como la calidad de vida basada en los síntomas respiratorios y de reflujo.
Una vez tomada la decisión sobre la estrategia de resección quirúrgica más adecuada en cada caso en base a la localización y extensión del tumor, las características del paciente y la experiencia del equipo quirúrgico, el abordaje mínimamente invasivo (MI) puede aportar ventajas adicionales al paciente.
Es bien conocido que la cirugía mínimamente invasiva conlleva menos dolor, menos complicaciones parietales, menor pérdida hemática, mejor preservación de la función pulmonar postoperatoria y estancia hospitalaria más corta13–15. Dado que minimiza la morbilidad, se ha mostrado como un abordaje seguro en ancianos. Adicionalmente, debido a la magnificación que aporta, puede permitir una más precisa valoración de la anatomía quirúrgica. Estas ventajas se observan también en el abordaje híbrido16,17, donde únicamente el tiempo abdominal se realiza por laparoscopia. Por otro lado, al favorecer una pronta recuperación, la cirugía mínimamente invasiva aumenta las posibilidades de recibir tratamiento adyuvante18.
Sin embargo, existen dudas acerca de la posibilidad de realizar una linfadenectomía comparable a la cirugía abierta, sobre las complicaciones en las fases iniciales de la experiencia, con mayor número de reintervenciones15,19,20, la adecuación de márgenes de resección y los resultados oncológicos a largo plazo, aunque parece ser que las posibles diferencias se reducen a medida que aumenta el volumen de actividad.
En todo caso, la cirugía del cáncer gástrico o esofágico debe respetar los principios oncológicos de la resección y el objetivo es la supervivencia a largo plazo. El bienestar perioperatorio no puede primar sobre la calidad de la cirugía. Como señala Sasako, la primera operación decide el destino de los pacientes, y la perfección quirúrgica no puede compensarse con radioterapia o quimioterapia21.
En este trabajo se realiza una revisión de la experiencia y evidencia disponibles y se aportan recomendaciones sobre el abordaje mínimamente invasivo y mediante cirugía robótica en el cáncer de la UEG.
Utilidad de la cirugía mínimamente invasivaAdemás de los beneficios generales que aporta el abordaje MI en la cirugía digestiva, una utilidad reconocida de la laparoscopia es la realización de un procedimiento diagnóstico previo al inicio de la neoadyuvancia en tumores transmurales de la UEG con riesgo de carcinomatosis.
Gastrectomía laparoscópicaEn la gastrectomía, la vía laparoscópica se aplica a menudo a formas más precoces de la enfermedad, con un TNM más alto en cirugía abierta22. Para las sociedades orientales, se acepta que no hay diferencias en cuanto a patrones de recidiva o supervivencia entre la gastrectomía total abierta o laparoscópica en el cáncer gástrico precoz. Sin embargo, en la serie de Lee, donde se analizan 753 pacientes, existen significativamente más complicaciones anastomóticas y mayor mortalidad postoperatoria en la cirugía mínimamente invasiva, frente a más complicaciones parietales en la abierta23. La anastomosis en el mediastino es considerada como el paso más dificultoso en la gastrectomía total ampliada por laparoscopia, aunque la evolución de la tecnología, la exposición amplia del hiato y la introducción transoral del cabezal de la grapadora circular han permitido mejorar el margen de sección y aumentar la seguridad.
El uso de la cirugía laparoscópica en el tratamiento del cáncer gástrico avanzado no está ampliamente aceptado, principalmente por la dificultad técnica de realizar una linfadenectomía D2 adecuada, y su empleo parece aconsejable solamente en centros de alto volumen, con experiencia en cirugía mínimamente invasiva compleja y en un marco de investigación clínica. La evidencia es aún más dudosa en la gastrectomía total que en la subtotal24, aunque tal vez el STOMACH trial, con el reclutamiento de pacientes recientemente cerrado, pueda aportar algo de luz25. En una amplia serie oriental recientemente publicada26, se comparan dos grupos de pacientes sometidos a gastrectomía total abierta o laparoscópica en tumores tipo II y III (87 + 84 en cada brazo, respectivamente), observándose mejores resultados a corto y a largo plazo con la vía MI, especialmente en cuanto a supervivencia en el tipo II. En la serie de Shi27, con 132 gastrectomías laparoscópicas frente a 264 abiertas, no se objetivan diferencias en complicaciones ni en supervivencia a 2 años. Al tratarse ambos de estudios retrospectivos con pacientes pareados, puede existir un sesgo de selección que ponga en entredicho las conclusiones.
Con frecuencia, cuando se compara la cirugía abierta con la MI, la linfadenectomía es más amplia en la primera. En la revisión de Viñuela28, se realiza una linfadenectomía D2 en el 39% de las gastrectomías laparoscópicas y en el 69% de las abiertas. Por otro lado, la afectación macroscópica del borde proximal ocurre más a menudo en la cirugía laparoscópica (9 vs. 1% en la serie de Kelly18), particularmente en el tipo difuso de Lauren, por lo que resulta obligatoria la confirmación intraoperatoria mediante biopsia del margen proximal negativo. Estos hallazgos sugieren que, en algunos casos de tumores avanzados (voluminosos o dudosamente resecables), sobre todo difusos, un acceso abierto que permita la palpación del tumor puede ser aconsejable.
La tabla 1 recoge las principales limitaciones de los estudios comparativos entre cirugía abierta y mínimamente invasiva esofagogástrica.
Razones para la heterogeneidad de los estudios comparativos
| Diferencias en la experiencia laparoscópica o robóticaNúmero de pacientes pequeñoNumerosos estudios retrospectivosPorcentaje variable de gastrectomías totales o subtotalesDiferentes fases de la curva de aprendizajeExtensión de la linfadenectomíaNúmero de ganglios a menudo inferior en cirugía laparoscópicaSesgos de selección (no randomización), con frecuente asignación de enfermedad más avanzada a cirugía abiertaPredominio de series asiáticasAusencia habitual de resultados a largo plazo (seguimiento corto) |
Adaptado de Caruso et al.24.
Numerosos estudios encuentran resultados oncológicos similares entre la esofagectomía MI y la abierta29, apuntando en algunos casos a un incremento del número de ganglios linfáticos obtenidos con el abordaje MI, e incluso a una mejor supervivencia14. La calidad de vida es significativamente mejor. Los resultados a 3 años del TIME trial30 no observan diferencias entre la supervivencia global y libre de enfermedad entre la esofagectomía abierta y MI.
En un metaanálisis con 5235 esofagectomías MI y 10555 abiertas, las complicaciones generales, pulmonares, cardiovasculares y la mortalidad se reducen significativamente con el abordaje MI31. En el Registro Nacional holandés (Dutch Upper Gastrointestinal Cancer Audit = DUCA), la tasa de dehiscencias es significativamente mayor en la cirugía MI que en la abierta20.
En EE. UU., tal como refleja la National Cancer Data Base, en 2015, el número de esofagectomías mínimamente invasivas superó al de abiertas32. En los Países Bajos, el porcentaje de esofagectomías transtorácicas mínimamente invasivas subió del 42% en 2011 al 84% en 201520.
El principal problema para el desarrollo de la esofagectomía mínimamente invasiva estriba en las dificultades para realizar la anastomosis en la cúpula torácica, cuestión ineludible tanto para garantizar el margen proximal de resección como para minimizar el reflujo posterior. Numerosos equipos utilizan la anastomosis circular mecánica, particularmente en decúbito lateral, introduciendo el cabezal de 25-28mm por vía transoral o transtorácica33, para realizar una anastomosis término-lateral, y precisando a veces una minitoracotomía de asistencia, además de la que se usa para introducir la grapadora.
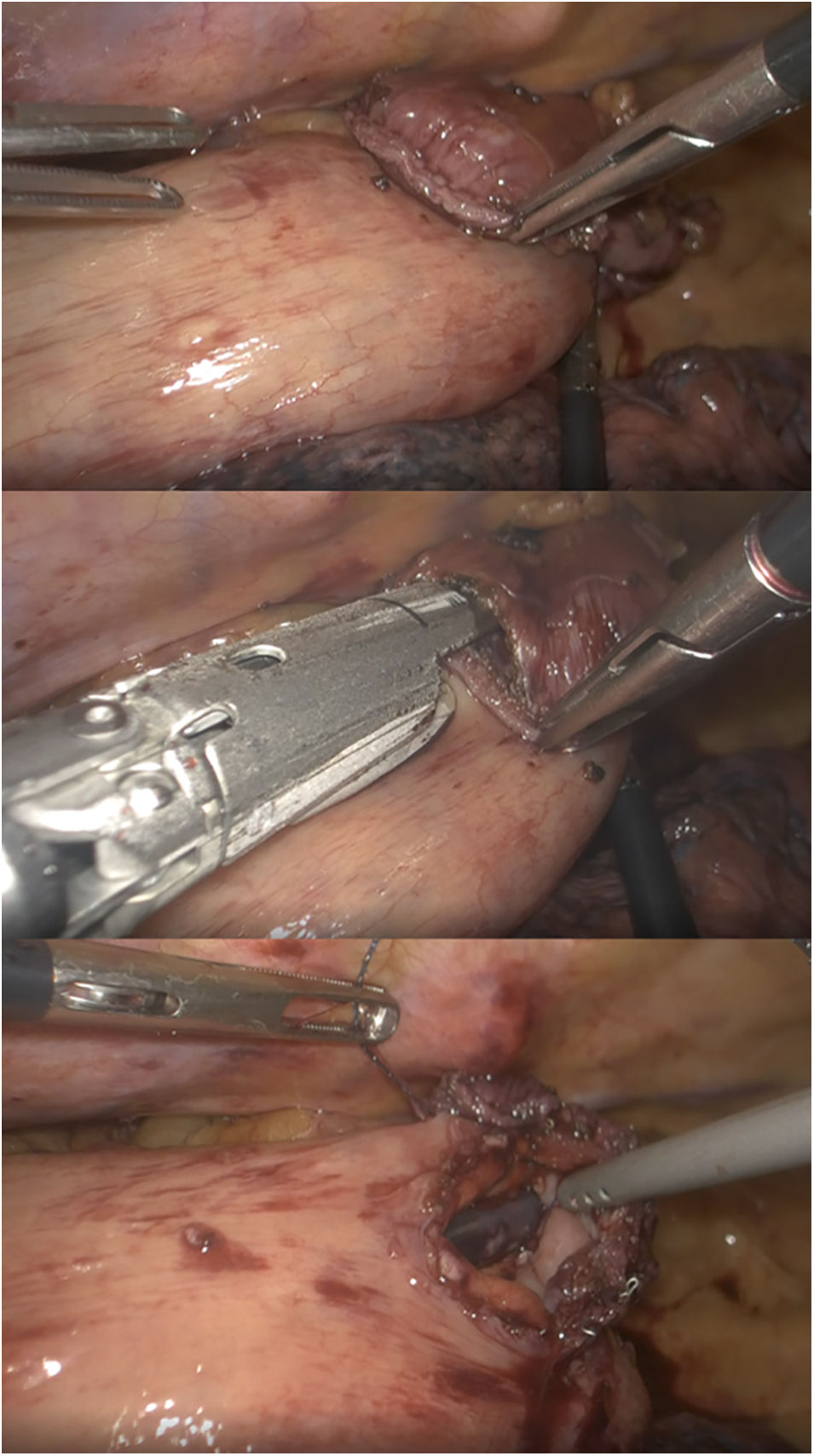
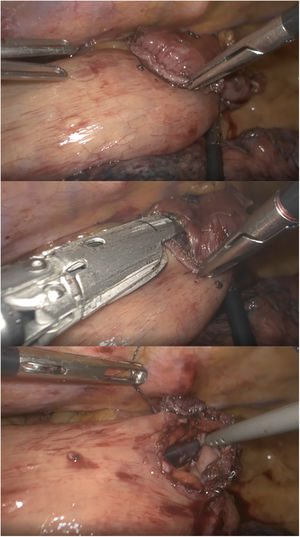
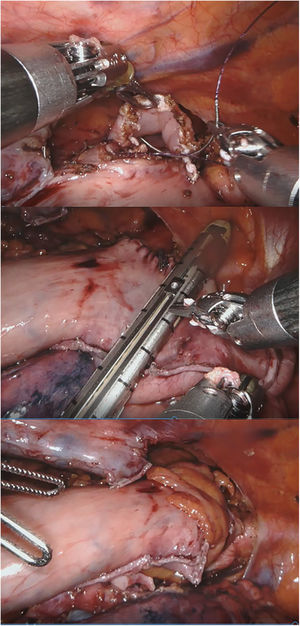
Otros autores proponen la realización de una anastomosis laterolateral «simplificada» en prono34,35 (fig. 1), con una baja tasa de dehiscencias y aparentemente menor porcentaje de estenosis. Esta es la técnica habitualmente realizada en el Hospital Universitario Donostia.
Aportación de la cirugía robóticaEl sistema quirúrgico da Vinci fue desarrollado como una innovación tecnológica prometedora que pretendía ofrecer soluciones potenciales más intuitivas a las limitaciones de la cirugía laparoscópica, en particular el aumento del temblor fisiológico en el extremo de los instrumentos, la restricción de movimientos debido a la naturaleza lineal de las pinzas de laparoscopia o la pérdida de profundidad debida a la visión bidimensional. El robot ofrece una visión tridimensional, reducción del temblor, magnificación de la imagen, escalado de los movimientos, con mayor libertad de los mismos (7 grados de libertad, frente a los 5 de la laparoscopia), control de la cámara por el cirujano y mejor ergonomía (tabla 2). La cuestión de la ergonomía es crucial, porque la fatiga del cirujano es una fuente potencial de imprecisión, y por tanto de inseguridad y de complicaciones, particularmente en intervenciones largas que precisan suturas delicadas tras varias horas de disección compleja. Como destaca Coratti, este conjunto de ventajas permite mejorar la calidad de la cirugía mínimamente invasiva36.
Ventajas de la cirugía robótica sobre la laparoscópica
| Disecciones precisas en pequeños camposAusencia de temblorMayor maniobrabilidad del instrumental, por los 7 grados de libertad, con 180o de articulación y 540o de rotaciónEscalado de los movimientos a una ratio de 3:1 o de 5:1Visión tridimensional de alta resoluciónEstabilidad de la imagenManejo de la cámara por el cirujano principalFacilita las anastomosis manualesCurva de aprendizaje más cortaReduce la fatiga del cirujano, por su mejor ergonomía |
Además, el abordaje robótico parece reducir la curva de aprendizaje de procedimientos mínimamente invasivos complejos, particularmente entre cirujanos con experiencia en cirugía laparoscópica.
Entre sus limitaciones, destacan la ausencia de sensación táctil, que debe ser compensada visualmente, y los costes, tanto relativos a la inversión inicial como a los gastos de mantenimiento (tabla 3).
Desventajas de la cirugía robótica
| Ausencia de sensación táctilTensión predeterminada de las pinzasRiesgo potencial de lesión tisular, particularmente durante la manipulación intestinalCampo de visión restringido respecto a la laparoscopiaEquipamiento voluminosoImposibilidad de cambios de posición del paciente una vez ensamblados los brazosCostes |
Desde la publicación del primer documento de consenso en cirugía robótica digestiva, la gastrectomía y la esofagectomía figuraban entre los procedimientos que podían beneficiarse del abordaje robótico, por ser de difícil acceso, limitados a un solo cuadrante, con necesidad de disección fina y de suturas difíciles37.
La gastrectomía robótica se ha mostrado como una técnica segura, que reduce la pérdida hemática respecto al abordaje abierto o laparoscópico, aunque prolonga el tiempo quirúrgico38,39. La tasa de complicaciones parece comparable, aunque algunos autores han reportado un índice de dehiscencias menor con la cirugía abierta22, y el número de ganglios linfáticos recolectados es similar. Otros autores encuentran una reducción significativa de las complicaciones postoperatorias con la cirugía robótica frente a la laparoscopia convencional, que podrían compensar al menos parcialmente los elevados costes39. Sus ventajas derivan de la propia naturaleza del robot, sobre todo la estabilidad, longitud del instrumental y definición visual, que facilitan el acceso a ciertos grupos ganglionares, como el suprapancreático o el hilio esplénico24. Los beneficios de la cirugía robótica parecen más importantes en pacientes obesos, donde el número de adenopatías resecadas es mayor que con laparoscopia23.
El posible interés de la anastomosis manual es controvertido36, y solamente algunos autores orientales han comunicado su experiencia preliminar con resultados satisfactorios. Aunque factible, significa en realidad convertir un gesto quirúrgico estandarizado y teóricamente «resuelto» en otro más complejo y, por tanto, sujeto a complicaciones potenciales, sobre todo en entornos con limitada disponibilidad del robot por compartir su uso con otras especialidades.
Esofagectomía robóticaLa revisión sistemática de Ruurda refleja la experiencia inicial en la adaptación al robot de numerosos grupos y los resultados lógicos de la curva de aprendizaje, además de sus beneficios potenciales40.
El recién publicado ROBOT trial muestra una reducción del dolor y de las complicaciones globales, particularmente pulmonares y cardíacas, con el abordaje robótico frente al abierto41. La calidad de vida es superior y los resultados oncológicos a largo plazo son similares.
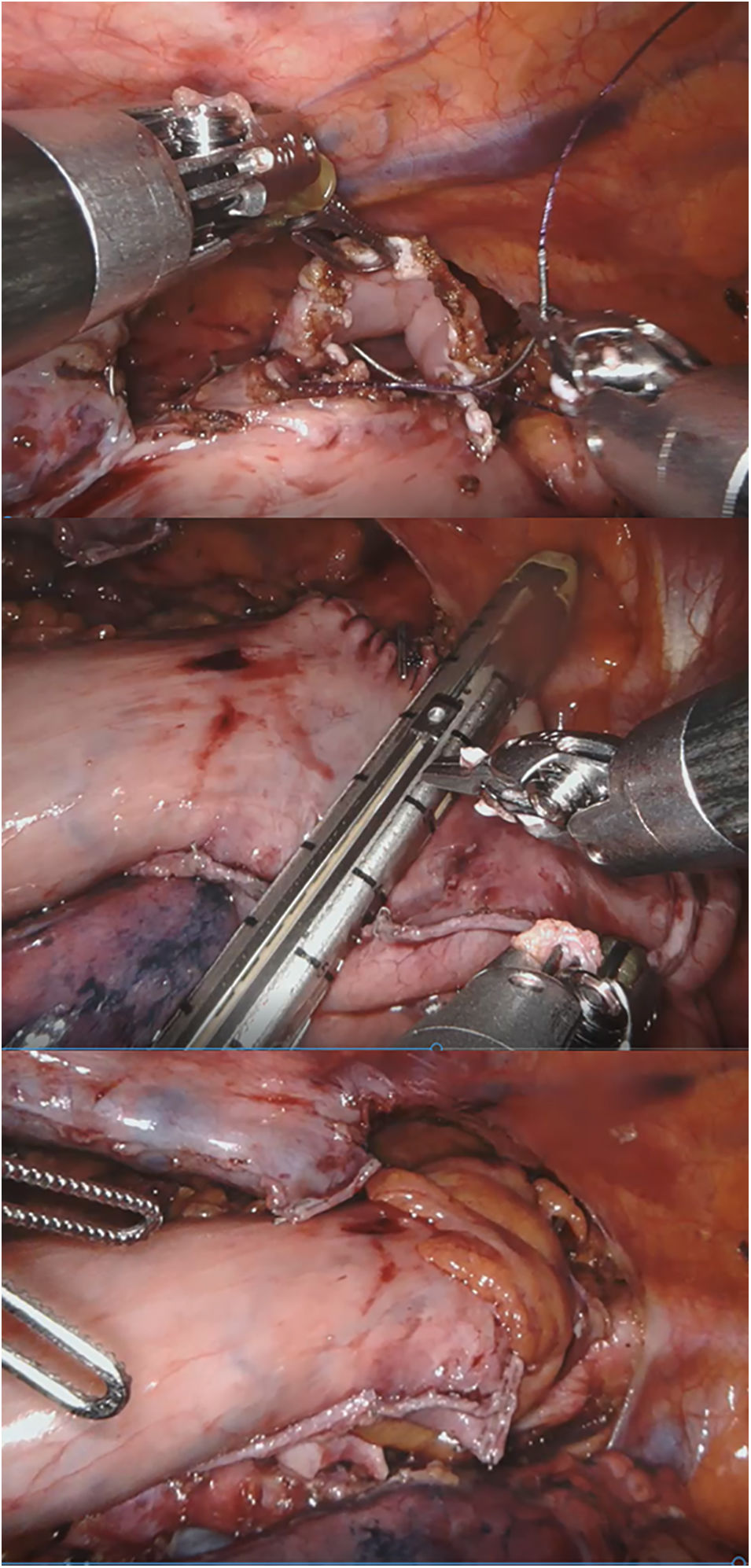
Aunque siguen existiendo dudas sobre la técnica ideal de reconstrucción esofagogástrica42, la anastomosis manual intratorácica con asistencia robótica permite, además de ofrecer los beneficios de la cirugía mínimamente invasiva y una linfadenectomía adecuada, aprovechar las ventajas de la anastomosis torácica frente a la cervical43 y de la sutura manual frente a la mecánica44, sin olvidar la relativa simplicidad de la técnica gracias a la versatilidad del instrumental45,46. Varios autores, sin embargo, realizan la anastomosis circular mecánica tras servirse del robot para hacer una bolsa de tabaco en el extremo esofágico proximal. Debido a la falta de sensación táctil, existe el riesgo de lesionar la plastia gástrica en caso de realizar la tracción con los instrumentos robóticos desde el tórax45. Por esta razón, puede ser útil introducir la plastia en el hemitórax derecho al terminar el tiempo abdominal, procediendo posteriormente al cierre hiatal46.
Con la experiencia en el Hospital Universitario Basurto, el robot se ha ido mostrando especialmente útil en la cirugía de campos profundos en un solo cuadrante, con poca manipulación visceral, sin anastomosis mecánicas, con suturas manuales «mal orientadas» y necesidades de sellado moderadas. Con el tiempo, la miotomía de Heller, el redo por fracaso o complicaciones de cirugía antirreflujo previa y la anastomosis manual en prono en la esofagectomía de Ivor-Lewis (fig. 2) se han convertido en las principales indicaciones en cirugía robótica esofagogástrica46, sin olvidar que la esofagectomía transhiatal robótica, aunque raramente indicada, puede realizarse con visión directa hasta superado el nivel de la carina.
Queda por determinar la utilidad del uso de la fluorescencia con verde de indocianina asociado al robot, particularmente en la visualización de la red vascular en la plastia gástrica. Si se emplea para seleccionar el lugar de la anastomosis, podría reducir el riesgo de fuga hasta en un 69%47. Zehetner observa una diferencia en la tasa de dehiscencias del 2 al 45% (p < 0,0001) según la calidad de la perfusión en el lugar de la anastomosis48.
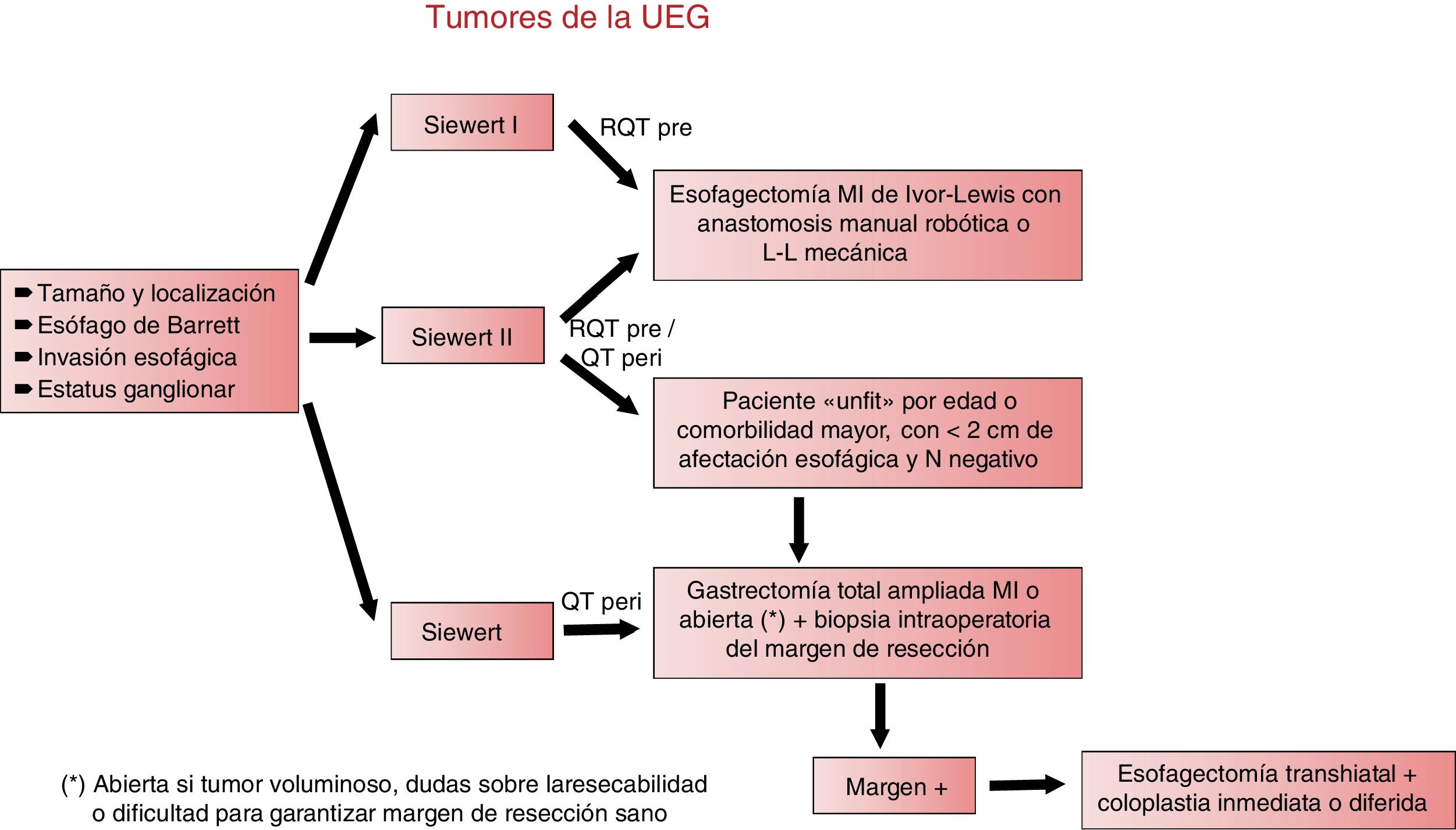
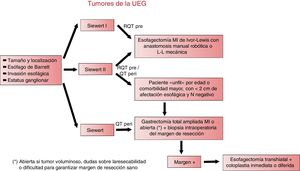
DiscusiónEl tratamiento óptimo de los tumores de la UEG exige un diagnóstico preciso y una toma de decisiones consensuada en el seno de un comité multidisciplinar, que tenga en cuenta tanto las características del tumor (epicentro, tamaño, presencia de metaplasia de Barrett, invasión esofágica, distribución de las posibles adenopatías metastásicas y afectación de órganos de vecindad) como la edad, comorbilidad, estado nutricional y situación funcional del paciente, a fin de decidir el esquema de tratamiento más adecuado, incluida la indicación de quimio- o radioquimioterapia neoadyuvante10,49 y el abordaje quirúrgico. La clasificación de Siewert, que tiene en cuenta las características epidemiológicas, morfológicas y de diseminación ganglionar, ayuda a determinar el mejor tratamiento quirúrgico para cada paciente.
En caso de los tumores de comportamiento dudoso (esofágico o gástrico), la decisión de realizar una gastrectomía o una esofagectomía debe tomarse empezando el procedimiento por la vía abdominal. Además, como norma general, el tratamiento de los tumores de la UEG debe realizarse en una unidad con experiencia tanto en cirugía gástrica como esofágica.
La figura 3 muestra el algoritmo de manejo terapéutico en los tumores de la UEG en el Hospital Universitario Basurto.
Es bien conocido que los resultados de seguridad de la cirugía dependen no solo de una técnica refinada, sino de la optimización de las comorbilidades y la preparación adecuada de los pacientes, tanto física como psíquica y nutricional.
El tratamiento estándar de los tumores tipo Siewert II debería ser la esofagectomía de Ivor-Lewis7,9,12, que permite la resección de los ganglios perihiatales, mediastínicos y en torno a la curvatura menor, garantizando además los márgenes proximal, distal y circunferencial. En relación con la anastomosis cervical, garantiza una mejor vascularización a nivel de la anastomosis, menos lesiones recurrenciales y menos estenosis43. El beneficio de la linfadenectomía de los grupos 4, 5 y 6 en estos tumores parece nulo3.
Los resultados de seguridad y efectividad del abordaje toracoabdominal izquierdo hacen desaconsejable su uso en la actualidad50. La esofagectomía distal con gastrectomía proximal parece ser un recurso de excepción.
La vía MI permite reducir significativamente eventuales complicaciones respiratorias, como se desprende de los ensayos TIME13 y MIRO17, e incluso la mortalidad. Por supuesto, pacientes añosos y/o frágiles, incluso tumores de cardias «puros» que apenas penetran en el esófago, pueden ser adecuadamente tratados con una gastrectomía total ampliada, respetando el margen proximal de unos 5cm, aunque algunos autores defienden que 2-3cm pueden ser suficientes51. En todo caso, tras la gastrectomía, resulta obligatoria la comprobación intraoperatoria de que el margen proximal está libre –particularmente en cirugía MI18, donde la sensación táctil está reducida–, por si pudiese precisar ampliación proximal, incluso en forma de esofagectomía transhiatal. En algunos casos, con tumores voluminosos, de manipulación dificultosa o resecabilidad dudosa, la cirugía abierta puede aportar ventajas respecto a la laparoscopia.
La cirugía mínimamente invasiva mejora el bienestar postoperatorio (incluido el dolor), la estancia hospitalaria, la función pulmonar e incluso las pérdidas hemáticas. Sin embargo, en las fases iniciales de la experiencia, la tasa de dehiscencias, incluso la mortalidad, pueden aumentar, y la calidad de la resección (márgenes libres, porcentaje de R0 y número de ganglios resecados) verse afectada.
A fin de paliar estos riesgos, al tratarse de una cirugía compleja y con complicaciones potenciales graves, su manejo debe llevarse a cabo en centros de alto volumen con cirujanos experimentados y equipos multidisciplinares52, que permitan aproximarse a cifras de mortalidad hospitalaria a 90 días inferior a 5%. Del mismo modo, deben establecerse programas de formación53 que permitan extender la cirugía mínimamente invasiva sin aumentar significativamente las complicaciones, apoyando a cirujanos expertos en cirugía esofagogástrica para que conozcan los nuevos abordajes y durante la fase de implementación en sus propios servicios.
La cirugía robótica ofrece la posibilidad de superar algunas limitaciones de la cirugía MI convencional. En el tratamiento de los tumores de la UEG, sus principales aportaciones son la linfadenectomía abdominal y la anastomosis intratorácica. Su principal problema, es decir, su elevado coste, podría verse compensado en parte por una potencial reducción en las complicaciones, gracias sobre todo a la calidad de la visión y la versatilidad del instrumental.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.