Actualmente el tratamiento del cáncer de esófago requiere un enfoque multidisciplinar en el que la esofaguectomía sigue siendo su pilar básico. El objetivo del estudio es analizar si el tratamiento multimodal y la introducción de nuevas técnicas quirúrgicas menos invasivas ha supuesto una disminución de las complicaciones de la esofaguectomía y una mayor supervivencia del cáncer de esófago.
MétodosEstudio retrospectivo de 318 pacientes con cáncer de esófago que incluyen 81 esofaguectomías. Se comparan los periodos 2000-2007 y 2008-2015 y se analizan los factores pronósticos que pueden influir en las complicaciones y supervivencia.
ResultadosLas complicaciones postoperatorias mayores según la clasificación de Clavien-Dindo fueron globalmente 35%, mostrando una disminución entre el 1.° y 2.° periodo: 41% de morbilidad vs. 30%, 27% de mortalidad vs. 9% (p < 0,001) y 13,5% de fístulas vs. 7%. La incorporación de la esofaguectomía toracoscópica con 19% de complicaciones y 5% de mortalidad y la anastomosis mecánica triangularizada con 5% de fístulas y 9% de estenosis contribuyeron a estos resultados. La supervivencia global a los 5 años fue del 19%, con una mejoría significativa entre el 1.° y 2.° periodo: 11 vs. 28% (p < 0,001).
ConclusionesLa valoración multidisciplinar de los pacientes, con una mejor selección e indicación del tratamiento multimodal, y la introducción de nuevas técnicas quirúrgicas menos invasivas y más depuradas, como la toracoscopia y la anastomosis mecánica triangularizada, se ha traducido en una disminución de la morbimortalidad de las esofaguectomías y en un aumento significativo de la supervivencia de los pacientes con CE.
Nowadays, treatment of esophageal cancer requires a multidisciplinary approach, in which esophagectomy remains the mainstay. The aim of this report is to assess whether multimodal treatment and minimally invasive surgery have led to a lower morbidity rate and an improvement in survival rates.
MethodsRetrospective evaluation of 318 patients diagnosed with esophageal cancer including 81 esophagectomies. The periods of 2000-2007 and 2008-2015 were compared, analyzing the prognostic factors that may have an impact in morbidity and survival rate.
ResultsMajor postoperative complications according to the Clavien-Dindo classification accounted for 35%, showing a decrease between the 1.st and 2.nd period: 41% morbidity vs. 30%, 27% mortality vs. 9% (p < .001) and 13.5% fistulas vs. 7%. The implementation of thoracoscopic esophagectomy contributed to the outcome improvement, as shown by 19% morbidity and 5% mortality rates, with triangularized mechanical anastomosis showing 9% fistula and 5% stenosis. The overall 5-year survival rate was 19%, with a significant increase from 11% in the 1.st period to 28% in the 2.nd (p < .001).
ConclusionsMultidisciplinary assessment of patients with esophageal cancer, as well as better selection and indication of treatment and the introduction of new minimally invasive techniques (thoracoscopy and triangularized mechanical anastomosis), have improved the morbidity and mortality rates of esophagectomies, resulting in increased survival rates of these patients.
En las últimas décadas se ha confirmado en Occidente un rápido incremento del adenocarcinoma (ADC) de esófago de localización distal con un descenso del carcinoma epidermoide (CEP) de esófago medio1. La supervivencia a los 5 años del cáncer de esófago (CE) permanece baja, con un promedio global2 de 10-20% y de 30% en los resecados3, aunque actualmente debido a los avances en el tratamiento multimodal4 y de la técnica quirúrgica5 se ha logrado llegar al 40-57% de las esofaguectomías.
La esofaguectomía, dentro de la terapia multimodal, sigue siendo el pilar básico para el tratamiento del CE locorregional2, pero mantiene un elevado índice de complicaciones mayores (40-60%)6,7 y un riesgo significativo de mortalidad, entre 8-23%8 dependiendo del volumen quirúrgico del hospital, aunque se ha logrado disminuir a < 2%9 en centros muy especializados.
Dada la complejidad del tratamiento del CE es muy útil la valoración de estos pacientes por un Comité Multidisciplinar de Tumores Digestivos (CMTD) para lograr una mejor selección de los mismos y una correcta indicación del tratamiento multimodal10,11. La formación de Unidades de Cirugía Esófago-Gástrica, con la aplicación de técnicas quirúrgicas menos invasivas como la toracoscopia12, ha logrado disminuir la morbimortalidad de esta desafiante cirugía.
El objetivo principal del estudio es analizar retrospectivamente a los pacientes diagnosticados de CE en nuestro hospital con el fin de comprobar si el tratamiento multimodal actual, con la aplicación de la neoadyuvancia, y la introducción de nuevas técnicas quirúrgicas menos invasivas y más depuradas, como la toracoscopia y la anastomosis mecánica triangularizada, han supuesto un beneficio para disminuir las complicaciones y aumentar la supervivencia.
MétodosPacientes y método de estudioSe realiza un estudio retrospectivo de los pacientes diagnosticados de CE epitelial en nuestro hospital desde el año 2000 al 2015. Se descartaron 29 pacientes por no disponer de anatomía patológica, 11 por falta de TAC y 8 por seguimiento < 1 año. Se aceptaron para el estudio 318 pacientes con adenocarcinoma, carcinoma epidermoide o indiferenciado de esófago, incluyendo el tipo Siewert I.
En 89 pacientes se practicó una esofaguectomía. Con el fin de que tuvieran unos riesgos postoperatorios similares y poder establecer unos grupos homogéneos con un número mínimo de pacientes se desestimaron 4 gastrectomías con esofaguectomía distal (cuyo riesgo de complicaciones es similar a la gastrectomía total y no a la esofaguectomía), 2 esofaguectomías realizadas en dos tiempos y sin reconstrucción por recidiva precoz del cáncer y 2 esofaguectomías por toracotomía izquierda, quedando para el análisis de las complicaciones 81 pacientes con esofaguectomías estándar.
Los pacientes se dividieron, coincidiendo con la formación en 2008 de la Unidad de Cirugía Esófago-Gástrica y del CMTD, en dos periodos de 8 años cada uno: 2000 a 2007 (1.er periodo) con 157 pacientes y 2008 a 2015 (2.° periodo) con 161. El tiempo de observación fue hasta marzo de 2017, con un tiempo medio de seguimiento de 20 meses (0,1-205).
Se analizan las características preoperatorias y se estudia en detalle la comorbilidad, la técnica quirúrgica, las complicaciones y la supervivencia. Para el estudio de los posibles factores pronósticos de las complicaciones y supervivencia se correlacionan las distintas variables mediante un análisis univariante y multivariante.
Selección de pacientesA todos los pacientes se les realizó estudio baritado, endoscopia, biopsia, TAC y, desde 2008, ecoendoscopia. Se solicitó PET si hubo dudas en el TAC y broncoscopia si los tumores eran de tercio medio.
Desde 2008 el CMTD evalúa a todos los CE y según su estudio de extensión (TNM-7.ª edición13) se indica la siguiente actitud14: «enfermedad limitada» (≤ T2/N0/M0) con indicación de cirugía directa; «localmente avanzado» (T3-4/y/o/N +, M0) candidato a neoadyuvancia y reevaluación con TAC/PET con posterior esofaguectomía y «enfermedad metastásica» (M1) quimioterapia o medidas de soporte. La neoadyuvancia consistió para los CEP en quimioterapia preoperatoria, fundamentalmente TPF (taxotere/ cisplatino/5-fluoracilo), concomitante con radioterapia (45-50,4Gy) seguida de esofagectomía a las 4-6 semanas y para los ADC en quimioterapia perioperatoria (basada en una combinación en forma de diplete o triplete de platinos/fluoropirimidinas/taxanos) con posibilidad de radioterapia postoperatoria si R1/2 o N +.
Anteriormente a 2008 se practicó esofaguectomía si no había evidencia preoperatoria de enfermedad metastásica ni afectación de órganos irresecables. La adyuvancia (similar pauta de dipletes o tripletes con radioterapia postoperatoria) se indicó cuando la anatomía patológica confirmó un estadio localmente avanzado.
Técnica quirúrgicaLas intervenciones se realizaron por dos cirujanos de la unidad, actualmente G.M. y M.V. Las técnicas de esofaguectomías estándar empleadas fueron: transtorácica derecha (Ivor-Lewis), triincisional (McKeown), transhiatal (Orringer) y en los últimos años esofaguectomía mínimamente invasiva híbrida (EMI-híbrida15) por toracoscopia derecha en decúbito prono, laparotomía y cervicotomía. La linfadenectomía practicada en la esofaguectomía transtorácica y toracoscópica fue en dos campos de tipo estándar y en la transhiatal se consideró incompleta a nivel torácico.
La plastia habitual fue la gástrica estrecha con piloroplastia, salvo 4 coloplastias en que no se pudo utilizar el estómago. La anastomosis a nivel mediastínico fue supraácigos, con sutura mecánica circular T-L, y a nivel cervical se han empleado diversas técnicas, generalmente mecánicas. Actualmente la anastomosis estándar que utilizamos es la mecánica total triangularizada T-L de Singh16, que realizamos con endograpadora (60x3,5) mediante una sutura en la cara posterior y dos suturas entrecruzadas en la cara anterior. Rutinariamente se hizo yeyunostomía de alimentación.
DefinicionesLa comorbilidad se expresa por el índice de Charlson ajustado por la edad17 (ICC + E) y ligeramente modificado18, excluyéndose para la comorbilidad el propio CE y las metástasis, y aceptándose como puntuación: infarto de miocardio, IC cardiaca congestiva, enfermedad vascular periférica, cerebrovascular, pulmonar crónica, tejido conectivo, hepática benigna, úlcera péptica, diabetes sin afectación orgánica y demencia = 1; hemiplejia, I renal moderada/severa, diabetes con afectación orgánica, otros cánceres activos = 2; enfermedad hepática moderada/severa = 3; sida = 6; < 50 años = 0; 50-59 = 1; 60-69 = 2; 70-79 = 3; 80-89 = 4; ≥ 90 = 5. El ICC + E se dividió en tres grados19: bajo riesgo (0-2), medio (3-4) y alto (≥ 5) puntos.
Las complicaciones postoperatorias se describen según la clasificación de Clavien-Dindo20, considerándose mayores los grados21: III (intervención endoscópica, radiológica o quirúrgica sin/con anestesia general), IV (ingreso UCI por fallo uni/multiorgánico) y V (muerte), y también por la clasificación internacional de consenso de Low22,23. Tanto la morbilidad como la mortalidad se consideró durante el total del postoperatorio (hospitalaria) e incluso si tuvo un reingreso cercano al alta (90 días).
La supervivencia estudiada fue de tipo cáncer-específico, valorando el periodo de tiempo desde el diagnóstico hasta la muerte del paciente y aceptándose como evento de éxitus solo si la muerte se produjo en relación con el cáncer de esófago. En los pacientes que fallecieron por otras causas, no relacionadas con el cáncer de esófago, se consideró su tiempo de observación hasta la salida del estudio.
Estudio estadísticoPara el análisis descriptivo de las variables cualitativas se utilizó el n.° y % y para las variables cuantitativas la media, desviación típica y rango. El estudio de los factores pronósticos de las complicaciones se realizó mediante un análisis univariante de contraste de hipótesis con la prueba de la Chi-cuadrado, y las variables con tendencia significativa se analizaron según un modelo de regresión logística multivariante, ajustado por el test de Hosmer-Lemeshow, para determinar la contribución independiente de cada una de ellas. La supervivencia se calculó según el método de Kaplan-Meyer, realizándose el análisis univariante por el test de Log-Rank y el multivariante mediante la regresión de Cox.
El valor de p estadísticamente significativo, así como el intervalo de confianza de la odds ratio fue del 95% (p < 0,05). El análisis de los datos se realizó con el programa SPSS para Windows versión 21.0 (Chicago, Illinois, EE. UU.).
ResultadosDe los 318 pacientes 294 (92,5%) fueron hombres y 24 (7,5%) mujeres, con una edad media de 65 años (34-87) sin diferencias significativas en ambos periodos. La mayoría fueron CEP, 228 (71,8%), 80 adenocarcinomas (25,2%) y 10 carcinomas indiferenciados (3,1%). Hubo un aumento, no significativo (p = 0,507), de adenocarcinomas en el 2.° periodo: 45 pacientes (28%) frente a 35 (22,3%) del 1.er periodo. La localización fue de 23 a nivel cervical (7,2%), 32 en tercio superior torácico (10,1%), 130 en tercio medio torácico (40,9%), 127 en tercio inferior (39,9%) y 6 multicéntricos (1,9%). En el 2.° periodo aumentó la localización en el tercio inferior, 68 pacientes (42,2%) frente a 59 (37,6%) del 1.er periodo, sin valor significativo. El esófago de Barrett tuvo menor incidencia en el 2.° periodo, 18 (11,2%) frente a 28 (17,8%) del 1.er periodo.
La estadificación fue de tipo clínico (cTNM) en 225 pacientes que no se resecaron, patológico (pTNM) en 76 que se resecaron sin neoadyuvancia previa y clínico preneoadyuvancia (cTNM) en 17 pacientes en que se practicó esofaguectomía después de neoadyuvancia, porque refleja con mayor exactitud lo avanzado de la enfermedad que el patológico posneoadyuvancia (ypTNM). La distribución por estadios fue la siguiente: «0» 2 pacientes (0,6%), «I» 29 (9,1%), «II» 28 (8,8%), «III» 172 (54,1%) y «IV» 87 (27,4%), sin diferencias significativas en ambos periodos (p = 0,373).
El tumor fue resecado en 93 pacientes (29,2%): 4 endoscópicamente y 89 mediante esofaguectomía total o parcial. En 179 pacientes (56,3%) no se resecó el tumor pero fueron tratados con quimioterapia y/o radioterapia con diferentes intenciones terapéuticas y en 46 (14,5%) no se resecó el tumor y solo recibieron cuidados de soporte.
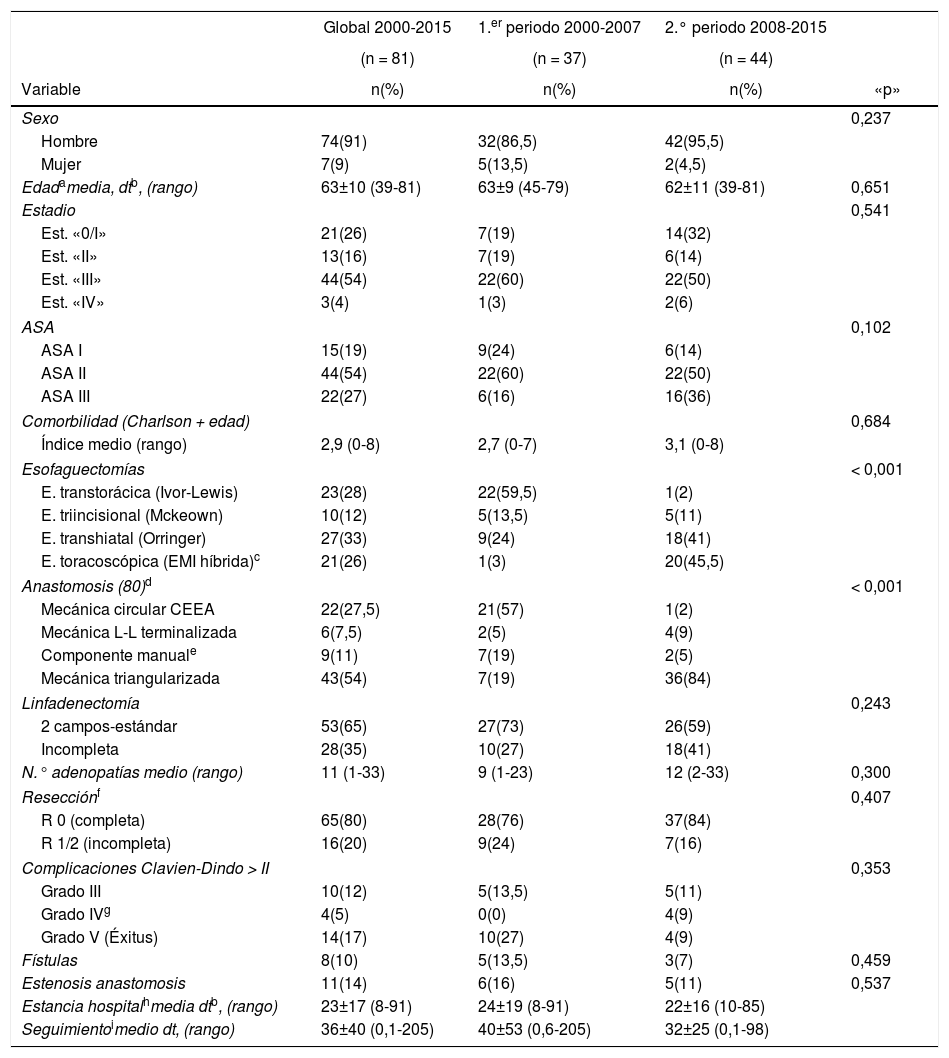
Las características de las 81 esofaguectomías estándar y las complicaciones mayores de la clasificación de Clavien-Dindo se analizan en la tabla 1. En el 2.° periodo se realizaron más esofaguectomías transhiatales y, por consiguiente, más linfadenectomías incompletas, intentando evitar las graves complicaciones de la esofaguectomía transtorácica, debido a que la instauración del abordaje toracoscópico fue progresivo. En la tabla 2 se detallan las complicaciones según la clasificación estandarizada de Low. De las 8 fugas anastomóticas (10%) 7 fueron fístulas de tipo II, sin necesidad de tratamiento quirúrgico, y una se produjo por una necrosis de la plastia tipo III con resección de la misma y exclusión esofágica, a pesar de lo cual falleció a los pocos días de la reintervención. Catorce pacientes (17%) fallecieron a consecuencia de la intervención: uno intraoperatoriamente, por una hemorragia incoercible durante una esofaguectomía transhiatal, y 13 (16%) en el postoperatorio inmediato. Se reoperaron 6 pacientes (7%), 4 de ellos por complicación aguda: una necrosis de la plastia ya referida, una fístula traqueal tratada con plastia pleural, un quilotórax (tipo IIIB) con ligadura del conducto torácico y un absceso abdominal con drenaje. Dos pacientes se reoperaron tardíamente por obstrucción intestinal y eventración. Se produjeron 6 lesiones del recurrente (7%), todas ellas transitorias tipo I sin necesidad de operación de ORL, y 11 estenosis de la anastomosis (14%) que requirieron varias dilataciones endoscópicas.
Esofaguectomías: características y complicaciones (Clavien-Dindo > II)
| Global 2000-2015 | 1.er periodo 2000-2007 | 2.° periodo 2008-2015 | ||
|---|---|---|---|---|
| (n = 81) | (n = 37) | (n = 44) | ||
| Variable | n(%) | n(%) | n(%) | «p» |
| Sexo | 0,237 | |||
| Hombre | 74(91) | 32(86,5) | 42(95,5) | |
| Mujer | 7(9) | 5(13,5) | 2(4,5) | |
| Edadamedia, dtb, (rango) | 63±10 (39-81) | 63±9 (45-79) | 62±11 (39-81) | 0,651 |
| Estadio | 0,541 | |||
| Est. «0/I» | 21(26) | 7(19) | 14(32) | |
| Est. «II» | 13(16) | 7(19) | 6(14) | |
| Est. «III» | 44(54) | 22(60) | 22(50) | |
| Est. «IV» | 3(4) | 1(3) | 2(6) | |
| ASA | 0,102 | |||
| ASA I | 15(19) | 9(24) | 6(14) | |
| ASA II | 44(54) | 22(60) | 22(50) | |
| ASA III | 22(27) | 6(16) | 16(36) | |
| Comorbilidad (Charlson + edad) | 0,684 | |||
| Índice medio (rango) | 2,9 (0-8) | 2,7 (0-7) | 3,1 (0-8) | |
| Esofaguectomías | < 0,001 | |||
| E. transtorácica (Ivor-Lewis) | 23(28) | 22(59,5) | 1(2) | |
| E. triincisional (Mckeown) | 10(12) | 5(13,5) | 5(11) | |
| E. transhiatal (Orringer) | 27(33) | 9(24) | 18(41) | |
| E. toracoscópica (EMI híbrida)c | 21(26) | 1(3) | 20(45,5) | |
| Anastomosis (80)d | < 0,001 | |||
| Mecánica circular CEEA | 22(27,5) | 21(57) | 1(2) | |
| Mecánica L-L terminalizada | 6(7,5) | 2(5) | 4(9) | |
| Componente manuale | 9(11) | 7(19) | 2(5) | |
| Mecánica triangularizada | 43(54) | 7(19) | 36(84) | |
| Linfadenectomía | 0,243 | |||
| 2 campos-estándar | 53(65) | 27(73) | 26(59) | |
| Incompleta | 28(35) | 10(27) | 18(41) | |
| N.° adenopatías medio (rango) | 11 (1-33) | 9 (1-23) | 12 (2-33) | 0,300 |
| Resecciónf | 0,407 | |||
| R 0 (completa) | 65(80) | 28(76) | 37(84) | |
| R 1/2 (incompleta) | 16(20) | 9(24) | 7(16) | |
| Complicaciones Clavien-Dindo > II | 0,353 | |||
| Grado III | 10(12) | 5(13,5) | 5(11) | |
| Grado IVg | 4(5) | 0(0) | 4(9) | |
| Grado V (Éxitus) | 14(17) | 10(27) | 4(9) | |
| Fístulas | 8(10) | 5(13,5) | 3(7) | 0,459 |
| Estenosis anastomosis | 11(14) | 6(16) | 5(11) | 0,537 |
| Estancia hospitalhmedia dtb, (rango) | 23±17 (8-91) | 24±19 (8-91) | 22±16 (10-85) | |
| Seguimientoimedio dt, (rango) | 36±40 (0,1-205) | 40±53 (0,6-205) | 32±25 (0,1-98) | |
Complicaciones de las esofaguectomías según clasificación de Low
| (n = 81) | ||
|---|---|---|
| n | (%) | |
| Pacientesacon complicaciones | 42 | (52) |
| Respiratorias | 30 | (37) |
| Neumonía | 16 | (20) |
| Derrame pleural + drenaje | 16 | (20) |
| Distrés respiratorio | 5 | (6) |
| Intubación prolongada | 4 | (5) |
| Empiema | 1 | (1) |
| Broncoaspiración | 1 | (1) |
| Lesión traqueobronquial | 2 | (2) |
| Fístulas | 8 | (10) |
| Fístulas según nivel de anastomosis | ||
| Cervical | 5/58 | (9) |
| Mediastínica | 3/23 | (13) |
| Fístulas según tipo de anastomosis | ||
| Mecánica circular CEEA | 3/22 | (17) |
| Mecánica L-L terminalizada | 0/6 | (0) |
| Componente manual | 3/9 | (33) |
| Mecánica triangularizada | 2/43 | (5) |
| Quilotórax | 4 | (5) |
| Otras complicaciones | 21 | (26) |
| Cardíacas | 1 | (1) |
| Hemorragia | 4 | (5) |
| Troemboembolismo pulmonar | 2 | (2) |
| Fracaso multiorgánico | 8 | (10) |
| Sepsis | 8 | (10) |
| Absceso intraabdominal | 1 | (1) |
| Lesión recurrente | 6 | (7) |
| Mortalidad hospitalaria | 14 | (17) |
| Intraoperatoria | 1 | (1) |
| Postoperatoria | 13 | (16) |
| Mortalidad según técnica de esofaguectomía | ||
| E. transtorácica (Ivor-Lewis) | 7/23 | (30) |
| E. triincisional (Mckeown) | 4/10 | (40) |
| E. transhiatal (Orringer) | 2/27 | (7) |
| E. toracoscópica (EMI híbrida) | 1/21 | (5) |
| Estenosis anastomosis (80 anastomosis) | 11 | (14) |
| Mecánica circular CEEA | 3/22 | (14) |
| Mecánica L-L terminalizada | 3/6 | (50) |
| Componente manual | 1/9 | (11) |
| Mecánica triangularizada | 4/43 | (9) |
| Reoperaciones | 6 | (7) |
| Postoperatorias tempranas | 4 | (5) |
| Tardías | 2 | (2) |
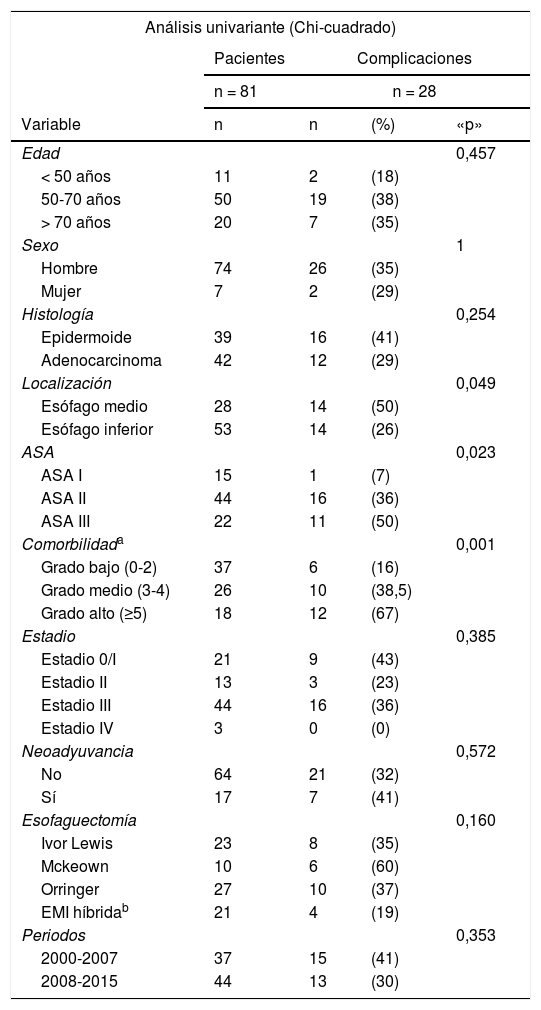
Los factores pronósticos de las complicaciones postoperatorias (Clavien-Dindo > II) se detallan en la tabla 3. La localización y el ASA influyeron significativamente en la aparición de complicaciones y la comorbilidad, expresada por el ICC + E, tuvo un valor significativo muy alto (p < 0,001), pero solamente la localización y el ICC + E fueron factores independientes para predecir complicaciones.
Factores pronósticos de la complicaciones de las esofaguectomías (Clavien-Dindo > II)
| Análisis univariante (Chi-cuadrado) | ||||
|---|---|---|---|---|
| Pacientes | Complicaciones | |||
| n = 81 | n = 28 | |||
| Variable | n | n | (%) | «p» |
| Edad | 0,457 | |||
| < 50 años | 11 | 2 | (18) | |
| 50-70 años | 50 | 19 | (38) | |
| > 70 años | 20 | 7 | (35) | |
| Sexo | 1 | |||
| Hombre | 74 | 26 | (35) | |
| Mujer | 7 | 2 | (29) | |
| Histología | 0,254 | |||
| Epidermoide | 39 | 16 | (41) | |
| Adenocarcinoma | 42 | 12 | (29) | |
| Localización | 0,049 | |||
| Esófago medio | 28 | 14 | (50) | |
| Esófago inferior | 53 | 14 | (26) | |
| ASA | 0,023 | |||
| ASA I | 15 | 1 | (7) | |
| ASA II | 44 | 16 | (36) | |
| ASA III | 22 | 11 | (50) | |
| Comorbilidada | 0,001 | |||
| Grado bajo (0-2) | 37 | 6 | (16) | |
| Grado medio (3-4) | 26 | 10 | (38,5) | |
| Grado alto (≥5) | 18 | 12 | (67) | |
| Estadio | 0,385 | |||
| Estadio 0/I | 21 | 9 | (43) | |
| Estadio II | 13 | 3 | (23) | |
| Estadio III | 44 | 16 | (36) | |
| Estadio IV | 3 | 0 | (0) | |
| Neoadyuvancia | 0,572 | |||
| No | 64 | 21 | (32) | |
| Sí | 17 | 7 | (41) | |
| Esofaguectomía | 0,160 | |||
| Ivor Lewis | 23 | 8 | (35) | |
| Mckeown | 10 | 6 | (60) | |
| Orringer | 27 | 10 | (37) | |
| EMI híbridab | 21 | 4 | (19) | |
| Periodos | 0,353 | |||
| 2000-2007 | 37 | 15 | (41) | |
| 2008-2015 | 44 | 13 | (30) | |
| Análisis multivariante (regresión logística) | ||||
|---|---|---|---|---|
| Variable | Coeficiente | Error típico | Odds ratio | |
| predictora | de beta | de beta | «p» | (IC del 95%) |
| Localización | ||||
| Esof. inferior | 1 | |||
| Esof. medio | 1,523 | 0,591 | 0,010 | 4,584 (1,440-14,599) |
| Índice de Charlson + edad | ||||
| G. bajo | 1 | |||
| G. medio | 1,365 | 0,647 | 0,035 | 3,914 (1,100-13,919) |
| G. alto | 2,766 | 0,749 | < 0,001 | 15,898(3,661-69,039) |
La supervivencia global de los 318 pacientes fue de 19% a los 5 años con una supervivencia media de 41 meses. El factor que más influyó fue el estadio ya que refleja lo avanzado de la enfermedad en el momento del diagnóstico: estadio «0/I» 72% de supervivencia a los 5 años, «II» 35%, «III» 18% «IV» 0% (p < 0,001). La actitud terapéutica adoptada, que lógicamente está muy relacionada con el estadio, también tuvo un valor muy significativo: esofaguectomía con intención curativa 54% de supervivencia a los 5 años, resección local (4 casos) 100%, esofaguectomía paliativa 0%, no resecados pero tratamiento oncológico con cualquier intención 8,5% y no resecados solo con medidas de soporte 0% (p < 0,001). En el 1.er periodo la supervivencia a los 5 años fue de 11% con una supervivencia media de 29 meses y en el 2.° periodo de 28% y 36 meses respectivamente (p < 0,001).
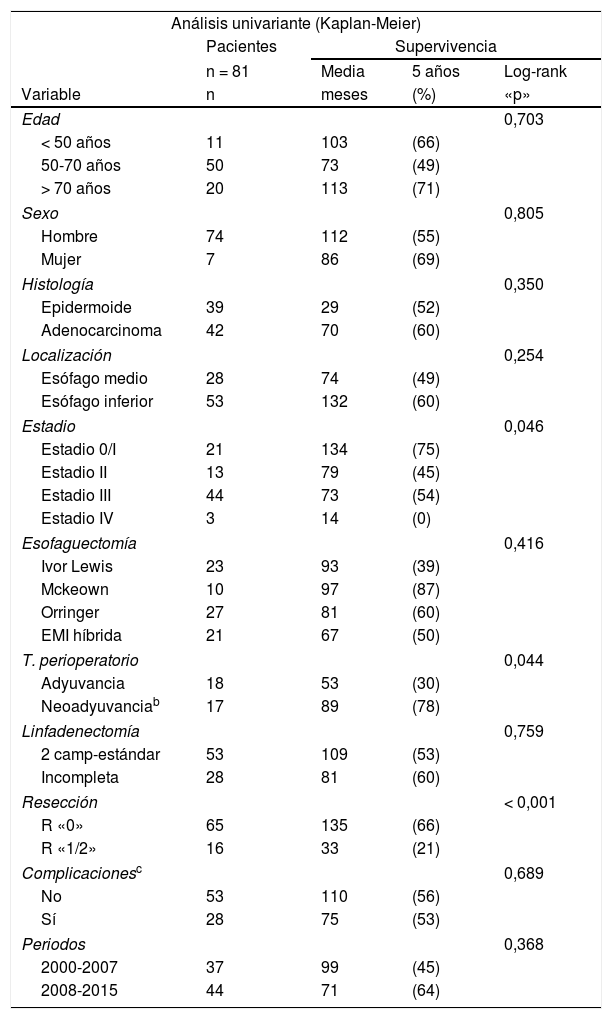
Al analizar los factores que pueden contribuir a una mayor supervivencia en los 81 pacientes con esofaguectomías estándar (tabla 4) encontramos que además del estadio (p = 0,046) tienen un valor significativo el tratamiento oncológico perioperatorio (p = 0,044) y sobre todo el tipo de resección practicada (p < 0,001), siendo este el único factor independiente en el análisis multivariante.
Esofaguectomías. Factores pronósticos de la supervivenciaa
| Análisis univariante (Kaplan-Meier) | ||||
| Pacientes | Supervivencia | |||
| n = 81 | Media | 5 años | Log-rank | |
| Variable | n | meses | (%) | «p» |
| Edad | 0,703 | |||
| < 50 años | 11 | 103 | (66) | |
| 50-70 años | 50 | 73 | (49) | |
| > 70 años | 20 | 113 | (71) | |
| Sexo | 0,805 | |||
| Hombre | 74 | 112 | (55) | |
| Mujer | 7 | 86 | (69) | |
| Histología | 0,350 | |||
| Epidermoide | 39 | 29 | (52) | |
| Adenocarcinoma | 42 | 70 | (60) | |
| Localización | 0,254 | |||
| Esófago medio | 28 | 74 | (49) | |
| Esófago inferior | 53 | 132 | (60) | |
| Estadio | 0,046 | |||
| Estadio 0/I | 21 | 134 | (75) | |
| Estadio II | 13 | 79 | (45) | |
| Estadio III | 44 | 73 | (54) | |
| Estadio IV | 3 | 14 | (0) | |
| Esofaguectomía | 0,416 | |||
| Ivor Lewis | 23 | 93 | (39) | |
| Mckeown | 10 | 97 | (87) | |
| Orringer | 27 | 81 | (60) | |
| EMI híbrida | 21 | 67 | (50) | |
| T. perioperatorio | 0,044 | |||
| Adyuvancia | 18 | 53 | (30) | |
| Neoadyuvanciab | 17 | 89 | (78) | |
| Linfadenectomía | 0,759 | |||
| 2 camp-estándar | 53 | 109 | (53) | |
| Incompleta | 28 | 81 | (60) | |
| Resección | < 0,001 | |||
| R «0» | 65 | 135 | (66) | |
| R «1/2» | 16 | 33 | (21) | |
| Complicacionesc | 0,689 | |||
| No | 53 | 110 | (56) | |
| Sí | 28 | 75 | (53) | |
| Periodos | 0,368 | |||
| 2000-2007 | 37 | 99 | (45) | |
| 2008-2015 | 44 | 71 | (64) | |
| Análisis multivariante (regresión de Cox) | ||||
|---|---|---|---|---|
| Variable | Coef. | E. típico | Hazard ratio | |
| predictora | de beta | de beta | «p» | (IC del 95%) |
| Resección completa vs. incompleta | ||||
| R «0» | 1 | |||
| R «1/2» | 1,989 | 0,414 | < 0,001 | 7,305 (3,246-16,442) |
Factores pronósticos relacionados con la probabilidad de morir por la evolución del cáncer de esófago.
La epidemiología del CE está cambiando en Occidente apreciándose un aumento de los ADC localizados en esófago distal y una disminución de los CEP localizados en esófago medio/alto1. Las causas no son bien conocidas, pero se relaciona con el aumento del reflujo gastroesofágico, el esófago de Barrett y la obesidad1,2. Nuestros datos confirman esta tendencia progresiva, llegando en el año 2015 a 44% de ADC y a 60% CE distales, pero sin poder asociarlo a un incremento del esófago de Barrett.
La técnica y el abordaje de las esofaguectomías están en continuo debate intentando disminuir las complicaciones de esta compleja cirugía. En nuestro país los grupos24,25 que, entre otros, han preconizado la utilización de la esofaguectomía mínimamente invasiva (EMI) han ilusionado a muchos cirujanos esófago-gástricos al demostrar que la toracoscopia es un abordaje posible y seguro. Actualmente hay una tendencia a favor de realizar una anastomosis intratorácica en los CE distales mediante la técnica de Ivor-Lewis con EMI9,26,27, evitando la anastomosis cervical, con la justificación de que no es necesario por criterios oncológicos resecar todo el esófago, disminuyéndose las lesiones del recurrente y las fístulas. Esto puede ser cierto, pero en nuestra opinión realizar la anastomosis mediastínica mediante EMI es complejo y no exento de complicaciones. La utilización del robot28 es una alternativa, aunque su disponibilidad y el tiempo operatorio necesario condicionan su empleo. Nosotros pensamos que lo fundamental en la cirugía del CE es evitar las graves complicaciones de la esofaguectomía, debidas en buena parte a la toracotomía, y que la toracoscopia tiene muchas ventajas, disminuyendo sobre todo las complicaciones respiratorias11,24 que son la principal causa de muerte en esta cirugía29,30. El tiempo abdominal por vía abierta (EMI híbrida) aporta mayor facilidad para realizar una gran maniobra de Kocher logrando una plastia gástrica larga que llegue sobrante al cuello, una piloroplastia y una yeyunostomía de alimentación. La anastomosis cervical mecánica triangularizada16 se ha confirmado como una técnica muy segura, al reducir al mínimo la manipulación de los extremos a anastomosar, que es la principal causa de fístulas por la precaria vascularización de la plastia, y proporciona una amplia superficie de boca anastomótica con pocas estenosis postoperatorias16,31.
Es necesario definir las complicaciones postoperatorias de manera objetiva y comparable para poder evaluar los resultados de la cirugía. La morbilidad de las esofaguectomías se describe habitualmente mediante las complicaciones mayores de la clasificación de Clavien-Dindo17,21. Siguiendo este criterio, de las 81 esofaguectomías analizadas 28 (35%) tuvieron complicaciones mayores y, de estos, 14 fallecieron (17%). Esta clasificación de las complicaciones, basada en el esfuerzo terapéutico necesario para tratarlas, se ha revelado útil y objetiva en estudios retrospectivos, pero no detalla todas las complicaciones graves que realmente se producen en las esofaguectomías, y por esto debe complementarse con la clasificación estandarizada de Low22,23. Según esta clasificación tuvimos 42 pacientes (52%) con complicaciones graves, de las cuales las más frecuentes fueron las respiratorias, 30 (37%) y las fístulas, 8 (10%). Algunas de estas, si no requieren medidas invasivas de tratamiento, pueden no ser reflejadas como complicaciones mayores en la clasificación de Clavien-Dindo que en realidad minimiza la morbilidad de una operación tan compleja como la esofaguectomía.
Al estudiar los factores que pueden influir en las complicaciones de las esofaguectomías encontramos que solo tienen un valor significativo independiente la localización (p = 0,049) y la comorbilidad (p < 0,001), expresada por el ICC + E. La indicación correcta de una esofaguectomía en un paciente con CE es fundamental ya que aunque la mortalidad se ha logrado disminuir la morbilidad permanece muy alta6,7,29. Por este motivo se han desarrollado múltiples escalas de valoración del riesgo quirúrgico siendo la de Charlson ajustada por la edad la más aceptada32. El ICC + E deberíamos tenerlo en cuenta como criterio objetivo al indicar una esofaguectomía18 y también son muy útiles las vías clínicas33 en el curso postoperatorio.
La técnica quirúrgica y el abordaje influyeron en las complicaciones, aunque no alcanzó un nivel significativo en nuestro trabajo (p = 0,160): de las 21 esofaguectomías toracoscópicas híbridas 4 (19%) tuvieron complicaciones mayores y solamente uno (5%) falleció frente a 35% de complicaciones del Ivor-Lewis y 60% del Mckeow. El tipo de anastomosis a nivel cervical también influyó en la aparición de fístulas y estenosis: de las 43 anastomosis mecánicas triangularizadas 2 (5%) presentaron fístulas y 4 (9%) tuvieron una estenosis postoperatoria frente a 33% y 11% respectivamente de las de componente manual.
La supervivencia global a los 5 años de los 318 pacientes fue del 19%, similar a lo publicado por otros autores2, y refleja la agresividad del CE que en la mayoría de los casos se detecta en estadios avanzados2,34. La edad, el tipo histológico y lógicamente el estadio y la actitud terapéutica que se deriva del mismo influyeron significativamente en la supervivencia, pero también el periodo analizado: 28% de supervivencia a 5 años en el 2.° periodo frente a 11% del 1.er periodo (p < 0,001). Es difícil demostrar qué cambios contribuyeron a esta mejoría, pero entre ellos se encuentran la valoración multidisciplinar y la mejor selección de los pacientes para el tratamiento multimodal.
Los factores que influyeron significativamente en la supervivencia de las esofaguectomías, además del estadio, fueron el tratamiento perioperatorio y el tipo de resección del tumor que se pudo realizar. Sorprende los excesivamente buenos resultados de la neoadyuvancia con 78% de supervivencia a los 5 años frente al 30% de la adyuvancia (p = 0,044). Creemos que estos resultados, aunque ciertos, no son válidos para comparar adyuvancia vs. neoadyuvancia debido a un sesgo en la selección ya que varios de los pacientes a los que inicialmente se les indicó neoadyuvancia progresaron antes de poder operarles y por este motivo no se les pudo incluir en este análisis de la supervivencia que comprende solo a las esofaguectomías. Además, el tiempo de seguimiento de los pacientes con neoadyuvancia es más corto que el de la adyuvancia, existiendo en el primer grupo varios pacientes con recidiva de la enfermedad que probablemente con mayor tiempo de observación habrían fallecido por CE. La resección completa (R0) del tumor alcanzó 66% de supervivencia a los 5 años frente al 21% de la incompleta (p < 0,001) y en el análisis multivariante fue el único factor protector independiente. El principal beneficio de la neoadyuvancia35 es conseguir una mayor tasa de resecciones completas y evitar esofaguectomías en pacientes que probablemente iban a progresar de todas formas.
Actualmente la verdadera cuestión para lograr mayor supervivencia en el CE no es la técnica quirúrgica, salvo para evitar morbimortalidad, sino el tratamiento multimodal36 del mismo. La quimioterapia37 con dianas terapéuticas específicas (HER2 y EGFR), la inmunoterapia y la radioterapia con protones38, cada vez más selectiva y con menor daño a los tejidos circundantes, son los campos de investigación con mayor futuro.
Las principales inconsistencias de nuestro estudio son debidas a que se trata de un análisis retrospectivo con grupos no aleatorios, analizándose largos periodos de tiempo con esquemas de tratamiento y tiempos de seguimientos diferentes, que como veíamos anteriormente pueden dar resultados no concluyentes. El grupo general de 318 pacientes con CE no es pequeño, pero sí el número de esofaguectomías analizadas (81) y más los grupos dentro de las mismas.
Como conclusión pensamos que este estudio, a pesar de sus limitaciones metodológicas, puede ser útil para confirmar que la valoración multidisciplinar de los pacientes con CE, con una mejor selección e indicación del tratamiento multimodal, y la introducción de nuevas técnicas quirúrgicas menos invasivas y más depuradas, como la toracoscopia y la anastomosis mecánica triangularizada, se traduce en una disminución de la morbimortalidad de las esofaguectomías y en un aumento significativo de la supervivencia de los pacientes con CE.
Autoría/colaboradores- -
Investigador principal: G.I. Moral Moral, diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo, revisión crítica y aprobación de la versión final.
- -
Investigadores secundarios: M. Viana Miguel, O. Vidal Doce, R. Martínez Castro, R. Parra López, A. Palomo Luquero, M.J. Cardo Díez, I. Sánchez Pedrique, J. Santos González, J. Zanfaño Palacios: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo, revisión crítica y aprobación de la versión final.
Los autores declaran no tener ningún conflicto de intereses.
- -
Al Dr. José Cordero Guevara, técnico de salud de la Gerencia de Atención Primaria de Burgos, por la ayuda en el análisis estadístico del estudio.
- -
A las Dras. Ana López Muñoz del Servicio de Oncología Médica y Eva Corrales García del Servicio de Oncología Radioterapéutica por su continuada participación en el Comité Multidisciplinar de Tumores Digestivos del Hospital Universitario de Burgos.
- -
Al Dr. Juan Luís Seco Gil, anterior Jefe de Servicio de Cirugía General, por su decisiva contribución a la formación y desarrollo de la Unidad de Cirugía Esófago-Gástrica y del Comité Multidisciplinar de Tumores Digestivos del Hospital Universitario de Burgos.
- -
A los Dres. José L. Elorza Orúe, José I. Asensio Gallego y Santiago Larburu Etxaniz del Hospital de Donostia de San Sebastián por las enseñanzas de la cirugía toracoscópica del cáncer de esófago.
Parte de la información de este artículo ha sido presentada en el XIX Congreso de la Asociación de Cirujanos de Castilla y León, realizado en Burgos el 8 y 9 de junio de 2017.