La aplicación de radioterapia intraoperatoria en el lecho tumoral tras la resección de un cáncer de páncreas ha demostrado ser beneficiosa en el control local de la enfermedad. El objetivo de este estudio fue valorar los resultados iniciales obtenidos tras la aplicación de una nueva modalidad de radioterapia intraoperatoria (Intrabeam®) en términos de viabilidad, seguridad y resultados a corto plazo.
MétodosSe estudiaron 5 pacientes sometidos a duodenopancreatectomía cefálica por cáncer de páncreas resecable, en los que se aplicó intraoperatoriamente un boost de radioterapia (5Gy) en el lecho tumoral mediante la utilización del dispositivo portátil Intrabeam®, fuente puntual de rayos X de baja energía. Se analizaron las complicaciones, estancia y mortalidad postoperatorias, recidivas y superviviencia a corto plazo.
ResultadosLa edad media fue de 68 años. Todos los pacientes presentaban un estadio tumoral T3 y uno de ellos N1. En 3 pacientes se realizó una resección R0 y en 2 casos resultó ser una resección R1. La mortalidad peroperatoria fue del 0%. Solo se presentaron como complicaciones un retraso en el vaciamiento gástrico y una hemorragia postoperatoria. No hubo fístulas pancreáticas. Durante el seguimiento (media: 11,2 meses) se constató una recidiva en el paciente en el que se había practicado una resección R1.
ConclusionesLa aplicación de radioterapia con el dispositivo Intrabeam® en pacientes seleccionados no ha supuesto un aumento de la morbimortalidad peroperatoria, mostrándose como un procedimiento seguro en el tratamiento del cáncer resecable.
The application of intraoperative radiation therapy to the tumor bed after resection of pancreatic cancer has been shown to be beneficial in the local control of the disease. The objective of this study was to evaluate the preliminary outcomes after the application of a single intraoperative dose to the tumor bed with a new intraoperative radiotherapy device (Intrabeam®) in terms of viability, safety and short-term results.
MethodsWe studied 5 patients who underwent pancreaticoduodenectomy for resectable pancreatic cancer in which a radiotherapy boost (5Gy) was intraoperatively applied to the tumoral bed using the portable Intrabeam® device, a low-energy point-source X-ray. Postoperative complications, hospital stay and mortality, recurrences and short-term survival were analyzed.
ResultsMean patient age was 68 years. All patients had a T3-stage tumor and one of them N1. In 3 patients, R0 resection was performed, while R1 resection was conducted in 2. Perioperative mortality was 0%. The only complications included delayed gastric emptying and postoperative hemorrhage. There were no pancreatic fistulas. During follow-up (mean: 11.2 months), there was a relapse in the patient who had undergone R1 resection.
ConclusionsThe application of radiotherapy with the Intrabeam® device in selected patients has not resulted in increased perioperative morbidity or mortality; therefore, this is a safe procedure for the treatment of resectable cancer.
La incidencia del cáncer de páncreas es similar a su mortalidad, siendo responsable de 331.000 muertes al año, constituyendo la séptima causa de muerte por cáncer en ambos sexos1. Esta situación viene condicionada porque el diagnóstico se suele hacer en fase tardía y por las características biológicas de este tipo de tumor, que determinan esta evolución tan desfavorable2. Al diagnóstico el 52% de pacientes tienen ya enfermedad a distancia, y en un 26% tienen extensión locorregional. Por estos motivos tan solo el 20% de pacientes resultan resecables3.
Además de la quimiorradioterapia neoadyuvante y/o adyuvante3 se ha utilizado la radioterapia intraoperatoria del lecho tumoral (IORT), que ha demostrado un beneficio en el control local de la enfermedad y de la calidad de vida de los pacientes2,4–7. La mayor parte de estos estudios son retrospectivos, salvo el de Klinkenbilj, que realiza un trabajo prospectivo no aleatorizado4. En la mayoría de las series publicadas la IORT ha sido administrada con aceleradores lineales de electrones, que ha requerido el traslado del paciente desde el quirófano a la sala de radioterapia durante el acto quirúrgico, aunque ya se dispone en el mercado de dispositivos portátiles para aplicar el tratamiento en quirófano8. El desarrollo de equipos de radioterapia portátiles es un hecho de fundamental trascendencia, que ha permitido la generalización del uso de la IORT a muchos centros.
El uso de la terapia de rayos X de baja energía tipo targeted intraoperative radiotherapy o radioterapia intraoperatoria dirigida, mediante el dispositivo portátil Intrabeam®, se ha revelado como un excelente método para el tratamiento del cáncer de mama9–11 y de otras localizaciones, incluidas las del ámbito digestivo12. Sin embargo, su uso intraoperatorio para el tratamiento del cáncer de páncreas como complemento a la cirugía ha sido poco documentado.
El objetivo de este estudio fue presentar nuestra experiencia inicial de IORT con Intrabeam® para el tratamiento del cáncer de páncreas resecable en términos de viabilidad, seguridad y resultados a corto plazo.
MétodosSe trata de un estudio observacional con recogida prospectiva de datos. Entre junio de 2016 y mayo de 2017 8 pacientes con cáncer de cabeza de páncreas potencialmente resecable13 fueron remitidos al servicio de cirugía para tratamiento. De estos, 5 fueron seleccionados para el protocolo de cirugía e IORT, tras ser presentados en el comité multidisciplinar. En los 3 casos restantes no se pudo aplicar este tipo de terapia por falta de disponibilidad del dispositivo.
El estudio fue aprobado por el Comité de Ética e Investigación Clínica del hospital (Código AEMPS: Estudio R-kilovolt; Código CEIC: 150063). Todos los pacientes firmaron el consentimiento informado.
Criterios de inclusión1) Pacientes de 18 años de edad o más, de ambos sexos; 2) buen estado funcional (KPS≥70%), con una esperanza de vida mayor de 6 meses; 3) carcinoma de páncreas potencialmente resecable y sin metástasis a distancia, con confirmación histológica pre o intraoperatoria (si no se obtiene el diagnóstico de adenocarcinoma no se aplica el tratamiento); y 4) lesión pancreática unifocal, con diámetro inferior a 7cm.
Criterios de exclusión1) Enfermedad metastásica; 2) insuficiencia hepática (AST y/o ALT>2 veces de los valores normales establecidos por el rango de referencia del laboratorio); insuficiencia renal (creatinina sérica superior a 2mg/dl) y/o diátesis hemorrágica; 3) función inadecuada de la médula ósea (neutrófilos<2.000/l, plaquetas<100.000/l); 4) embarazo; 5) tumores malignos previos; 6) tumores papilares intraductales malignizados; 7) pacientes en los que no se pudo obtener la positividad de la muestra pre o intraoperatoriamente; y 8) incapacidad de cumplir con el tratamiento del estudio y/o seguimiento.
ProcedimientoTodos los pacientes fueron evaluados mediante una tomografía computarizada (TAC) de estadificación, resonancia magnética (RMN) y/o ecografía endoscópica. En todos los pacientes se pudo confirmar histológicamente la existencia de la neoplasia durante el acto operatorio. Algunos pacientes fueron sometidos a drenaje de la vía biliar de forma preoperatoria por presentar bilirrubina mayor de 15mg/dl. Los pacientes candidatos fueron remitidos al Servicio de Oncología Radioterápica, para valoración y firma de consentimiento informado.
En el día de la intervención el protocolo se desarrolló como sigue:
- 1.
En el antequirófano el servicio de física médica efectúa las calibraciones necesarias para asegurar la estabilidad del haz de radiación del acelerador.
- 2.
Realización de una laparotomía exploradora y, tras la confirmación de la resecabilidad del tumor, realización de duodenopancreatectomía cefálica con o sin preservación pilórica.
- 3.
Confirmación intraoperatoria de malignidad y comprobación patológica de los márgenes de la pieza quirúrgica.
- 4.
Se prepara el soporte quirúrgico de la fuente de rayos X con una funda estéril de cobertura y se ajusta el aplicador estéril a la fuente que se encuentra en la terminal del soporte. Se elige el diámetro del aplicador en función del lecho quirúrgico que se pretende irradiar.
- 5.
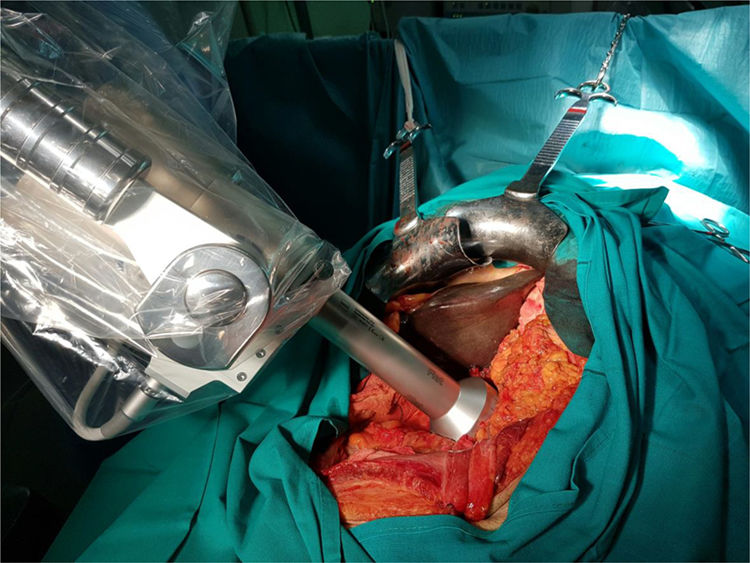
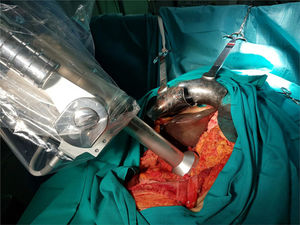
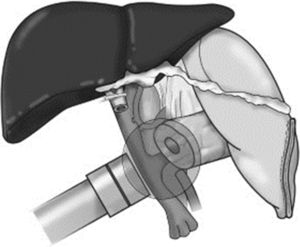
Movilización del soporte y colocación del aplicador plano a 1cm del lecho quirúrgico, mediante el brazo articulado (fig. 1).
- 6.
Colocación de compresas húmedas en el resto del campo quirúrgico.
- 7.
Se colocan láminas de wolframio de radioprotección en el perímetro del dispositivo, aunque con el aplicador plano la dispersión de la radiación se sabe que es mínima. Estas láminas bloquean el 95% de la radiación. A pesar de ello, en nuestro centro se aplican medidas de radioprotección del personal que incluyen:
- a.
Control de acceso al quirófano durante el tratamiento.
- b.
Evacuación del personal del quirófano.
- c.
Control de la consola del acelerador y control anestésico desde el antequirófano contiguo.
- d.
Comprobación de la señalización de riesgo radiológico y de que las puertas de acceso al quirófano están bloqueadas.
- 8.
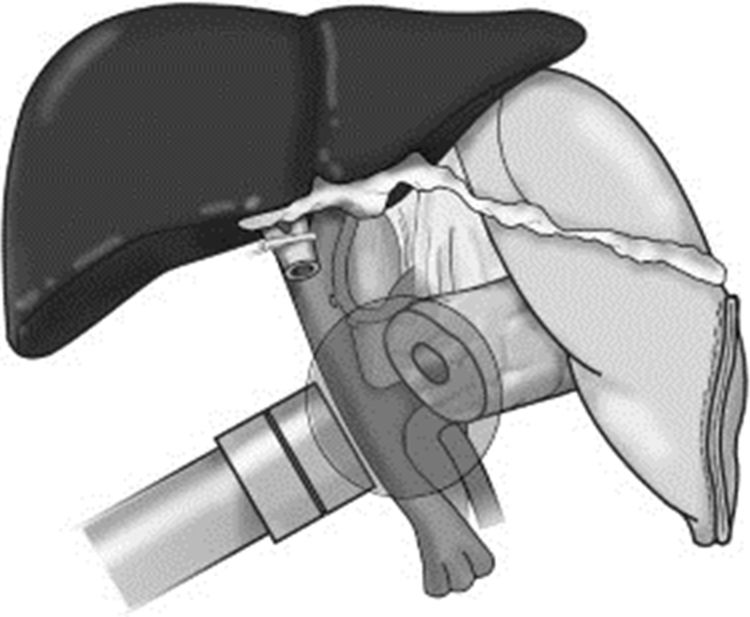
Inicio de la radioterapia. Se administra mediante el dispositivo Intrabeam® (Carl Zeiss Meditec, Oberkochen, Alemania), que proporciona una fuente puntual de rayos X de baja energía (máximo 50kV) en la punta de un tubo de diámetro variable que se encuentra en el centro de un aplicador plano de diámetro variable (de 2,5 a 6cm de diámetro). El objetivo es aplicar una dosis de radioterapia como boost en el lecho quirúrgico tras la resección, en la región más próxima al tumor extirpado, considerada de mayor riesgo de recidiva, con la intención de disminuir las probabilidades de recidiva local. El tiempo de aplicación varía en función del diámetro del aplicador, de la superficie y del paciente. El tiempo ha oscilado entre 27 y 42minutos, calculado en función del diámetro del aplicador y de la actividad de la fuente. La dosis prescrita en la superficie del aplicador es de 20Gy, que se corresponde con una dosis de 5Gy a 1cm del mismo (fig. 2).
- 9.
Retirada del dispositivo, revisión de hemostasia y reconstrucción tipo Child.
En todos los pacientes se procedió a administrar quimioterapia con gemcitabina y radioterapia externa adyuvantes con radioterapia de intensidad modulada con control de imagen guiada (45Gy, 1,8Gy/día) de acuerdo con el protocolo vigente en el centro. Se administró tratamiento adyuvante en los casos indicados según las guías del National Comprehensive Cancer Network. Como neoadyuvancia en nuestro centro se utilizan esquemas basados en la combinación de gemcitabina-paclitaxel o FOLFIRINOX. Todos los pacientes han sido seguidos en consultas externas y sometidos a revisiones trimestrales con TAC toracoabdominal y analítica con marcadores tumorales.
Análisis estadísticoFueron recogidos prospectivamente los siguientes datos: edad, sexo, drenaje preoperatorio, complicaciones postoperatorias estadificadas según las definiciones del International Study Group of Pancreatic Surgery14–16 y la clasificación de Clavien-Dindo17, mortalidad operatoria, estancia, reingresos, histología, tipo de resección (R0, R1) siguiendo los criterios establecidos por la International Union Against Cancer18,19, características de la IORT, tratamientos complementarios y recidiva precoz.
Las variables cualitativas se expresaron como número y porcentaje, y las numéricas mediante la media±desviación estándar. Dado el pequeño número de pacientes de la muestra estudiada no se realizó estudio estadístico.
ResultadosLas características y resultados se recogen en la tabla 1. La edad media fue de 67,8 años (±10,3), 2 varones y 3 mujeres. Fue preciso drenaje preoperatorio en 4 pacientes (80%) y resección vascular portal parcial en 3 casos (60%) por sospecha de invasión vascular, no precisándose la utilización de prótesis o injertos vasculares, solo pudiéndose confirmar en el estudio histológico en uno de ellos. La estancia media fue de 10,4 días (±6,0). Se presentaron complicaciones en 2 pacientes (40%), un retraso en el vaciamiento gástrico y una hemorragia postoperatoria extraluminal grado B16, que fue tratada mediante transfusión. No hubo fístulas pancreáticas. En 3 pacientes no se presentó ninguna complicación. La mortalidad peroperatoria fue del 0%. No se evidenciaron complicaciones secundarias al uso del IORT. En 2 casos, tras el estudio histológico definitivo, se constató resección R1 (afectación microscópica del margen). Según la clasificación TNM todos los tumores resultaron adenocarcinomas ductales y se estadificaron como T3, siendo 3 de ellos N1. Se objetivó invasión perineural en todos los casos. Uno de ellos era bien diferenciado (G1), 2 fueron moderadamente diferenciados (G2) y los otros 2 pobremente diferenciados (G3). Se administró adyuvancia con gemcitabina y RT a todos los pacientes. En una paciente se objetivó una toxicidad gastrointestinal grado 2, objetivándose náuseas y diarrea.
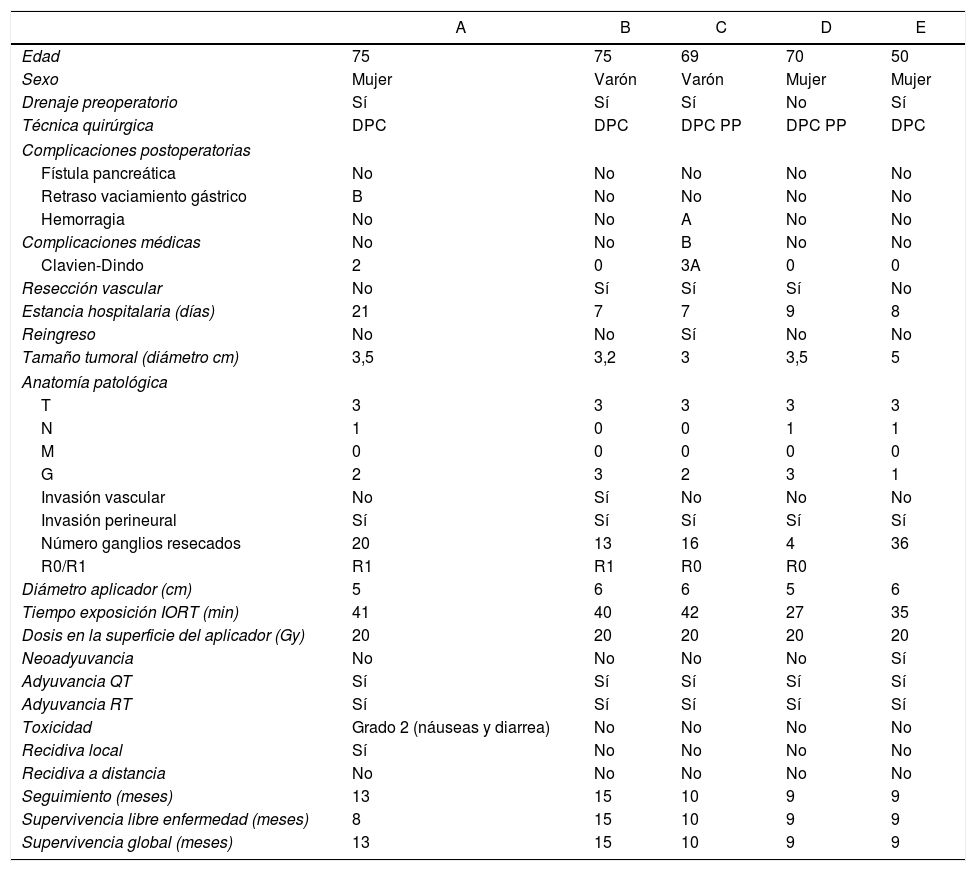
Características de los pacientes y resultados de los pacientes sometidos a cirugía radical e IORT con Intrabeam por cáncer de cabeza de páncreas resecable
| A | B | C | D | E | |
|---|---|---|---|---|---|
| Edad | 75 | 75 | 69 | 70 | 50 |
| Sexo | Mujer | Varón | Varón | Mujer | Mujer |
| Drenaje preoperatorio | Sí | Sí | Sí | No | Sí |
| Técnica quirúrgica | DPC | DPC | DPC PP | DPC PP | DPC |
| Complicaciones postoperatorias | |||||
| Fístula pancreática | No | No | No | No | No |
| Retraso vaciamiento gástrico | B | No | No | No | No |
| Hemorragia | No | No | A | No | No |
| Complicaciones médicas | No | No | B | No | No |
| Clavien-Dindo | 2 | 0 | 3A | 0 | 0 |
| Resección vascular | No | Sí | Sí | Sí | No |
| Estancia hospitalaria (días) | 21 | 7 | 7 | 9 | 8 |
| Reingreso | No | No | Sí | No | No |
| Tamaño tumoral (diámetro cm) | 3,5 | 3,2 | 3 | 3,5 | 5 |
| Anatomía patológica | |||||
| T | 3 | 3 | 3 | 3 | 3 |
| N | 1 | 0 | 0 | 1 | 1 |
| M | 0 | 0 | 0 | 0 | 0 |
| G | 2 | 3 | 2 | 3 | 1 |
| Invasión vascular | No | Sí | No | No | No |
| Invasión perineural | Sí | Sí | Sí | Sí | Sí |
| Número ganglios resecados | 20 | 13 | 16 | 4 | 36 |
| R0/R1 | R1 | R1 | R0 | R0 | |
| Diámetro aplicador (cm) | 5 | 6 | 6 | 5 | 6 |
| Tiempo exposición IORT (min) | 41 | 40 | 42 | 27 | 35 |
| Dosis en la superficie del aplicador (Gy) | 20 | 20 | 20 | 20 | 20 |
| Neoadyuvancia | No | No | No | No | Sí |
| Adyuvancia QT | Sí | Sí | Sí | Sí | Sí |
| Adyuvancia RT | Sí | Sí | Sí | Sí | Sí |
| Toxicidad | Grado 2 (náuseas y diarrea) | No | No | No | No |
| Recidiva local | Sí | No | No | No | No |
| Recidiva a distancia | No | No | No | No | No |
| Seguimiento (meses) | 13 | 15 | 10 | 9 | 9 |
| Supervivencia libre enfermedad (meses) | 8 | 15 | 10 | 9 | 9 |
| Supervivencia global (meses) | 13 | 15 | 10 | 9 | 9 |
DPC: duodenopancreatectomía cefálica; DPC PP: duodenopancreatectomía con preservación pilórica
El seguimiento medio ha sido de 11,2 meses (±2,7). Durante este escaso periodo de seguimiento recidivó un paciente cuya histología definitiva había resultado R1.
DiscusiónLa cirugía se considera la única opción terapéutica con capacidad curativa del cáncer de páncreas. No obstante, la recurrencia locorregional y/o metastásica aparece entre los 9 y 15 meses del diagnóstico, y la expectativa de vida es de entre 12 y 15 meses sin tratamiento adyuvante2.
La presencia de enfermedad subclínica locorregional y a distancia es la responsable de la limitada supervivencia de estos pacientes resecables. Aunque teóricamente la obtención de una resección R0 implicaría una supervivencia mayor que los pacientes con enfermedad residual tras la resección, el control de la enfermedad a largo plazo aún no se ha conseguido20.
A día de hoy el uso estandarizado de tratamientos locorregionales, como la radioterapia externa, o sistémicos como la quimioterapia han supuesto solamente una modesta mejora de los resultados clínicos20,21.
Estos modestos resultados vienen dados por 2 razones fundamentales. La primera, una limitada eficacia de los tratamientos sistémicos disponibles hasta ahora, que hacen difícil el control de la enfermedad subclínica a distancia, a pesar del uso de nuevas combinaciones (FOLFIRINOX y nab-paclitaxel) más allá de la gemcitabina22,23.
La segunda razón es la dificultad técnica que existe para administrar altas dosis de radioterapia adyuvante cuando se usa radioterapia externa. Si bien las nuevas técnicas de radioterapia de intensidad modulada con control de imagen guiada24 han mejorado la distribución y precisión de la dosis de radioterapia a administrar, la existencia de órganos sanos con una baja tolerancia a la radiación, en el territorio adyacente al lecho quirúrgico, no nos permiten administrar toda la dosis de radioterapia que sería necesaria para mejorar los resultados obtenidos hasta ahora.
Quizás la única forma de la que disponemos en la actualidad de administrar una alta dosis de radiación en el lecho, con extrema precisión en la localización del mismo, sin pérdida de tiempo y en el mismo acto quirúrgico, sería la IORT. Tiene la ventaja de modificar el microambiente del lecho quirúrgico limitando el crecimiento de las células tumorales residuales25. Definida como la aplicación de una sola fracción de alta dosis de irradiación durante un acto quirúrgico sobre el lecho tumoral, puede permitir el disminuir la dosis de radiación a los tejidos normales circundantes, que son apartados del campo de irradiación durante el procedimiento26,27. El IORT para el cáncer de páncreas se utilizaría, pues, como un boost antes de la EBRT adyuvante. Podríamos considerar que, debido a la caída de dosis desde la salida del aplicador hasta la llegada al lecho quirúrgico, la dosis utilizada podría ser insuficiente, pero es la dosis equivalente a la que se aplica en páncreas con terapia de electrones. No existe certeza de que dosis mayores sean seguras en relación con la morbimortalidad peroperatoria. Tras demostrar su seguridad en estudios más amplios, podría plantearse aumentarla.
Todos los estudios publicados hasta ahora26–34 han conseguido demostrar la utilidad de la IORT en el control local de la enfermedad, siendo el estudio de Sindelair34 el único estudio prospectivo aleatorizado que ha demostrado un control local. Sin embargo, se ha producido un estancamiento de esta técnica, probablemente inducida por la falta de mejora en la supervivencia, aunque con las nuevas estrategias quimioterápicas es posible que la IORT mejore esta.
La aplicación de la IORT con Intrabeam® ofrecería varias ventajas con respecto a las otras técnicas. La dosis de radiación se aplica en la extensión de lecho tumoral necesaria en cada caso, con una mínima dispersión de la radiación con el aplicador plano, siendo la precisión de la aplicación en el lecho máxima. La dosis de radiación se puede modificar y el tiempo de exposición no aumenta de forma significativa el tiempo operatorio. Desde el comienzo de la aplicación en nuestro centro de esta terapia en el cáncer de mama se han ido mejorando los problemas técnicos que fueron surgiendo para implementar esta técnica11, y hoy día la consideramos una técnica segura y reproducible para el tratamiento de tumores resecables de páncreas.
Este estudio está limitado por el escaso número de pacientes y el escaso seguimiento, ya que para valorar los resultados de este nuevo enfoque es necesario esperar a los resultados obtenidos a largo plazo y su inclusión en estudios multicéntricos con grupo control.
No obstante, a pesar de las limitaciones comentadas, han quedado demostradas la seguridad, validez y fiabilidad del tratamiento mediante cirugía radical combinada con IORT utilizando un dispositivo portátil de rayos X de baja energía tipo targeted intraoperative radiotherapy. No se ha demostrado la existencia de complicaciones inherentes a la aplicación de la técnica.
AutoríaAida Cristina Rahy-Martín: diseño del estudio, recogida de datos, redacción del artículo, revisión crítica y aprobación de la versión final.
Francisco Cruz-Benavides: diseño del estudio, revisión crítica y aprobación de la versión final.
Mar Sánchez-Lauro: revisión crítica y aprobación de la versión final.
Álvaro Rodríguez-Méndez: revisión crítica y aprobación de la versión final.
Íñigo San Miguel: diseño del estudio, revisión crítica y aprobación de la versión final.
Pedro Lara: diseño del estudio, revisión crítica y aprobación de la versión final.
Joaquín Marchena-Gómez: diseño del estudio, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información contenida en este artículo ha sido presentada en los siguientes congresos: XVII Congreso de la Sociedad Canaria de Cirugía. Las Palmas de Gran Canaria, 24-26 de noviembre de 2016 y XIV Reunión Nacional de la Sección de Cirugía Mínimamente Invasiva e Innovación Tecnológica de la Asociación Española de Cirujanos. Toledo, 11-13 mayo de 2017.