Actualmente la imagen potenciada en difusión (diffusion weighted image [DWI]) en resonancia magnética (RM) constituye una importante herramienta para la detección y caracterización de lesiones hepáticas, así como para la monitorización y evaluación de la respuesta al tratamiento de la enfermedad tumoral. Por otro lado se está estudiando también la utilidad de esta técnica para el estudio de la enfermedad hepática difusa.
Entre las ventajas adicionales de la DWI-RM, destaca la ausencia de emisión de radiaciones ionizantes y la ausencia de necesidad de utilizar contraste paramagnético, por lo que se puede realizar el estudio en pacientes con insuficiencia renal. Otra ventaja es la corta duración de la secuencia de difusión por lo que apenas incrementa el tiempo de exploración de la RM abdominal.
Por lo tanto, es importante que el médico conozca esta técnica diagnóstica, ya que la DWI es una secuencia que debería ser incluida de forma rutinaria en el protocolo de estudio de la RM hepática.
Diffusion weighted imaging (DWI) in magnetic resonance imaging (MRI) is currently an important tool for detecting and characterising hepatic lesions, as well as for monitoring and evaluating the response to the treatment of the tumour disease. The use of this technique is also being assessed for the study of diffuse liver disease.
Among the additional advantages of DWI-MRI, is the absence of emission of ionising radiation and not having to use paramagnetic contrasts, which means it can be used in the study of patients with renal failure. Another advantage is the short duration of the diffusion sequence, which means that the examination time in abdominal MRI is scarcely increased.
Therefore, it is important that the physician is aware of this diagnostic technique, since DWI is a sequence that should be routinely included in the liver MRI study protocol.
La imagen potenciada en difusión en resonancia magnética (DWI-RM) es una técnica que empezó a desarrollarse en un principio para el diagnóstico de los infartos agudos cerebrales. Stejskal y Tanner fueron los primeros en aplicar la propiedad de la difusión a las secuencias de RM en 19651, Le Bihan et al. desarrollaron en 1986 la primera imagen de difusión en una RM cerebral2 y Warach et al. fueron los primeros en aplicar esta técnica para el estudio del infarto cerebral en 19923.
Sin embargo la aplicación de esta técnica para el estudio de la enfermedad abdominal es relativamente reciente, ya que inicialmente no fue posible debido a la baja relación señal ruido y a la poca resolución espacial de la imagen. La evolución técnica con secuencias rápidas con supresión grasa ha conseguido mejorar considerablemente la calidad de la imagen.
Hay que reseñar que una de las limitaciones clásicas de las DWI en el abdomen ha sido la degradación de la imagen por los movimientos respiratorios, por lo que la posibilidad de realizar secuencias sincronizadas con la respiración ha permitido obtener imágenes de mayor calidad y con mayor resolución. También la adquisición de imágenes con sincronización cardiaca puede resultar útil cuando se va a estudiar el lóbulo hepático izquierdo para evitar artefactos debidos al movimiento cardiaco.
Estos importantes avances tecnológicos de la RM han permitido que se pueda aplicar la DWI-RM en el estudio de la enfermedad abdominal, particularmente para el diagnóstico de lesiones hepáticas4.
Principios físicos de la difusiónLa difusión es la propiedad física que describe el movimiento browniano o movimiento aleatorio de las moléculas de agua en un tejido, como respuesta a una energía térmica5. El cuerpo humano está compuesto en un 75% por agua, que se localiza en tres compartimentos, el intravascular, el intracelular y el extracelular. La secuencia de difusión es sensible a la detección del movimiento de las moléculas de agua en estos compartimentos a un nivel microscópico, pero es el movimiento de las moléculas de agua en el espacio extracelular el que más interesa en el estudio de las lesiones tumorales.
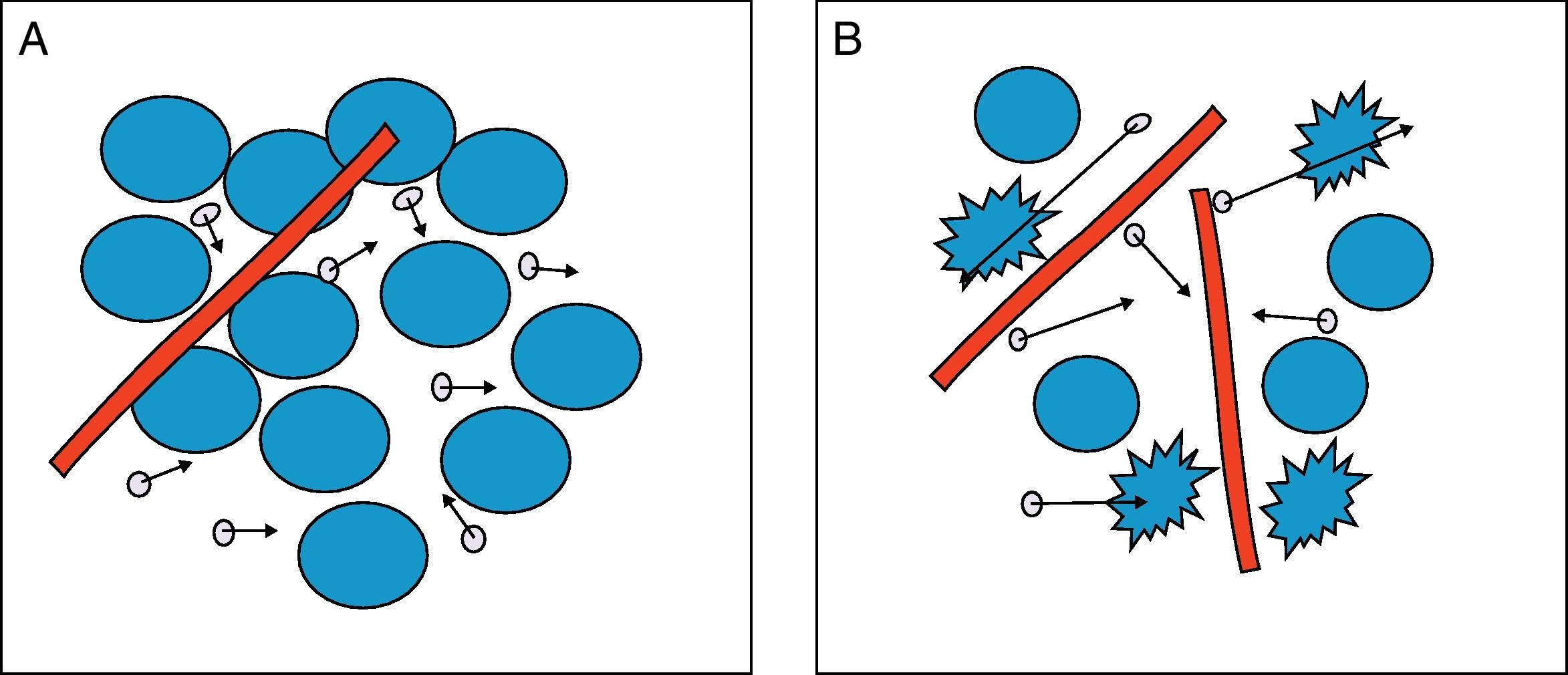
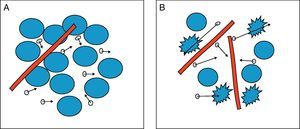
El mayor o menor grado de movimiento de las moléculas de agua en el medio extracelular va a estar condicionado, fundamentalmente, por la cantidad de células (densidad celular), la integridad de membranas y la viscosidad del tejido. Así, en los tejidos con poca celularidad como los tumores benignos, o con membranas rotas, como los tumores con necrosis, las moléculas de agua se mueven fácilmente, es lo que se conoce como libre difusión; por el contrario en tejidos con gran celularidad, como los tumores malignos, el movimiento de las moléculas de agua está limitado y por tanto la difusión va a estar restringida. De igual forma, en los abscesos al estar formados por células inflamatorias, proteínas, células desbridadas, bacterias y pus de alta viscosidad, la difusión también está restringida, además las moléculas del agua se unen a los aminoácidos de la superficie de las macromoléculas, restringiendo aún más su movimiento. En la figura 1 se representa la mayor o menor movilidad de las moléculas de agua dependiendo de la celularidad del tejido y de la integridad de las membranas.
Difusión de las moléculas de agua. A) Difusión restringida en el espacio extracelular por la celularidad y la integridad de las membranas. Las moléculas de agua (círculos con flechas) se mueven con dificultad. B) Difusión libre en el espacio extracelular por la poca celularidad y existencia de membranas rotas. Las moléculas de agua se mueven libremente entra las células y atravesando las células con membranas rotas.
Las secuencias de difusión que se utilizan son secuencias potenciadas en T2 modificadas, a las que se les aplica un gradiente bipolar de difusión. En las DWI-RM los tejidos que restringen la difusión aparecen con una señal aumentada o hiperintensos y aquellos donde la difusión está facilitada se ven con una señal más baja o hipointensos. Es decir, el grado de movilidad de las moléculas de agua es proporcional al grado de atenuación de la señal. Por lo tanto, con la secuencia de la difusión se va a conseguir una información única sobre la celularidad de un tejido y la integridad de las membranas celulares6.
Pero la intensidad de la señal que se obtiene de los diferentes tejidos no solo va a depender del movimiento de las moléculas de agua, sino también esta señal varía al modificar la amplitud, duración o intervalo del gradiente aplicado7. El parámetro conocido como valor b es proporcional a esos tres factores, especialmente al cuadrado de la amplitud del gradiente, por lo que al modificar el parámetro b, la sensibilidad de la difusión también varía y la señal se modifica.
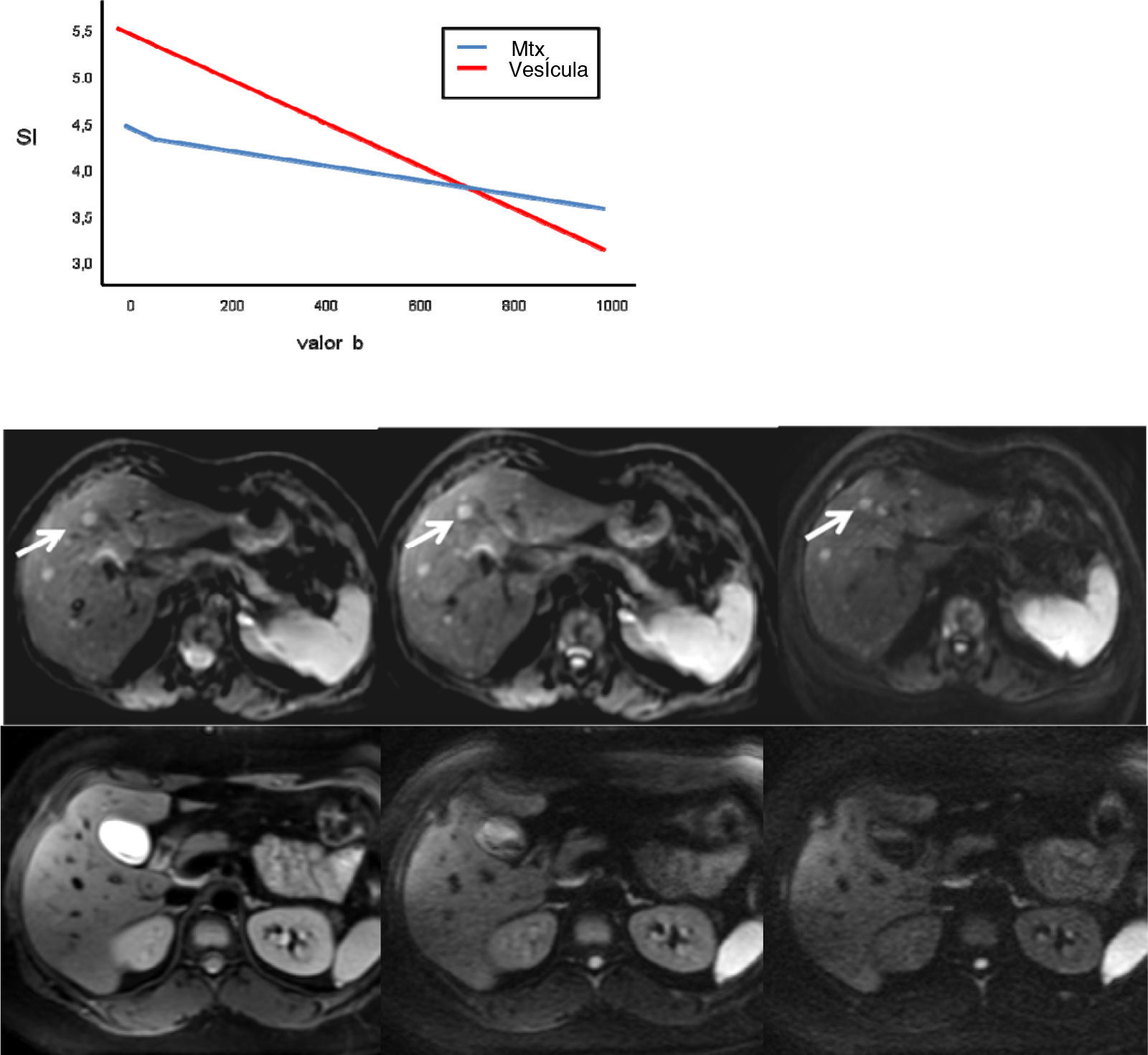
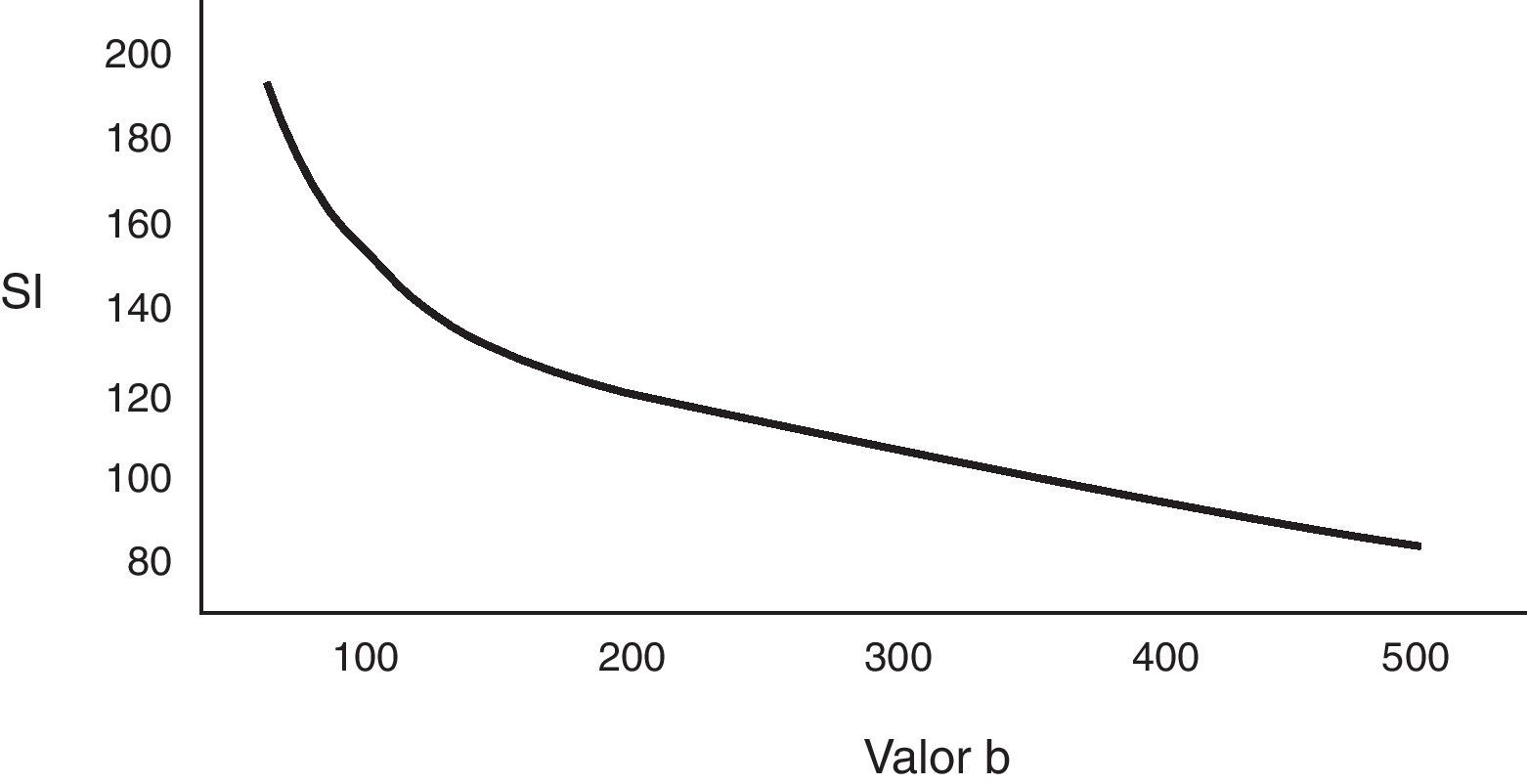
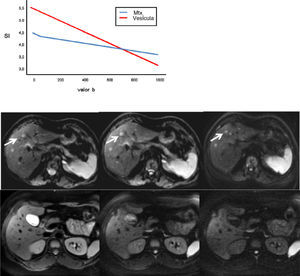
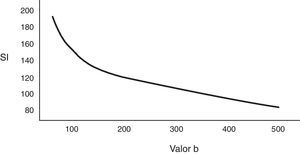
El valor b se mide en seg/mm2, a medida que aumenta este valor, la intensidad de la señal de las lesiones disminuye. Esta pérdida de señal será mayor en aquellas lesiones donde la difusión esté facilitada; sin embargo las lesiones que restringen la difusión perderán menos señal. En la figura 2 se representa la pérdida de señal de la vesícula biliar y de una metástasis hepática en varias DWI con distintos valores b y la gráfica de esta pérdida de señal, al aumentar los valores b, la vesícula biliar pierde mucha señal mientras que la metástasis poca, por lo tanto, la pendiente de la gráfica de la vesícula biliar es muy pronunciada y la de la metástasis, no. Esta pendiente puede ser calculada mediante una operación matemática obteniendo un valor numérico conocido como coeficiente de difusión aparente (aparent diffussion coeficient [ADC])8.
Pérdida de la intensidad de la señal de una metástasis hepática y de la vesícula biliar al aumentar el valor b. En la gráfica se representa esa pérdida de la intensidad de la señal. La vesícula biliar pierde mucha señal y la metástasis, poca. En las imágenes superiores se señala en una metástasis hepática de un cáncer de mama cómo casi no pierde señal en las imágenes de difusión al aumentar los valores b (b=0, b=50, b=600 seg/mm2). En las imágenes inferiores la vesícula biliar pierde mucha señal en las imágenes de difusión al aumentar los valores b (b=0, b=600, b=1.000 seg/mm2).
SI: intensidad de la señal.
El ADC proporciona una medida cuantitativa, independiente del campo magnético y mide el desplazamiento microscópico de las moléculas de agua en 10−3 mm2/seg, reflejando la capacidad de difusión específica de un tejido. Tejidos muy celulares, con difusión restringida, muestran valores de ADC bajos, porque pierden poca señal al aumentar el valor b, mientras que zonas con menor densidad celular, que pierden más señal al aumentar el valor b, presentan valores de ADC más altos.
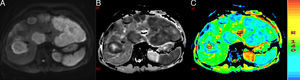
El ADC puede ser calculado para cada píxel de la imagen obteniendo un mapa paramétrico (mapa de ADC) en blanco y negro o mapa de colores, las áreas que restringen la difusión aparecen hipointensas o en tonos azules y las que tienen difusión libre, hiperintensas o en tonos rojos. Es posible determinar el valor del ADC de una región determinada mediante la selección de una región de interés (ROI). En la figura 3 podemos ver una DWI y los mapas de ADC en blanco y negro y de colores de un hígado con metástasis, donde se han colocado dos ROIS en una metástasis, uno en la zona central necrótica y otro en la zona sólida periférica.
A) Imagen potenciada en difusión. B y C) Mapas de ADC. Hígado con metástasis de cáncer de colon. Se estudia una de ellas con centro necrótico, el cual se ve hipointenso en DWI e hiperintenso o rojo en los mapas de ADC con un valor de 2,34×10−3 mm2/s. La porción sólida periférica restringe la difusión, es hiperintensa en DWI e hipointensa y azul en los mapas de ADC con un valor de 1,09×10−3 mm2/s.
Por lo tanto con la DWI-RM se obtiene dos tipos de información, una información cualitativa y una información cuantitativa:
Información cualitativaLas imágenes con valores individuales de b proporcionan información cualitativa de la lesión, basada en la intensidad de la señal; por ejemplo, en tumores sólidos hipercelulares, donde la difusión está restringida, la imagen aparece hiperintensa y por el contrario, en lesiones donde la difusión es libre, la imagen aparece hipointensa.
Información cuantitativaSe adquieren imágenes utilizando dos o más valores b, uno siempre es 0 y el otro menor de 1.000 seg/mm2, para valorar la pérdida de señal que está relacionada con la capacidad de difusión. En el mapa de ADC podemos calcular la capacidad de difusión de áreas concretas de un tejido. Si la difusión está restringida, el valor de ADC es bajo y si la difusión está facilitada, el valor de ADC es alto.
Uno de los problemas del análisis cualitativo es que la señal observada depende no solo de la difusión del agua sino también del tiempo de relajación T2. Cuando los valores b son bajos la imagen tiene una mayor potenciación en T2 y cuando se utilizan valores b altos la secuencia está más potenciada en difusión. Sin embargo las lesiones con alto componente líquido (como los quistes o el líquido en la vesícula) que tienen un tiempo de relajación muy largo en T2, pueden aparecer hiperintensas en las imágenes de difusión, incluso en secuencias con b muy alto, simulando difusión restringida. Esto es lo que se conoce como «efecto T2» (T2 shine through effect). Este efecto paradójico es fácilmente identificable al realizar un mapa de ADC; la señal es hiperintensa lo que indica que la difusión no está restringida. Además al medir el ADC el valor será alto. Por eso las DWI deben ser interpretadas conjuntamente con el mapa ADC.
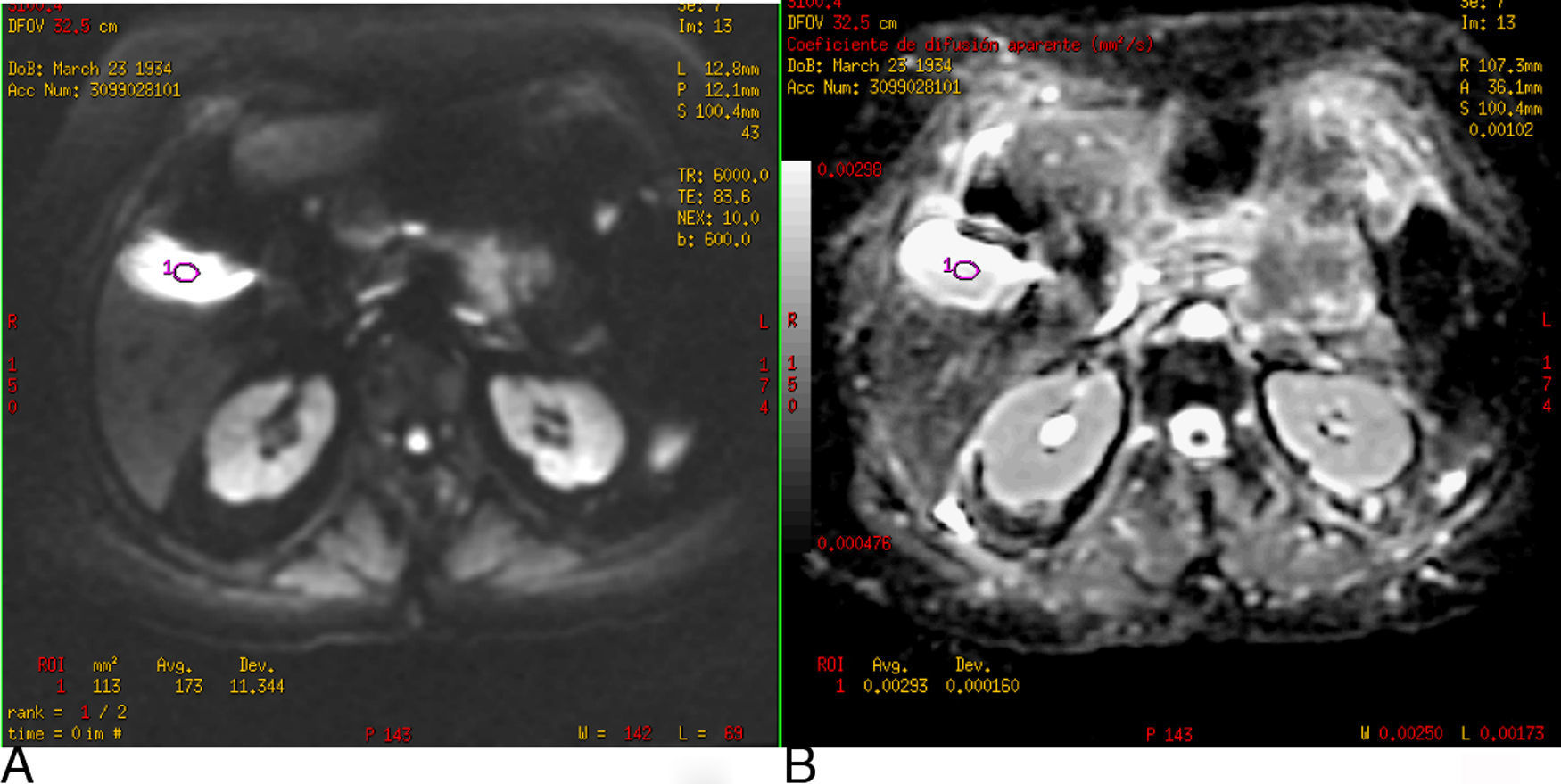
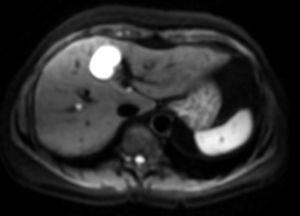
En la figura 4 se representa la vesícula biliar en DWI con valor b de 600 seg/mm2 hiperintensa, debido al efecto T2, sin embargo también aparece hiperintensa en el mapa de ADC y al cuantificar el valor de ADC es alto (2,9×10−3 mm2/s).
A) Imagen potenciada en difusión (b: 600 seg/mm2). B) Mapa de ADC. Efecto T2 de la vesícula biliar. En la DWI la vesícula es hiperintensa, no porque restrinja la difusión sino porque tiene un tiempo de relajación T2 largo, se comprueba con el mapa ADC donde también es hiperintensa y el valor es de 2,9×10−3 mm2/s.
Las principales aplicaciones clínicas de la DWI-RM en el hígado son la detección y caracterización de lesiones focales hepáticas y la monitorización y evaluación de la respuesta al tratamiento en enfermedad tumoral. También se está estudiando la utilidad de esta técnica para el estudio de enfermedad difusa hepática.
En el Hospital Quirón de Madrid se utiliza esta técnica de forma sistemática en todas las RM hepáticas, desde finales del año 2006. En total se han realizado más de 3.000 estudios de difusión hepática, siendo de gran utilidad sobre todo para detectar y caracterizar lesiones y en caso de enfermedad tumoral maligna, para la valoración de la respuesta al tratamiento.
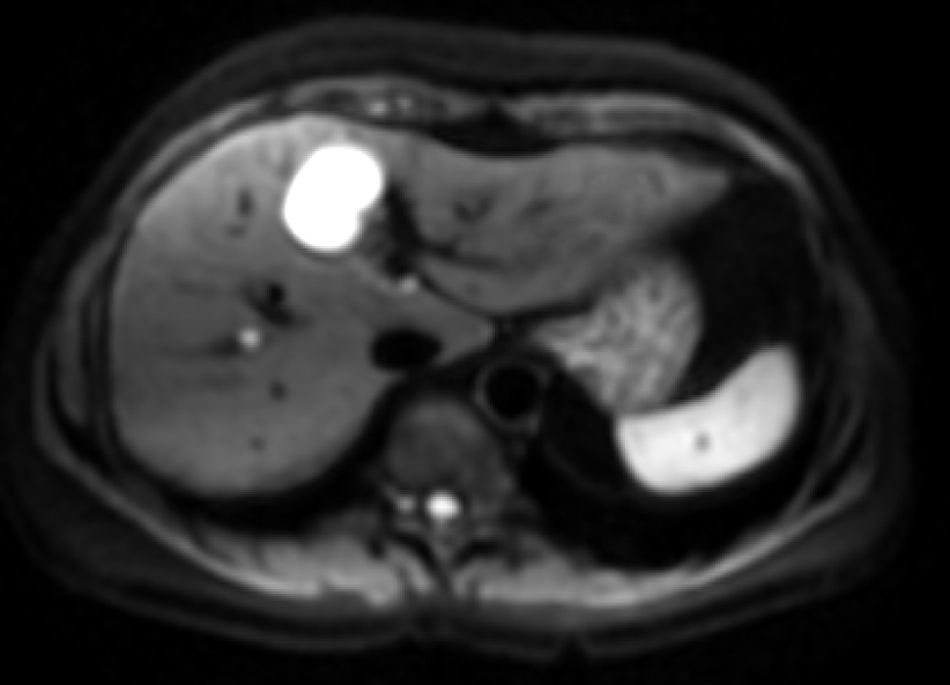
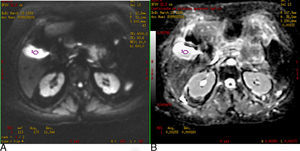
Detección de lesionesUna de las principales aplicaciones de la DWI-RM hepática es la detección de lesiones. La utilización de secuencias con valores b bajos (entre 50 y 150 seg/mm2) tiene varias ventajas. Por un lado cuanto menor es el valor b la relación señal/ruido es mayor y la resolución de la imagen mejora. Por otro lado a partir de valores b>50 seg/mm2 solo se perciben movimientos muy pequeños de las moléculas de agua, la alta señal de los vasos hepáticos se suprime, apareciendo hipointensos, son las llamadas imágenes de sangre negra, que mejoran la detección de lesiones (fig. 5).
Varios autores han publicado diferentes estudios demostrando que las imágenes de difusión con valores b bajos (50-150 seg/mm2) tienen mayor sensibilidad para detectar lesiones hepáticas que las obtenidas con secuencias convencionales potenciadas en T29–13.
En el estudio de Zech et al.11 compararon las imágenes de difusión (b=50 seg/mm2) con las imágenes potenciadas en T2 y supresión grasa, obteniendo una sensibilidad para detectar lesiones hepáticas del 83% con la difusión, frente a una sensibilidad del 61% con las secuencias T2. Parikh et al.12 también obtuvieron una sensibilidad mayor (87,7%) para detectar lesiones hepáticas con secuencias de difusión (b=50 seg/mm2) que con secuencias T2 (70%). Incluso esta diferencia era aún mayor cuando solo se detectaban lesiones malignas, 86,4% frente a un 62,9%. El equipo de investigación de Bruegel10 comparó la sensibilidad de estas dos secuencias para detectar metástasis hepáticas, variando la sensibilidad con la técnica de difusión entre un 91-92% y con las secuencias potenciadas en T2 entre un 47-67%. Estas diferencias eran aún más acusadas para metástasis de tamaño inferior a 1cm.
De igual forma, otros autores han comparado la eficacia de la técnica de la difusión para detectar lesiones hepáticas con las secuencias de RM con contraste14–18.
Nasu et al.14 demostraron que las imágenes de difusión son más sensibles que los estudios con contraste superparamagnetic iron oxides (SPIO) para detectar metástasis menores de 1cm, sin embargo eran menos sensibles para detectar las metástasis localizadas en el lóbulo hepático izquierdo, debido a los artefactos de los movimientos cardiacos. En el estudio realizado por Koh et al.17 se obtuvieron resultados muy parecidos al grupo anterior. Compararon la capacidad de las secuencias de difusión y las secuencias con contraste que utilizan mangafodipir trisodium para la detección de metástasis hepáticas de cáncer de colon y demostraron que con los estudios con contraste era más fácil que pasaran desapercibidas lesiones <1cm o lesiones cerca del borde hepático. Low et al.18 también observaron mayor sensibilidad para la detención de lesiones hepáticas con las secuencias de difusión que con las secuencias de RM sin contraste o tras la administración de gadolinio.
De todos modos, todas estas secuencias no son técnicas excluyentes y la máxima eficacia diagnóstica se consigue combinando secuencias potenciadas en difusión con secuencias convencionales, incluyendo secuencias potenciadas en T2 y secuencias tras la administración de contraste4.
Caracterización de lesionesCon la DWI se obtiene una información cualitativa, basada en la intensidad de la señal, que ayuda a distinguir entre lesiones quísticas y sólidas; está información será más discriminativa al utilizar valores b altos. Sin embargo, en ocasiones las lesiones quísticas pueden tener comportamiento hiperintenso en imágenes obtenidas con secuencias con valores b altos debido al efecto T2 shine through. Por esta razón, para diferenciar entre lesiones benignas y malignas, son más útiles los mapas de ADC, con los que se obtienen una información cuantitativa. Las lesiones benignas tienen generalmente un valor de ADC mayor que las lesiones malignas.
Para determinar el valor ADC de las lesiones hepáticas son necesarias al menos dos secuencias de difusión, una con un valor b 0 seg/mm2 y otra con valor b menor a 1.000 seg/mm2. La reducción de la señal en el hígado no ocurre de forma lineal con el aumento del valor b, sino exponencial. Entre los valores b 0 y 150 seg/mm2 la pérdida de la señal es mayor debida a la contribución de la microcirculación19. Sin embargo a partir de valores b mayores de 150 seg/mm2 el movimiento de las moléculas de agua en los vasos macroscópicos no es detectado. En la figura 6 se representa esta pérdida de señal exponencial y la zona de la curva influenciada por el efecto de la perfusión hepática normal. El movimiento de las moléculas en el espacio capilar deja de detectarse a partir de valores de 500 seg/mm2, por esta razón, es mejor obtener el mapa de ADC con secuencias con valores b por encima de 500 seg/mm2.
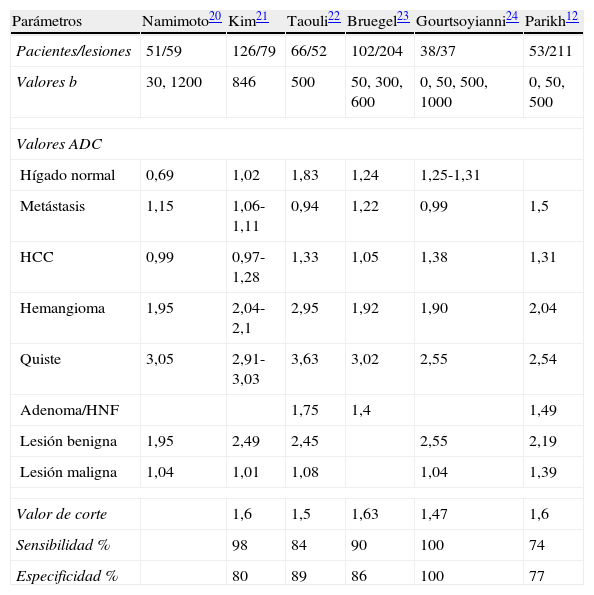
Varios autores han realizados diversos estudios calculando los valores de ADC en distintas lesiones hepáticas, con el fin de determinar un punto de corte entre las lesiones benignas y malignas. En la tabla 14 se reflejan los valores medios de ADC de varias lesiones hepáticas, el punto de corte entre las lesiones benignas y malignas y la sensibilidad y especificidad para detectar lesiones malignas, calculados por distintos autores12,20–24.
Valores medios de ADC del hígado normal y lesiones hepáticas focales, valor de corte y sensibilidad y especificidad para el diagnóstico de lesiones malignas en diferentes estudios publicados
| Parámetros | Namimoto20 | Kim21 | Taouli22 | Bruegel23 | Gourtsoyianni24 | Parikh12 |
| Pacientes/lesiones | 51/59 | 126/79 | 66/52 | 102/204 | 38/37 | 53/211 |
| Valores b | 30, 1200 | 846 | 500 | 50, 300, 600 | 0, 50, 500, 1000 | 0, 50, 500 |
| Valores ADC | ||||||
| Hígado normal | 0,69 | 1,02 | 1,83 | 1,24 | 1,25-1,31 | |
| Metástasis | 1,15 | 1,06-1,11 | 0,94 | 1,22 | 0,99 | 1,5 |
| HCC | 0,99 | 0,97-1,28 | 1,33 | 1,05 | 1,38 | 1,31 |
| Hemangioma | 1,95 | 2,04-2,1 | 2,95 | 1,92 | 1,90 | 2,04 |
| Quiste | 3,05 | 2,91-3,03 | 3,63 | 3,02 | 2,55 | 2,54 |
| Adenoma/HNF | 1,75 | 1,4 | 1,49 | |||
| Lesión benigna | 1,95 | 2,49 | 2,45 | 2,55 | 2,19 | |
| Lesión maligna | 1,04 | 1,01 | 1,08 | 1,04 | 1,39 | |
| Valor de corte | 1,6 | 1,5 | 1,63 | 1,47 | 1,6 | |
| Sensibilidad % | 98 | 84 | 90 | 100 | 74 | |
| Especificidad % | 80 | 89 | 86 | 100 | 77 | |
Fuente: Tomada de Taouli4.
Los valores de ADC en estos estudios oscilaron entre 0,97 y 1,38×10−3 mm2/s para los hepatocarcinomas, entre 0,94 y 1,50×10−3 mm2/s para las metástasis, entre 1,4 y 1,75 para los adenomas e hiperplasia nodular focal (HNF), entre 1,90 y 2,10×10−3 mm2/s para los hemangiomas y 2,91 y 3,63×10−3 mm2/s para los quistes, con un punto de corte entre lesiones malignas y benignas de 1,47-1,63. Estas diferencias se debieron fundamentalmente a la realización del estudio con distinta técnica y distintos valores b. Utilizando un valor umbral de ADC de 1,63×10−3 mm2/s se clasifican como benignas o malignas en un 88% y con un valor umbral de ADC de 1,57×10−3mm2/s se establece el diagnóstico diferencial entre hemangioma vs. metástasis en un 83%23.
A pesar de que los tumores malignos generalmente tienen un valor de ADC menor que los benignos, existen valores de solapamiento entre algunas lesiones benignas, como el adenoma o la HNF y lesiones malignas, como las metástasis o el hepatocarcinoma. Además, algunos tumores malignos como los mucinosos o necróticos no restringen tanto la difusión al tener menos celularidad, por lo que tienen un valor ADC más alto, por encima del punto de corte, simulando una lesión benigna (falsos negativos) y por otro lado, procesos benignos, como los abscesos hepáticos, restringen la difusión y tienen un ADC bajo (falsos positivos).
Un tema menos estudiado ha sido la capacidad de la DWI-RM para discriminar entre hepatocarcinomas de bajo y alto grado. En el estudio de Muhi et al.25 concluyeron que los hepatocarcinomas moderadamente mal diferenciados y mal diferenciados tenían un valor de ADC menor que los hepatocarcinomas bien diferenciados y los nódulos displásicos que pueden mostrar una señal similar a la del parénquima hepático en la imagen de difusión.
En resumen, es posible utilizar la información cuantitativa de la DWI para diferenciar lesiones benignas de lesiones malignas hepáticas y dentro de estas últimas, tumores bien diferenciados de los mal diferenciados. No obstante pueden existir errores por solapamiento entre los valores de ADC de las lesiones benignas y malignas. Por esta razón, para caracterizar lesiones hepáticas, es aconsejable valorar la DWI conjuntamente con el resto de secuencias del estudio (secuencias potenciadas en T2 y secuencias tras contraste paramagnético).
Monitorización y valoración de la respuesta al tratamientoLa utilización de la DWI para la monitorización y valoración de la respuesta al tratamiento está aumentando considerablemente26. Cuando un tratamiento para el cáncer es efectivo se produce lisis celular, rotura de membranas y aumento del espacio extracelular, lo que conlleva un aumento del valor de ADC que puede ser observado incluso antes de la disminución del tamaño del tumor.
Estudios realizados con animales han confirmado que tras el tratamiento con quimioterapia o radioterapia, en las primeras 24 horas las células se hinchan y el ADC baja, pero posteriormente, si el tratamiento es efectivo, el ADC se eleva porque la difusión del agua aumenta debido a la lisis de las células27.
Chen et al.28 realizaron un estudio midiendo el ADC en pacientes tras ser tratados de un carcinoma hepatocelular, encontrando que los individuos que respondían al tratamiento mostraban un aumento significativo de los valores de ADC. Koh et al.29 observaron un aumento del ADC en pacientes tratados de metástasis hepáticas de cáncer de colon con al menos una respuesta parcial al tratamiento. Estos autores han utilizado también el valor de ADC como factor predictivo de la respuesta al tratamiento: las metástasis hepáticas que mejor respondían tenían un ADC, antes del tratamiento, más bajo. Se cree que es debido a que las metástasis con un valor más alto de ADC tienen más necrosis y esto conlleva un aumento de la hipoxia, acidosis y disminución de la perfusión que disminuye la sensibilidad a la quimio- y radioterapia.
Otro aspecto importante es la dificultad de diferenciar mediante técnicas de imagen habituales entre las alteraciones residuales postratamiento de las recidivas locales del tumor. Con la DWI-MR es posible distinguir los cambios postradiación de las recurrencias gracias a la determinación de los valores de ADC, que son mayores en las zonas tratadas que en aquellas zonas de actividad tumoral, por la presencia de edema extracelular30.
Enfermedad difusa hepáticaPor último, se está estudiando la utilidad de la DWI para el estudio del grado de fibrosis en enfermedad hepática crónica difusa.
Lewin et al.31 estudiaron a 54 pacientes con hepatitis C crónica y a 20 sujetos sanos a los que se les realizó una RM con secuencias de difusión utilizando valores b de 0, 200, 400 y 800 seg/mm2. Compararon los valores de ADC con los resultados obtenidos en la ecografía con elastografía y los marcadores sanguíneos de fibrosis, concluyendo que los valores de ADC eran más bajos en pacientes con fibrosis moderada o severa (1,1±0,11×10−3 mm2/s), después en pacientes con fibrosis leve (1,3±0,12×10−3 mm2/s) y más altos en el parénquima hepático sano (1,44±0,02×10−3 mm2/s). La sensibilidad y especificidad de la técnica de difusión para diagnosticar fibrosis fue de un 87%.
El mecanismo por el cual el ADC es más bajo en enfermedad difusa hepática crónica con fibrosis todavía no es del todo conocido y es probablemente multifactorial, influyendo el aumento del tejido conectivo y la disminución del flujo sanguíneo4. Además, estos mismos autores encontraron una relación significativa entre los valores de ADC y la sospecha de enfermedad inflamatoria y esteatosis hepática.
Chandarana et al.8 consideran el valor ADC como un factor predictivo de la estadificación de la fibrosis con una sensibilidad del 88,5% y una especificidad del 73,3% y del grado de inflamación hepática con una sensibilidad del 75% y una especificidad del 78,6%.
ConclusiónLa DWI-RM supone una importante herramienta para el diagnóstico de las lesiones hepáticas como secuencia complementaria y adicional al resto del protocolo de estudio habitual. La eficacia diagnóstica de lesiones hepáticas mediante RM mejora significativamente cuando se utilizan de forma combinada las secuencias convencionales y la secuencia de DWI.
La DWI-RM tiene la ventaja de no utilizar radiaciones ionizantes, apenas incrementa el tiempo de exploración al tratarse de secuencias rápidas y no es precisa la administración de contraste paramagnético, por lo que se puede utilizar en pacientes con insuficiencia renal.
La DWI se considera una técnica muy eficaz para detectar lesiones hepáticas, sobre todo con secuencias con valores b bajos (50-150 seg/mm2), ya que la resolución anatómica de la imagen es mejor. La determinación del ADC ayuda a caracterizar las lesiones y las mediciones seriadas de los valores de ADC son muy útiles también para la valoración de la respuesta al tratamiento de los procesos neoplásicos: los pacientes con buena respuesta al tratamiento muestran una elevación del ADC.
Por lo tanto, es importante que el médico conozca esta técnica diagnóstica, ya que la DWI es una secuencia que debería ser incluida de forma rutinaria en el protocolo de estudio de la RM hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.