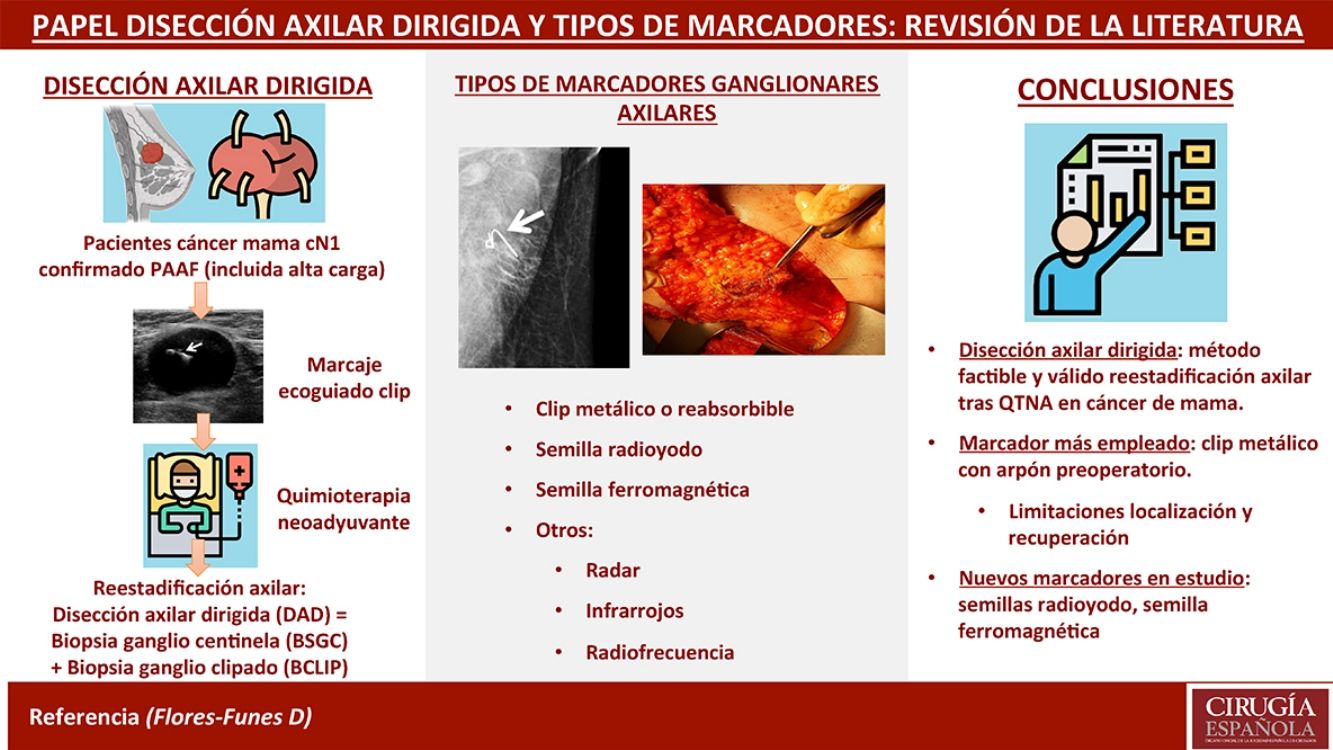
La disección axilar dirigida (DAD) consiste en una nueva técnica de estadificación axilar que combina la biopsia selectiva del ganglio centinela (BSGC) y la biopsia del ganglio marcado con clip (BCLIP) en la misma cirugía, para reestadificar a las pacientes con cáncer de mama con ganglios axilares positivos tratadas mediante quimioterapia neoadyuvante (QTNA). Para su realización, previo a la QTNA, se punciona el ganglio metastásico de manera ecoguiada y se deja un marcador en su interior, para biopsiarlo de manera dirigida en la cirugía posterior. Existen numerosos marcadores: desde clips de acero, titanio o ácido poliglicólico hasta semillas de radioyodo o ferromagnéticas, que difieren en su método de localización y recuperación (arpón, sonda de detección gamma, o sonda magnética). El objetivo de este trabajo es realizar una revisión sistemática del estado actual de la DAD, así como explicar las diferentes técnicas y tipos de marcaje axilar, con base en la evidencia disponible.
Targeted axillary dissection (TAD) consists of a new axillary staging technique that combines sentinel lymph node biopsy (SLNB) and clipped lymph node biopsy (CLNB) in the same surgery, in order to re-stage patients with breast cancer and positive axillary lymph nodes undergoing neoadjuvant chemotherapy (NAQT). Prior to the NAQT, the affected lymph node is punctured and a solid marker is left inside echo-guided, in order to biopsy it in the subsequent surgery. There are numerous types of markers: metallic (steel, titanium or polyglycolic acid clips), radioiodine or ferromagnetic seeds, which differ in the method of location (wire, gamma-detection or magnetic probe). The aim of this study is to perform a systematic review about the current status of the TAD, as well as to explain the different techniques and types of axillary marking, based on the current available evidence.
La disección axilar dirigida (DAD) consiste en una nueva técnica de estadificación axilar que combina la biopsia selectiva del ganglio centinela (BSGC) y la biopsia del ganglio marcado con clip (BCLIP) en un mismo acto quirúrgico. Surgió de la necesidad de reestadificar a las pacientes con cáncer de mama y ganglios axilares positivos al diagnóstico tratadas mediante quimioterapia neoadyuvante (QTNA), tras observar en el estudio ACOSOG Z10711 que la BSGC sola no era suficiente por su elevada tasa de falsos negativos (TFN) (12,6%). Este mismo grupo de trabajo, liderado por Boughey, probó en un grupo de pacientes la utilidad del marcaje ganglionar, identificando y publicando en 2016 un subgrupo de 107 pacientes en las que se realizó un marcaje de los ganglios axilares metastásicos, que después se extirparon mediante una disección dirigida en quirófano colocando previamente a la cirugía una semilla yodada, obteniendo una TFN del 6,8% tomando como referencia la linfadenectomía axilar (LA)2. Estos resultados fueron corroborados ese mismo año por el grupo de Caudle et al.3, que observó, en una serie de 191 pacientes tratadas mediante LA con BSGC y BCLIP previas, una TFN del 4,2%. Dicho grupo acuñó el concepto de «targeted axillary dissection», traducido al castellano como «disección axilar dirigida».
Para la realización de la DAD, es necesario, previo al inicio de la QTNA, puncionar el ganglio metastásico de manera ecoguiada y dejar un marcador sólido en su interior, de cara a extirparlo de manera dirigida en la cirugía posterior. Existen numerosos tipos de marcadores sólidos que podemos utilizar: desde clips de acero, titanio o ácido poliglicólico, hasta semillas de radioyodo o ferromagnéticas, que difieren en su método de localización y recuperación (arpón, sonda de detección gamma, o sonda magnética). No está claro todavía el papel de la DAD, así como el tipo de marcador más indicado en función de su accesibilidad, precio, seguridad y facilidad para su implantación y recuperación. Por ello, el objetivo de este trabajo es revisar el estado actual de la DAD, así como discutir las diferentes técnicas y tipos de marcaje axilar, con base en la evidencia actual disponible.
Material y métodosSe realizó una revisión sistemática de los artículos disponibles sobre la DAD, centrándose en los diferentes tipos de marcadores axilares utilizados y en estudio, sus ventajas e inconvenientes. Para ello se hizo una búsqueda bibliográfica, empleando las bases de datos de MEDLINE (vía Pubmed), Google Scholar, ISI Web of Science y SCOPUS. El término empleado en los diferentes buscadores fue targeted axillary dissection seleccionando estudios de los últimos 10 años. Para la elección de los artículos a analizar, se realizó una lectura completa del abstract de todos aquellos cuyo título tuviera al menos unos de los siguientes términos en inglés: clip markers, clipped lymph node, wire localization, intraoperative ultrasound, iodine seed, magnetic seed y breast cancer. Al ser un tema relativamente novedoso, sin estudios de alta calidad publicados (ensayos clínicos aleatorizados y metaanálisis), se incluyeron todo tipo de estudios en la revisión.
A partir de los artículos seleccionados, se hizo una lectura crítica del artículo, descartando aquellos artículos que no cumplieran al menos el 70% de los criterios propuestos por la red CASPe4 en función del tipo de estudio seleccionado (revisión, cohortes, casos y controles, ensayos clínicos), y se revisaron aquellos trabajos cuya referencia contenía información relevante para el tema a tratar. Finalmente, se analizaron las conclusiones de cada uno de los artículos y se elaboraron, con el programa Mendeley Desktop© de Elsevier®, todas las referencias para incluirlas en este trabajo.
Para la elaboración de este artículo se han seguido las bases propuestas por el Preferred Reporting Items for Systematic reviews and MetaAnalyses (PRISMA)5.
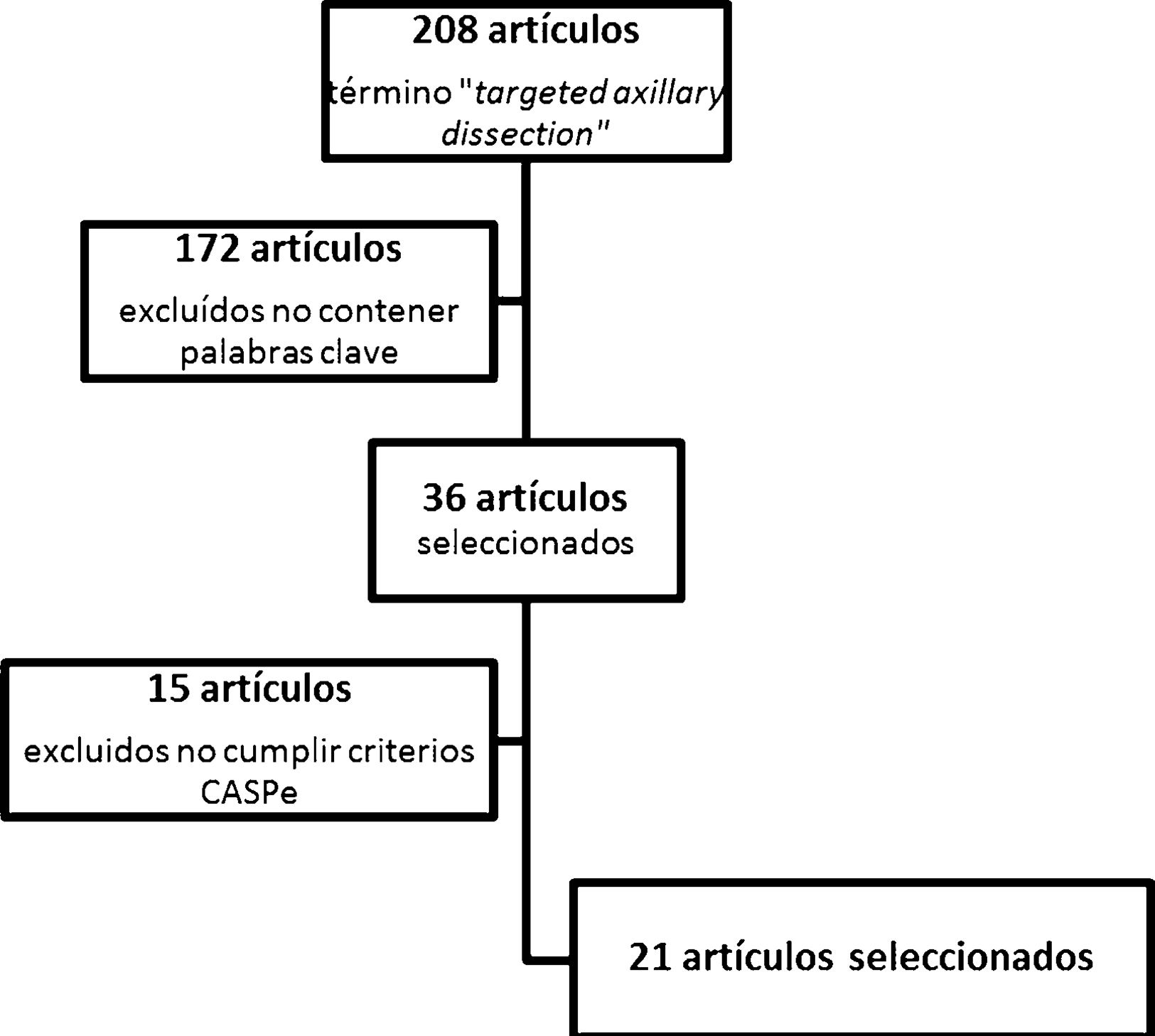
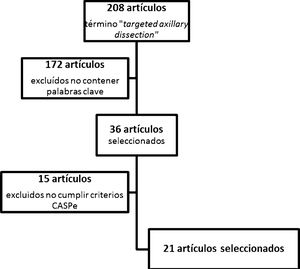
ResultadosTras la realización del algoritmo de búsqueda, se hallaron 208 artículos relacionados con el término targeted axillary dissection. De ellos, 36 artículos fueron seleccionados por contener alguna de las palabras clave referidas anteriormente. Tras su lectura crítica, se excluyeron 15 artículos por no ser considerados con suficiente calidad por los criterios de la red CASPe, quedando un total de 21 artículos. Además, se añadió una referencia directa a la aprobación y utilización de la semilla ferromagnética Magseed® (Magseed© de Sysmex®).
En los artículos seleccionados para la realización de esta revisión (fig. 1) se incluye una revisión sistemática, 2 ensayos clínicos no aleatorizados, 8 estudios de pruebas diagnósticas y 10 estudios comparativos observacionales.
DiscusiónDisección axilar dirigidaLos marcadores sólidos fueron inicialmente descritos al final de la década de los 90 para el marcaje de las lesiones tumorales mamarias3, adaptándose posteriormente a su uso en la axila.
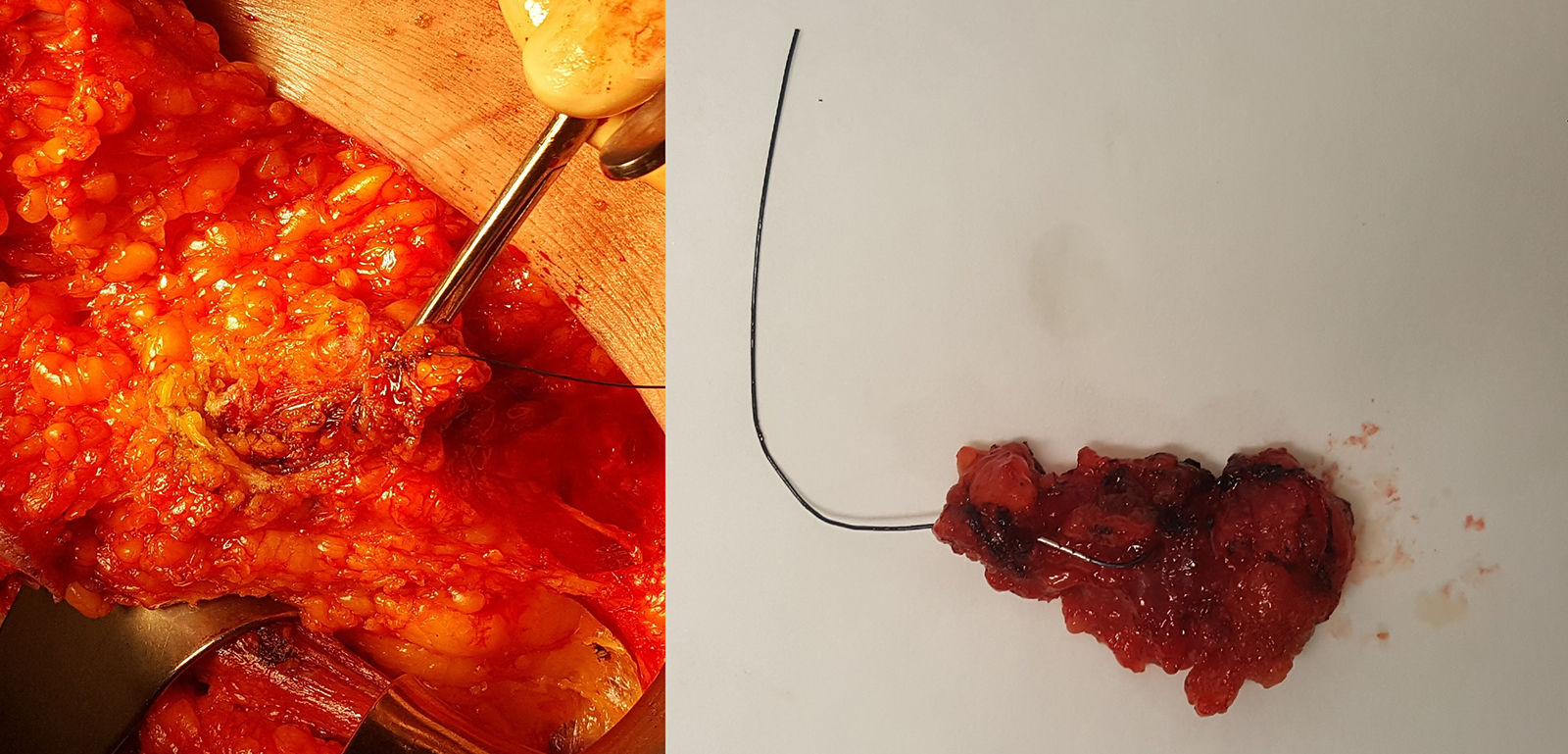
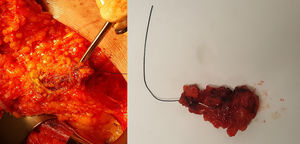
Su utilización comienza en el momento del diagnóstico: el radiólogo identifica, mediante ecografía, las adenopatías patológicas confirmadas mediante punción-aspiración con aguja fina, realizada conjuntamente con un patólogo experto en patología mamaria, y realiza un marcaje de las mismas (con 1 o 2 marcadores) mediante algún tipo de marcador de los expuestos anteriormente. Tras la administración de QTNA durante 4-6 meses, la paciente es sometida a una nueva evaluación mediante ecografía, localizando el clip y observando la respuesta anatómica de los ganglios marcados. Durante el acto quirúrgico, se procede a la DAD. La técnica quirúrgica es sencilla y semejante a la realizada en la BSGC (fig. 2): tras su identificación preoperatoria e inyección del coloide radiactivo para la BSGC, el cirujano realiza una incisión en la parte inferior del hueco axilar, generalmente en el borde inferior del vello, o bien accede a través de la incisión de la mastectomía, en su caso. A través de la incisión, realiza una disección y exéresis dirigida del ganglio marcado (ayudado bien con un arpón colocado de manera ecoguiada, bien con ecografía intraoperatoria, o en el caso de marcaje con semilla radiactiva o con clip ferromagnético, con la sonda detectora correspondiente). Una vez extraído el o los ganglios marcados, se escanean con el detector gammagráfico para ver si coinciden con el ganglio centinela y también se escanea el hueco axilar para localizar otros ganglios captantes del radiotrazador, y extirparlos si los hubiera. Esta parte de la intervención es fundamental, puesto que el valor de la BCLIP radica en el elevado número de casos en los que el ganglio marcado no coincide con el ganglio centinela (en el trabajo de Caudle et al. un 23% de los casos no coincidían). Posteriormente, siguiendo el protocolo de nuestro centro, analizamos todos los ganglios extirpados mediante método OSNA de forma intraoperatoria, independientemente del marcador utilizado, y la positividad de cualquiera de ellos (incluido micrometástasis) sería indicación de LA.
Biopsia del ganglio clipado marcado con arpón colocado de manera ecoguiada. A la izquierda, se muestra la disección del ganglio dirigido por arpón a través de una incisión de mastectomía. A la derecha, la pieza quirúrgica extraída y enviada a anatomía patológica para su análisis intraoperatorio mediante One-Step Nucleic Acid Amplification (OSNA).
Como se ha comentado anteriormente, los trabajos de Boughey et al.2 y de Caudle et al.3 fueron pioneros en el desarrollo de esta técnica, al demostrar una TFN del 6,8 y el 4,2%, respectivamente. Tras la publicación de estos resultados, se han realizado estudios posteriores, la mayoría de validación de la técnica y de las ventajas e inconvenientes del marcaje y de su recuperación quirúrgica posterior. El grupo de Kim et al.6 realizó un estudio de factibilidad en 20 pacientes, con un total de 24 marcajes con clip, pudiendo recuperar durante la cirugía 23 de ellos (95,8%). Otro estudio reciente de validación7, probablemente el más amplio hasta la fecha, utiliza la DAD en 98 pacientes, hallando una TFN del 4,2% si el clip estaba localizado en el ganglio centinela, mientras que esta tasa subía al 16,7% si el ganglio clipado no era el centinela, coincidiendo ambos ganglios en el 81,4%. Una teoría que explica esto es la distorsión del drenaje linfático axilar debido a la enfermedad y a la QTNA, nombrada por Ahmed y Douek en una nota de revista British Journal of Surgery8, en la que resumieron la historia de la DAD y añadieron que dicha técnica asegura con confianza la ausencia de enfermedad residual axilar tras la QTNA, a pesar de los escasos estudios disponibles. Otros trabajos, como el estudio español ILINA9, o un estudio preliminar de validación de la técnica10, presentan TFN semejantes.
Por todo ello, los estudios publicados hasta la fecha, mostraron que la DAD es una técnica factible y válida, y que permite predecir la ausencia de enfermedad axilar residual en más de un 95% de los casos.
Clip metálico o reabsorbibleLos clips usados como marcadores ganglionares son generalmente metálicos (acero o titanio) o parcialmente hechos de material reabsorbible (colágeno o ácido poliglicólico)11. Su fundamento es la posibilidad de localización posterior durante la cirugía mediante ecografía, bien intraoperatoria, bien con un marcaje preoperatorio con arpón. Como ventajas, presenta su facilidad de implantación y su precio asequible. Sin embargo, su principal desventaja es su elevada capacidad de migración durante el periodo de QTNA y la dificultad en su localización ecográfica. Por ello, algunos clips se han fabricado con una base de hidrogel para facilitar su visión ecográfica12. Sin embargo, incluso con los clips con hidrogel y las nuevas sondas ecográficas, la localización y la recuperación del ganglio clipado puede ser problemática hasta en el 30% de los casos13. Las 2técnicas más empleadas para dicha recuperación son:
- –
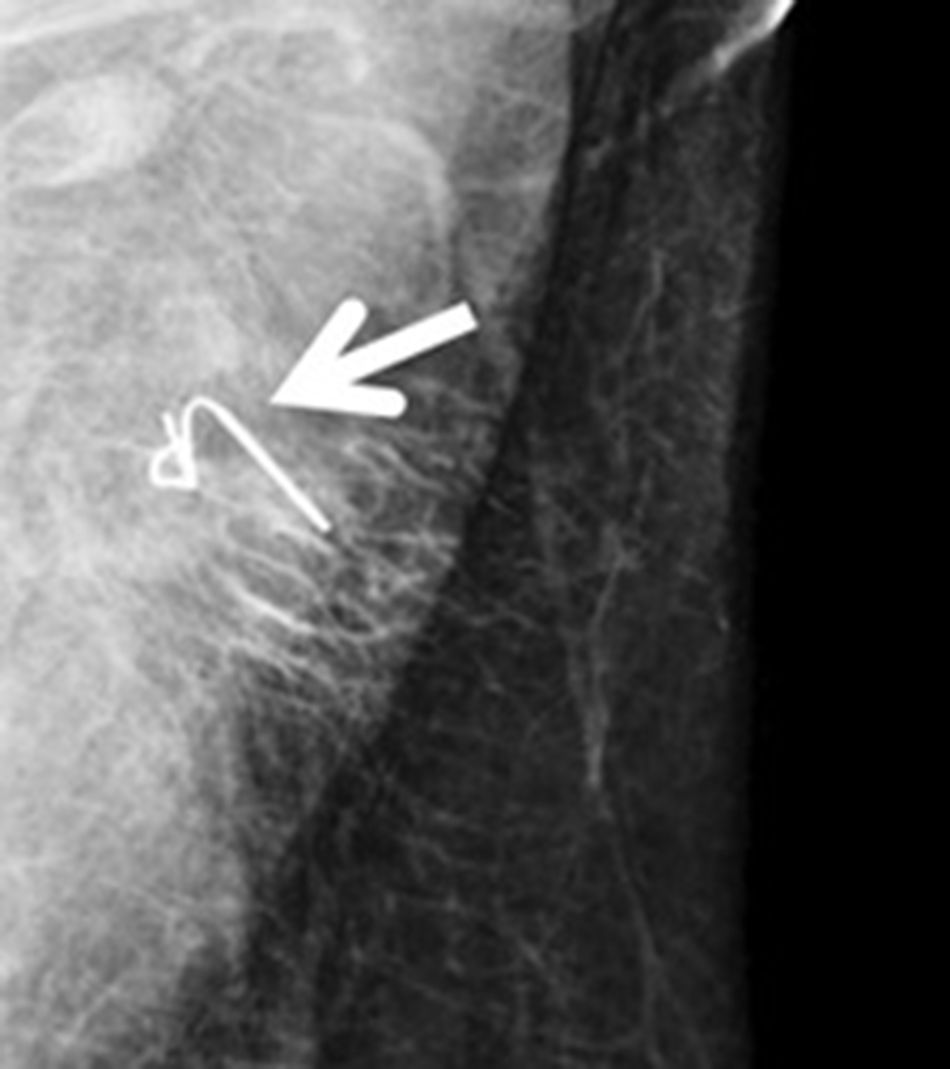
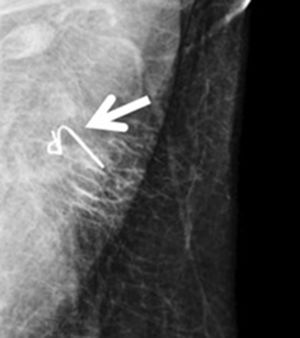
Arpón ecoguiado (fig. 3): consiste en la colocación, de manera ecoguiada, de un arpón en el ganglio clipado durante el preoperatorio inmediato, con el fin de orientar al cirujano para su recuperación posterior. En 2015, Plecha et al.14 describieron esta técnica, con un 97,3% de éxito a la hora de recuperar el ganglio durante la cirugía. Sin embargo, en un estudio posterior15, hallaron limitaciones importantes de la técnica, como la dificultad para ver el ganglio clipado mediante ecografía y la elevada tasa de fracasos en la recuperación del clip en su serie (30%).
- –
Ecografía intraoperatoria: consiste en realizar una cirugía ecoguiada, localizando el ganglio clipado de manera directa en quirófano con una sonda ecográfica intraoperatoria. Esta técnica fue mayormente descrita por el único grupo español que ha publicado sobre la DAD hasta la fecha, dentro del estudio ILINA9. En dicho trabajo, también de validación en 46 pacientes (también realizaron LA posterior) pudieron localizar y extirpar el ganglio mediante ecografía intraoperatoria en el 95,7% de los casos, con una TFN del 4,1%, concluyendo que, en manos con experiencia, esta técnica es válida y factible, y con menores molestias para la paciente.
Consiste en una semilla de titanio marcada con 125I, que se implanta en la zona a marcar antes de iniciar la QTNA. Durante la cirugía, se localiza con una sonda de detección gamma manual el ganglio para su exéresis. El principal estudio que describe la técnica y demuestra su utilidad es el trabajo Marking axillary lymph nodes with radioactive iodine seeds (MARI)16, en el cual, tras una media de 17 semanas desde su implantación, realizaron una DAD a 100 pacientes, con una tasa de localización del 97% y una TFN del 7%. El trabajo posterior de Caudle et al.3 también utilizó semillas yodadas como localizador, pero implantado durante la semana previa a la intervención. Como principal ventaja, presenta la facilidad de localización de la semilla intraoperatoriamente con la sonda gammagráfica. Sus principales limitaciones son: la radiactividad que genera, si bien las tasas de radiación emitidas son tan bajas (0,04-0,19 mCi) que permite mantenerlo implantado durante todo el tratamiento neoadyuvante y la necesidad de un especialista en medicina nuclear junto con infraestructura para manipular y desechar este tipo de semillas, no disponible en todos los centros. Dada su alta tasa de éxito en la localización intraoperatoria, el uso de las semillas de radioyodo podría postularse como una alternativa válida al pinzamiento clásico.
Semilla ferromagnéticaEs una semilla de óxido de hierro baja en níquel, que se puede implantar a una profundidad de hasta 3-4cm y mantenerse en el tejido sin restricción de tiempo17. Dicha semilla es localizada por una sonda que genera un campo magnético alternante, que la magnetiza y permite su localización en cuentas numéricas y audio de manera intraoperatoria. Es un método seguro y fiable para la cirugía conservadora mamaria18 y recientemente se han publicado los primeros estudios de factibilidad de la técnica en ganglios axilares, con una tasa de detección del 97%19, si bien no existen trabajos sobre su uso específico en la DAD. Al haber muy pocos estudios sobre el tema, y no existir estudios comparativos con el resto de marcadores, todavía no se conocen las limitaciones de la técnica, pero los estudios de factibilidad muestran la semilla ferromagnética como otra opción respecto al marcaje clásico con clip o con semilla yodada.
Otros marcadores en desarrollo- –
Tecnología de radar y luz infrarrojos20,21: consiste en la implantación de un reflector radar o infrarrojo en la zona, para posteriormente localizar la reflexión de las ondas de radar o infrarrojas mediante una sonda intraoperatoria. Se está probando en la cirugía mamaria, aunque todavía no se aplica en la axila debido al gran tamaño del reflector (hasta 1,2cm).
- –
Identificadores por radiofrecuencia: recientemente aprobados por la Food and Drug Administration para su uso en humanos. Consiste en la colocación de un microchip encapsulado, que emite una señal de radiofrecuencia que puede ser detectada por una sonda intraoperatoria. Descrito por primera vez en 200822, se ha utilizado únicamente en lesiones no palpables de mama23.
Existe cada vez más evidencia de que la DAD es un método factible y válido para reestadificar adecuadamente a las pacientes con cáncer de mama y adenopatías axilares patológicas tratadas mediante QTNA, lo que sugiere que se podría omitir la LA de manera segura en aquellas pacientes con respuesta completa al tratamiento quimioterápico. El marcador axilar más empleado es el clip metálico, si bien muestra limitaciones sobre todo en su localización y recuperación quirúrgica posterior. Nuevos métodos como el uso de semillas de radioyodo o ferromagnéticas (ya en uso en algunos centros), y otros aún en estudio, como la identificación por radar, infrarrojos o radiofrecuencia, parecen prometedores para mejorar la localización posterior, pero son necesarios estudios, preferiblemente ensayos clínicos comparativos aleatorizados, para ver su utilidad en la práctica clínica.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.