El objetivo del presente estudio es analizar el impacto de la afectación del ganglio de la arteria hepática (GAH) en la supervivencia de los pacientes intervenidos de duodenopancreatectomía cefálica (DPC) por adenocarcinoma (ADK) de cabeza de páncreas.
MétodosEstudio retrospectivo unicéntrico de pacientes intervenidos de DPC por ADK de cabeza de páncreas, con estudio anatomopatológico independiente del GAH. Los pacientes se agruparon en: 1)pacientes sin afectación del GAH ni ganglios peripancreáticos (GGP) (GPP−/GAH−); 2)pacientes con afectación ganglionar peripancreática (GPP+/GAH−), y 3)pacientes con afectación ganglionar peripancreática y de la arteria hepática (GGP+/GAH+). Para el análisis de supervivencia se utilizaron las curvas Kaplan-Meier. Los factores pronósticos de supervivencia global (SG) y libre de enfermedad (SLE) fueron identificados mediante el análisis de regresión de Cox.
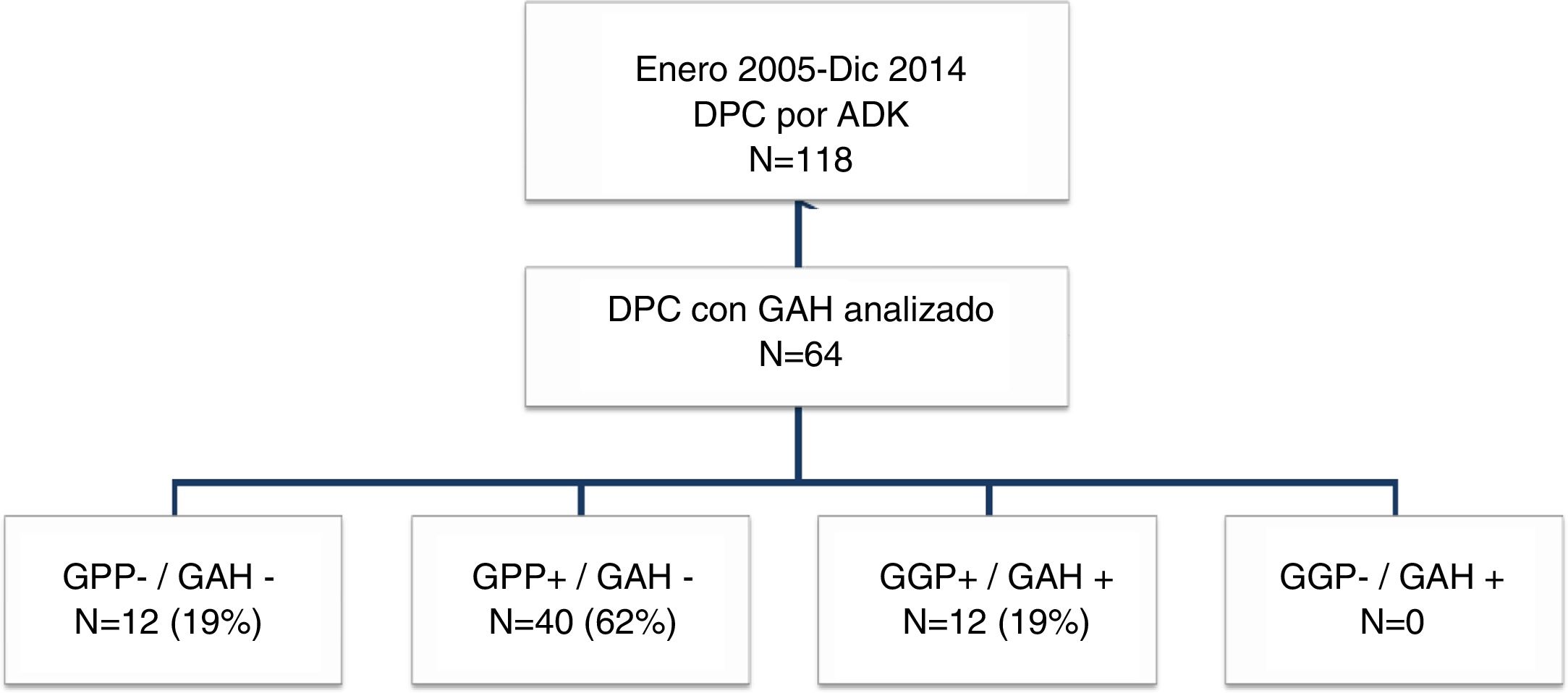
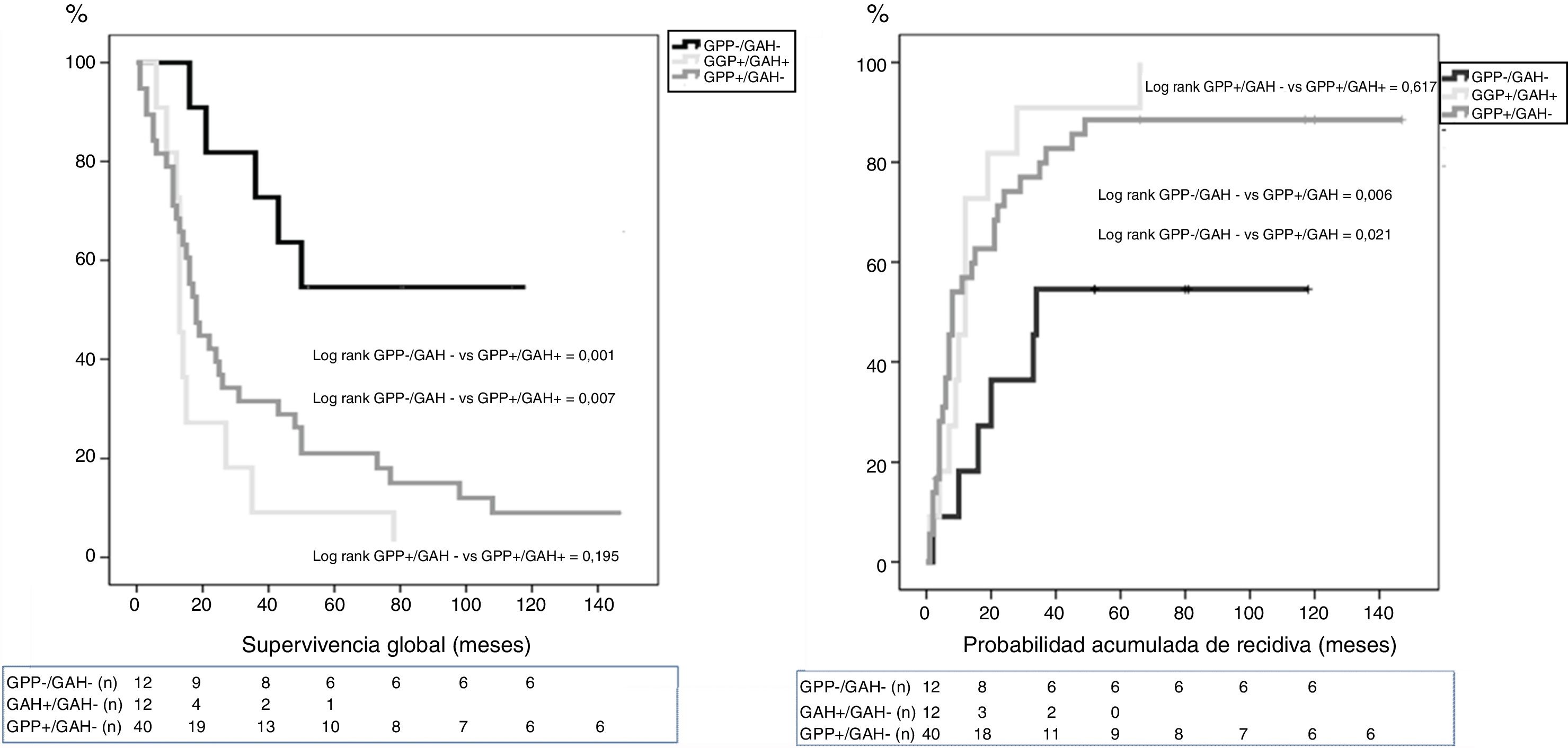
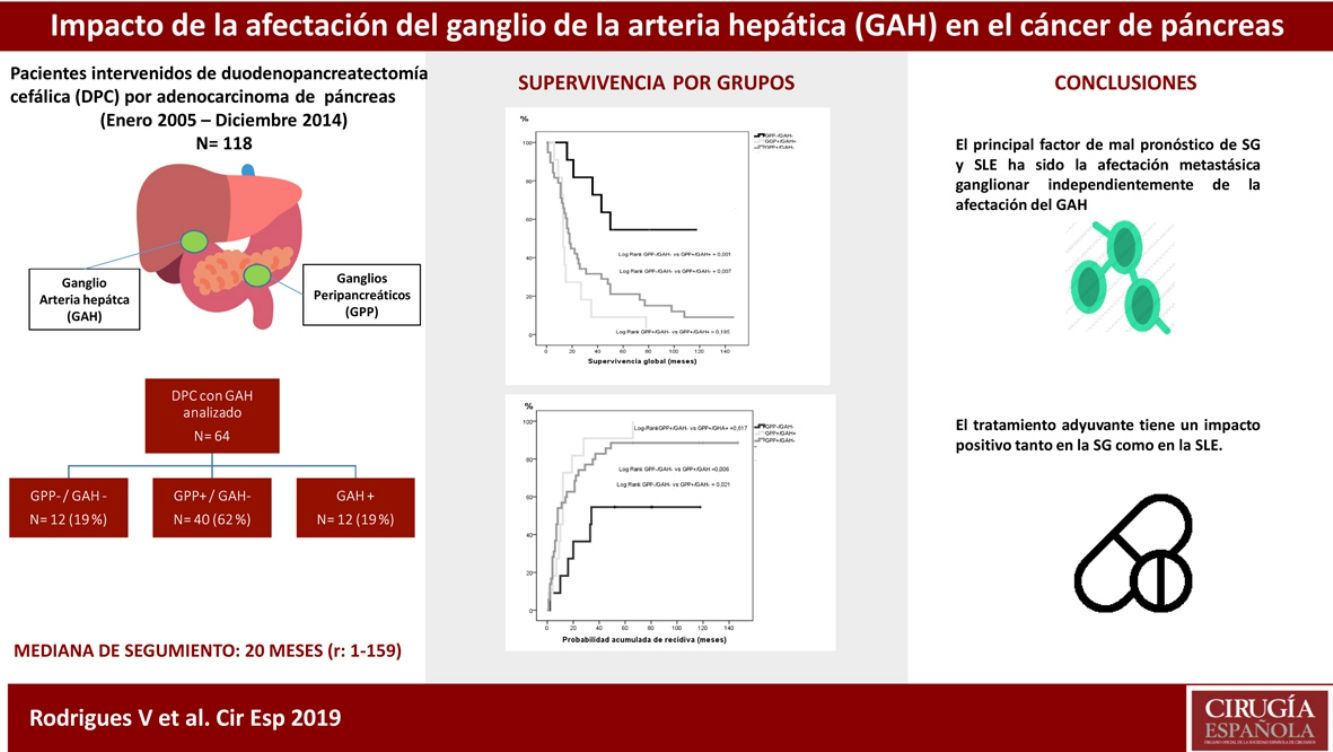
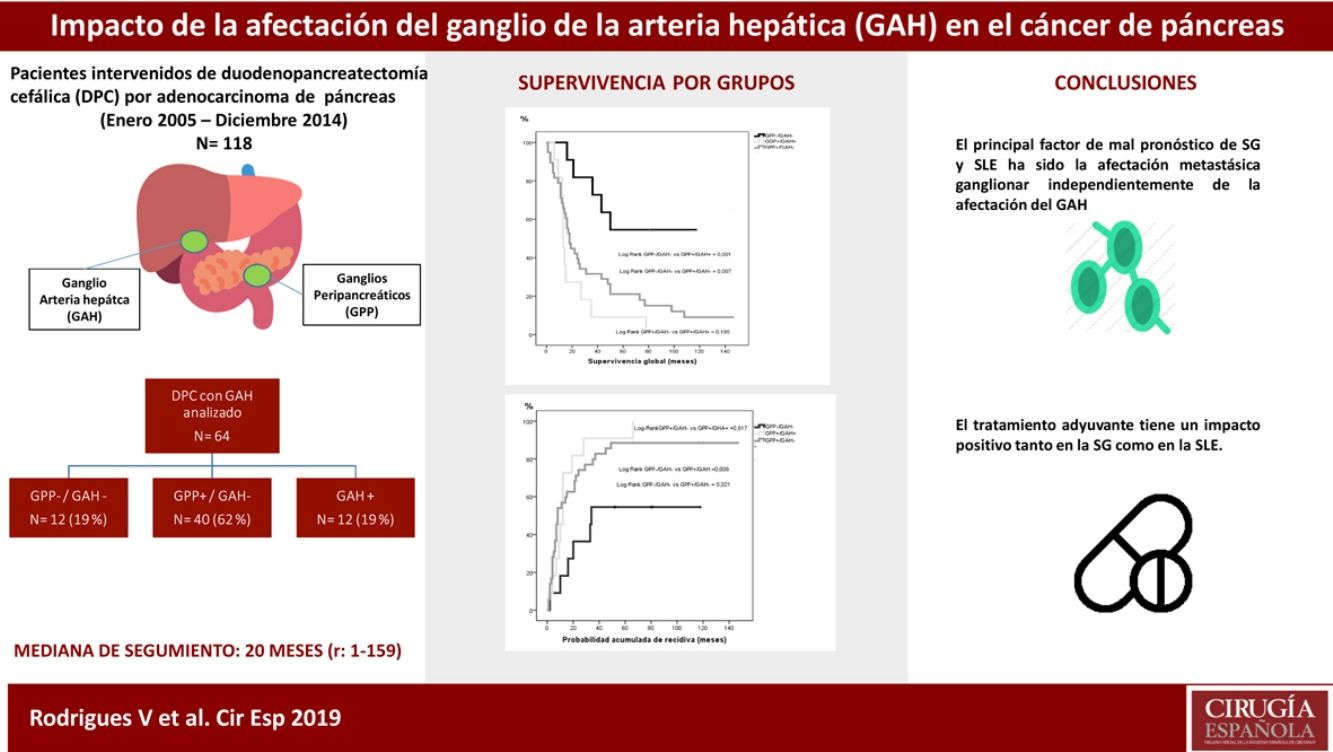
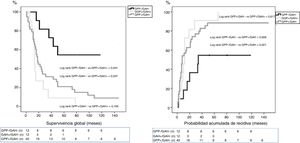
ResultadosEntre enero de 2005 y diciembre de 2014 se intervinieron 118 pacientes, y el GAH fue analizado en 64 de ellos. La mediana de seguimiento fue de 20meses (r: 1-159meses). La distribución por grupos fue la siguiente: GPP−/GAH− en 12 (19%), GPP+/GAH− en 40 (62%), GGP+/GAH+ en 12 (19%) y CGP-/CGH+ en 0 (0%), La SG a 1, 3 y 5años fue estadísticamente mejor en el grupo GPP−/GAH− (82, 72 y 54%) comparado con GPP+/GAH− (68, 29 y 21%) y GGP+/GAH+ (72, 9 y 9%) (p=0,001 vs p=0,007). La probabilidad acumulada de recidiva a 1, 3 y 5años fue estadísticamente inferior en el grupo GPP−/GAH− (18, 46 y 55%) comparado con el grupo GPP+/GAH− (57, 80 y 89%) y grupo GGP+/GAH+ (46, 91 y 100%) (p=0,006 vs p=0,021). En el análisis multivariante el principal factor de riesgo tanto de SG como de SLE fue la invasión linfática independientemente del estado del GAH.
ConclusionesNuestros resultados sugieren que la afectación adenopática impacta en la supervivencia del ADK de páncreas sin poder identificar la afectación del GAH como marcador pronóstico.
The aim of this study is to analyze the impact of hepatic artery lymph node (HALN) involvement on the survival of patients undergoing pancreaticoduodenectomy (PD) for pancreatic adenocarcinoma (PA).
MethodsA single-center retrospective study analyzing patients who underwent PD for PA. Patients were included if, during PD, the HALN was submitted for pathologic evaluation. Patients were stratified by node status: PPLN− (peripancreatic lymph node)/HALN−, PPLN+/HALN− and PPLN+/HALN+. Survival analysis was estimated by the Kaplan-Meier method, and Cox regression was used for risk factors analyses.
ResultsOut of the 118 patients who underwent PD for PA, HALN status was analyzed in 64 patients. The median follow-up was 20months (r: 1-159months). HALN and PPLN were negative in 12patients (PPLN−/HALN−, 19%), PPLN was positive and HALN negative in 40patients (PPLN+/HALN−, 62%), PPLN and HALN were positive in 12 patients (PPLN+/HALN+, 19%) and PPLN was negative and HALN positive in 0 patients (PPLN-/HALN+, 0%). The overall 1, 3 and 5-year survival rates were statistically better in the PPLN−/HALN− group (82%, 72%, 54%) than in the PPLN+/HALN− group (68%, 29%, 21%) and the PPLN+/HALN+ group (72%, 9%, 9%, respectively) (P=.001 vs P=.007). The 1, 3 and 5-year probabilities of cumulative recurrence were also statistically better in the PPLN−/HALN− group (18%, 46%, 55%) than in the PPLN+/HALN− group (57%, 80%, 89%) and the PPLN+/HALN+ group (46%, 91%, 100%, respectively) (P=.006 vs P=.021). In the multivariate model, the main risk factor for overall survival and recurrence was lymphatic invasion, regardless of HALN status.
ConclusionsIn pancreatic adenocarcinoma patients with lymph node disease, survival after PD is comparable regardless of HALN status.
El cáncer de páncreas es la séptima causa global de muerte por cáncer en países industrializados. Según las estimaciones de GLOBOCAN 2018, el cáncer de páncreas ha sido clasificado como el undécimo cáncer más común en el mundo, con 458.918 casos nuevos al año y 432.242 muertes; en España se estiman unas 7.279 muertes, con una incidencia de 7.765 casos en 20181. La resección quirúrgica es el único tratamiento potencialmente curativo2, siendo candidatos a este tratamiento tan solo un 20% de los pacientes, con una supervivencia a los 5años que no supera el 30%3.
La duodenopancreatectomía cefálica (DPC) es una cirugía compleja que se asocia con una mortalidad del 2,1-10,3%4 y una morbilidad del 65-69%5. Esta elevada morbimortalidad podría evitarse en aquellos pacientes en los cuales la cirugía no tendría un beneficio en la supervivencia si pudieran identificarse preoperatoriamente. Se han descrito varios factores pronósticos en el cáncer de páncreas, como el tamaño tumoral, el grado histopatológico, la invasión vascular, la invasión perineural, la afectación de los márgenes de resección y la afectación ganglionar6, siendo esta última uno de los principales factores de mal pronóstico en los pacientes intervenidos con intención curativa7. El ganglio de la arteria hepática común (GAH) (nivel 8a del Sistema de Clasificación de la Sociedad Japonesa de Páncreas8) podría ser un marcador pronóstico interesante debido a su fácil acceso, lo que permitiría evitar exponer al paciente a una cirugía mayor y, por lo tanto, identificar los pacientes que no se beneficiarían de una DPC sino de tratamiento paliativo. Varios estudios han evaluado el valor pronóstico de las metástasis del GAH con resultados contradictorios. Algunos señalan que su afectación se correlaciona con una disminución significativa de la supervivencia9-12, teniendo un pronóstico similar al de los pacientes con metástasis hepáticas o enfermedad peritoneal13, mientras que otros autores señalan no haber diferencias en la supervivencia entre los pacientes con afectación del GAH comparado con los que presentan afectación ganglionar a cualquier otro nivel14.
El objetivo de este estudio fue analizar el impacto de la afectación metastásica del GAH común (nivel 8a del International Study Group on Pancreatic Surgery [ISGPS]) en la supervivencia de los pacientes intervenidos de adenocarcinoma (ADK) de cabeza de páncreas.
MétodosSe trata un estudio observacional, retrospectivo y unicéntrico en el que se incluyeron los pacientes intervenidos de DPC por ADK de cabeza de páncreas con intención curativa en nuestro centro entre enero de 2005 y diciembre de 2014, con seguimiento hasta noviembre 2018, y en los cuales el GAH y los ganglios peripancreáticos (GPP) fueron identificados y analizados histológicamente de forma independiente.
Este estudio se realizó de acuerdo con la Declaración de Helsinki sobre los principios éticos para investigaciones médicas y fue aprobado por el Comité Ético del centro.
Estudio de estadificaciónLa evaluación preoperatoria de los pacientes consistió en una historia clínica detallada y un examen físico, el nivel de Ca19.9 y una tomografía computarizada (TC) toracoabdominal para el diagnóstico y la estadificación. En los casos en que el diagnóstico se realizó mediante colangiopancreatografía por resonancia magnética se completó el estudio de extensión con la realización de una TC torácica. La colangiografía retrógrada endoscópica y la ecografía endoscópica con o sin biopsia del tumor se realizaron de forma selectiva en los casos con dudas diagnósticas.
Los pacientes fueron clasificados, de acuerdo con los criterios publicados por el National Comprehensive Cancer Network (NCCN 2012)15, en tumores resecables, boderline resecables e irresecables. Así, se definieron como tumores resecables las lesiones de cabeza pancreática sin contacto o menos de 180° sin irregularidad del contorno del eje mesentérico-portal y sin contacto arterial. La presencia de adenopatías a nivel regional (hilio hepático o peripancreáticas) no fue criterio de irresecabilidad.
Técnica quirúrgica y estudio anatomopatológicoSe realizó una DPC con preservación pilórica ya descrita previamente5, con reconstrucción mediante pancreatoyeyunostomía ducto mucosa con tutorización del conducto de Wirsung, hepatoyeyunostomía sin tutor y gastroyeyunostomía antecólica utilizando una única asa. Si hubo sospecha de invasión vascular de la vena porta, se procedió a exéresis del segmento afecto y posterior reconstrucción vascular. Realizamos una linfadenectomía estándar8 de la cabeza pancreática y periduodenal con disección del pedículo hepático, arteria hepática común y exéresis de la lámina pancreática retroportal y del tejido linfático situado a la derecha de la arteria mesentérica superior sin linfadenectomía extendida descrita por otros autores16,17.
Con respecto al estudio anatomopatológico, se utilizó la clasificación pTNM de la International Union Against Cancer (UICC)18 y el estudio de los márgenes de resección quirúrgicos se basó en el estudio del Royal College of Pathologist19,20. El GAH fue identificado durante la disección de la arteria hepática común y remitido a análisis histológico de forma separada de los GPP extraídos conjuntamente con la exéresis de la pieza21.
Quimioterapia adyuvante y seguimientoNingún paciente recibió quimioterapia neoadyuvante. Inicialmente y según protocolo del centro, los pacientes con factores de riesgo de recidiva (afectación metastásica de los ganglios linfáticos, invasión perineural o microvascular) eran tratados con quimioterapia adyuvante basada en gemcitabina sobre una base individual hasta el año 2008. No obstante, los pacientes del presente estudio fueron tratados con quimioterapia adyuvante basada en gemcitabina en función del estado general, de las comorbilidades y de la edad del paciente. Inicialmente, dentro de ensayo clínico22 recibían radioterapia asociada a gemcitabina y 5-fluorouracilo y posteriormente gemcitabina sin radioterapia23 más oxiplatino o capecitabina según tolerancia clínica del paciente.
El seguimiento evolutivo se realizó mediante TC toracoabdominal y Ca19.9 cada 4meses durante los dos primeros años y posteriormente cada 6meses. La sospecha de recidiva por imagen radiológica o elevación de marcador tumoral se confirmaba mediante PET-scan.
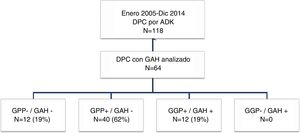
Grupos de estudioPara el objetivo del estudio los pacientes se dividieron en cuatro grupos (fig. 1) según la presencia de metástasis en el GAH o los GPP. Estos cuatro grupos fueron: pacientes sin afectación ganglionar (GPP−/GAH−), pacientes con afectación ganglionar peripancreática y GAH negativo (GPP+/GAH−), pacientes con afectación ganglionar peripancreática y de los ganglios de la arteria hepática (GGP+/GAH+) y pacientes sin afectación peripancreática pero GAH positivo (GGP−/GAH+). Se recogieron diferentes variables relacionadas con las características del paciente, características anatomopatológicas del tumor, morbilidad postoperatoria de acuerdo con los criterios de Clasificación Clavien-Dindo24, mortalidad postoperatoria y supervivencia.
SupervivenciaLa supervivencia global (SG) se calculó desde la fecha de la cirugía hasta la fecha del último seguimiento o la muerte, y la supervivencia libre de enfermedad (SLE), desde la fecha de la cirugía hasta la fecha de la primera recidiva excluyendo la mortalidad postoperatoria, definida como la que ocurre durante el ingreso o durante los primeros 30días desde la cirugía.
Análisis estadísticoSe realizó un análisis descriptivo presentando las variables categóricas en número total y porcentaje, y las variables cuantitativas en medianas y rango. Para la comparación de grupos (GPP−/GAH− vs GPP+/GAH− vs GGP−/GAH+) se utilizó el test de Kruskal Wallis en el caso de las variables continuas y el test de chi cuadrado con la corrección de Fisher para las variables cualitativas. Para el análisis de SG y la probabilidad acumulada de recidiva (logaritmo inverso de la SLE) se utilizaron las curvas Kaplan-Meier y log-rank test, así como el análisis de regresión de Cox para el estudio de los factores de riesgo de SG y SLE. El análisis estadístico se realizó utilizando SPSS® Statistics Version 22.
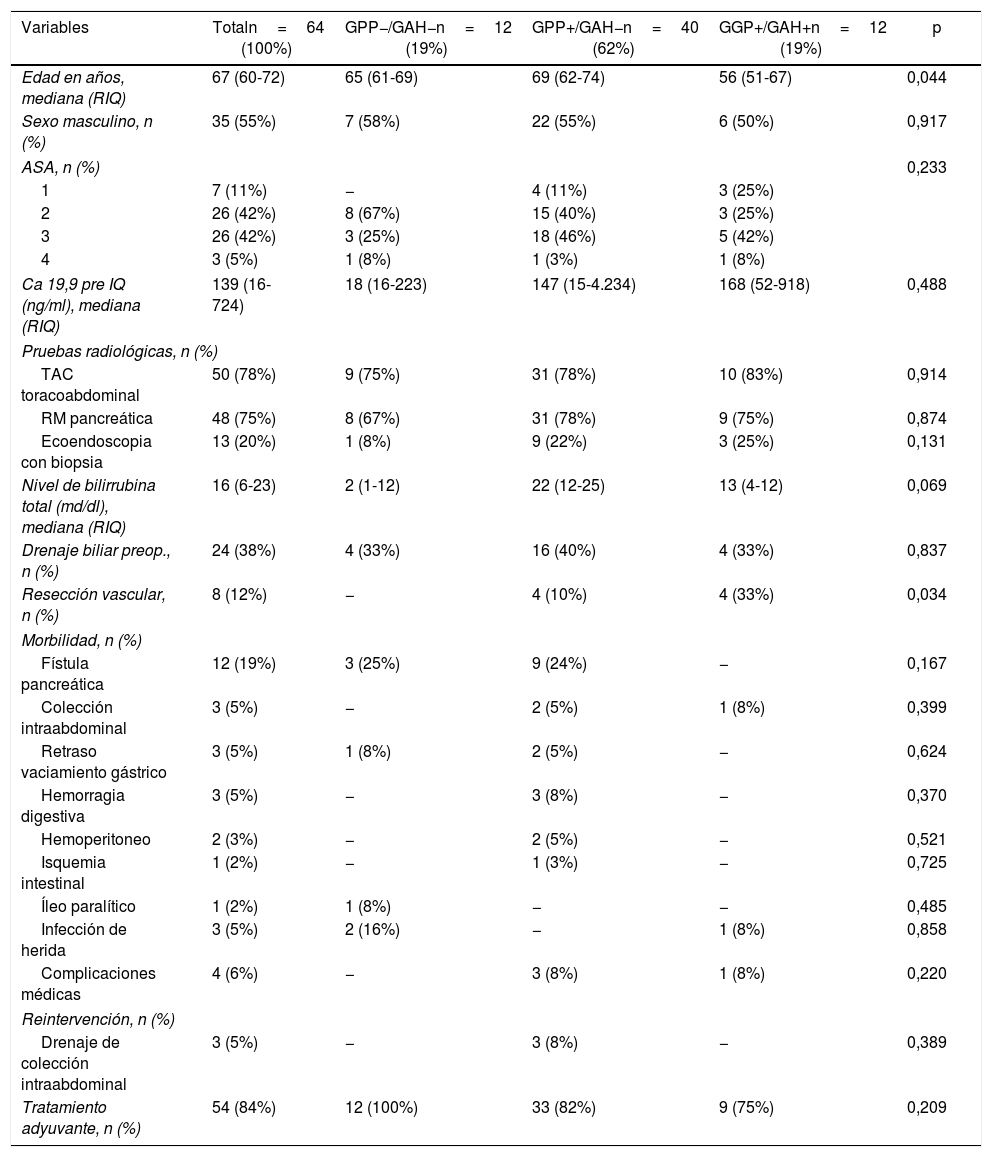
ResultadosCaracterísticas de los pacientes y seguimiento postoperatorioDurante el período de estudio se intervinieron 118 pacientes de DPC por ADK de cabeza de páncreas en nuestro centro, de los cuales se incluyeron en el estudio 64 pacientes en los que el GAH común y los GPP fueron identificados intraoperatoriamente y analizados histológicamente de forma independiente. Las características de los pacientes aparecen reflejadas en la tabla 1. La mediana de seguimiento de la presente serie fue de 20meses (r: 1-159meses).
Características de los pacientes
| Variables | Totaln=64 (100%) | GPP−/GAH−n=12 (19%) | GPP+/GAH−n=40 (62%) | GGP+/GAH+n=12 (19%) | p |
|---|---|---|---|---|---|
| Edad en años, mediana (RIQ) | 67 (60-72) | 65 (61-69) | 69 (62-74) | 56 (51-67) | 0,044 |
| Sexo masculino, n (%) | 35 (55%) | 7 (58%) | 22 (55%) | 6 (50%) | 0,917 |
| ASA, n (%) | 0,233 | ||||
| 1 | 7 (11%) | − | 4 (11%) | 3 (25%) | |
| 2 | 26 (42%) | 8 (67%) | 15 (40%) | 3 (25%) | |
| 3 | 26 (42%) | 3 (25%) | 18 (46%) | 5 (42%) | |
| 4 | 3 (5%) | 1 (8%) | 1 (3%) | 1 (8%) | |
| Ca 19,9 pre IQ (ng/ml), mediana (RIQ) | 139 (16-724) | 18 (16-223) | 147 (15-4.234) | 168 (52-918) | 0,488 |
| Pruebas radiológicas, n (%) | |||||
| TAC toracoabdominal | 50 (78%) | 9 (75%) | 31 (78%) | 10 (83%) | 0,914 |
| RM pancreática | 48 (75%) | 8 (67%) | 31 (78%) | 9 (75%) | 0,874 |
| Ecoendoscopia con biopsia | 13 (20%) | 1 (8%) | 9 (22%) | 3 (25%) | 0,131 |
| Nivel de bilirrubina total (md/dl), mediana (RIQ) | 16 (6-23) | 2 (1-12) | 22 (12-25) | 13 (4-12) | 0,069 |
| Drenaje biliar preop., n (%) | 24 (38%) | 4 (33%) | 16 (40%) | 4 (33%) | 0,837 |
| Resección vascular, n (%) | 8 (12%) | − | 4 (10%) | 4 (33%) | 0,034 |
| Morbilidad, n (%) | |||||
| Fístula pancreática | 12 (19%) | 3 (25%) | 9 (24%) | − | 0,167 |
| Colección intraabdominal | 3 (5%) | − | 2 (5%) | 1 (8%) | 0,399 |
| Retraso vaciamiento gástrico | 3 (5%) | 1 (8%) | 2 (5%) | − | 0,624 |
| Hemorragia digestiva | 3 (5%) | − | 3 (8%) | − | 0,370 |
| Hemoperitoneo | 2 (3%) | − | 2 (5%) | − | 0,521 |
| Isquemia intestinal | 1 (2%) | − | 1 (3%) | − | 0,725 |
| Íleo paralítico | 1 (2%) | 1 (8%) | − | − | 0,485 |
| Infección de herida | 3 (5%) | 2 (16%) | − | 1 (8%) | 0,858 |
| Complicaciones médicas | 4 (6%) | − | 3 (8%) | 1 (8%) | 0,220 |
| Reintervención, n (%) | |||||
| Drenaje de colección intraabdominal | 3 (5%) | − | 3 (8%) | − | 0,389 |
| Tratamiento adyuvante, n (%) | 54 (84%) | 12 (100%) | 33 (82%) | 9 (75%) | 0,209 |
ASA: American Society of Anesthesiology; GAH: ganglios arteria hepática; GPP: ganglios peripancreáticos; RIQ: rango intercuartílico.
Con respecto a los grupos de estudio, tanto los GPP como el GAH fueron negativos en 12 pacientes (GPP−/GAH−, 19%), los GPP positivos con GAH fueron negativos en 40 pacientes (GPP+/GAH−, 62%) y los GPP positivos con GAH positivo en 12 pacientes (GPP+/GAH+, 19%). Ningún paciente en nuestra serie presentó GPP negativos con GAH positivo (GPP−/GAH+, 0%). La media de resección de ganglios en toda la serie fue de 13 ganglios (r: 5-24). No obstante, en dos pacientes en el grupo GPP+/GAH− y en el grupo GPP+/GAH+ el global de ganglios resecados fue de 5, con dos y tres ganglios afectos, respectivamente, incluyendo el GAH en el último grupo, sin afectar a la estadificación final del tumor.
La morbilidad postoperatoria se registró en 32 pacientes (50%). En la tabla 1 se analizan cada una de las complicaciones posquirúrgicas por grupos. La mortalidad postoperatoria global fue del 3% (n=2), los dos en el grupo GPP+/GAH−, debido a isquemia intestinal y tromboembolismo pulmonar, respectivamente. De forma que, según la clasificación Clavien-Dindo, el 53% fueron complicaciones gradoI, el 16% gradoII, el 16% gradoIIIa, el 9% gradoIIIb con necesidad de reintervención para drenaje de colecciones intraabdominales secundarias a fístula pancreática, y el 6% gradoV, correspondientes a los dos casos anteriormente descritos.
En la tabla 2 se describen las características histopatológicas del tumor.
Características histopatológicas del tumor
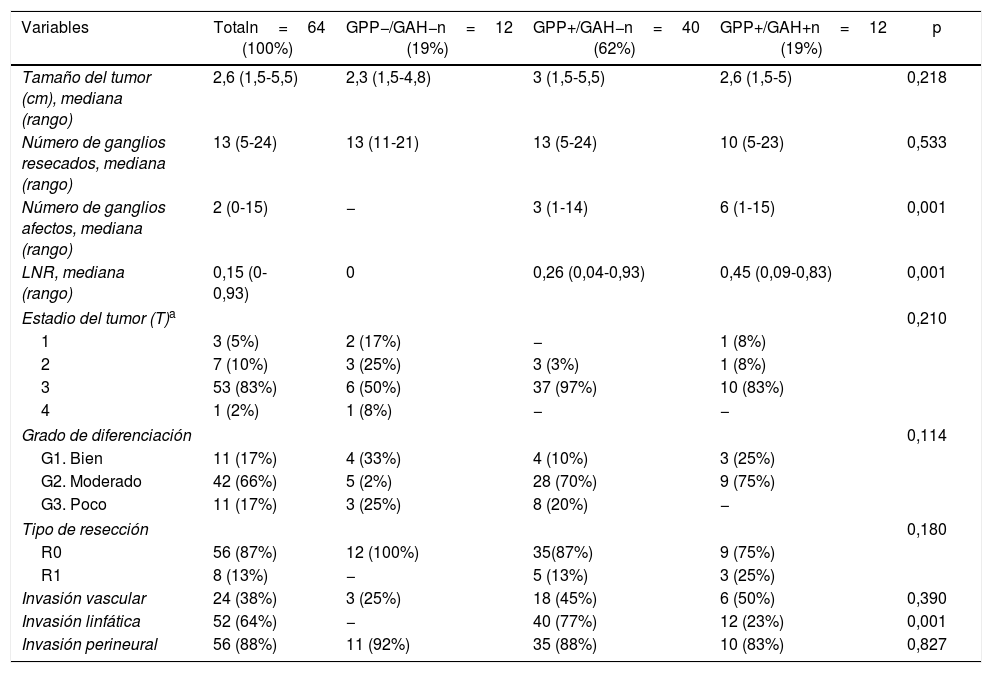
| Variables | Totaln=64 (100%) | GPP−/GAH−n=12 (19%) | GPP+/GAH−n=40 (62%) | GPP+/GAH+n=12 (19%) | p |
|---|---|---|---|---|---|
| Tamaño del tumor (cm), mediana (rango) | 2,6 (1,5-5,5) | 2,3 (1,5-4,8) | 3 (1,5-5,5) | 2,6 (1,5-5) | 0,218 |
| Número de ganglios resecados, mediana (rango) | 13 (5-24) | 13 (11-21) | 13 (5-24) | 10 (5-23) | 0,533 |
| Número de ganglios afectos, mediana (rango) | 2 (0-15) | − | 3 (1-14) | 6 (1-15) | 0,001 |
| LNR, mediana (rango) | 0,15 (0-0,93) | 0 | 0,26 (0,04-0,93) | 0,45 (0,09-0,83) | 0,001 |
| Estadio del tumor (T)a | 0,210 | ||||
| 1 | 3 (5%) | 2 (17%) | − | 1 (8%) | |
| 2 | 7 (10%) | 3 (25%) | 3 (3%) | 1 (8%) | |
| 3 | 53 (83%) | 6 (50%) | 37 (97%) | 10 (83%) | |
| 4 | 1 (2%) | 1 (8%) | − | − | |
| Grado de diferenciación | 0,114 | ||||
| G1. Bien | 11 (17%) | 4 (33%) | 4 (10%) | 3 (25%) | |
| G2. Moderado | 42 (66%) | 5 (2%) | 28 (70%) | 9 (75%) | |
| G3. Poco | 11 (17%) | 3 (25%) | 8 (20%) | − | |
| Tipo de resección | 0,180 | ||||
| R0 | 56 (87%) | 12 (100%) | 35(87%) | 9 (75%) | |
| R1 | 8 (13%) | − | 5 (13%) | 3 (25%) | |
| Invasión vascular | 24 (38%) | 3 (25%) | 18 (45%) | 6 (50%) | 0,390 |
| Invasión linfática | 52 (64%) | − | 40 (77%) | 12 (23%) | 0,001 |
| Invasión perineural | 56 (88%) | 11 (92%) | 35 (88%) | 10 (83%) | 0,827 |
GAH: ganglios arteria hepática; GPP: ganglios peripancreáticos; LNR: lymph node ratio.
El 84% recibieron quimioterapia adyuvante basada en gemcitabina. El 75% presentaron recidiva de la enfermedad durante el período de seguimiento. El 36% presentaron recidiva local y sistémica tras un tiempo libre de enfermedad de 11meses (r: 1-49). En un 35% solo se objetivó recidiva sistémica tras un tiempo libre de enfermedad de 9meses (r: 1-66) y en un 4% solo recidiva local tras un tiempo libre de enfermedad de 5meses (r: 2-24 meses).
Análisis de la supervivenciaLa mediana de SG del total de la serie fue de 20meses (r: 1-159meses), con una SLE de 12meses (r: 1-159meses), sin objetivar pérdidas de seguimiento durante el período de estudio.
La mediana de SG entre los grupos fue: GPP−/GAH− 64meses (r: 16-130meses); GPP+/GAH− 18meses (r: 1-159meses) y GPP+/GAH+ 13meses (r: 6-78meses). La mediana de SLE entre los grupos fue: GPP−/GAH− 34meses (r: 2-130meses); GPP+/GAH− 8meses (r: 1-159meses) y GGP+/GAH+ 12meses (r: 1-66meses). Si bien hubo diferencias significativas tanto en la SG (p=0,007) como en la SLE (p=0,030) entre aquellos pacientes sin afectación adenopática vs los grupos con afectación adenopática, la mediana de SG de los pacientes con GPP+ no mostró diferencias significativas dependiendo o no de la afectación del GAH (p=0,195) ni tampoco respecto a la mediana de SLE (p=0,617).
La SG a 1, 3 y 5 años fue estadísticamente mejor en el grupo GPP−/GAH− (82, 72 y 54%) que en el grupo GPP+/GAH− (68, 29 y 21%) y grupo GAH+ (72, 9 y 9%) (fig. 1). La probabilidad acumulada de recidiva de la enfermedad a 1, 3 y 5años fue estadísticamente inferior en el grupo GPP−/GAH− (18, 46 y 55%) comparado con el grupo GPP+/GAH− (57, 80 y 89%) y grupo GGP+/GAH+ (46, 91 y 100%) (fig. 2).
Análisis de los factores de riesgo de SG y SLELos factores de riesgo estudiados para la SG y la SLE fueron los siguientes: edad, sexo, niveles de Ca19.9, morbilidad global, diámetro del tumor y la diferenciación, la estadificación (T/N), R0/R1, el lymph node ratio (LNR), la invasión microvascular, linfática y perineural y el tratamiento adyuvante.
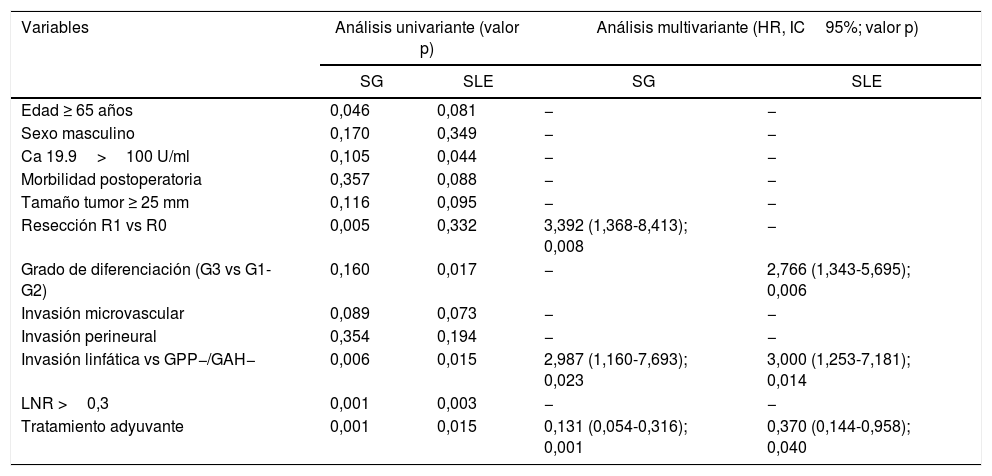
El principal factor de riesgo de SG en nuestra serie tanto en análisis univariante como multivariante resultó ser la invasión linfática (HR: 2,987; IC95%: 1,160-7,693) y la resección R1 vs R0 (HR: 3,39; IC95%: 1,368-8,413) y el tratamiento adyuvante como factor protector (HR: 0,13; IC95%: 0,054-0,316) (tabla 3).
Análisis de los factores de riesgo de supervivencia global (SG) y supervivencia libre de enfermedad (SLE)
| Variables | Análisis univariante (valor p) | Análisis multivariante (HR, IC95%; valor p) | ||
|---|---|---|---|---|
| SG | SLE | SG | SLE | |
| Edad ≥ 65 años | 0,046 | 0,081 | − | − |
| Sexo masculino | 0,170 | 0,349 | − | − |
| Ca 19.9>100 U/ml | 0,105 | 0,044 | − | − |
| Morbilidad postoperatoria | 0,357 | 0,088 | − | − |
| Tamaño tumor ≥ 25 mm | 0,116 | 0,095 | − | − |
| Resección R1 vs R0 | 0,005 | 0,332 | 3,392 (1,368-8,413); 0,008 | − |
| Grado de diferenciación (G3 vs G1-G2) | 0,160 | 0,017 | − | 2,766 (1,343-5,695); 0,006 |
| Invasión microvascular | 0,089 | 0,073 | − | − |
| Invasión perineural | 0,354 | 0,194 | − | − |
| Invasión linfática vs GPP−/GAH− | 0,006 | 0,015 | 2,987 (1,160-7,693); 0,023 | 3,000 (1,253-7,181); 0,014 |
| LNR >0,3 | 0,001 | 0,003 | − | − |
| Tratamiento adyuvante | 0,001 | 0,015 | 0,131 (0,054-0,316); 0,001 | 0,370 (0,144-0,958); 0,040 |
GAH: ganglios arteria hepática; GPP: ganglios peripancreáticos; HR: hazzard ratio; IC95%: intervalo de confianza del 95%; LNR: lymph node ratio.
Con respecto al análisis de los factores de riesgo de SLE, la afectación linfática (HR: 2,8; IC95%: 1,171-6,719) y el grado de diferenciación (G3 vs G1-G2) (HR: 2,76; IC95%: 1,343-5,695) resultaron estadísticamente significativos tanto en el análisis univariante como multivariante, siendo el tratamiento adyuvante factor protector (HR: 0,3; IC95%: 0,138-0,914) (tabla 3).
DiscusiónSe ha demostrado que la presencia de metástasis ganglionares es un factor pronóstico independiente en los pacientes intervenidos por ADK de páncreas7, y que además la localización de estas también se relaciona de forma significativa con el pronóstico. El GAH, por su fácil acceso y disección y ser anatómicamente constante, podría representar un papel de ganglio centinela en el ADK de páncreas. En algunos artículos10-12,14 hacen referencia a que ayudaría a identificar a los pacientes con peor pronóstico a largo plazo tras la realización de una cirugía con intención curativa. No obstante, observamos resultados contradictorios en la literatura.
En estudios previos como el realizado por Connor et al.12, donde se evaluaba el significado de la afectación de LN8 y LN16 en la supervivencia de los pacientes intervenidos de tumores periampulares, reportaron 54 pacientes donde el LN8 fue analizado de forma independiente, encontrando una disminución significativa en la mediana de supervivencia en los pacientes con metástasis a ese nivel, siendo la afectación del LN8 factor pronóstico independiente en el análisis multivariante. Por otra parte, Maithel et al.14, en un estudio donde analizaban la correlación radiológica entre las adenopatías de la arteria hepática y la vía biliar en términos de resecabilidad y supervivencia en pacientes con tumores periampulares resecados, demostraron en un análisis de subgrupos 49 pacientes, en los que se había recuperado y analizado individualmente el GAH, que los pacientes que presentaban afectación metastásica a dicho nivel tenían una disminución significativa de la supervivencia similar a los pacientes con carcinomatosis o metástasis hepáticas. En estos estudios se incluyeron pacientes con diferentes tipos histológicos, por lo que es difícil llegar a una conclusión concordante y realizar un correcto análisis de supervivencia.
Posteriormente Cordera et al.11 evaluaron 55 pacientes intervenidos de DPC por ADK de páncreas de los cuales 10 tenían afectación metastásica del GAH, hallando en estos pacientes peor SG. Similares resultados publicaron LaFemina et al.10 en un estudio que incluía únicamente pacientes intervenidos de DPC por ADK de páncreas. Encontraron que en un total de 147 pacientes, 23 presentaron afectación del GAH, hallando en estos una peor SG y SLE estadísticamente significativa.
Sin embargo, en la línea de nuestro trabajo, Philips et al.25 analizaron la relevancia pronóstica del GAH en un total de 247 pacientes intervenidos de DPC por ADK de páncreas, de los cuales 41 presentaba metástasis a ese nivel, hallando una peor SG en los pacientes con afectación del GAH pero sin diferencias significativas con respecto a aquellos con afectación linfática tanto del GAH como de los GPP. En nuestro estudio el 19% presentaron afectación del GAH y GPP y en el 62% afectación de los GPP sin afectación del GAH. Pudimos comprobar que la SG fue similar en ambos grupos y fue estadísticamente inferior a aquellos sin afectación adenopática. Con respecto a la probabilidad acumulada de recidiva tampoco hubo diferencias entre el grupo GPP+/GAH+ y el grupo GPP+/GAH−, pero sí estadísticamente más elevada que en los pacientes sin afectación adenopática, lo que demuestra que más que la afectación del GAH, es la afectación ganglionar lo que determina finalmente la supervivencia en los pacientes con ADK de páncreas.
Por otra parte, no identificamos casos de afectación aislada de GAH en nuestra serie, lo cual es consistente con otros estudios similares donde su presencia ha sido extremadamente rara (1,2-2%) y sugiere que el GAH no es un primer escalón de diseminación linfática, y que su afectación podría estar relacionada con una mayor carga tumoral y tumores biológicamente más agresivos, tal como ha sido señalado en otras publicaciones9,10,25.
Finalmente, el análisis multivariante de los factores de riesgo tanto de la SG como de la SLE de nuestra serie demostró que la afectación adenopática resultó ser el principal factor de mal pronóstico. Si bien el margen de resección afecto impactó en la SG, no fue así en la SLE mayormente condicionada por el grado de diferenciación tumoral. Ni los valores de marcador tumoral preoperatorios ni la afectación vascular resultaron significativos en comparación con otras series3,26-28. Aunque los valores de Ca19.9 son discretamente superiores en el grupo con afectación adenopática, no hubo diferencias significativas entre grupos ni tampoco pudimos demostrar su impacto en la supervivencia. Panaro et al.29 han demostrado recientemente que la invasión microvascular, la afectación del margen y linfática fueron los principales factores de riesgo en análisis univariante tanto de SLE como de SG, y que la invasión microvascular es el principal factor determinante de supervivencia a largo plazo. Otros estudios recientes30,31, en cambio, reportaron que la afectación linfática está asociada a recidiva precoz y peor pronóstico a largo plazo, independientemente de la afectación del margen u de la invasión vascular. En definitiva, esto demuestra que el ADK de páncreas es una enfermedad sistémica que requiere una quimioterapia adyuvante eficaz para control de la enfermedad, resultando ser el principal factor protector consistente con lo publicado en la literatura32,33.
A pesar de las limitaciones de nuestro estudio, debido al carácter retrospectivo del mismo y a un limitado tamaño muestral diferente en cada grupo, los resultados de nuestra experiencia inicial sugieren que la afectación del GAH está asociada con afectación de los GPP y, por tanto, con una mayor carga tumoral y peor comportamiento biológico. Teniendo en cuenta que el GAH es positivo entre el 10 y el 24% de los pacientes11,12,24 (19% en nuestra serie), la identificación preoperatoria del mismo, bien mediante estadificación laparoscópica o biopsia por ecografía endoscópica, podría identificar preoperatoriamente un grupo de pacientes tributario de quimioterapia neoadyuvante.
No obstante, concluimos que, si bien la afectación adenopática impacta en la supervivencia a largo plazo del ADK de páncreas, no hemos podido identificar la afectación del GAH como marcador pronóstico per se y no debería ser considerado, hasta la fecha, como criterio de irresecabilidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Santiago Pérez-Hoyos, bioestadístico de la Unidad de Estadística y Bioinformática, del Institut de Recerca del Vall d’Hebron, por la revisión del análisis estadístico.