La infección de localización quirúrgica se asocia a prolongación de la estancia hospitalaria, aumento de la morbilidad, mortalidad y gasto sanitario. La adherencia a paquetes sistematizados que incluyan medidas de prevención validadas científicamente consigue disminuir la tasa de infección postoperatoria. La Sección de Infección Quirúrgica de la Asociación Española de Cirujanos ha realizado una revisión crítica de la evidencia científica y las más recientes guías internacionales, para seleccionar las medidas con mayor grado de evidencia a fin de facilitar su aplicación en los servicios de cirugía españoles. Cuentan con mayor grado de evidencia: no eliminación del vello del campo quirúrgico o eliminación con maquinilla eléctrica, descontaminación de la piel con soluciones alcohólicas, profilaxis antibiótica sistémica adecuada (inicio 30-60 minutos antes de la incisión, uso preferente en monodosis, administración de dosis intraoperatoria si indicada), mantenimiento de la normotermia y el control de la glucemia perioperatoria.
Surgical site infection is associated with prolonged hospital stay and increased morbidity, mortality and healthcare costs, as well as a poorer patient quality of life. Many hospitals have adopted scientifically-validated guidelines for the prevention of surgical site infection. Most of these protocols have resulted in improved postoperative results. The Surgical Infection Division of the Spanish Association of Surgery conducted a critical review of the scientific evidence and the most recent international guidelines in order to select measures with the highest degree of evidence to be applied in Spanish surgical services. The best measures are: no removal or clipping of hair from the surgical field, skin decontamination with alcohol solutions, adequate systemic antibiotic prophylaxis (administration within 30-60minutes before the incision in a single preoperative dose; intraoperative re-dosing when indicated), maintenance of normothermia and perioperative maintenance of glucose levels.
La infección de localización quirúrgica (ILQ) es la infección relacionada con la asistencia sanitaria más prevalente en España (21,6%)1 y en Europa (19,6%)2, representando una importante carga económica para el sistema sanitario, con incremento del consumo de antibióticos y de la estancia media3.
Cerca del 50% de las ILQ se consideran evitables, por lo que su prevención debe ser una prioridad para las sociedades científicas. Periódicamente se publican guías con recomendaciones de prevención, pero su existencia no asegura su utilización4. La Sección de Infección Quirúrgica de la Asociación Española de Cirujanos, ha revisado la evidencia científica para sintetizar y poner en valor las medidas con mayor grado de evidencia, a fin de facilitar su aplicación en los servicios de cirugía españoles.
MétodosSe ha realizado una revisión de la literatura a través de PubMed y las plataformas: Tripdatabase, National Guideline Clearinghouse y The Cochrane Library. Se han consultado las guías clínicas o las páginas web de la Organización Mundial de la Salud (OMS)5, Centers for Disease Control and Prevention6, National Institute of Health and Clinical Excellence (NICE)7,8, Canadian Patient Safety Institute9, Society for Healthcare Epidemiology of America (SHEA)10, Infectious Diseases Society of America (IDSA)11, American College of Surgeons (ACS)12, National Health Service Scotland13, Ministerio de Sanidad, Servicios Sociales e Igualdad14 y Programa de Prevenció d’Infecció Quirúrgica (PREVINQ-CAT) de la Generalitat de Catalunya15. Se utilizó terminología MeSH bajo los descriptores: postoperative complications; surgical wound infection; anastomotic leak; prevention and control; y antibiotic prophylaxis. Se desarrollaron búsquedas adicionales mediante los términos: hair removal; skin antisepsis; decolonization; preoperative nutrition; oral antibiotic prophylaxis; mechanical colon preparation; suplemental oxygen; normothermia; normovolemia; glucose control; antiseptic sutures; wound retractor; wound irrigation; surgical site infection. Los criterios de inclusión fueron: guías de práctica clínica, estudios clínicos controlados, estudios de cohorte, metaanálisis y revisiones sistemáticas. La búsqueda bibliográfica, la revisión de los documentos seleccionados y la decisión de inclusión fueron realizadas por todos los investigadores firmantes.
Se recogieron y sintetizaron de forma ordenada las recomendaciones para facilitar la accesibilidad y consulta en el presente documento. Además, los miembros de la sección realizaron una puesta en común para decidir las recomendaciones más importantes por orden de prioridad adaptadas a la aplicabilidad real en nuestro medio.
En el manuscrito, el panel de expertos emite una recomendación ante una alta calidad de evidencia y una sugerencia ante una calidad moderada/baja de evidencia.
ResultadosMedidas preoperatoriasNutrición preoperatoriaLa desnutrición altera la cicatrización y la respuesta ante una infección postoperatoria. Existe confusión entre la optimización del estado nutricional y el uso de la «inmunonutrición», que consiste en suplementos específicos orientados a mejorar el sistema inmune.
El paciente debe llegar adecuadamente nutrido a cualquier intervención electiva. La OMS5 recomienda la inmunonutrición de forma condicional (evidencia de baja calidad). Ante la discordancia de resultados, la heterogeneidad de los estudios y el elevado precio de las formulaciones, deberían realizarse más estudios independientes antes de poder incluirla en las recomendaciones para la reducción de ILQ. La inmunonutrición podría tener un papel en pacientes con desnutrición grave que van a ser sometidos a intervenciones mayores (sobre todo gastrointestinales y cardíacas)16–18.
Se recomienda la nutrición perioperatoria del paciente desnutrido. Se sugiere la inmunonutrición preoperatoria en los pacientes desnutridos con cáncer que van a ser sometidos a cirugía mayor.
Descontaminación con mupirocina nasalLa pomada nasal de mupirocina es una medida efectiva, segura y barata para la erradicación del estado de portador de Staphylococcus aureus(S. aureus)5.
La evidencia no es unánime y se centra mayoritariamente en la cirugía cardíaca y ortopédica19–22. Habría evidencia insuficiente/de baja calidad sobre la descontaminación nasal para reducir la tasa de ILQ en cirugía cardíaca23.
No se recomienda el cribado sistemático y la descolonización de los portadores de S. aureus previamente a la cirugía general.
Suspensión del tratamiento inmunomodulador antes de la intervenciónLa terapia inmunosupresora sistémica, en pacientes trasplantados o con enfermedades inflamatorias, se considera un factor de riesgo para la ILQ24,25. Su discontinuación preoperatoria conllevaría asimismo riesgos, como el rechazo o la agudización de la enfermedad de base26.
La mayor parte de los estudios se han centrado en metotrexate, agentes biológicos (principalmente anti-TNF) y corticosteroides. Con un bajo nivel de evidencia, se recomienda no detener dichos tratamientos5,6. Tampoco se recomienda la prolongación en la profilaxis antibiótica en pacientes con terapia inmunosupresora6.
No se recomienda la retirada de la terapia inmunosupresora sistémica previa a la cirugía mayor.
Baño/ducha preoperatorioPara la descontaminación de la piel antes de una intervención hay poca evidencia sobre el número de baños o duchas, el momento más adecuado o el tipo y número de aplicaciones de los jabones. La ducha preoperatoria con jabón de clorhexidina reduce más el inóculo bacteriano que el jabón de povidona yodada o el jabón no farmacológico27,28. Sin embargo, no se ha conseguido correlacionar dicha reducción de la microflora con una menor incidencia de ILQ29–32. Se sugiere que ello puede ser debido al heterogéneo modo de aplicación del jabón (número de aplicaciones, tiempo de actuación, momento antes de la cirugía)33 y que se debería empoderar al paciente proporcionándole instrucciones precisas34. Se debe insistir en lavar adecuadamente axilas, ingles y pliegues, y en caso de jabones con clorhexidina, esperar el tiempo indicado (1-2 min) antes de aclarar. Todas las guías recomiendan un baño o ducha con agua y jabón o con jabones antisépticos5–15.
Se recomienda que el paciente se duche el mismo día de la intervención con un jabón de clorhexidina o con jabón no farmacológico, proporcionando la máxima información al paciente sobre el procedimiento a seguir.
Preparación mecánica del colonLa preparación mecánica de colon (PMC) con soluciones evacuantes no disminuye las complicaciones infecciosas ni la dehiscencia anastomótica cuando se utiliza sin antibióticos orales35–41, por lo que puede omitirse en la cirugía colorrectal electiva.
Las guías de la SHEA-IDSA10 y la OMS5 coinciden en proponerla solo si se utiliza en combinación con antibióticos orales.
No se recomienda la preparación mecánica de colon aislada como medida de prevención de ILQ en cirugía colorrectal.
Profilaxis antibiótica vía oral en cirugía colorrectalLos estudios aleatorizados y metaanálisis muestran que los antibióticos orales combinados con PMC reducen el riesgo de ILQ superficial, profunda y de órgano espacio (O/E)5,42–47. Hasta ahora, ninguno de estos estudios analizaba el efecto de los antibióticos orales en ausencia de PMC. Un estudio aleatorizado exclusivamente en cirugía de colon48 no halla disminución de ILQ comparando PMC y antibiótico oral con ausencia de preparación. No obstante, el estudio tiene poca potencia estadística para detectar la reducción del 4% de ILQ que obtuvo el grupo de preparación49. En cambio, amplios estudios poblacionales hallan menor incidencia de ILQ y otras complicaciones50–55. El riesgo de colitis por Clostridium difficile es bajo46. El efecto de los antibióticos orales en ausencia de PMC no queda suficientemente definido, debido a la falta de estudios controlados y el escaso número de pacientes con esta modalidad en estudios poblacionales. Las dos únicas guías que abordan este tema los recomiendan en combinación con PMC5,10. La evidencia actual no permite recomendar una pauta antibiótica frente a otra (incluyendo momento de administración y dosis). Algunas de las más utilizadas son aminoglucósidos en combinación con anaerobicidas (metronidazol o eritromicina). Se deben cubrir necesariamente bacterias gramnegativas facultativas y anaerobios, y son preferibles los antibióticos no absorbibles vía entérica.
Se recomienda la profilaxis antibiótica por vía oral asociada a la preparación mecánica de colon en cirugía colorrectal.
Profilaxis antibiótica adecuadaLa profilaxis antibiótica es fundamental para la reducción de ILQ en los procedimientos en los que está indicada. Se deben alcanzar concentraciones terapéuticas en los tejidos en el momento de la incisión y durante toda la intervención. En el caso de los betalactámicos más utilizados, por su volumen de distribución y vida media, se considera óptima la administración intravenosa 30-60 min antes de la incisión.
Para poder considerar adecuada la profilaxis antibiótica deben cumplirse los criterios de indicación, dosificación, momento de infusión y duración que se especifican en la tabla 15–15. El checklist de seguridad quirúrgica de la OMS la incluye como elemento a comprobar antes de comenzar la intervención.
Criterios para considerar adecuada la profilaxis antibiótica en cirugía
| Indicación según el tipo de cirugía y su grado de contaminación anticipado (no se recomienda de rutina en cirugías limpias cortas sin colocación de prótesis o en procedimientos menores) |
| Ajuste al tipo de paciente (índice de masa corporal, función renal o hepática y variables que puedan afectar la distribución del antibiótico) |
| Atención al tipo de antibiótico: debe cubrir los microorganismos habituales sin favorecer resistencia |
| Correcta vía de administración: en general intravenosa |
| Momento y lugar de administración: en el antequirófano (30-60 minutos antes de iniciar la intervención, en todo caso no>120 minutos) |
| Repetición intraoperatoria de dosis: cuando la intervención se prolonga más de dos veces la vida media real del antibiótico (desde la finalización de la infusión de la primera dosis del antibiótico) o hay hemorragia perioperatoria superior a 1500 ml |
| Duración adecuada: generalmente una única dosis |
Se recomienda la profilaxis antibiótica sistémica adecuada, en general en monodosis. Se recomiendan redosificaciones que proporcionen niveles terapéuticos óptimos durante toda la intervención.
Prolongación de la profilaxis antibióticaLa duración excesiva es el error más frecuente en el uso de la profilaxis56 y se asocia a aumento de toxicidad, costes y resistencias bacterianas. La administración de antibióticos tras el cierre de la herida no disminuye el riesgo de ILQ (recomendación fuerte)5,10,12,57.
Se recomienda no prolongar la profilaxis antibiótica más de 24 h.
Eliminación del vello cutáneoEl vello puede interferir con la exposición operatoria, pero su retirada conlleva microtraumatismos cutáneos por corte, abrasión química o reacciones cutáneas en función del agente empleado (cuchillas, maquinillas rasuradoras o crema depilatoria)12. Las guías5–9,12,58 señalan que es una medida cuestionable. El riesgo de ILQ es comparable si no se retira el vello o si se retira con maquinilla eléctrica con cabezal desechable, pero es más elevado con afeitado con cuchilla o cremas depilatorias5.
Se recomienda no retirar de forma rutinaria el vello del campo quirúrgico. En caso de considerarse necesario, se debe eliminar fuera del área quirúrgica, poco tiempo antes del inicio de la intervención y mediante corte con maquinilla eléctrica.
Medidas intraoperatoriasPreparación/lavado de manosLas bacterias residentes en la piel del equipo quirúrgico pueden ser causa de ILQ59,60. Los antisépticos más empleados para la higiene de manos han sido soluciones jabonosas de clorhexidina o povidona. Los alcoholes actúan con rapidez y tienen amplio espectro, pero su acción antibacteriana no es persistente ni acumulativa y se deben combinar con otros antisépticos, como clorhexidina, que posee un alto efecto residual.
Al lavado de manos se deben asociar medidas como evitar uñas artificiales, llevar las uñas recortadas, limpiar el espacio subungueal o retirar anillos y pulseras. Si las manos no están visiblemente sucias, no hay diferencias entre el lavado con soluciones jabonosas de povidona al 7,5%-10% o clorhexidina al 4% o la aplicación de una solución alcohólica.
Es recomendable un primer lavado del día con un cepillo para las uñas y una solución jabonosa antiséptica durante 5 min. Si no se abandona el bloque quirúrgico, los sucesivos lavados entre intervenciones se pueden realizar también con jabón antiséptico o con soluciones alcohólicas durante 2 min (dos tandas de 60 segundos dejando secar completamente al final del procedimiento), dejando que el producto se evapore5,61.
Se recomienda que la primera higiene quirúrgica de manos del día sea con soluciónjabonosa antiséptica, de 5 min, y que incluya manos, antebrazos y codos.
Las ulteriores preparaciones quirúrgicas pueden ser con jabón antiséptico o con solución alcohólica, dejando que se evapore de la piel.
Antisepsia de la pielLa antisepsia del campo quirúrgico reduce la incidencia de ILQ5,10. Las soluciones de clorhexidina parecen más eficaces que las de povidona yodada en cirugía limpia o limpia-contaminada5,62–64. Las soluciones alcohólicas, que suman dos antisépticos, son más eficaces que las acuosas5,6. La solución alcohólica de clorhexidina 2% tiene mayor efecto que la de 1% de povidona yodada (evidencia de calidad baja o moderada)65–68.
Los preparados de base alcohólica no pueden utilizarse en mucosas o tejido nervioso, en piel no indemne y en recién nacidos, donde se recomiendan soluciones acuosas de clorhexidina o povidona. Existe riesgo de ignición de las soluciones alcohólicas cuando se combinan con el bisturí eléctrico69, por lo que hay que minimizar la cantidad que se aplica, evitar su derramamiento sobre los paños quirúrgicos y dejar secar al aire un mínimo de tres min antes de la colocación de la cobertura quirúrgica. Debido a la posibilidad de contaminación de los envases de antisépticos, se recomienda utilizar botellas monodosis. Los antisépticos con categoría de medicamento son más fiables que los biocidas. Los aplicadores estériles monodosis pueden aumentar la seguridad del uso de soluciones alcohólicas.
En piel indemne se recomienda descontaminar la piel con una solución alcohólica, con gluconato de clorhexidina al 2% con 70% de alcohol o povidona yodada al 5% en 70% de alcohol, en cantidad y extensión adecuadas.
En mucosas o piel con heridas abiertas, se recomienda un antiséptico de base acuosa con clorhexidina al 2% o con povidona yodada al 10%.
Se recomienda que todos los antisépticos actúen sobre la piel al menos durante 3 min y se dejen secar al aire por completo antes de colocar la cobertura quirúrgica.
Cuando se utilicen soluciones alcohólicas, se recomienda extremar las medidas de seguridad para evitar el riesgo de incendios y quemaduras.
Ropa operatoria/campos quirúrgicosLos paños quirúrgicos y las batas estériles minimizan la contaminación, pero pierden su función si se humedecen. La OMS sugiere que los campos y batas no reutilizables y los reutilizables son equivalentes (recomendación condicional, calidad de evidencia moderada-muy baja)5. Los factores de coste, protección y comodidad son razonablemente similares, pero el material desechable presenta problemas de sostenibilidad (gasto de recursos naturales y agua, huella de carbono y desechos sólidos)70.
Hay poca evidencia sobre la vestimenta del personal del área quirúrgica. La Joint Commission, y el ACS apoyan el uso de gorros quirúrgicos desechables y cubrir la boca, la nariz y el pelo craneal durante todos los procedimientos invasivos; que las mascarillas quirúrgicas no queden desatadas y colgando; un gorro quirúrgico que cubra el cabello, con retirada o cobertura de las joyas de cabeza y cuello; así como abandonar el área quirúrgica con un atuendo diferente al utilizado en ella y nunca salir con la misma vestimenta fuera del perímetro hospitalario.
Se recomienda el uso de mascarillas y gorros cubriendo el pelo, además de campos quirúrgicos y ropa operatoria estériles.
No se recomienda utilizar la vestimenta del área quirúrgica fuera de ella.
Protectores de plástico adhesivo sobre el campo quirúrgicoLos plásticos transparentes adhesivos colocados sobre el campo quirúrgico71 aumentan la ILQ y no son actualmente recomendados72. Existen plásticos adhesivos impregnados en sustancias antimicrobianas, normalmente yodóforos, que tampoco aportan un claro beneficio73–76. No obstante, las recomendaciones NICE indican que se usen plásticos yodóforos en caso de ser necesarios para fijar los paños7.
No se recomienda utilizar protectores de plástico adhesivo sobre el campo quirúrgico.
Utilización de sellantes cutáneosLos sellantes son sustancias químicas que forman una película protectora sobre la piel con la intención de actuar como barrera y bloquear el paso de bacterias a la herida. La evidencia a su favor es de baja calidad y no muestra beneficio5. En nuestro medio los sellantes no se utilizan de forma rutinaria. Con la evidencia disponible, en un sistema de salud público no estaría justificada su utilización por una cuestión de coste-beneficio.
No se recomienda utilizar sellantes cutáneos sobre el campo quirúrgico.
Protección de los márgenes de la herida quirúrgicaLa aplicación de barreras físicas impermeables en los bordes de la herida disminuye significativamente la tasa de ILQ77,78. En laparotomía, los dispositivos plásticos de un solo aro no ofrecen una protección significativa, mientras que los de doble aro parecen disminuir significativamente el riesgo de infección5,79–81.
Se recomienda la utilización de protectores plásticos para proteger los márgenes de la herida quirúrgica, preferiblemente de doble anillo.
NormoglucemiaLa hiperglucemia perioperatoria se relaciona con aumento de la ILQ. Para su prevención, se debe establecer un control no estricto de la glucemia, tanto en pacientes diabéticos como no diabéticos. Durante la fase intraoperatoria y en el postoperatorio inmediato, el objetivo es tratar la hiperglucemia con insulina rápida para mantener niveles alrededor de 150-200mg/dl (8,3 mmol/l - 11,1 mmol/l). Un control estricto, con valores <150mg/dl, puede resultar perjudicial por el alto porcentaje de hipoglucemias5–7,15.
Se recomienda el control no estricto de la glucemia perioperatoria en cirugía mayor en pacientes diabéticos y no diabéticos, con el objetivo de alcanzar niveles por debajo de 150-200mg/dl (8,3 mmol/l - 11,1 mmol/l).
NormovolemiaLa recomendación actual se basa en una reanimación guiada por objetivos («goal-directed fluid therapy»), para evitar el déficit hemodinámico sistémico y local del espacio quirúrgico5. Se ha observado una correlación entre el tiempo de hipotensión intraoperatoria y la tasa de ILQ82, así como con un compromiso de la vascularización y oxigenación de las anastomosis intestinales83,84.
Se recomienda evitar la hipotensión perioperatoria y el exceso de volumen que produzca edema de los tejidos y una expansión significativa del volumen extracelular, situaciones que pueden interferir tanto en la cicatrización correcta de las anastomosis y suturas como en la biodisponibilidad correcta de los antibióticos profilácticos.
NormotermiaLa hipotermia perioperatoria se asocia a una mayor tasa de ILQ y mayores pérdidas sanguíneas. No existe consenso sobre el mejor método para la medición de la temperatura (la temperatura central mediante la sonda esofágica puede ser la más fiable), ni sobre el método para el calentamiento (aire caliente a presión, sistemas de calentamiento de fluidos, colchonetas térmicas) en pacientes con campos quirúrgicos complejos5–15.
Se recomienda mantener la temperatura central del paciente por encima de 36°C durante todo el periodo perioperatorio en todos los procedimientos de>30 min de duración.
OxigenaciónLa hiperoxigenación perioperatoria, con un aumento de la fracción de oxígeno inspirado (FiO2) del 80% de los pacientes sometidos a anestesia general con intubación endotraqueal, se ha propuesto como medida para mejorar la cicatrización de las anastomosis digestivas, adecuar la respuesta inflamatoria local perioperatoria y disminuir la ILQ5. Las altas concentraciones de oxígeno perioperatorio no parecen ser perjudiciales, pero los resultados clínicos son discordantes85,86. Las iniciales recomendaciones de la OMS fueron controvertidas y han generado nuevos metaanálisis que han hecho reconsiderar la recomendación87.
No se recomienda la hiperoxia durante el periodo perioperatorio.
Sistemas de ventilación con flujo laminar en quirófanoLa existencia de gérmenes en concentración suficiente en el ambiente del quirófano puede condicionar la aparición de ILQ. Algunos estudios muestran reducción en la concentración de gérmenes en el quirófano con los sistemas de flujo laminar88, aunque con un impacto incierto en la tasa de ILQ89. La literatura ofrece resultados contradictorios90–92. Los sistemas de ventilación con flujo laminar no aportan un beneficio clínico suficientemente para justificar el gasto de su instalación5.
No se recomienda la instalación de sistemas de ventilación con flujo laminar en los quirófanos de cirugía general.
Uso de doble guante quirúrgicoEl uso de guantes protege al personal sanitario de los fluidos orgánicos y reduce la transmisión de microorganismos desde las manos del personal93. El uso de doble guante disminuye la tasa de perforación del guante interno94, pero no hay evidencia directa de que los defectos en los guantes aumenten el riesgo de ILQ95.
A pesar de ello, las guías ACS, SHEA e IDSA recomiendan el uso rutinario de doble guante10,12. La OMS no halla suficiente evidencia para evaluar su efectividad ni de los criterios de cambio de guantes durante la operación o de los tipos de guantes5. NICE recomienda el uso de doble guante si hay alto riesgo de perforación y de riesgo para el personal7,8.
Se sugiere la utilización de doble guante para aumentar la protección a la contaminación tanto de los pacientes al equipo quirúrgico como del equipo quirúrgico a los pacientes.
Suturas con antisépticoLas suturas recubiertas con antisépticos reducen la colonización bacteriana in vitro. Existe controversia sobre su utilidad in vivo, con metaanálisis de resultados discordantes96–98. En general, los estudios tienen alta posibilidad de sesgo, son de baja calidad y presentan potenciales conflictos de interés. El metaanálisis más reciente muestra una reducción en la incidencia de ILQ con suturas impregnadas en triclosan99. Sin embargo, el beneficio es solo evidente con suturas de poliglactina 910 y no en suturas de polidioxanona. Su efecto parece ser independiente del tipo de cirugía realizada y de la contaminación de la misma, aunque en los estudios de alta calidad el efecto solo se mantiene en cirugía limpia.
NICE, los CDC y la OMS sugieren considerar su uso en todo tipo de intervenciones5,6,8. La OMS considera necesario realizar más estudios, analizar otro tipo de antisépticos y considerar variables como la disponibilidad y los costes, en función del ámbito en el que se trabaja.
Se sugiere la utilización de suturas impregnadas con antiséptico en cirugía limpia y limpia-contaminada.
Irrigación de la herida quirúrgicaLa irrigación de la herida al finalizar la intervención pretende reducir la carga bacteriana, detritus y cuerpos extraños. Existen estudios que analizan la irrigación con suero fisiológico, soluciones antisépticas y antibióticas con resultados no concluyentes. Los metaanálisis muestran gran heterogeneidad y baja calidad de los estudios. Sus conclusiones son contradictorias, especialmente en las soluciones antibióticas y antisépticas, que implican una posible toxicidad y un potencial aumento de las resistencias bacterianas a los fármacos utilizados.
En un metaanálisis100 la irrigación con cualquier solución fue superior a la ausencia de lavado. Los análisis de subgrupos mostraron significación en cirugía colorrectal, así como mayor efecto de las soluciones antibióticas contra las de povidona. Otro metaanálisis101, mostró que la irrigación con solución salina a presión reduce la ILQ y que la solución acuosa de povidona-yodada podría ser beneficiosa, particularmente en cirugía limpia y limpia-contaminada (recomendación condicional, baja calidad de evidencia). La irrigación con antibióticos no prevendría la ILQ (recomendación condicional, baja calidad de evidencia). En 2019, nuevos metaanálisis no recomiendan la irrigación con povidona yodada102, pero hallan que las irrigaciones con antibióticos betalactámicos podrían ser efectivas103, aunque debido a la calidad de los estudios se concluye que no se puede afirmar ni excluir la eficacia de los lavados con antibióticos.
La irrigación de la herida quirúrgica podría tener un efecto beneficioso sobre la ILQ, al eliminar detritus, coágulos y potencialmente disminuir el inóculo bacteriano después de una cirugía contaminada. Sin embargo, debido a la gran heterogeneidad de los ensayos, no se puede recomendar ningún régimen concreto en este momento.
Se sugiere la irrigación de las heridas al final de la intervención con una cantidad moderada de una solución a presión para eliminar detritus y cuerpos extraños.
Cambio del material quirúrgicoEl instrumental quirúrgico se puede contaminar durante la cirugía (por contacto con la microbiota cutánea o con bacterias del tracto digestivo). El cambio del material quirúrgico antes del cierre de la pared abdominal no cuenta con estudios controlados5. Sin embargo, parece obvio que debería cambiarse el material cuando de una zona sucia o contaminada se pasa a una zona limpia104. La carga biológica media en procedimientos contaminados es 5 veces superior que en procedimientos limpios contaminados105–110.
Se sugiere cambiar el instrumental quirúrgico y el material auxiliar (terminales de aspirador, bisturí eléctrico, mangos de las lámparas quirúrgicas) antes del cierre de las heridas en cirugía limpia-contaminada, contaminada y sucia.
Cambios de guantesExiste poca evidencia acerca de los cambios de guantes y bata al final de una intervención, proviniendo la más reciente del análisis de bundles que los incluyen en su lista de medidas111,112. Se puede aconsejar el cambio de guantes cuando se sospecha su contaminación o perforación y cuando se termine un tiempo contaminado de la cirugía, como una anastomosis.
Se sugiere el cambio de guantes cuando se sospeche contaminación o perforación, al finalizar una anastomosis digestiva y, como rutina, en las operaciones de más de 2 h, antes de colocar una prótesis y antes de cerrar la incisión.
Medidas postoperatoriasApósitos protectores para las heridas quirúrgicasLa herida quirúrgica debe protegerse con apósito estéril durante 24-48h. El personal debe lavarse las manos antes y después de cualquier contacto con la herida quirúrgica o del cambio de apósito y no deben utilizarse pegamentos en las heridas tras la cirugía5,7,8,15. No hay suficiente evidencia para aconsejar un tipo de apósito activo sobre el resto. Debe evitarse la manipulación innecesaria de las heridas en el postoperatorio.
Se recomienda aplicar un apósito con gasa estéril durante 48 h sobre las heridas quirúrgicas.
Terapia de presión negativaLa terapia de presión negativa de heridas aplica un sistema sellado conectado con una bomba de vacío sobre una herida cerrada por primera intención. En cirugía abdominal y cardíaca se consigue una reducción de ILQ con la aplicación estos sistemas frente a los apósitos convencionales. La OMS recomienda su uso en cirugías con alto riesgo de infección (gran daño tisular, isquemia, espacios muertos, hematoma o gran contaminación intraoperatoria)5. La SIS limita su recomendación a cirugía abdominal abierta o cirugía vascular en la ingle12. Dado el elevado coste actual de esta medida, debería limitarse a la cirugía de alto riesgo de ILQ, y siempre que exista disponibilidad.
Se sugiere la terapia de presión negativa sobre la herida cerrada únicamente en cirugía con alto riesgo de infección.
Las medidas de prevención de la ILQ preoperatorias se resumen en la tabla 2, y las medidas intra- y postoperatorias en la tabla 3. El listado completo de medidas y recomendaciones se muestra e el Anexo.
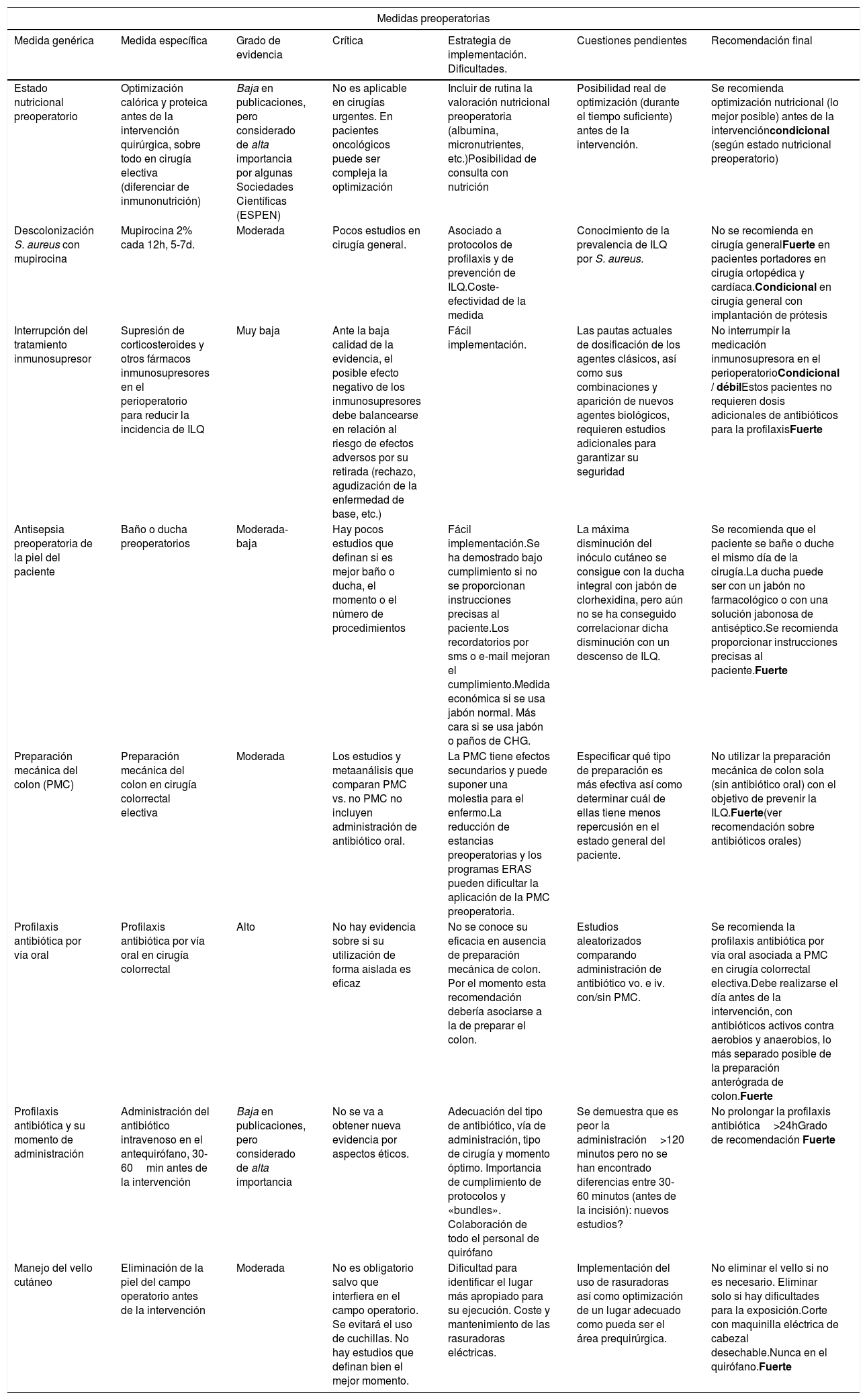
Medidas preoperatorias
| Medidas preoperatorias | ||||||
|---|---|---|---|---|---|---|
| Medida genérica | Medida específica | Grado de evidencia | Crítica | Estrategia de implementación. Dificultades. | Cuestiones pendientes | Recomendación final |
| Estado nutricional preoperatorio | Optimización calórica y proteica antes de la intervención quirúrgica, sobre todo en cirugía electiva (diferenciar de inmunonutrición) | Baja en publicaciones, pero considerado de alta importancia por algunas Sociedades Científicas (ESPEN) | No es aplicable en cirugías urgentes. En pacientes oncológicos puede ser compleja la optimización | Incluir de rutina la valoración nutricional preoperatoria (albumina, micronutrientes, etc.)Posibilidad de consulta con nutrición | Posibilidad real de optimización (durante el tiempo suficiente) antes de la intervención. | Se recomienda optimización nutricional (lo mejor posible) antes de la intervencióncondicional (según estado nutricional preoperatorio) |
| Descolonización S. aureus con mupirocina | Mupirocina 2% cada 12h, 5-7d. | Moderada | Pocos estudios en cirugía general. | Asociado a protocolos de profilaxis y de prevención de ILQ.Coste-efectividad de la medida | Conocimiento de la prevalencia de ILQ por S. aureus. | No se recomienda en cirugía generalFuerte en pacientes portadores en cirugía ortopédica y cardíaca.Condicional en cirugía general con implantación de prótesis |
| Interrupción del tratamiento inmunosupresor | Supresión de corticosteroides y otros fármacos inmunosupresores en el perioperatorio para reducir la incidencia de ILQ | Muy baja | Ante la baja calidad de la evidencia, el posible efecto negativo de los inmunosupresores debe balancearse en relación al riesgo de efectos adversos por su retirada (rechazo, agudización de la enfermedad de base, etc.) | Fácil implementación. | Las pautas actuales de dosificación de los agentes clásicos, así como sus combinaciones y aparición de nuevos agentes biológicos, requieren estudios adicionales para garantizar su seguridad | No interrumpir la medicación inmunosupresora en el perioperatorioCondicional / débilEstos pacientes no requieren dosis adicionales de antibióticos para la profilaxisFuerte |
| Antisepsia preoperatoria de la piel del paciente | Baño o ducha preoperatorios | Moderada- baja | Hay pocos estudios que definan si es mejor baño o ducha, el momento o el número de procedimientos | Fácil implementación.Se ha demostrado bajo cumplimiento si no se proporcionan instrucciones precisas al paciente.Los recordatorios por sms o e-mail mejoran el cumplimiento.Medida económica si se usa jabón normal. Más cara si se usa jabón o paños de CHG. | La máxima disminución del inóculo cutáneo se consigue con la ducha integral con jabón de clorhexidina, pero aún no se ha conseguido correlacionar dicha disminución con un descenso de ILQ. | Se recomienda que el paciente se bañe o duche el mismo día de la cirugía.La ducha puede ser con un jabón no farmacológico o con una solución jabonosa de antiséptico.Se recomienda proporcionar instrucciones precisas al paciente.Fuerte |
| Preparación mecánica del colon (PMC) | Preparación mecánica del colon en cirugía colorrectal electiva | Moderada | Los estudios y metaanálisis que comparan PMC vs. no PMC no incluyen administración de antibiótico oral. | La PMC tiene efectos secundarios y puede suponer una molestia para el enfermo.La reducción de estancias preoperatorias y los programas ERAS pueden dificultar la aplicación de la PMC preoperatoria. | Especificar qué tipo de preparación es más efectiva así como determinar cuál de ellas tiene menos repercusión en el estado general del paciente. | No utilizar la preparación mecánica de colon sola (sin antibiótico oral) con el objetivo de prevenir la ILQ.Fuerte(ver recomendación sobre antibióticos orales) |
| Profilaxis antibiótica por vía oral | Profilaxis antibiótica por vía oral en cirugía colorrectal | Alto | No hay evidencia sobre si su utilización de forma aislada es eficaz | No se conoce su eficacia en ausencia de preparación mecánica de colon. Por el momento esta recomendación debería asociarse a la de preparar el colon. | Estudios aleatorizados comparando administración de antibiótico vo. e iv. con/sin PMC. | Se recomienda la profilaxis antibiótica por vía oral asociada a PMC en cirugía colorrectal electiva.Debe realizarse el día antes de la intervención, con antibióticos activos contra aerobios y anaerobios, lo más separado posible de la preparación anterógrada de colon.Fuerte |
| Profilaxis antibiótica y su momento de administración | Administración del antibiótico intravenoso en el antequirófano, 30-60min antes de la intervención | Baja en publicaciones, pero considerado de alta importancia | No se va a obtener nueva evidencia por aspectos éticos. | Adecuación del tipo de antibiótico, vía de administración, tipo de cirugía y momento óptimo. Importancia de cumplimiento de protocolos y «bundles». Colaboración de todo el personal de quirófano | Se demuestra que es peor la administración>120 minutos pero no se han encontrado diferencias entre 30-60 minutos (antes de la incisión): nuevos estudios? | No prolongar la profilaxis antibiótica>24hGrado de recomendación Fuerte |
| Manejo del vello cutáneo | Eliminación de la piel del campo operatorio antes de la intervención | Moderada | No es obligatorio salvo que interfiera en el campo operatorio. Se evitará el uso de cuchillas. No hay estudios que definan bien el mejor momento. | Dificultad para identificar el lugar más apropiado para su ejecución. Coste y mantenimiento de las rasuradoras eléctricas. | Implementación del uso de rasuradoras así como optimización de un lugar adecuado como pueda ser el área prequirúrgica. | No eliminar el vello si no es necesario. Eliminar solo si hay dificultades para la exposición.Corte con maquinilla eléctrica de cabezal desechable.Nunca en el quirófano.Fuerte |
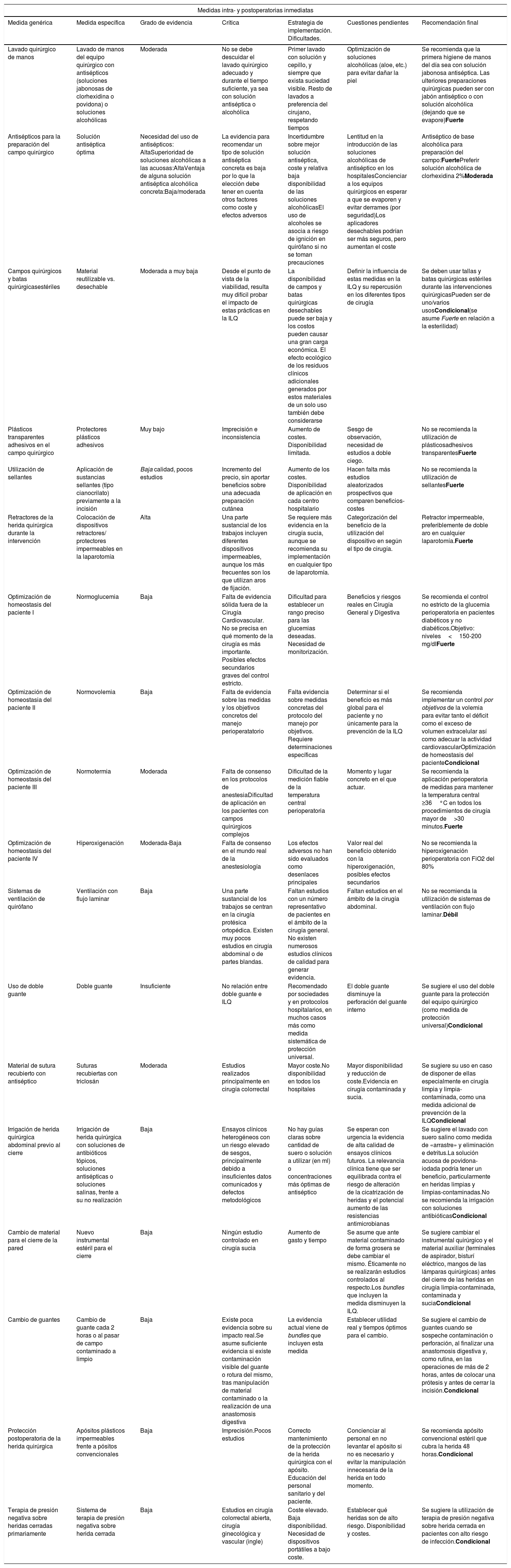
Medidas intra- y postoperatorias inmediatas
| Medidas intra- y postoperatorias inmediatas | ||||||
|---|---|---|---|---|---|---|
| Medida genérica | Medida específica | Grado de evidencia | Crítica | Estrategia de implementación. Dificultades. | Cuestiones pendientes | Recomendación final |
| Lavado quirúrgico de manos | Lavado de manos del equipo quirúrgico con antisépticos (soluciones jabonosas de clorhexidina o povidona) o soluciones alcohólicas | Moderada | No se debe descuidar el lavado quirúrgico adecuado y durante el tiempo suficiente, ya sea con solución antiséptica o alcohólica | Primer lavado con solución y cepillo, y siempre que exista suciedad visible. Resto de lavados a preferencia del cirujano, respetando tiempos | Optimización de soluciones alcohólicas (aloe, etc.) para evitar dañar la piel | Se recomienda que la primera higiene de manos del día sea con solución jabonosa antiséptica. Las ulteriores preparaciones quirúrgicas pueden ser con jabón antiséptico o con solución alcohólica (dejando que se evapore)Fuerte |
| Antisépticos para la preparación del campo quirúrgico | Solución antiséptica óptima | Necesidad del uso de antisépticos: AltaSuperioridad de soluciones alcohólicas a las acuosas:AltaVentaja de alguna solución antiséptica alcohólica concreta:Baja/moderada | La evidencia para recomendar un tipo de solución antiséptica concreta es baja por lo que la elección debe tener en cuenta otros factores como coste y efectos adversos | Incertidumbre sobre mejor solución antiséptica, coste y relativa baja disponibilidad de las soluciones alcohólicasEl uso de alcoholes se asocia a riesgo de ignición en quirófano si no se toman precauciones | Lentitud en la introducción de las soluciones alcohólicas de antiséptico en los hospitalesConcienciar a los equipos quirúrgicos en esperar a que se evaporen y evitar derrames (por seguridad)Los aplicadores desechables podrían ser más seguros, pero aumentan el coste | Antiséptico de base alcohólica para preparación del campo:FuertePreferir solución alcohólica de clorhexidina 2%Moderada |
| Campos quirúrgicos y batas quirúrgicasestériles | Material reutilizable vs. desechable | Moderada a muy baja | Desde el punto de vista de la viabilidad, resulta muy difícil probar el impacto de estas prácticas en la ILQ | La disponibilidad de campos y batas quirúrgicas desechables puede ser baja y los costos pueden causar una gran carga económica. El efecto ecológico de los residuos clínicos adicionales generados por estos materiales de un solo uso también debe considerarse | Definir la influencia de estas medidas en la ILQ y su repercusión en los diferentes tipos de cirugía | Se deben usar tallas y batas quirúrgicas estériles durante las intervenciones quirúrgicasPueden ser de uno/varios usosCondicional(se asume Fuerte en relación a la esterilidad) |
| Plásticos transparentes adhesivos en el campo quirúrgico | Protectores plásticos adhesivos | Muy bajo | Imprecisión e inconsistencia | Aumento de costes. Disponibilidad limitada. | Sesgo de observación, necesidad de estudios a doble ciego. | No se recomienda la utilización de plásticosadhesivos transparentesFuerte |
| Utilización de sellantes | Aplicación de sustancias sellantes (tipo cianocrilato) previamente a la incisión | Baja calidad, pocos estudios | Incremento del precio, sin aportar beneficios sobre una adecuada preparación cutánea | Aumento de los costes. Disponibilidad de aplicación en cada centro hospitalario | Hacen falta más estudios aleatorizados prospectivos que comparen beneficios-costes | No se recomienda la utilización de sellantesFuerte |
| Retractores de la herida quirúrgica durante la intervención | Colocación de dispositivos retractores/ protectores impermeables en la laparotomía | Alta | Una parte sustancial de los trabajos incluyen diferentes dispositivos impermeables, aunque los más frecuentes son los que utilizan aros de fijación. | Se requiere más evidencia en la cirugía sucia, aunque se recomienda su implementación en cualquier tipo de laparotomía. | Categorización del beneficio de la utilización del dispositivo en según el tipo de cirugía. | Retractor impermeable, preferiblemente de doble aro en cualquier laparotomía.Fuerte |
| Optimización de homeostasis del paciente I | Normoglucemia | Baja | Falta de evidencia sólida fuera de la Cirugía Cardiovascular. No se precisa en qué momento de la cirugía es más importante. Posibles efectos secundarios graves del control estricto. | Dificultad para establecer un rango preciso para las glucemias deseadas. Necesidad de monitorización. | Beneficios y riesgos reales en Cirugía General y Digestiva | Se recomienda el control no estricto de la glucemia perioperatoria en pacientes diabéticos y no diabéticos.Objetivo: niveles<150-200 mg/dlFuerte |
| Optimización de homeostasia del paciente II | Normovolemia | Baja | Falta de evidencia sobre las medidas y los objetivos concretos del manejo perioperatatorio | Falta evidencia sobre medidas concretas del protocolo del manejo por objetivos. Requiere determinaciones específicas | Determinar si el beneficio es más global para el paciente y no únicamente para la prevención de la ILQ | Se recomienda implementar un control por objetivos de la volemia para evitar tanto el déficit como el exceso de volumen extracelular así como adecuar la actividad cardiovascularOptimización de homeostasis del pacienteCondicional |
| Optimización de homeostasis del paciente III | Normotermia | Moderada | Falta de consenso en los protocolos de anestesiaDificultad de aplicación en los pacientes con campos quirúrgicos complejos | Dificultad de la medición fiable de la temperatura central perioperatoria | Momento y lugar concreto en el que actuar. | Se recomienda la aplicación perioperatoria de medidas para mantener la temperatura central ≥36°C en todos los procedimientos de cirugía mayor de>30 minutos.Fuerte |
| Optimización de homeostasis del paciente IV | Hiperoxigenación | Moderada-Baja | Falta de consenso en el mundo real de la anestesiología | Los efectos adversos no han sido evaluados como desenlaces principales | Valor real del beneficio obtenido con la hiperoxigenación, posibles efectos secundarios | No se recomienda la hiperoxigenación perioperatoria con FiO2 del 80% |
| Sistemas de ventilación de quirófano | Ventilación con flujo laminar | Baja | Una parte sustancial de los trabajos se centran en la cirugía protésica ortopédica. Existen muy pocos estudios en cirugía abdominal o de partes blandas. | Faltan estudios con un número representativo de pacientes en el ámbito de la cirugía general. No existen numerosos estudios clínicos de calidad para generar evidencia. | Faltan estudios en el ámbito de la cirugía abdominal. | No se recomienda la utilización de sistemas de ventilación con flujo laminar.Débil |
| Uso de doble guante | Doble guante | Insuficiente | No relación entre doble guante e ILQ | Recomendado por sociedades y en protocolos hospitalarios, en muchos casos más como medida sistemática de protección universal. | El doble guante disminuye la perforación del guante interno | Se sugiere el uso del doble guante para la protección del equipo quirúrgico (como medida de protección universal)Condicional |
| Material de sutura recubierto con antiséptico | Suturas recubiertas con triclosán | Moderada | Estudios realizados principalmente en cirugía colorrectal | Mayor coste.No disponibilidad en todos los hospitales | Mayor disponibilidad y reducción de coste.Evidencia en cirugía contaminada y sucia. | Se sugiere su uso en caso de disponer de ellas especialmente en cirugía limpia y limpia-contaminada, como una medida adicional de prevención de la ILQCondicional |
| Irrigación de herida quirúrgica abdominal previo al cierre | Irrigación de herida quirúrgica con soluciones de antibióticos tópicos, soluciones antisépticas o soluciones salinas, frente a su no realización | Baja | Ensayos clínicos heterogéneos con un riesgo elevado de sesgos, principalmente debido a insuficientes datos comunicados y defectos metodológicos | No hay guías claras sobre cantidad de suero o solución a utilizar (en ml) o concentraciones más óptimas de antiséptico | Se esperan con urgencia la evidencia de alta calidad de ensayos clínicos futuros. La relevancia clínica tiene que ser equilibrada contra el riesgo de alteración de la cicatrización de heridas y el potencial aumento de las resistencias antimicrobianas | Se sugiere el lavado con suero salino como medida de «arrastre» y eliminación e detritus.La solución acuosa de povidona-iodada podría tener un beneficio, particularmente en heridas limpias y limpias-contaminadas.No se recomienda la irrigación con soluciones antibióticasCondicional |
| Cambio de material para el cierre de la pared | Nuevo instrumental estéril para el cierre | Baja | Ningún estudio controlado en cirugía sucia | Aumento de gasto y tiempo | Se asume que ante material contaminado de forma grosera se debe cambiar el mismo. Éticamente no se realizarán estudios controlados al respecto.Los bundles que incluyen la medida disminuyen la ILQ. | Se sugiere cambiar el instrumental quirúrgico y el material auxiliar (terminales de aspirador, bisturí eléctrico, mangos de las lámparas quirúrgicas) antes del cierre de las heridas en cirugía limpia-contaminada, contaminada y suciaCondicional |
| Cambio de guantes | Cambio de guante cada 2 horas o al pasar de campo contaminado a limpio | Baja | Existe poca evidencia sobre su impacto real.Se asume suficiente evidencia si existe contaminación visible del guante o rotura del mismo, tras manipulación de material contaminado o la realización de una anastomosis digestiva | La evidencia actual viene de bundles que incluyen esta medida | Establecer utilidad real y tiempos óptimos para el cambio. | Se sugiere el cambio de guantes cuando se sospeche contaminación o perforación, al finalizar una anastomosis digestiva y, como rutina, en las operaciones de más de 2 horas, antes de colocar una prótesis y antes de cerrar la incisión.Condicional |
| Protección postoperatoria de la herida quirúrgica | Apósitos plásticos impermeables frente a pósitos convencionales | Baja | Imprecisión.Pocos estudios | Correcto mantenimiento de la protección de la herida quirúrgica con el apósito. Educación del personal sanitario y del paciente. | Concienciar al personal en no levantar el apósito si no es necesario y evitar la manipulación innecesaria de la herida en todo momento. | Se recomienda apósito convencional estéril que cubra la herida 48 horas.Condicional |
| Terapia de presión negativa sobre heridas cerradas primariamente | Sistema de terapia de presión negativa sobre herida cerrada | Baja | Estudios en cirugía colorrectal abierta, cirugía ginecológica y vascular (ingle) | Coste elevado. Baja disponibilidad. Necesidad de dispositivos portátiles a bajo coste. | Establecer qué heridas son de alto riesgo. Disponibilidad y costes. | Se sugiere la utilización de terapia de presión negativa sobre herida cerrada en pacientes con alto riesgo de infección.Condicional |
Se han propuesto diversas medidas para reducir la incidencia de ILQ. Muchas han sido evaluadas en estudios controlados, en algún caso con resultados divergentes, mientras que otras son el resultado de la observación clínica o la práctica quirúrgica habitual y difícilmente pueden ser sometidas a un análisis científico estructurado. Periódicamente, sociedades científicas y entidades nacionales o internacionales emiten guías de práctica clínica basadas en el análisis de la evidencia científica disponible. Aunque todas se basan en las mismas evidencias originales, a menudo no alcanzan conclusiones similares, probablemente debido a una combinación de motivos: no todas las medidas profilácticas han sido suficientemente evaluadas; existe una variabilidad en la inclusión y exclusión de estudios clínicos en las revisiones sistemáticas y, finalmente, se utilizan diferentes sistemas de evaluación y gradación de calidad de evidencia. Además, los grupos de expertos introducen su propio sesgo en la evaluación final. El resultado es un seguimiento dispar de las medidas de profilaxis y de las recomendaciones de las guías4.
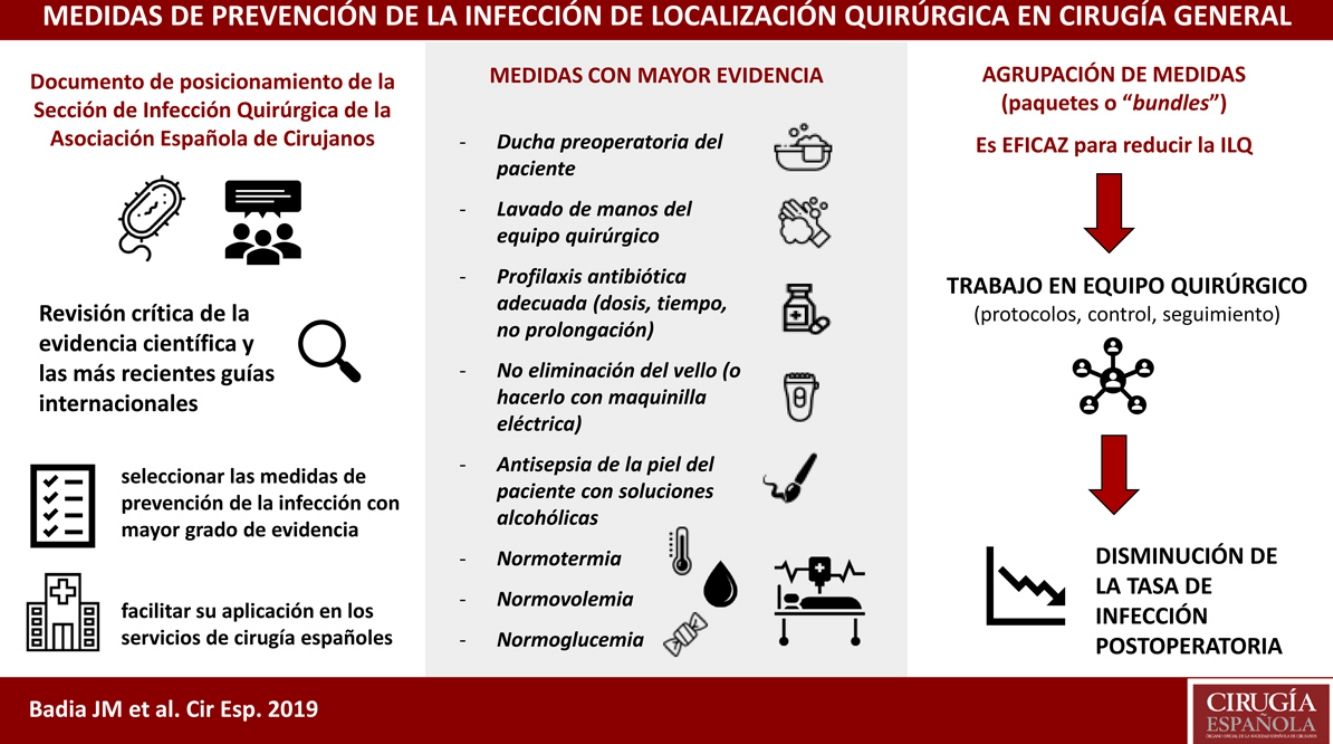
Podría identificarse un grupo de medidas centrales con un alto nivel de evidencia, que son recomendadas por la mayoría de las guías y deberían aplicarse en todos los procedimientos quirúrgicos. Estas incluyen la ducha preoperatoria del paciente, el lavado de manos del equipo quirúrgico, la profilaxis antibiótica, la no eliminación del vello (o hacerlo con maquinilla eléctrica), la antisepsia de la piel del paciente con soluciones alcohólicas y el mantenimiento de la normotermia, normovolemia y normoglucemia. Por otro lado, existe otro grupo de medidas auxiliares con menor nivel de evidencia que se pueden sugerir según el tipo de cirugía, la incidencia local de ILQ y los recursos disponibles. Entre ellas se encuentran la protección de los márgenes de la laparotomía con un dispositivo plástico de doble anillo, las suturas impregnadas con antiséptico, el cambio de guantes y material quirúrgico antes de concluir una intervención contaminada, o la terapia de presión negativa sobre la herida cerrada en cirugía de riesgo.
La selección y agrupación de estas medidas en paquetes sistematizados o bundles ha demostrado su eficacia en diversos tipos de cirugía113,114. Su protocolización y el control de su seguimiento, mediante listados de verificación o check-list conduce a una mejora del proceso quirúrgico y a la disminución de la tasa de ILQ115.
La reducción de la infección postoperatoria es el paradigma del trabajo en equipo. El equipo quirúrgico, compuesto por enfermería quirúrgica, anestesistas y cirujanos, debe trabajar de forma coordinada con el objetivo último de mejorar la atención del paciente siguiendo la mejor evidencia científica disponible y olvidando las acciones que no aportan valor o se sustentan por evidencias dudosas. No obstante, en la lucha por la disminución de la infección quirúrgica existen factores aún poco conocidos y sistematizables, por lo que una exquisita técnica quirúrgica y el buen criterio para escoger las medidas de profilaxis más apropiadas siguen siendo insustituibles.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.