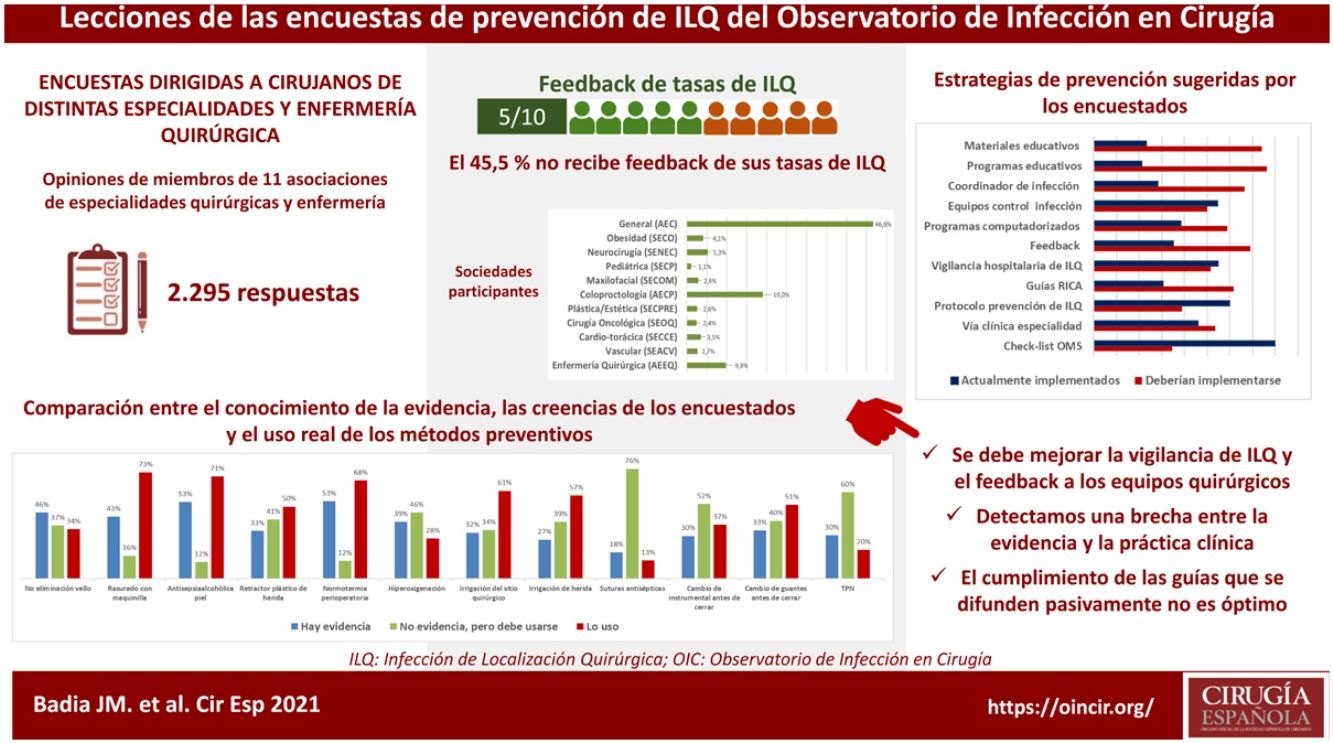
Antes de planificar estrategias de mejora, es crucial conocer el grado de implementación de las medidas preventivas de infección postoperatoria. Se presentan los resultados agregados de 3encuestas realizadas por el Observatorio de Infección en Cirugía a miembros de 11 asociaciones de cirugía y de enfermería quirúrgica. Las preguntas fueron dirigidas a determinar el conocimiento de la evidencia científica, las creencias personales y el uso real de las principales medidas. De 2.295 encuestados, el 45,1% no recibe información de la tasa de infección de su unidad. Se observó un conocimiento insuficiente de algunas de las principales recomendaciones de prevención y unas tasas de utilización, en ocasiones, inquietante. Se indagó sobre las estrategias preferidas para mejorar el cumplimiento de las pautas preventivas y su grado de implementación. Se confirmó la brecha existente entre la evidencia científica y la práctica clínica en la prevención de infecciones en diferentes especialidades quirúrgicas.
Before planning improvement strategies, it is crucial to know the degree of implementation of preventative measures for postoperative infection. The aggregated results of 3surveys carried out by the Observatory of Infection in Surgery to members of 11 associations of surgeons and perioperative nurses are presented. The questions were aimed to determine the knowledge of the scientific evidence, personal beliefs and the actual use of the main measures. Of 2295 respondents, 45.1% did not receive feedback on the infection rate of their unit. Insufficient knowledge of some of the main prevention recommendations and some disturbing rates of use were observed. The preferred strategies to improve compliance with preventive guidelines and their degree of implementation were investigated. A gap between scientific evidence and clinical practice in the prevention of infection in different surgical specialties was confirmed.
La infección de localización quirúrgica (ILQ) es la complicación postoperatoria más frecuente y se ha convertido en la infección relacionada con la asistencia sanitaria más frecuente en España (27,2%)1 y Europa (19,6%)2. Alcanza tasas de hasta el 20% para la cirugía colorrectal3 o del 45% después de la cirugía por cáncer de cabeza y cuello4 y representa una carga sustancial para los pacientes y los sistemas sanitarios5-7.
Las más de 50 medidas perioperatorias postuladas para reducir la tasa de ILQ son periódicamente analizadas por los organismos de salud nacionales e internacionales, que elaboran guías de práctica clínica a partir del nivel de la evidencia científica detectada. Estas guías deberían plasmar todo el conocimiento científico en sólidas recomendaciones basadas en revisiones sistemáticas y metaanálisis y su difusión debería mejorar las tasas de infección de manera homogénea entre hospitales y cirujanos. Sin embargo, esto no es así, dado que persisten tasas de infección elevadas distribuidas de forma heterogénea entre especialidades y hospitales. Además, el nivel de conocimiento y cumplimiento de los protocolos preventivos de ILQ parece ser muy variable8 y se ha reportado un bajo nivel de adhesión a guías clínicas, bundles o paquetes de medidas de prevención y listas de verificación. La aceptación y cumplimiento de estas guías a menudo requieren sustanciales cambios culturales y organizativos y los cirujanos han sido identificados como factores clave en el incumplimiento9.
El proyecto que se muestra fue diseñado por el Observatorio de Infección en Cirugía y consta de 3encuestas dirigidas a profesionales de enfermería quirúrgica y de cirugía de distintas especialidades, todas ellas elaboradas para conocer el nivel actual de conocimiento y cumplimiento de estas recomendaciones en los servicios quirúrgicos de los hospitales españoles. A pesar de que sus resultados se han publicado por separado, la agregación de los datos y su comparación con las recientes recomendaciones de prevención de ILQ de la Asociación Española de Cirujanos (AEC) puede concienciar a los cirujanos generales de los principales problemas detectados.
MétodosSe presentan los datos agrupados de 3encuestas diseñadas para conocer el grado de aplicación de las principales medidas de prevención de infección postoperatoria propuestas por entidades científicas internacionales. En total, se invitó a miembros de 11 asociaciones quirúrgicas españolas, incluyendo la de enfermería quirúrgica y las de cirujanos de diferentes especialidades. Las preguntas iban dirigidas no solo a conocer la tasa real de utilización de dichas medidas, sino también a identificar el grado de conocimiento de la evidencia científica que las apoyaba y las creencias personales de los encuestados.
Las encuestas se crearon a través de una plataforma web (SurveyMonkey), se realizaron entre 2016 y 2019 y se distribuyeron por correo electrónico, boletines (newsletter) de las sociedades y Twitter a los miembros de cada una de las sociedades participantes. Se indicó a los destinatarios que no completaran la encuesta 2veces si eran miembros de varias sociedades. El cuestionario incluía preguntas demográficas personales (nivel profesional, años de experiencia) y del lugar de trabajo (tipo, tamaño, ubicación del hospital). Hubo 2tipos de preguntas principales: unas tenían como objetivo determinar el uso real de las medidas en su hospital y otras inquirían sobre las preferencias personales del encuestado y su nivel de conocimiento sobre la evidencia existente para las diferentes medidas.
Los cuestionarios fueron diseñados por un equipo central con experiencia previa en la elaboración de encuestas y fueron sometidos para su evaluación a un panel de expertos pertenecientes a las sociedades implicadas. Se redactaron preguntas directas, sin ambigüedades, simples e imparciales, intentando evitar las preguntas dirigidas. En su mayoría, se trató de preguntas estructuradas que cubrían todas las alternativas posibles, para asegurar que cada respuesta fuera única. En varias preguntas, se incluyeron al final respuestas generales (como «otro», «no sé») para garantizar la recopilación eficaz de la diversidad potencial de respuestas.
Las preguntas abordaron el nivel de acuerdo entre sus creencias y los protocolos o la práctica habitual de sus unidades. Se calculó la tasa de acuerdo entre las creencias y la práctica habitual de todos los encuestados en una escala de 0 a 100. Una vez definidos los cuestionarios, se realizaron pequeñas pruebas (10 personas, con al menos un miembro de cada asociación) para asegurarse de que los encuestados habían entendido las preguntas y de que se estaba capturando la información necesaria para el estudio. Se incluyeron varias preguntas de control interno y se verificó la consistencia de las respuestas. Cada encuesta estuvo abierta durante 3meses y los invitados a participar recibieron varios correos electrónicos o avisos por Twitter de recordatorio.
Las respuestas se han comparado con las recomendaciones de las guías de práctica clínica más recientes: las guías de la Organización Mundial de la Salud (OMS)10 y el Centre for Disease Prevention and Control (CDC)11, además de las del National Institute of Health and Clinical Excellence (NICE) en sus actualizaciones de 200812 y 201913; la Guía de práctica clínica para la seguridad del paciente quirúrgico del Sistema Nacional de Salud de España (2010)14; la Canadian Patient Safety Institute Guideline (2014)15; la actualización de 2014 de la Recomendación SHEA/IDSA16, la National Health Service Scotland Guideline (2015)17; las Surgical Site Infection Guidelines del American College of Surgeons y de la Surgical Infection Society, actualización de 201618, las recomendaciones de la Asociación Española de Cirujanos de 202019 y las del Proyecto Infección Quirúrgica Zero20. Un resumen comparativo de algunas de estas recomendaciones se muestra en la tabla 1. En los resultados se destacan los más relevantes o los que el grupo de trabajo ha considerado desviaciones importantes de las guías clínicas.
Resumen de las principales medidas de prevención de infección postoperatoria según las más recientes guías de práctica clínica nacionales e internacionales
| Medida preventiva | MSPSI,2010 | CPSI,2014 | SHEA/IDSA, 2014 | HPS,2015 | ACS/SSI,2016 | OMS,2016 | CDC,2017 | NICE,2008, 2019 | AEC,2020 |
|---|---|---|---|---|---|---|---|---|---|
| Vigilancia de tasas de ILQ y feedback | Sí(moderada) | ||||||||
| Checklist OMS | Sí(alta) | ||||||||
| Profilaxis antibiótica intravenosa adecuada | Sí(fuerte) | Sí(fuerte) | Sí(alta) | Sí(fuerte) | Sí | Sí(fuerte) | Sí(fuerte) | Sí(fuerte) | Sí(fuerte) |
| Baño o ducha preoperatorio | SÍ(fuerte) | Sí(fuerte) | Sí(fuerte) | Sí | Sí(moderada) | Sí(fuerte) | SÍ(fuerte) | SÍ(fuerte) | |
| Descolonización S. aureus con mupirocina | En portadores y cirugía de alto riesgo(débil) | Sí | En cirugía de alto riesgo (cardíaca, COT)(moderada) | Screening según riesgoDescolonización en portadores(fuerte) | Screening según riesgoDescolonización en portadores | En portadores y cirugía de alto riesgo (cardíaca, COT)(moderada) | Screening según riesgoDescolonización en portadores(fuerte) | Condicional en cirugía general con implantación de prótesis | |
| Interrupción del tratamiento inmunosupresor | No interrumpir(condicional) | No resuelto | No interrumpir(condicional/débil) | ||||||
| Manejo del vello cutáneo | No retirar(si necesario: maquinilla eléctrica)(fuerte) | No retirar(si necesario: maquinilla eléctrica) | No retirar(si necesario: maquinilla eléctrica)(moderada) | No retirar(si necesario: maquinilla eléctrica)(moderada) | No retirar(si necesario: maquinilla eléctrica)(fuerte) | No retirar(si necesario: maquinilla eléctrica)(fuerte) | No retirar(si necesario: maquinilla eléctrica)(fuerte) | No retirar(si necesario: maquinilla eléctrica)(fuerte) | No retirar(si necesario: maquinilla eléctrica)(fuerte) |
| Preparación mecánica del colon (PMC) | No(fuerte) | No(alta) | No(moderada) | No(fuerte) | No(alta) | No(fuerte) | |||
| Profilaxis antibiótica por vía oral+PMC | Sí(alta) | Sí(moderada) | Sí | Sí(condicional) | SÍ(fuerte) | ||||
| Producto para la higiene quirúrgica de manos | Primera: agua y jabón antiséptico Sucesivas: gel alcohólico(fuerte) | Agua y jabón antiséptico(fuerte) | Agua y jabón antiséptico o gel alcohólico | Agua y jabón antiséptico o gel alcohólico(fuerte) | Primera: agua y jabón antiséptico Sucesivas: agua y jabón antiséptico o gel alcohólico(fuerte) | Primera: agua y jabón antiséptico Sucesivas: agua y jabón antiséptico o gel alcohólico(fuerte) | |||
| Campos quirúrgicos y batas quirúrgicasestériles | Sí(fuerte) | Sí | Reusables o desechables(condicional) | Reusables o desechables(fuerte) | Reusables o desechables(condicional) | ||||
| Guantes | Doble guante | Doble guante | Doble guante | No resuelto | Doble guante | Doble guante(condicional) | |||
| Antisepsia preoperatoria de la piel del paciente | Clorhexidina (alternativa: povidona)(débil) | Solución alcohólicacon CH o PI | Solución alcohólicacon CH o PI(alta) | Solución alcohólicacon CH(fuerte) | Solución alcohólicacon CH o PI | Solución alcohólicacon CH(fuerte) | Solución alcohólica(fuerte) | Solución alcohólicacon CH(alta) | Solución alcohólica (alta)con CH (moderada) |
| Sellante antimicrobiano después de antisepsia de piel | No(condicional) | No(débil) | No(fuerte) | ||||||
| Plásticos transparentes adhesivos en el campo quirúrgico | No(fuerte) | No(alta) | No resuelto | No(condicional) | No(débil) | No(fuerte)Si se precisa, impregnada con yodóforo | No(fuerte) | ||
| Retractores plásticos de la herida quirúrgica | Sí, plástico2 anillos > 1(alta) | Sí | SíUno-dos anillos(condicional) | Retractor impermeable, preferible de doble aro(fuerte) | |||||
| Normotermia | Sí(débil) | Sí | Sí(alta) | Sí(fuerte) | Sí | Sí(condicional) | Sí(fuerte) | Sí(fuerte) | Sí(fuerte) |
| Control de glucemia | No(alta) | Sí, diabéticos (<180 mg/dl) | Sí, cardíaca/no cardíaca(<180 mg/dl)(alta/mod) | Sí, diabéticos (<200 mg/dl)(fuerte) | Sí, diabéticos y no diabéticos(<150 mg/dl) | Sí, diabéticos y no diabéticos(<150 mg/dl)(condicional) | Sí, diabéticos y no diabéticos(<200 mg/dl)(fuerte) | Sí, diabéticos | Sí, diabéticos y no diabéticos (control no estricto, <150-200 mg/dl) (fuerte) |
| Normovolemia | «Perfusión adecuada»(baja) | Goal-directed fluid therapy (condicional) | Control por objetivosOptimización de homeostasis del paciente(condicional) | ||||||
| Hiperoxigenación(FIO2 0,8) | No(alta) | Sí(alta) | No(fuerte) | Sí | Sí(condicional) | No resuelto | No(alta) | No | |
| Irrigación peritoneal con antisépticos/ antibióticos | No(débil) | Sí, povidona(moderada) | Antibiótico: no resueltoAntisépticos: no(débil) | No | |||||
| Irrigación de herida quirúrgica con antisépticos | Sí (povidona o suero a presión)(alta) | Sí, povidona(condicional) | Sí (povidona)(débil) | No | Sí, suero salino o povidona(condicional) | ||||
| Irrigación de herida quirúrgica con antibióticos | No(alta) | No resuelto | No(condicional) | No resuelto | No | No(condicional) | |||
| Material de sutura recubierto con antiséptico | No(moderada) | No | No(moderada) | Sí, cirugía limpia y limpia-contaminada(si disponible) | Sí(condicional) | Considerar su uso(débil) | Considerar su uso | Considerar su uso en cirugía limpia y limpia-contaminada(condicional) | |
| Cambio de material para el cierre de la pared | Sí | No resuelto | Sí, instrumental quirúrgico y material auxiliar en cirugía no limpia(condicional) | ||||||
| Cambio de guantes | Sí | No resuelto | Sí, cuando se sospeche contaminación o perforación, al finalizar una anastomosis digestiva y, como rutina, en las operaciones de más de 2 h, antes de colocar una prótesis y antes de cerrar la incisión(condicional) | ||||||
| Apósitos antisépticos postoperatorios sobre herida quirúrgica | No resuelto | No(condicional) | No resuelto | Sí, apósito convencional estéril 48 h(condicional) | |||||
| Terapia de presión negativa sobre heridas cerradas primariamente | Sí, en alto riesgo | Sí, en alto riesgo(condicional) | Sí, en alto riesgo(condicional) |
Cuando está disponible, se muestra el grado de recomendación (fuerte, moderado, débil) o el nivel de evidencia (alta, moderada, baja).
En blanco: Medida no incluida en la guía.
No resuelto: no se emite recomendación por falta de suficiente evidencia a favor o en contra.
Modificado de Badia JM et al.19. ACS/SIS: American College of Surgeons/Surgical Infection Society (Estados Unidos); AEC: Asociación Española de Cirujanos; CDC: Centers for Disease Control and Prevention (Estados Unidos); CH: clorhexidina; COT: cirugía ortopédica y traumatológica; CPSI: Canadian Patient Safety Institute (Canadá); HPS: Health Protection Scotland. National Health Services Scotland (Reino Unido); MSPI: Ministerio de Sanidad, Política Social e Igualdad (España); NIHCE: National Institute for Health and Clinical Excellence (Reino Unido); OMS: Organización Mundial de la Salud; PI: povidona iodada; SHEA/IDS Society for Healthcare Epidemiology of America/Infectious Diseases Society of America (Estados Unidos).
Los proyectos se registraron con los identificadores de ClinicalTrials.gov: NCT03883399 y NCT04310878. Los resultados se han redactado de acuerdo con los Criterios consolidados para informar sobre investigaciones cualitativas (COREQ) y se expresan en porcentajes del total de respuestas. Los datos se analizaron utilizando el programa SPSS (v.10.0, Chicago, IL, EE. UU.). Para analizar la relación entre 2variables categóricas, se ha utilizado la prueba de χ?. La significación estadística se definió como p<0,05.
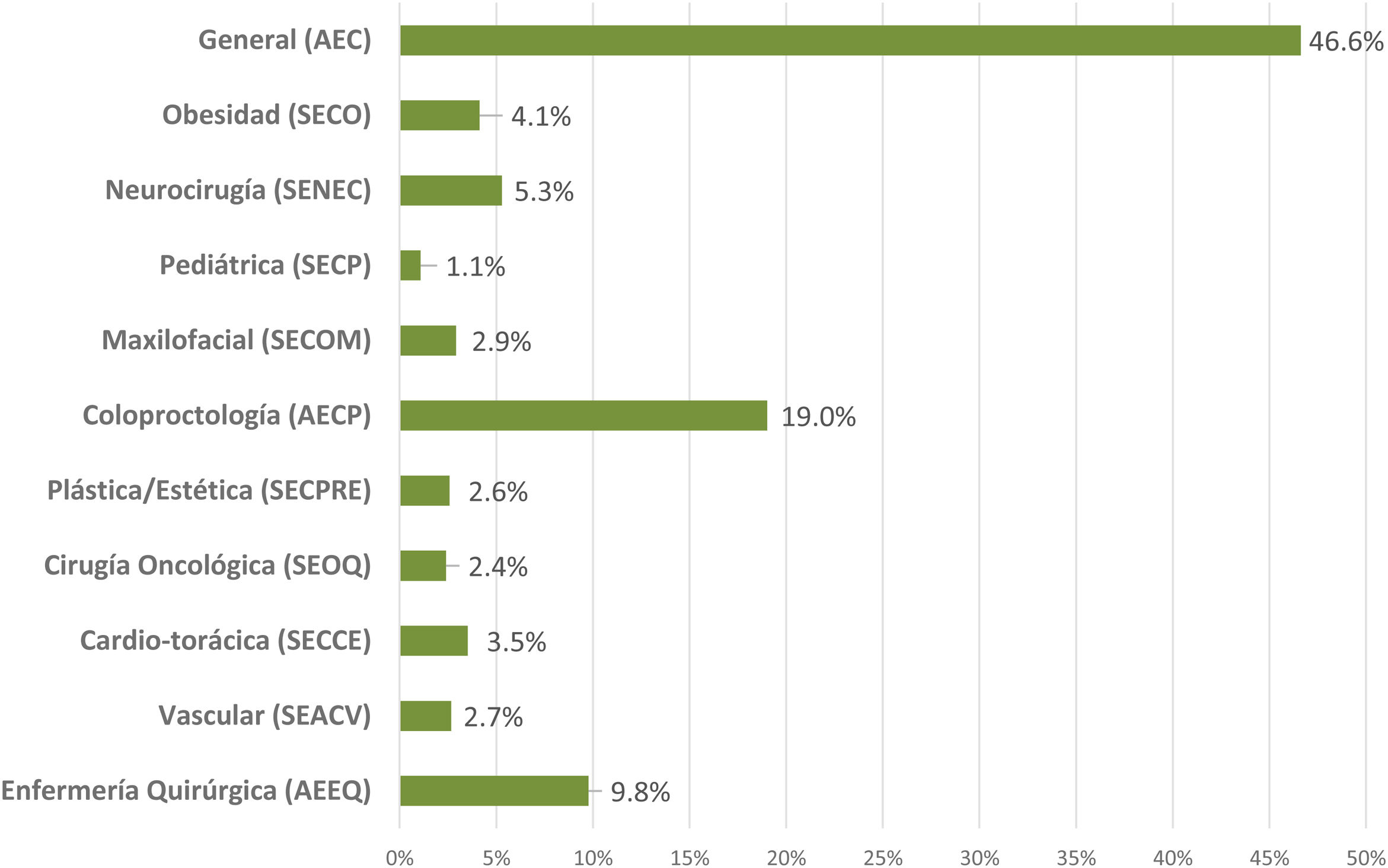
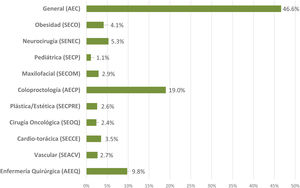
ResultadosContestaron a las 3encuestas21-23 un total de 2.295 profesionales de enfermería y de cirugía. Su distribución según su sociedad científica se muestra en la figura 1. La mayoría trabaja en hospitales públicos (87,6%), la mitad de ellos, centros universitarios de alto volumen. El 61,3% son profesionales con más de 10 años de experiencia.
Con variaciones en función de su especialidad, entre el 25 y el 50% de los encuestados no recibe información institucional de sus tasas de infección postoperatoria, ni siquiera en unidades de alto volumen y hospitales de tercer nivel. Se han detectado diferencias significativas en esta tasa: las especialidades de cirugía cardíaca (77,5%; χ2 18.86; p<0,001) y colorrectal (68,4%; χ2 8.85; p<0,001) son las que reciben más información y la de ORL la que recibe menos (29,8%; χ2 8.78; p<0,05).
En la mayoría de los hospitales existen protocolos de seguridad en quirófano y de preparación del paciente quirúrgico, aunque alrededor del 15% de los que contestaron desconocían su contenido.
Los encuestados dan poca importancia a las costumbres de su servicio para evitar la ILQ (solo el 46,8% las consideran importantes o muy importantes). Son las guías nacionales (90%), las guías internacionales (87,0%) y los protocolos hospitalarios (87,5%) los que a su juicio alcanzan más valor para el diseño de medidas de prevención.
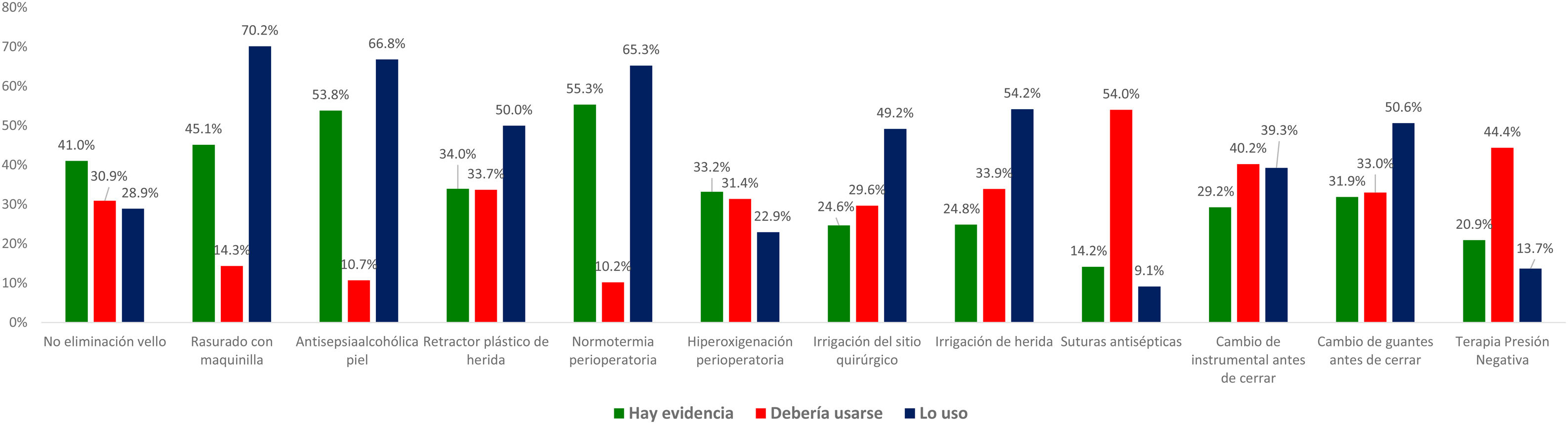
Preguntados por diversas recomendaciones catalogadas como fuertes en las guías clínicas, en general, se ha detectado un elevado nivel de discrepancia entre la percepción de la evidencia de los encuestados y la valoración efectuada por las guías clínicas más recientes. Por ejemplo, la tasa de evidencia se ha considerado solo del 33% para el uso de retractores-protectores plásticos de herida, del 43% para el corte del pelo con maquinilla eléctrica, del 46% para la no eliminación del vello cutáneo y del 53% para la antisepsia con soluciones alcohólicas y el mantenimiento de la normotermia perioperatoria. Cuando se comparan los niveles de aplicación de estas recomendaciones en la práctica habitual con las creencias personales de los encuestados, los resultados son variables y se reflejan en la figura 2. Hay una elevada discrepancia entre el valor que los encuestados otorgan a algunas medidas (sumando el grado de evidencia a la creencia personal) y su uso clínico.
El nivel real de uso de medidas preventivas de ILQ se resume en la tabla 2. En la comparación de esas tasas con las recomendaciones de las guías clínicas más recientes, se detectan potenciales disfunciones. Destaca que la tasa global de valoración nutricional preoperatoria antes de cirugía mayor es del 37% y que el 15% de los encuestados indica suplementos nutricionales preoperatorios en los pacientes previamente bien nutridos. Por el contrario, el 24% afirma no realizar intervención nutricional artificial en los enfermos con desnutrición preoperatoria. Hubo diferencias significativas en el uso de suplementos nutricionales preoperatorios para pacientes bien nutridos, que fueron más utilizados por los encuestados de las sociedades de cirugía colorrectal (44,7%; χ2 52,85; p<0,001), general (32,4%; χ2 62,64; p<0,001), oncología quirúrgica (33,3%; χ2 10,11; p<0,05) y cirugía bariátrica (29,2%; χ2 13,28; p<0,001).
Comparación de las recomendaciones de la AEC para prevención de infección postoperatoria con los resultados de utilización de las medidas por todas las sociedades
| Medida genérica | Recomendación de la AEC | Uso de la medida (%) |
|---|---|---|
| Estado nutricional preoperatorio | Se recomienda optimización nutricional según valoración del estado nutricional preoperatorio antes de la intervención | 37 |
| Descolonización de S. aureus con mupirocina | No se recomienda en cirugía generalCondicional en cirugía general con implantación de prótesis | 30,3 |
| Profilaxis antibiótica y su momento de administración | No prolongar la profilaxis antibiótica>24 h | 81,2 |
| PMC en cirugía colorrectal electiva | No utilizar la preparación mecánica de colon sola (sin antibiótico oral) con el objetivo de prevenir la ILQ | 96,2 |
| Profilaxis antibiótica por vía oral en cirugía colorrectal electiva | Se recomienda la profilaxis antibiótica por vía oral asociada a PMC en cirugía colorrectal electiva | 32,6 |
| Ducha preoperatoria | Se recomienda que el paciente se duche el mismo día de la intervencióncon un jabón de clorhexidinao con jabón no farmacológico | 94,555,937,8 |
| Manejo del vello cutáneo | Se recomienda no retirar de forma rutinaria el vello del campo quirúrgico.En caso de considerarse necesario, se debe eliminar fuera del área quirúrgica,nunca afeitado con cuchilla,y mediante corte con maquinilla eléctrica | 10,229,915,879,2 |
| Higiene quirúrgica de manos | Primera higiene del día con solución jabonosaLas ulteriores con jabón antiséptico o con solución alcohólica (dejando que se evapore) | 88,436,3 |
| Antisépticos para la preparación del campo quirúrgico | Antiséptico de base alcohólicaPreferir solución alcohólica de clorhexidina 2% | 65,457,5 |
| Plásticos transparentes adhesivos en el campo quirúrgico | No se recomienda la utilización de plásticos adhesivos transparentes | 35,7 |
| Retractores/ protectores impermeables de la herida quirúrgica en laparotomía | Retractor impermeable, preferiblemente de doble aro en cualquier laparotomía | 32,2 |
| Normoglucemia | Se recomienda el control no estricto de la glucemia perioperatoria en pacientes diabéticos y no diabéticosObjetivo: niveles <150-200 mg/dl | 59,0 |
| Normotermia | Se recomienda la aplicación perioperatoria de medidas para mantener la temperatura central ≥36°C en todos los procedimientos de cirugía mayor de>30 min | 88, 4 |
| Hiperoxigenación | No se recomienda la hiperoxigenación perioperatoria con FiO2 del 80% | 25,7 |
| Uso de doble guante | Se recomienda el uso del doble guante para la protección del equipo quirúrgico | 18,9 |
| Material de sutura recubierto con antiséptico | Se recomienda su uso en caso de disponer de ellas. Especialmente en cirugía limpia y limpia-contaminada | 17,1 |
| Irrigación de herida quirúrgica abdominal previa al cierre Irrigación de herida quirúrgica con soluciones de antibióticos tópicos, soluciones antisépticas o soluciones salinas, frente a no hacerlo | Se recomienda el lavado con suero salino como medida de «arrastre» y eliminación de detritusLa solución acuosa de povidona yodada podría tener un beneficio, particularmente en heridas limpias y limpias-contaminadasNo se recomienda la irrigación con soluciones antibióticas | 89,03,81,5 |
| Cambio de instrumental estéril para el cierre de la pared | Se recomienda cambiar el instrumental quirúrgico y el material auxiliar (terminales de aspirador, bisturí eléctrico, mangos de las lámparas quirúrgicas) antes del cierre de las heridas en cirugía limpia-contaminada, contaminada y sucia | 41,3 |
| Cambio de guantes. Cambio de guante cada 2 horas o al pasar de campo contaminado a limpio | Se recomienda el cambio de guantes cuando se sospeche contaminación o perforación, al finalizar una anastomosis digestiva y, como rutina, en las operaciones de más de 2 h, antes de colocar una prótesis y antes de cerrar la incisión | 91,4 |
| Terapia de presión negativa sobre heridas cerradas primariamente | Se recomienda terapia de presión negativa sobre herida cerrada en pacientes con alto riesgo de infección | 37,8 |
ILQ: infección de localización quirúrgica; PMC: preparación mecánica del colon.
El cribado sistemático y la descolonización de los portadores de S. aureus no se recomienda previamente a la cirugía general, pero sí en especialidades como cirugía cardíaca u ortopédica. En las encuestas se detecta una tasa de tratamiento para la erradicación en el 30,3% de los pacientes a los que se detecta esta bacteria en el cribado.
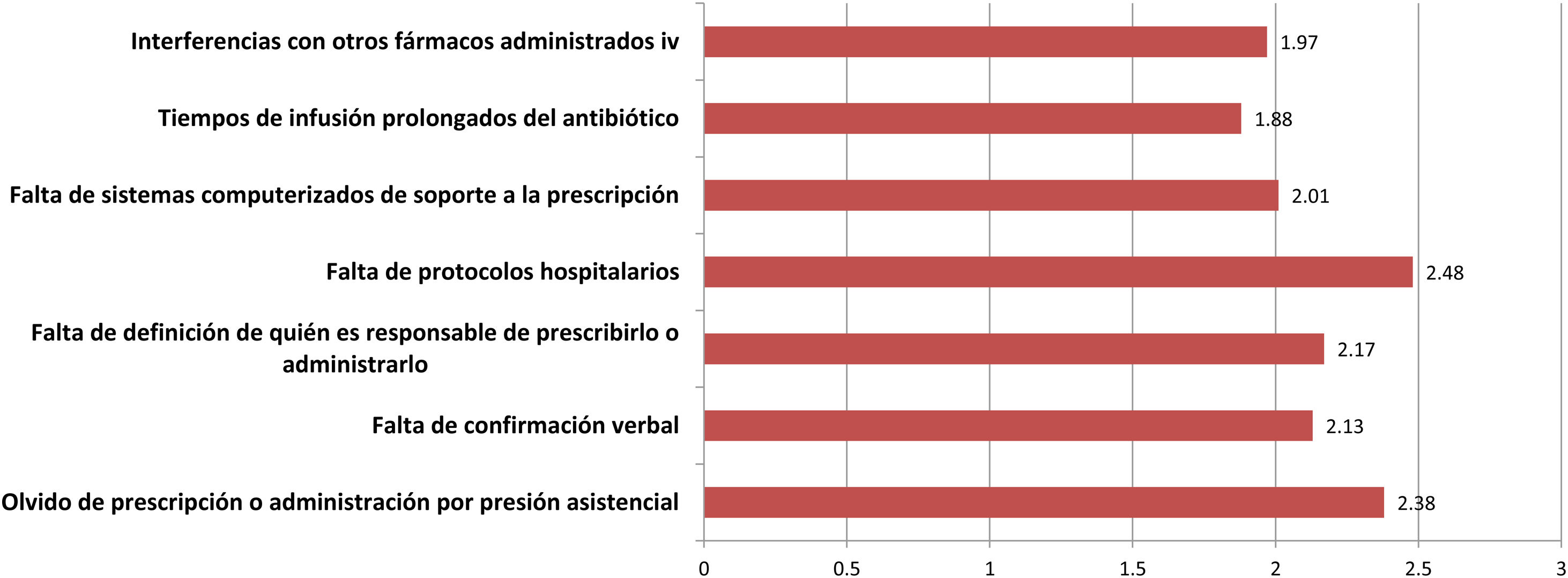
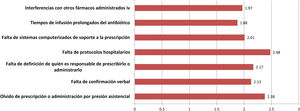
En cuanto a la profilaxis antibiótica intravenosa, destaca que el 11% afirma realizarla siempre en la sala de hospitalización, sobre todo en cirugía maxilofacial. La figura 3 muestra las principales causas de seguimiento incorrecto del protocolo de profilaxis, que también presenta diferencias significativas entre especialidades. Casi el 19% de los encuestados extienden la profilaxis durante más de 24 h, pero ello se centra casi de modo exclusivo en ORL (42,5%), cirugía cardíaca (41,2%) o pediátrica (11,8%). La tasa más elevada de uso de monodosis preoperatoria para profilaxis se observa en cirugía general (76,4%) y es similar a las de cirugía oncológica (75,6%), bariátrica (73%) y colorrectal (69,7%).
La eliminación de vello cutáneo se efectúa en el domicilio del paciente en el 5,1% de casos, en el hospital el día antes de la operación en el 19,3% y dentro del área quirúrgica en el 21,1%.
Para la antisepsis de la piel del paciente destaca una elevada tasa (80,4%) de utilización de botellas multiuso (250-500ml). El antiséptico se aplica de forma mayoritaria mediante pincelado con gasa y pinza (91,2%) y con aplicadores estériles monodosis en el 8,8%. El 57,9% efectúa una sola aplicación del antiséptico, mientras que el 42,1% realiza 2o más aplicaciones. En cuanto al secado del antiséptico, el 36,3% lo hace manualmente con gasas o compresas de papel, solo el 57,3% lo deja secar al aire y el 6,4% aplica la cobertura quirúrgica sin esperar al secado. El 28% de los encuestados ha oído hablar de algún incidente de ignición en su hospital relacionado con el uso de antisépticos de base alcohólica en el quirófano.
Los márgenes de una laparotomía no se protegen en el 9,9% de ocasiones, se cubren con materiales permeables a líquidos (y bacterias) en el 31,2% y con dispositivos impermeables en el 55,2%. El 52,1% de los encuestados desconoce si se emplea hiperoxigenación con FiO2 del 0,8 en el periodo perioperatorio y el 55,7% suele dejar drenajes de forma sistemática en cirugía electiva.
Antes de concluir la intervención, se irrigan de forma mayoritaria las cavidades y heridas quirúrgicas (85,9 y 89%, respectivamente), en el 90% de las ocasiones con suero fisiológico. Preguntados por la sutura con antiséptico, la utiliza siempre o de forma ocasional el 17,1% de los encuestados, probablemente debido a que el 19% desconoce su existencia, el 31% cree que no hay suficiente evidencia y el 46,5% no dispone de este material.
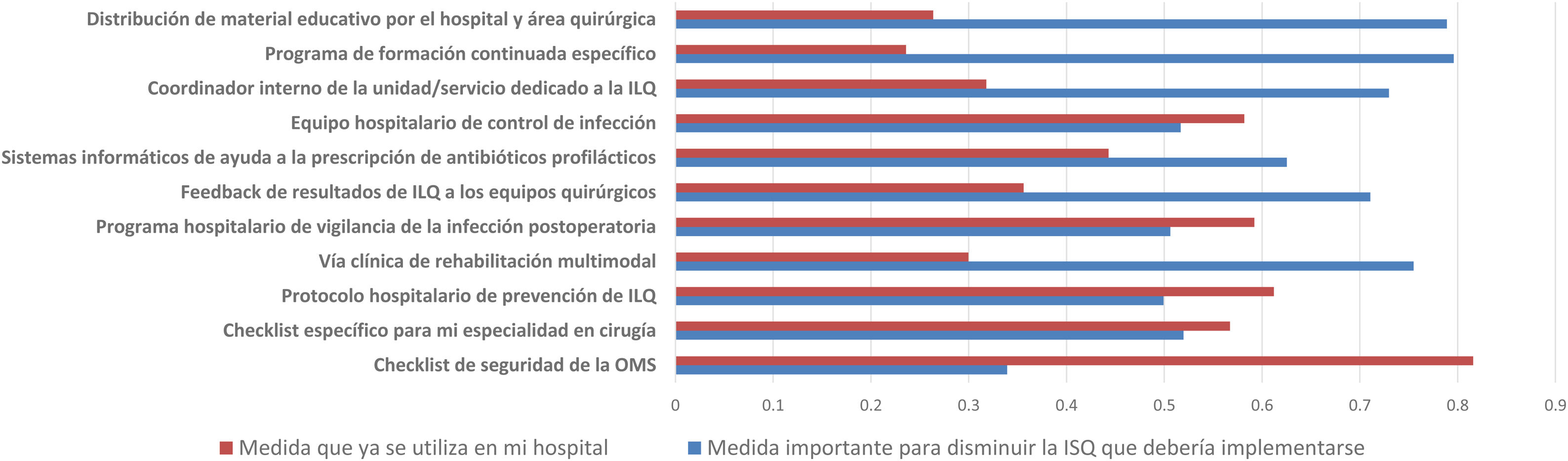
La mayoría de los encuestados consideró que hay una gran discrepancia entre las recomendaciones de las guías publicadas y la práctica clínica real, lo que se traduce en una tasa general de divergencia evidencia-práctica en las encuestas cercana al 70%. Preguntados por los potenciales métodos para aproximar la práctica clínica a la evidencia, se propuso la implementación de programas educativos (76,3%), la información de resultados a los equipos quirúrgicos (69,1%), la figura de un coordinador de ILQ en los servicios quirúrgicos (66,5%), los protocolos de recuperación incentivada en cirugía (RICA o ERAS) (61,7%), las ayudas informatizadas de prescripción en los sistemas digitales hospitalarios (58,9%), los protocolos o vías clínicas específicos de especialidad (53,5%) y la vigilancia y control centralizados de la infección (51,6%), pero afirmaron que pocas de estas estrategias existen en sus instituciones (fig. 4).
DiscusiónA pesar de la publicación durante la última década de relevantes documentos para la prevención de la ILQ, como las guías de la OMS10, NICE12 o los CDC11, las tasas de ILQ no descienden de forma sustancial ni homogénea entre las diversas especialidades quirúrgicas2. Es conocido que el cumplimiento de las guías de práctica clínica que se difunden de forma pasiva no es óptimo y parece que se mantiene de forma constante una discrepancia entre las recomendaciones que contienen y la práctica diaria24,25.
El Observatorio de Infección en Cirugía (https://oincir.org/) fue impulsado en 2018 por la Sección de Infección Quirúrgica de la AEC y en él colaboran activamente 17 sociedades científicas, del ámbito médico y quirúrgico, con interés en la infección postoperatoria. El objetivo del presente estudio fue conocer el nivel local de implantación de las medidas recomendadas en las más recientes guías internacionales y el grado de conocimiento de los profesionales sobre la evidencia científica que las sustentan. Asimismo, se investigaron las creencias personales sobre el uso de dichas recomendaciones y sus propuestas para la mejora de la prevención de infección en sus hospitales. Todo ello se planteó como un primer paso hacia la preparación de unos nuevos paquetes de medidas de prevención, adaptados a la realidad de los hospitales españoles y difundidos de forma activa.
El nivel global de conocimiento de la evidencia científica alrededor de la infección postoperatoria de los encuestados se puede catalogar de mejorable, pero cuando se compara la aplicación real de las principales recomendaciones con las propuestas por las vigentes guías nacionales14,20 e internacionales o con las publicadas por la AEC en 202019, se han detectado situaciones y aspectos especialmente preocupantes, que deberían servir de guía para abordar los futuros proyectos del Observatorio.
Por ejemplo, destaca una elevada tasa de eliminación rutinaria del vello del campo quirúrgico (90%), que en ocasiones aún se realiza con cuchilla (16%), en el domicilio del paciente o dentro del área quirúrgica. La tasa más baja de ILQ se logra no eliminando el vello26, por lo que se recomienda de forma casi unánime no afeitarlo o, si se considera necesario, eliminarlo de forma selectiva mediante el rasurado con maquinilla eléctrica de cabezal desechable lo más cerca posible del inicio de la intervención y fuera del área quirúrgica.
Dejando aparte la controversia sobre los productos que se deben utilizar para la nutrición preoperatoria y el papel de la denominada inmunonutrición, sorprende que solo el 37% de los encuestados declare hacer una evaluación nutricional antes de un procedimiento de cirugía mayor y, en contraste, que en el 15% de casos se aporten suplementos nutricionales orales en pacientes considerados como bien nutridos, seguramente por la influencia de algunos programas de prehabilitación que los incluyen.
La discrepancia entre la práctica clínica y las creencias acerca de la preparación mecánica del colon (PMC) y la profilaxis oral antes de la cirugía colorrectal son discutidas en profundidad en uno de los artículos previos. En resumen, hay una alta sensación entre los encuestados de que la profilaxis antibiótica oral reduce el riesgo de ILQ, ya sea sola (55,5%) o en combinación con PMC (80,4%), pero solo es prescrita por el 32,6% de los cirujanos, en su mayoría en combinación con PMC (27,6%), sin que se detecten diferencias entre cirujanos pertenecientes a unidades de alto o bajo volumen, o que trabajen en hospitales con o sin unidades colorrectales22.
Entre otros resultados que llaman la atención, se cuentan los relacionados con la antisepsia cutánea. Existe un bajo uso de soluciones alcohólicas para la antisepsia de la piel sana del paciente (65,4%), a pesar de la abundante evidencia a su favor27,28. Las soluciones de base alcohólica tienen una actividad más inmediata y, especialmente combinadas con clorhexidina, más actividad residual, por lo que en la actualidad son apoyadas por la mayoría de las guías. Cabe recordar que las soluciones alcohólicas no se pueden utilizar en determinadas localizaciones (mucosas, oídos, ojos, boca, tejido neural, heridas abiertas, piel no intacta) y que su concentración debe limitarse para evitar quemaduras. Es importante resaltar que la reintroducción del alcohol en los quirófanos puede representar un problema de seguridad por el riesgo de ignición29. Más de una cuarta parte de los encuestados tiene conocimiento de un problema de seguridad relacionado con alcoholes en sus quirófanos. Con independencia del antiséptico utilizado, es imperativo dejar tiempo para que las soluciones antisépticas se sequen al aire para maximizar su eficacia y prevenir dicho riesgo de incendio15. Además, el mal hábito de secar el antiséptico con una gasa o papel absorbente puede provocar una violación accidental de la asepsia si se tocan inadvertidamente áreas no tratadas con antiséptico. Nuestra encuesta muestra una alarmante tasa de secado mecánico del 36,3% antes de aplicar la cobertura quirúrgica, lo que limita el tiempo necesario para la acción del antiséptico (3 min). Un 6,4% de los cirujanos aplican los campos quirúrgicos sin esperar al secado, lo que representa un peligro real de ignición cuando se utilizan soluciones alcohólicas, en especial combinadas con coberturas plásticas. La presente encuesta muestra que el uso de alcohol está asociado con un aumento significativo del secado espontáneo. Probablemente el alcohol, con su evaporación acelerada, facilita el cumplimiento de los protocolos de tiempo de secado, evita el secado con gasas y permite el mínimo tiempo de acción antimicrobiano requerido. Los aplicadores de un solo uso también podrían fomentar una práctica más estandarizada y el empleo de menor cantidad de antiséptico para la preparación de la piel.
Se ha observado un elevado uso de plásticos adhesivos sobre el campo quirúrgico (35,7%). Estos dispositivos están diseñados para reducir la contaminación de la herida con microorganismos de la piel del paciente, pero no hay evidencia de que reduzcan la ILQ, incluso hay alguna evidencia de que la aumentan30 y están desaconsejados por la mayoría de las guías vigentes. Cuando se consideren necesarios, algunos autores recomiendan utilizarlos en su versión con impregnación en yodóforos.
La tasa de protección de los márgenes de laparotomías parece insuficiente, al igual que el uso del retractor plástico de doble anillo (32,2%), que sería recomendable según los resultados de varios metaanálisis31,32. También se ha detectado una prolongación excesiva de la profilaxis antibiótica, ya que algunos especialistas extienden la profilaxis durante más de 24h, en especial en cirugía cardíaca, estética y de cabeza y cuello.
Creemos que otras medidas con escasa o nula evidencia científica, pero dictadas por el «sentido común quirúrgico» y avaladas por su inclusión en algunos exitosos bundles de prevención33, podrían ser más utilizadas. Ejemplos de estas serían el uso de doble guante (utilizado solo por el 19%) y el cambio intraoperatorio de guantes, de material quirúrgico y auxiliar después de una anastomosis digestiva o antes de cerrar una laparotomía. La irrigación de la herida quirúrgica con suero fisiológico a presión es una medida aún en evaluación, que no está recomendada por la mayoría de las guías clínicas, aunque periódicamente se publican nuevas evidencias a favor de su utilización34. Ello avalaría su eficacia en la retirada de detritus, coágulos y bacterias del espacio subcutáneo y su casi universal utilización en todo tipo de cirugía en nuestro medio (89%).
Una medida controvertida y en revisión, como es la hiperoxia perioperatoria, se utiliza poco (25,7%), aunque más de la mitad de los encuestados afirman desconocer si sus anestesistas lo utilizan, lo que indicaría un déficit de trabajo en equipo y comunicación interna en nuestros quirófanos, aspecto no analizado en las encuestas.
Sin embargo, consideramos que el hallazgo más inquietante del estudio es el bajo nivel de información de las tasas de ILQ en los hospitales españoles, más preocupante, si cabe, en hospitales de tercer nivel y unidades especializadas con alto volumen quirúrgico. El primer paso para la mejora de las tasas de ILQ de un país es el establecimiento de programas de vigilancia de la infección nosocomial, que se acompañen de información a los equipos quirúrgicos35.
Es llamativa la comparación entre las medidas más relevantes para romper la brecha entre la evidencia de la práctica y la realidad de su implementación (fig. 4), ya que las propuestas más valoradas por los encuestados son las menos implementadas en sus hospitales. Entre ellas, una vez más, se cuenta la información de las tasas de ILQ a los equipos quirúrgicos.
Se han publicado algunas encuestas similares, pero la mayoría se han realizado en áreas geográficas concretas (hospitales de una sola ciudad25 o de una región24,36) o en cirugías determinadas (como artroplastia37, derivación de arterias coronarias38 o cesáreas39). Algunas encuestas se han dirigido a enfermería de quirófano40 y otras a miembros de sociedades quirúrgicas específicas, como cirugía pediátrica41. Las encuestas del Observatorio de Infección en Cirugía son, hasta la fecha, las que obtienen un mayor número de respuestas y aportan la opinión de cirujanos de diversas especialidades y de enfermería quirúrgica a nivel estatal, y profundizan más en especialidades con alto riesgo de infección postoperatoria, como la cirugía colorrectal.
El proyecto tiene varias limitaciones. Primero, es difícil calcular con precisión la tasa de respuesta a las encuestas, dada la incertidumbre sobre el número de miembros de las diferentes sociedades que recibieron la invitación. Sin embargo, el número absoluto de encuestados es muy alto y parece suficientemente representativo en cada una de las especialidades quirúrgicas. Además, parece haber una representación equilibrada de diferentes tipos de hospitales (tamaño, docencia y propiedad), lo que indica que los resultados pueden generalizarse a la realidad de la práctica quirúrgica en el país. En segundo lugar, el estudio también puede estar limitado por un sesgo de autoevaluación, ya que se ha demostrado que las autoevaluaciones sobrevaloran los resultados propios42.
En resumen, parece que la indicación de ducha preoperatoria, el método de higiene de manos del personal, el uso de campos quirúrgicos impermeables y la normotermia perioperatoria son las medidas con las que enfermería y cirujanos españoles se aproximan más a las guías de práctica actual. Otras medidas, como la irrigación de cavidades quirúrgicas y el lavado de heridas con solución salina, se utilizan con frecuencia, probablemente debido a hábitos empíricos y a la denominada «tradición quirúrgica». Por otro lado, otras medidas que son muy recomendadas por las principales guías no están suficientemente implementadas. Entre ellas se incluyen: la no eliminación del vello de forma rutinaria en los protocolos de preparación del paciente, sino en función de las circunstancias del paciente y el tipo de intervención; no afeitar el pelo con cuchilla o navaja; utilizar soluciones de base alcohólica para la antisepsia cutánea; respetar el tiempo de secado al aire de la solución antiséptica; protocolizar una política intraoperatoria de cambio de guantes y generalizar el uso de protectores de márgenes de herida que sean impermeables a líquidos y bacterias.
Es fundamental conocer el grado de conocimiento de los profesionales de la evidencia científica y el nivel de implementación de las medidas preventivas de ILQ. Nuestros resultados señalan que persiste una brecha en la traducción de la mejor evidencia a la práctica real en la prevención de ILQ en cirugía, incluso en entornos académicos. El Observatorio de Infección en Cirugía se ha propuesto unificar todos estos hallazgos, analizando las actitudes negativas de los profesionales y las causas del incumplimiento de las medidas y pretende ser un foro para difundir soluciones, aumentar el cumplimiento de las recomendaciones de prevención y mejorar la educación en infección quirúrgica. El diseño de bundles o paquetes de medidas preventivas y su difusión mediante metodologías activas debería reducir las tasas de ILQ de manera homogénea entre especialidades y hospitales. Estas políticas de implementación deberían tener el soporte de las sociedades científicas y las instituciones sanitarias oficiales y concentrarse no solo en los profesionales sino también en el contexto en el que desempeñan su labor.
FinanciaciónLas encuestas se han realizado con fondos del Observatorio de Infección en Cirugía, provenientes de la Fundación Tecnología y Salud.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con esta publicación.
Bader Al-Raies Bolaño, Servicio de Cirugía Vascular, Hospital de Manises (Valencia); Elena Bravo-Brañas, Servicio de Cirugía Plástica, Estética y Reconstructiva, Hospital Universitario La Paz (Madrid); Ramón Calderón Nájera, Servicio de Cirugía Plástica, Estética y Reconstructiva, Hospital Ruber Internacional (Madrid); Manuel Chamorro Pons, Servicio de Cirugía Oral y Maxilofacial, Hospital Ruber Juan Bravo (Madrid); Cecilia Diez, Àrea Quirúrgica, Hospital Universitari Sant Pau (Barcelona); Xosé M. Meijome, Gerencia de Asistencia Sanitaria del Bierzo (León); José López Menéndez, Servicio de Cirugía Cardíaca, Hospital Universitario Ramón y Cajal (Madrid); Julia Ocaña Guaita, Servicio de Cirugía Vascular, Hospital Ramón y Cajal (Madrid); Gloria Ortega Pérez, Servicio de Cirugía Oncológica, MD Anderson Cancer Center (Madrid); Rosa Paredes Esteban, Unidad de Cirugía Pediátrica, Hospital Universitario Reina Sofía (Córdoba); Antonio L. Picardo, Unidad de Cirugía Endocrina, Metabólica y Bariátrica, HM Montepríncipe (Boadilla del Monte, Madrid); Cristina Sánchez Viguera, Servicio de Neurocirugía, Hospital Regional Universitario de Málaga (Málaga); Ramón Vilallonga, Unidad de Cirugía Endocrina, Metabólica y Bariátrica, Hospital Universitari Vall d’Hebrón (Barcelona).