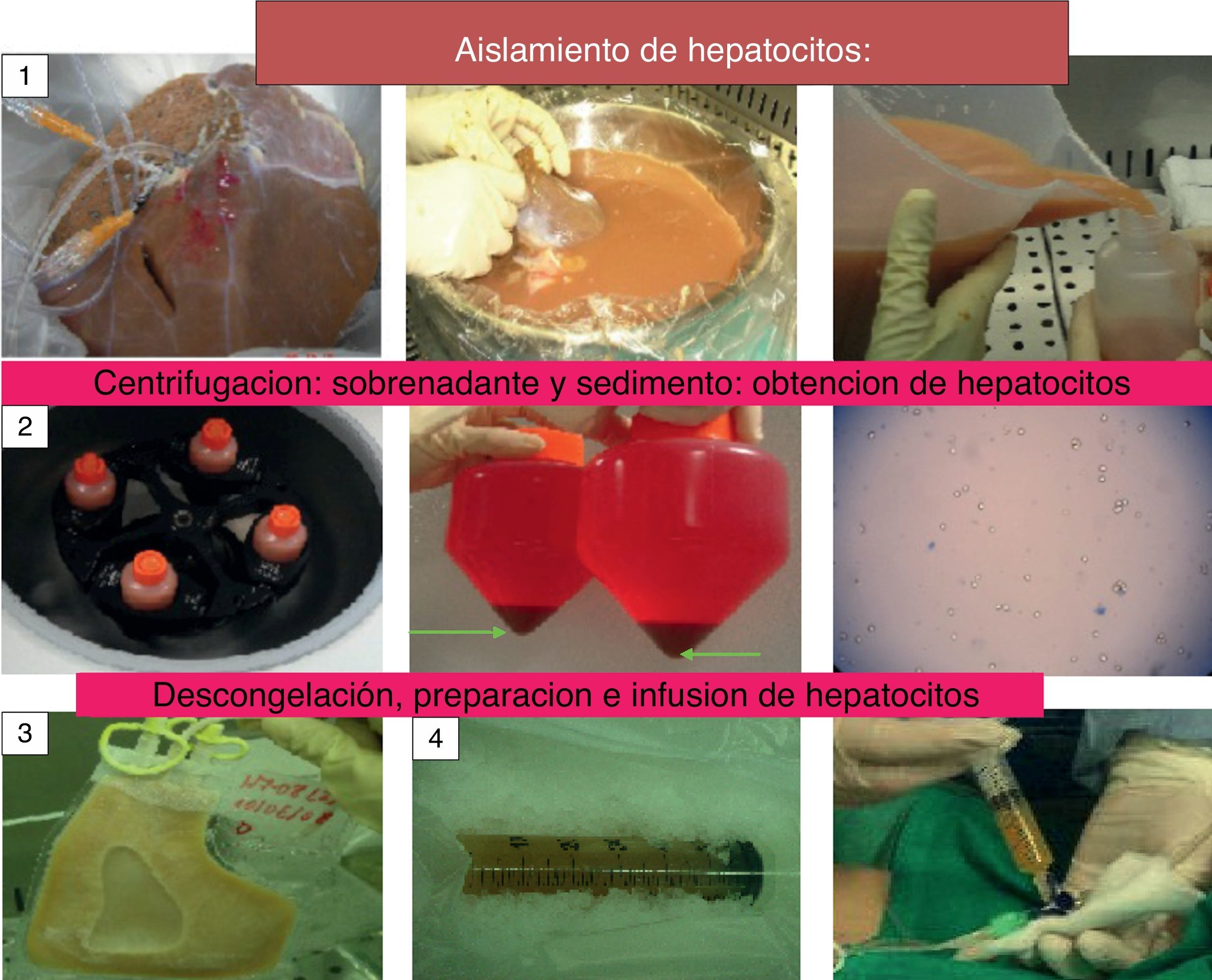
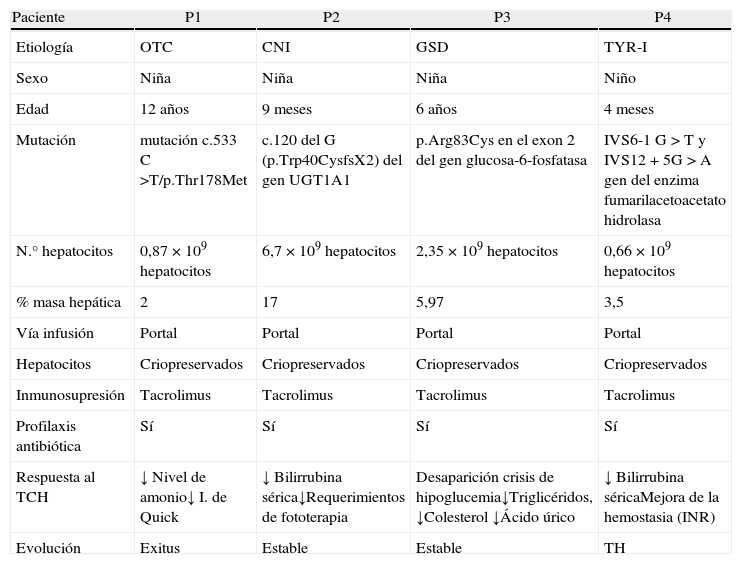
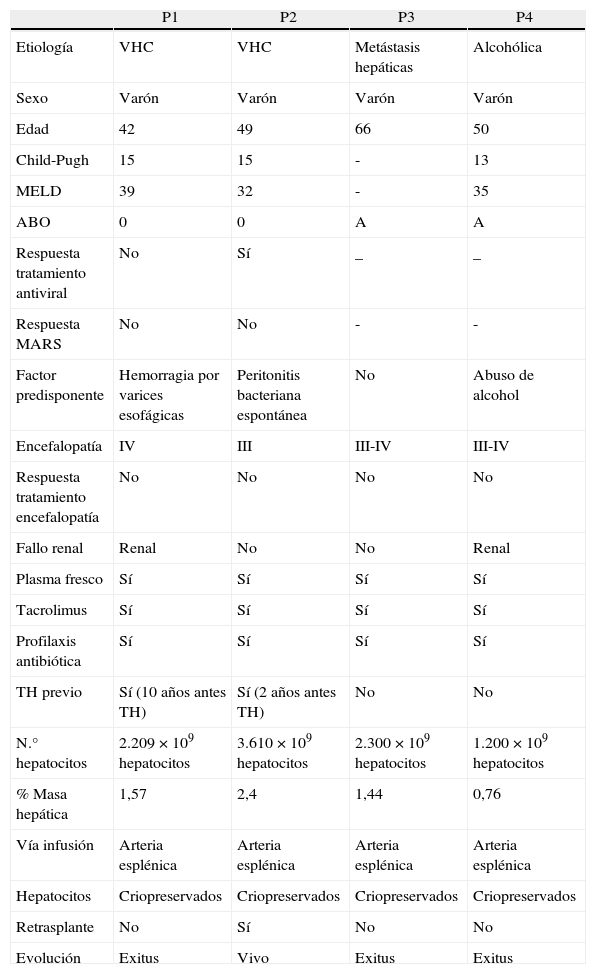
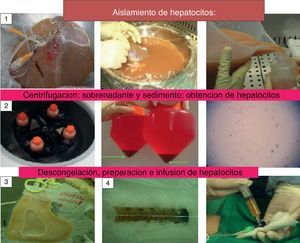
Existe un gran número de enfermedades hepáticas para las cuales el único tratamiento efectivo es el trasplante hepático. La disparidad entre el número de potenciales beneficiarios y de órganos disponibles motiva la búsqueda de nuevas alternativas de tratamiento, entre las que se encuentra el trasplante celular hepático (TCH). Esta terapia representa una alternativa de tratamiento en estos pacientes, sin embargo, la falta de unanimidad de criterios respecto a las indicaciones y técnica, los diferentes protocolos de criopreservación así como la distinta metodología para valorar la respuesta a esta terapia pone de manifiesto la necesidad de una conferencia de consenso que unifique criterios, planteando posibles estrategias futuras que mejoren la técnica y optimicen los resultados. Nuestro objetivo es realizar una revisión y puesta al día del estado actual del TCH, enfatizando las futuras líneas de investigación que tratan de solucionar los problemas y mejorar los resultados de esta terapia.
The imbalance between the number of potential beneficiaries and available organs, originates the search for new therapeutic alternatives, such as Hepatocyte transplantation (HT).Even though this is a treatment option for these patients, the lack of unanimity of criteria regarding indications and technique, different cryopreservation protocols, as well as the different methodology to assess the response to this therapy, highlights the need of a Consensus Conference to standardize criteria and consider future strategies to improve the technique and optimize the results.Our aim is to review and update the current state of hepatocyte transplantation, emphasizing the future research attempting to solve the problems and improve the results of this treatment.
En la actualidad, los avances en el campo de la medicina regenerativa plantean nuevas formas de actuación para determinadas enfermedades, cuyo problema reside en el deterioro celular de un órgano y en las que por diferentes causas no siempre la realización de un trasplante del órgano sólido constituye la primera opción terapéutica o el tratamiento de elección.
En el momento actual el único tratamiento efectivo para las enfermedades hepáticas en fase terminal es el trasplante hepático ortotópico (THO). Pese a ampliar los criterios de selección de donantes tratando de aumentar su número, los resultados obtenidos no han sido satisfactorios. La discrepancia entre demanda y oferta de órganos constituye la principal limitación del THO, planteando la necesidad de nuevas alternativas a este tratamiento. El trasplante celular hepático (TCH) o trasplante de hepatocitos humanos constituye la más prometedora por los resultados obtenidos considerándose una estrategia terapéutica de vanguardia complementaria al trasplante de órgano sólido. Pese a que en el momento actual el TCH no constituye una opción terapéutica definitiva, es aplicable a pacientes con insuficiencia hepática aguda, con intención de sustituir o servir de puente al THO y a pacientes pediátricos con errores congénitos del metabolismo en los que el enzima deficitario se expresa en el hepatocito.
Las observaciones clínicas han demostrado la seguridad del procedimiento y de los pacientes sometidos al TCH, sin embargo, la mayoría de las publicaciones hacen referencia a casos clínicos sin unanimidad de criterios con respecto a las indicaciones, metodología, criopreservación celular o valoración de la respuesta al TCH6–12.
El objeto de este manuscrito es realizar una revisión y puesta al día del estado actual del TCH al tiempo que enfatiza las nuevas líneas de investigación que traten de resolver la escasez de fuentes de obtención de los hepatocitos, su criopreservación y la integración de los mismos en el receptor (fig. 1).
Evolución del trasplante celular hepáticoLa terapia celular hepática se considera actualmente una estrategia terapéutica de vanguardia complementaria al trasplante hepático de órgano sólido cuyo principio fundamental es lograr la recuperación de la función perdida del órgano trasplantando sus componentes esenciales: las células.
Desde que Howard1, en el año 1967, realiza el primer aislamiento de hepatocitos de rata, sentando con este estudio las bases de los protocolos actuales, hasta que en 1992 y 1998 se lleva a cabo el primer TCH en adultos con cirrosis hepática2 y una niña de 10 años con una enfermedad de Criggler-Najjar tipo I respectivamente3, muchas han sido las investigaciones realizadas en este campo.
En 1976 se lleva a cabo el primer TCH en animales con una metabolopatía describiendo una disminución mantenida de los valores plasmáticos de bilirrubina en ratas Gunn homocigotas recesivas después de la infusión portal de hepatocitos obtenidos de ratas Gunn heterocigotas, considerando que trasplantar células capaces de aportar el enzima deficitario puede ser una forma eficaz de tratamiento4. Posteriormente, Sutherland lleva a cabo el TCH en ratas con fallo hepático agudo inducido por la administración intravenosa de dimetilnitrosamina, demostrando cómo la infusión de los hepatocitos puede proporcionar un soporte metabólico que permita la recuperación de la necrosis hepática inducida por dimetilnitrosamina5.
Las observaciones clínicas han demostrado la seguridad del procedimiento y de los pacientes sometidos al TCH, sin embargo, la mayoría de las publicaciones hacen referencia a casos clínicos sin unanimidad de criterios respecto a las indicaciones, metodología, criopreservación celular o valoración de la respuesta al TCH6–12, lo cual pone de manifiesto la necesidad de consensuar criterios en una conferencia de consenso. En ella, los participantes realizan un esfuerzo por identificar y discutir las posibles estrategias para superar las limitaciones de la técnica y aunar criterios. Al mismo tiempo se proponen sugerencias futuras para tratar de solucionar los problemas y mejorar los resultados de esta terapia.
Fuentes de obtención de hepatocitos para el trasplante celular hepático y sus indicacionesEn esta conferencia se aborda el principal problema del TCH: la escasez de fuentes para el aislamiento de hepatocitos para el trasplante celular. Puesto que esta constituye una de las principales limitaciones, las estrategias futuras van encaminadas a tratar de resolver este aspecto. Actualmente los hepatocitos se obtienen a partir de órganos descartados para THO, planteándose la utilización del tejido resultante de reducciones hepáticas, Split, el segmento IV tras Split para 2 receptores14 e injertos de donantes después de la muerte cardiaca (DCD) con menos de 40 minutos de isquemia caliente13. Ante la necesidad de buscar nuevas fuentes para obtención de hepatocitos adultos, se proponen donantes en asistolia15, donante neonatal e incluso, recientemente, se plantea el uso de hepatocitos de pacientes sometidos a THO por metabolopatías, planteando la opción de un trasplante dominó con las células obtenidas16.
La base actual del TCH reside en trasplantar hepatocitos adultos, células ya diferenciadas, sin embargo, las nuevas líneas de investigación están centradas en la obtención de hepatocitos procedentes de progenitoras de origen hepático o derivados de células madre progenitoras pluripotentes17–19. La administración de hepatocitos con células progenitoras combinaría los efectos metabólicos a corto plazo del hepatocito con la supervivencia celular a largo plazo de la progenitora.
Dentro de las células progenitoras de origen hepático se encuentran las progenitoras fetales hepáticas: los hepatoblastos y las células madre progenitoras hepáticas: células ovales, células bipotenciales, ya que se diferencian a colangiocitos y a hepatocitos. Constituyen una reserva de células que proliferan tras un daño hepático masivo y colonizan el parénquima hepático, planteándose la cuestión de si es posible aislarlas, crecer y expandirlas/diferenciarlas para uso terapéutico17,18. Sin embargo, hasta el momento actual su obtención es difícil.
Otra opción en desarrollo es la obtención de hepatocitos derivados de progenitoras pluripotentes procedentes de las células madre embrionarias (hES), células madre de origen mesenquimal (MSC), adiposas/medulares y células madre pluripotentes inducidas (Ips)17–19.
Las hES son células que derivan del embrión es el estadio de blastocisto. Son capaces de crecer indefinidamente in vitro y mantener su pluripotencialidad, diferenciándose a todos los tipos celulares. Sin embargo, plantean problemas éticos y legales que imposibilitan su uso en el momento actual19. La obtención de las MSC procedentes del tejido adiposo o médula ósea, es sencilla y no presenta las reservas de tipo ético o inmunorreactivo, ya que se trata de tejido autógeno. El tejido adiposo es rico en este tipo de células y su obtención es más fácil que desde la médula ósea, sin embargo, la necesidad de manipulación para obtenerlas las convierten en la categoría de medicamento siendo complejo su empleo19. Por último, las Ips inducidas son células somáticas con capacidad para poder ser reprogramadas a células pluripotenciales y a partir de ahí dirigir su diferenciación a hepatocitos. Constituyen una opción terapéutica muy prometedora y en combinación con la terapia génica podrían ser de gran utilidad. Sin embargo, los problemas de seguridad cuestionan en su uso, planteando críticas en especial por el riesgo de neoplasia e inmunogenicidad. Constituyen sin embargo una promesa de futuro17.
Respecto a las indicaciones del TCH, en la conferencia de consenso quedan resumidas las patologías en las que se ha llevado a cabo el TCH. A nivel mundial, se han comunicado más de 30 niños con errores congénitos del metabolismo tratados con TCH6–12, matizando las alteraciones del ciclo de la urea como la metabolopatía en la que más frecuentemente se ha indicado esta terapia13 (tabla 1).
Patologías en las que se ha realizado el trasplante celular hepático
| -Errores congénitos del metabolismo |
| -Síndrome de Crigler-Najjar tipo 1 |
| -Hipercolesterolemia familiar |
| -Déficit del factor VII |
| -Glucogenosis tipo I |
| -Enfermedad de Refsum's |
| -Colostasis familiar intrahepática tipo 2 |
| -Defectos del ciclo de la urea |
| -Déficit de ornitin transcarbamilasa |
| -Déficit de argininosuccinato liasa |
| -Déficit de carbamil fosfatasa sintetasa tipo 1 |
| -Citrulinemia |
| -Fallo hepático agudo |
| -Drogas |
| -Vírica |
| -Idiopática |
| -Intoxicación por setas |
| -Insuficiencia hepática tras resección hepática |
| -Insuficiencia hepática aguda en embarazo |
| -Acute on chronic liver failure (ACLF) |
| -Déficit de alfa 1 antitripsina |
| -Alcohol |
Más de 40 pacientes con insuficiencia hepática aguda han sido tratados en total, de los cuales 18 presentaban un fallo hepático fulminante. En estos pacientes el objetivo es mantener la función hepática como un puente para THO o hasta su regeneración. Aunque se describe una reducción de los niveles de bilirrubina y amonio, así como una mejoría de la encefalopatía hepática, el TCH no influyó de forma significativa en su evolución clínica20.
En mayo del 2008 iniciamos el programa de TCH en el Hospital La Fe de Valencia, habiendo realizado hasta el momento 8 TCH, 4 en adultos y 4 en niños11,12.
La indicación en los pacientes pediátricos son las metabolopatías: una paciente con deficiencia de la ornitinatranscarbamilasa, una niña con una enfermedad de Crigler-Najjar (CNI), una niña con una glucogenosis Ia GSD y un niño con una tirosinemia tipo I(TYR-I) (tabla 2). El diagnóstico se estableció mediante determinación de la actividad enzimática del hígado y/o metabolitos específicos en suero, confirmado mediante estudio genético. En todos los casos, las medidas terapéuticas no lograron estabilizar la enfermedad, evidenciándose un deterioro clínico y analítico. Nuestra indicación en estos niños se basa en la gravedad de la enfermedad y el deterioro de la calidad de vida, con el fin de mejorar su situación clínica; son niños en los que el TCH se indica como puente al THO o en los que por distintas circunstancias no existe indicación de THO12.
Experiencia del Hospital la Fe de Valencia en trasplante celular hepático en niños
| Paciente | P1 | P2 | P3 | P4 |
| Etiología | OTC | CNI | GSD | TYR-I |
| Sexo | Niña | Niña | Niña | Niño |
| Edad | 12 años | 9 meses | 6 años | 4 meses |
| Mutación | mutación c.533C >T/p.Thr178Met | c.120 del G (p.Trp40CysfsX2) del gen UGT1A1 | p.Arg83Cys en el exon 2 del gen glucosa-6-fosfatasa | IVS6-1 G>T y IVS12+5G>A gen del enzima fumarilacetoacetato hidrolasa |
| N.° hepatocitos | 0,87×109 hepatocitos | 6,7×109 hepatocitos | 2,35×109 hepatocitos | 0,66×109 hepatocitos |
| % masa hepática | 2 | 17 | 5,97 | 3,5 |
| Vía infusión | Portal | Portal | Portal | Portal |
| Hepatocitos | Criopreservados | Criopreservados | Criopreservados | Criopreservados |
| Inmunosupresión | Tacrolimus | Tacrolimus | Tacrolimus | Tacrolimus |
| Profilaxis antibiótica | Sí | Sí | Sí | Sí |
| Respuesta al TCH | ↓ Nivel de amonio↓ I. de Quick | ↓ Bilirrubina sérica↓Requerimientos de fototerapia | Desaparición crisis de hipoglucemia↓Triglicéridos, ↓Colesterol ↓Ácido úrico | ↓ Bilirrubina séricaMejora de la hemostasia (INR) |
| Evolución | Exitus | Estable | Estable | TH |
CNI: enfermedad de Crigler-Najjar; GSD: glucogenosis Ia; INR: international normalized ratio; TCH: trasplante celular hepático; TH: trasplante hepático; TYR-I: tirosinemia tipo I; OTC: deficiencia de la ornitina transcarbamilasa.
Los pacientes adultos, todos varones, presentaban una insuficiencia hepática aguda. De los 4 pacientes, 2 habían sido previamente trasplantados por cirrosis hepática virus C, y se encontraban en lista para retrasplante hepático por recidiva del virus; el objetivo del TCH era servir de puente hasta el retrasplante. En los otros 2, la insuficiencia hepática aguda se presentó tras una resección hepática mayor por metástasis hepáticas y tras una importante ingesta de alcohol en el contexto de una cirrosis hepática alcohólica no diagnosticada (tabla 3). Ambos pacientes recibieron el TCH como puente al restablecimiento de la función hepática. Nuestra indicación del TCH fue cuando todas las medidas terapéuticas habían fracasado, presentaban un deterioro clínico y analítico con encefalopatía hepática grado III o IV pese a la instauración de un tratamiento médico agresivo, siendo necesario su ingreso en la unidad de cuidados intensivos11.
Experiencia en trasplante celular en adultos con insuficiencia hepática aguda
| P1 | P2 | P3 | P4 | |
| Etiología | VHC | VHC | Metástasis hepáticas | Alcohólica |
| Sexo | Varón | Varón | Varón | Varón |
| Edad | 42 | 49 | 66 | 50 |
| Child-Pugh | 15 | 15 | - | 13 |
| MELD | 39 | 32 | - | 35 |
| ABO | 0 | 0 | A | A |
| Respuesta tratamiento antiviral | No | Sí | _ | _ |
| Respuesta MARS | No | No | - | - |
| Factor predisponente | Hemorragia por varices esofágicas | Peritonitis bacteriana espontánea | No | Abuso de alcohol |
| Encefalopatía | IV | III | III-IV | III-IV |
| Respuesta tratamiento encefalopatía | No | No | No | No |
| Fallo renal | Renal | No | No | Renal |
| Plasma fresco | Sí | Sí | Sí | Sí |
| Tacrolimus | Sí | Sí | Sí | Sí |
| Profilaxis antibiótica | Sí | Sí | Sí | Sí |
| TH previo | Sí (10 años antes TH) | Sí (2 años antes TH) | No | No |
| N.° hepatocitos | 2.209×109 hepatocitos | 3.610×109 hepatocitos | 2.300×109 hepatocitos | 1.200×109 hepatocitos |
| % Masa hepática | 1,57 | 2,4 | 1,44 | 0,76 |
| Vía infusión | Arteria esplénica | Arteria esplénica | Arteria esplénica | Arteria esplénica |
| Hepatocitos | Criopreservados | Criopreservados | Criopreservados | Criopreservados |
| Retrasplante | No | Sí | No | No |
| Evolución | Exitus | Vivo | Exitus | Exitus |
ABO: grupo sanguíneo; MARS: molecular adsorbent recirculating system; MELD: model for end-stage liver disease; TH: trasplante hepático; VHC: virus hepatitis C.
Existe unanimidad respecto al procedimiento para el aislamiento de hepatocitos mediante la perfusión del hígado in situ con colagenasa. La viabilidad celular es determinada mediante el test de exclusión del azul-tripán, que mide la integridad de la membrana celular. Las células muertas son permeables al colorante y se tiñen de azul, sin embargo, su correlación con la función metabólica y la posibilidad de injertarse en el receptor no ha sido demostrada. Con el fin de mejorar la viabilidad y la función metabólica del hepatocito, las nuevas líneas de investigación proponen la adición de un antioxidante como la N-acetilcisteína a la solución de perfusión al aislar las células. Se describe una mejoría de estos parámetros en los hepatocitos aislados a partir de hígados grasos, proponiendo su uso de forma rutinaria21.
Se considera indicado determinar la viabilidad antes de la criopreservación y después de la descongelación de las células así como antes y después de su infusión, debiendo de ser esta superior al 80% para criopreservar los hepatocitos y superior al 60% tras la descongelación, antes de su infusión en el receptor13.
Criopreservación de los hepatocitosLa criopreservación representa una de las grandes dificultades en la terapia celular hepática. Los hepatocitos administrados pueden ser frescos o criopreservados. La criopreservación origina un daño a nivel mitocondrial, aumenta la permeabilidad de la mitocondria, ocasionando una pérdida de la capacidad de síntesis de ATP y alteraciones a nivel de la respiración celular al ocasionar cambios en la actividad de los enzimas de la cadena respiratoria13. Algunos centros de Europa solo trasplantan hepatocitos criopreservados, lo cual permite efectuar controles microbiológicos exhaustivos evitando el riesgo de transmisión de infecciones, posibilita la creación de un banco de células permitiendo disponer de ellas en situaciones de urgencia al tiempo que aporta flexibilidad para la realización esta terapia como un tratamiento programado13,22. Sin embargo, la criopreservación tiene efectos dañinos sobre la viabilidad y la función metabólica de las células, lo cual implica que tras la descongelación estas pueden no ser aptas para su uso.
Las diferencias en los procedimientos de criopreservación entre los distintos grupos ocasionan diferencias en la calidad de las células tras su realización, dificultando la comparación de los resultados, lo cual pone de manifiesto la necesidad de aunar y mejorar dichos protocolos. Algunos autores postulan que las lesiones de criopreservación son Fe+ dependientes, por lo que proponen la adición de sustancias quelantes del hierro como la desferoxamina y LK 614 con el fin de disminuir el daño ocasionado por el frío. Estudios realizados demuestran que el empleo de soluciones de preservación ricas en iones (Cl−,Na+, K+, y Ph 7,0) contribuirían a disminuir las lesiones de criopreservación23. Otros autores proponen la adición de crioprotectores con objeto de mejorar el protocolo de criopreservación DMSO-UW. El equipo de trabajo del King's College propone nuevas medidas como una disminución de la densidad celular (107 células/mL) en las criobolsas y una mejora de la solución de criopreservación. Con este protocolo obtienen una criopreservación del hepatocito sin pérdida de la función hasta 3 años con mejora de la viabilidad y el rendimiento24. Tras la conferencia de consenso, los autores concluyen que las células frescas tienen mayor viabilidad que las criopreservadas.
Control de calidad de los hepatocitosEl resultado de TCH está estrechamente relacionado con la calidad de las células trasplantadas. Los controles de calidad de las células tratan de obtener información que permita seleccionar las mejores células en función de la patología de base del receptor en el menor tiempo posible13,25. Para ello se propone la determinación de la producción de ATP, que proporciona una estimación indirecta de la viabilidad y actividad funcional de los hepatocitos así como la determinación de las funciones metabólicas del hepatocito, tales como ureogénesis, determinación de los niveles de actividad enzimática en la célula y la metabolización de fármacos mediante medición de la actividad del citocromo P 45022.
Nuevas líneas de investigación proponen la determinación del perfil metabólico de las células mediante la cuantificación de la respiración celular a nivel mitocondrial así como la obtención de metabolitos fluorescentes y luminiscentes mediante el uso de equipos de fluorescencia y luminiscencia. Se plantea la posibilidad de realizar una biopsia hepática con el fin de efectuar un estudio histológico y análisis de estrés oxidativo y apoptosis al tiempo que se realiza un análisis metabonómico con determinación enzimática mediante H-resonancia nuclear magnética (Hydrogen-1 NMR) o por espectrometría de masas, que permitiría de seleccionar las células en función de su actividad enzimática26. Ello plantea la posibilidad de infundir hepatocitos con mayor actividad enzimática. Sin embargo, y pese a todo lo expuesto anteriormente, en el momento actual se desconoce cuáles son los parámetros de calidad celular que se correlacionan mejor con la integración celular y con un resultado favorable trasplante celular.
Realización del trasplante celular hepáticoLa realización del trasplante de hepatocitos debe respetar la compatibilidad ABO. Son aspectos clave en su realización: la vía y lugar de infusión de los hepatocitos así como el número de infusiones y de células administradas por infusión. Trasplantamos entre el 5-10% de la masa celular hepática teórica estimada del receptor siendo necesario tener en cuenta el número máximo de células por infusión con objeto de evitar efectos secundarios, especialmente la aparición de un aumento de la presión portal, que se controlará mediante la realización de eco-doppler13.
El trasplante de hepatocitos se realiza mediante infusión manual vía portal (previa colocación de un port-a-cath en la vena porta) en las metabolopatías o en la arteria esplénica (en los adultos con cirrosis hepática), de células frescas o criopreservadas, precisando para ello realizar un número variable de infusiones2,6–12,15. Entre las alternativas al sitio de infusión, las líneas futuras proponen la infusión intraperitoneal de hepatocitos encapsulados en microesferas de alginato, lo cual ofrecería la ventaja de evitar la inmunosupresión. Estudios realizados apunta a una mejora en la supervivencia de los hepatocitos debida más al soporte metabólico que a la estimulación de la regeneración hepática27,28.
Es necesaria una pauta de inmunosupresión se basa en la administración de un bolo de corticoides de forma previa a la infusión celular seguida de doble terapia con corticoides e inhibidores de la calcineurina.
Integración de las células trasplantadas en el receptor o «engraftment»El resultado del TCH está limitado por la baja eficiencia de la integración de las células trasplantadas en el receptor así como por la dificultad de monitorización de estas células tras el TCH. Su identificación en el hígado receptor puede ayudar a determinar los mecanismos implicados. En humanos, sin embargo, la demostración de esta integración celular no es fácil. Se considera que el mejor método para la monitorización de los hepatocitos tras el TCH reside en la determinación de la actividad enzimática deficitaria. Ello proporcionaría una evidencia indirecta de la función celular tras el trasplante, aunque no aporta información respecto a la ubicación o el número de células funcionantes.
Estudios experimentales demuestran que un 70% de los hepatocitos son eliminados del sistema portal y sinusoide hepático en 24-48h por el sistema inmune, las células de Kufffer y los neutrófilos, por lo que una cuestión pendiente de resolver es como prevenir la pérdida precoz de estas células trasplantadas. Investigaciones realizadas apoyan que la expresión de un factor tisular del hepatocito origina una activación de la cascada de la coagulación; con esta premisa, se estudia inhibir la actividad procoagulante con Nacetil cisteina, ası como el uso de inhibidores de la activación del complemento y de la coagulación con sulfato de dextrano como posibles vías de actuación para evitar la pérdida de los hepatocitos.
Otros autores consideran que controlar los cambios vasculares y la inflamación hepática puede mejorar el proceso de integración de los hepatocitos en el receptor. La infusión de células en el interior del vaso ocasiona una respuesta inflamatoria que origina un aumento de la permeabilidad vascular y una disrupción del endotelio vascular, detectando una sobrerregulación de citocinas asociada a la activación de neutrófilos, macrófagos y citocinas reguladoras (factor de necrosis tumoral e interleucina 6), lo cual plantearía la posibilidad de modular directamente el proceso de anidación celular con fármacos29,30.
Por otra parte, se ha observado en estudios animales que la integración de los hepatocitos en el parénquima requiere entre 3-7 días, constatando que mediadores de la respuesta inmune como los linfocitos T CD4 y CD8 contribuyen a la pérdida de función del injerto31. Los pacientes muestran una mejoría clínica y/o corrección parcial del defecto metabólico subyacente, aunque, en la mayoría de los casos, no se objetivan beneficios sostenidos.
Las futuras líneas de investigación están basadas en el uso de técnicas de preacondicionamiento, cuyo fin es buscar métodos aceptables desde el punto de vista clínico que estimulen la proliferación de los hepatocitos implantados. Entre estas técnicas se encuentran la irradiación del hígado y la embolización parcial portal de forma aislada o conjunta con cirugía32–34.
La irradiación hepática es un método de preacondicionamiento propuesta para mejorar la integración celular en el parénquima hepático. Modelos experimentales exponen que la irradiación hepática con dosis 15-50Gy unos 7 días antes del TCH mejora la integración y la proliferación celular, debiendo realizar el implante celular entre 1-7 días después. En pacientes con cirrosis hepática se debe evitar la irradiación al ser el parénquima hepático más sensible. No hay datos concluyentes respecto a la irradiación hepática en los niños menores de 2 años; por encima de esta edad fracciones aisladas de 3-5Gy son seguras, aunque se desconoce si sería suficiente para estimular la repoblación con células del donante. Son necesarios futuros estudios que definan en que pacientes y en que patologías estaría indicada su aplicación33,34.
La embolización portal es otra técnica de preacondicionamiento, considerado como un procedimiento menos invasivo que propicia la regeneración hepática. Se ha descrito el uso de partículas de material absorbible (Gelofoam®), realizando una embolización muy distal. Ello induce la proliferación de hepatocitos y la hipertrofia el lóbulo no embolizado, observando la recanalización completa de la porta trascurridos 13 días35.
Si los estudios previstos iniciales con estas técnicas permitieran establecer que el acondicionamiento previo del hígado es seguro y ofrece una mejora en el injerto, abriría sin duda nuevas oportunidades en el campo del TCH.
En el momento actual, el trasplante de hepatocitos constituye un avance en el tratamiento de la insuficiencia hepática. La infusión de hepatocitos en el hígado o el bazo es un procedimiento seguro y bien tolerado por los pacientes. Aporta la ventaja de no ser un proceso quirúrgico mayor, con menor morbilidad, mortalidad y coste y ser una terapia mucho menos invasiva que el trasplante convencional, ofreciendo la posibilidad de maximizar recursos al poder utilizar un mismo donante para varios receptores. Las experiencias clínicas demuestran mejoría metabólica en los pacientes cuando trasplantamos células adultas diferenciadas aunque el beneficio obtenido no se mantiene de forma indefinida en el tiempo. La integración de los hepatocitos en el receptor requiere de células con mayor crecimiento, por ello se investigan nuevas líneas celulares como las progenitoras hepáticas o fetales, aunque este tipo de células actualmente son difíciles de obtener. Los hepatocitos derivados de células pluripotentes constituyen una opción muy prometedora, en particular el uso de células madre pluripotentes inducidas en combinación con la terapia génica. Sin embargo, en el momento actual quedan por resolver cuestiones de seguridad en especial riesgo de neoplasia e inmunogenicidad, que permita plantear su uso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.