Identificar las características clínicas, las modalidades de tratamiento y la evolución del hematoma espontáneo de la vaina del recto (HEVR). En la literatura, no hay ningún estudio clínico prospectivo sobre el tratamiento en un ámbito de investigación clínica.
MétodosSe incluyeron en el estudio 17 pacientes con HEVR que fueron diagnosticados y tratados entre marzo de 2012 y marzo de 2014 en el Departamento de Cirugía General del Hospital Docente e Investigador de la Universidad de Erzincan. Se evaluaron los datos de edad, sexo, peso, altura, factores predisponentes, comorbilidades, índice de Charlson, tratamiento médico actual, signos a la exploración física, exploraciones de diagnóstico por la imagen, valor mínimo de la hemoglobina, tipo sanguíneo, tipo de HEVR, valores de INR/mutación de factor v Leiden/factor vii/factor viii/factor x/proteína S/proteína C, método de tratamiento, transfusiones, duración de la hospitalización y evolución clínica.
ResultadosTrece pacientes fueron mujeres. La media de edad fue de 63,3±18,7 años (rango, 22-87 años), y la media del IMC fue de 27,8±3,5 (rango, 20,9-33,7). Seis pacientes presentaban un HEVR de grado i, 5 un HEVR de grado ii y 6 un HEVR de grado iii. Trece fueron ingresados durante un periodo medio de hospitalización de 9,3±8,1 días (rango, 1-30 días). La tasa de mortalidad atribuible al HEVR fue del 5,8%.
ConclusionesUn diagnóstico precoz del HEVR mediante ecografía y/o tomografía computarizada es importante para obtener una tasa de mortalidad baja. A pesar de que los tratamientos médicos son importantes, pueden ser necesarias una embolización arterial mediante radiología intervencionista o intervenciones más radicales como la cirugía.
To identify clinical characteristics, treatment modalities, and course of spontaneous rectus sheath hematoma (SRSH). In the literature, there is no prospective clinical trial that is intended for treatment in clinical research.
MethodsSeventeen SRSH patients diagnosed and treated between March 2012 and March 2014 at the general Surgery Department of Erzincan University Training and Research Hospital were included. Age, sex, weight, height, predisposing factors, comorbid diseases, Charlson index, current medical treatment, physical examination signs, imaging methods, lowest hemoglobin value, blood type, SRSH type, INR/Factor V Leiden mutation/Factor VII/Factor VIII/Factor X/Protein S/Protein C values, treatment method, transfusions hospitalization duration, and outcome were studied.
ResultsThirteen patients were female. The mean age was 63.3±18.7 years (range, 22-87 years), and the mean BMI was 27.8±3.5 (range, 20.9-33.7). Six patients had Grade I SRSH, 5 had Grade II SRSH, and 6 had Grade III SRSH. Thirteen were hospitalized for a mean duration of 9.3±8.1 days (range, 1-30 days). The death rate attributable to SRSH was 5.8%.
ConclusionEarly diagnosis of SRSH by ultrasonography and/or computerized tomography is important for a low mortality rate. Even though medical treatments are important, arterial embolization by interventional radiology, or more radical interventions such as surgery, may be required.
El hematoma de la vaina del recto es consecuencia de una rotura directa o un daño sufrido por la arteria epigástrica inferior o superior. Como resultado de ello, se acumula sangre en la vaina del recto1,2. Dado que, en la mayoría de los casos, no hay una intervención quirúrgica previa, el proceso se denomina hematoma espontáneo de la vaina del recto (HEVR) 3. En el pasado, esta enfermedad se observaba de manera muy infrecuente. El diagnóstico clínico inicial de la enfermedad puede resultar difícil ya que es posible confundirlo con otros trastornos. Por ejemplo, puede diagnosticarse como un proceso inflamatorio intraabdominal, lo cual puede comportar un retraso en el diagnóstico y una laparotomía innecesaria. Una forma de presentación clínica general es la aparición súbita de dolor abdominal con masas palpables en mujeres ancianas. Por lo que respecta a la etiología, la enfermedad se asocia al sexo femenino, la edad avanzada, el tratamiento anticoagulante y la tensión exagerada en la pared abdominal4. Una etiología poco clara del HEVR es el déficit de factores de la coagulación, que es infrecuente que se defina. Concretamente, se observan déficits de los factores vii y x5.
En los pacientes con dolor abdominal agudo que son evaluados radiológicamente, la tasa anual estimada de HEVR se sitúa entre el 1,2% y el 1,5%. En consecuencia, es excepcional que un médico se encuentre con esta situación clínica a lo largo de su práctica clínica. Aunque el reposo en cama y la analgesia son la base de los protocolos de tratamiento estándares, pueden ser necesarias intervenciones más radicales6. Aunque el HEVR puede presentar una regresión espontánea con un tratamiento conservador, la tasa de mortalidad puede ser de hasta un 4%, y aumenta hasta un 25% si el paciente está siendo tratado con anticoagulantes3. La identificación de los factores etiológicos existentes en el HEVR facilita el diagnóstico en el momento de la presentación clínica, lo cual asegura la aplicación de un tratamiento rápido y efectivo. El objetivo del presente estudio prospectivo es identificar las características clínicas, las modalidades terapéuticas aplicadas y la evolución de la enfermedad. En la literatura, no hay ningún otro estudio prospectivo planificado sobre el tratamiento en un ámbito clínico.
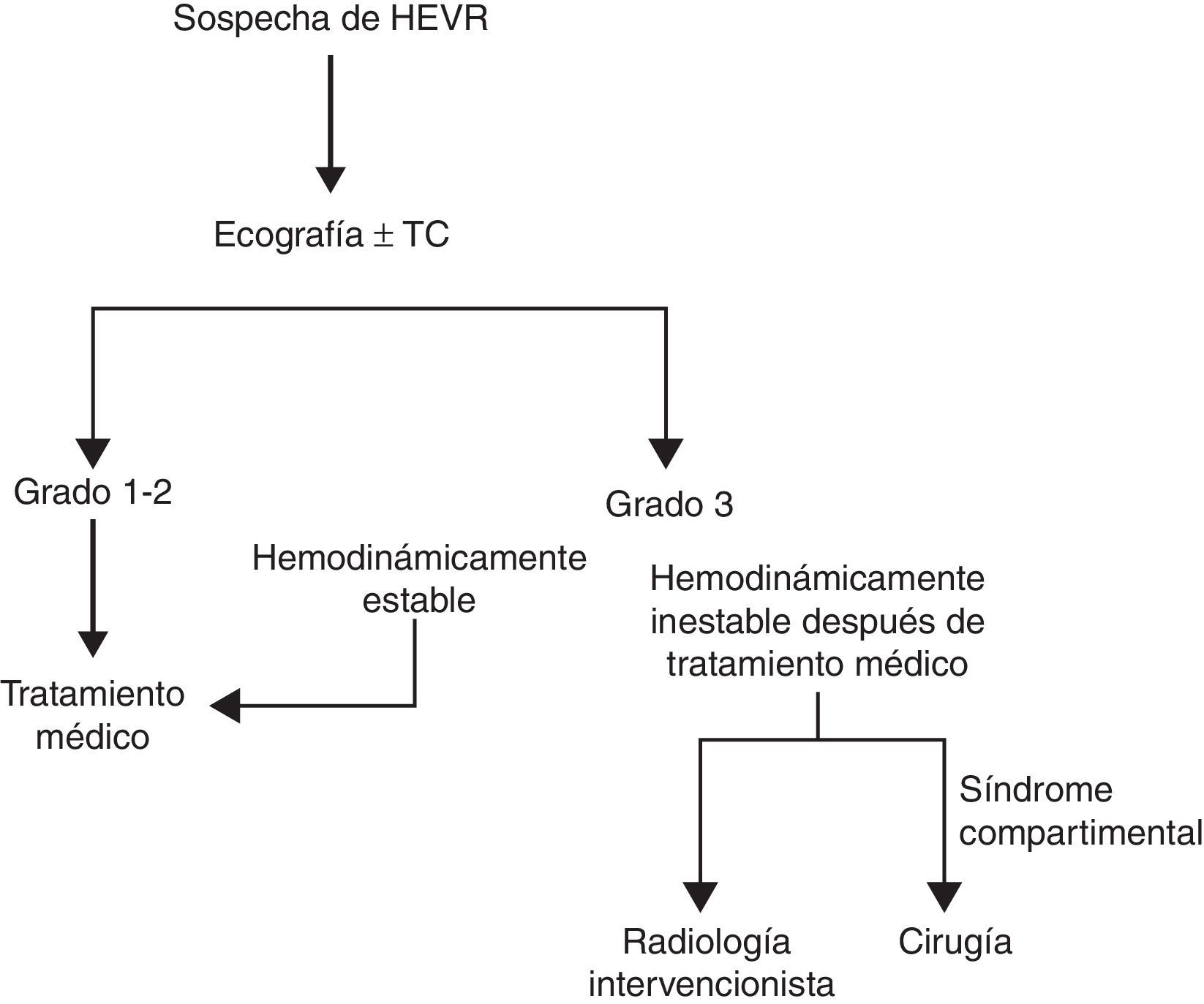
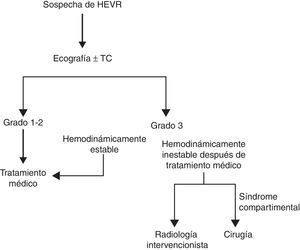
MétodosSe incluyeron en el estudio los pacientes con HEVR que fueron diagnosticados y tratados entre marzo de 2012 y marzo de 2014 en la clínica de cirugía general del Hospital Docente e Investigador de la Universidad de Erzincan. El Hospital Docente e Investigador de la Universidad de Erzincan es un hospital de referencia, de nivel terciario. Se utilizó Microsoft Excel 2007 después de cada tratamiento para registrar una serie de factores como edad, sexo, peso, altura, factores predisponentes (tos, ejercicio, etc.), y comorbilidades. También se registró el índice de Charlson, el tratamiento médico actual (anticoagulantes, antiagregantes plaquetarios, etc.), signos en el momento de la exploración física (signos de Carnett/Fothergill) y las exploraciones de diagnóstico por la imagen como la ecografía y la tomografía computarizada (TC). Por último, se registraron asimismo el valor más bajo de la hemoglobina, el tipo sanguíneo, el tipo de HEVR, los valores de INR/mutación de factor v Leiden/factor vii/factor viii/factor x/proteína S/proteína C, los métodos de tratamiento (médico, embolización arterial mediante radiología intervencionista, cirugía), el estado transfusional, la duración de la hospitalización y la evolución clínica (curación, exitus, causa del exitus). Se registraron también los valores de factor vii/factor viii/factor x/proteína S/proteína C de los pacientes tratados con anticoagulantes, antiagregantes plaquetarios, etc., una semana después de la última dosis de medicación. Utilizamos la exploración física y las técnicas de imagen para diagnosticar el HEVR, y se dividió a los pacientes en 3 grupos según lo observado en las técnicas de diagnóstico por la imagen. En el grupo de grado i había un hematoma intramuscular unilateral, que no producía una disección a lo largo de la fascia. En el grupo de grado ii había un hematoma intramuscular que podía ser bilateral y producir una disección a lo largo de la fascia, dando lugar a una posible reducción de la hemoglobina. En el grupo de grado iii había un hematoma que causaba una disección a lo largo de la fascia, con extensión extraperitoneal o extensión intraperitoneal y presencia de sangre prevesical, asociado a una disminución de la hemoglobina7. El protocolo de diagnóstico y tratamiento aplicado se muestra en la figura 1. Los pacientes de grado i que presentaban comorbilidades, así como todos los pacientes de grado ii o iii, fueron hospitalizados. Un paciente fue dado de alta cuando se confirmó la regresión del hematoma con el empleo de ecografía. Todos los pacientes fueron remitidos a AI, que se encargó de su seguimiento. Este estudio se llevó a cabo cumpliendo las directrices de la Declaración de Helsinki y con la aprobación ética local del comité ético de la Universidad de Erzincan. Se obtuvo el consentimiento informado de todos los pacientes.
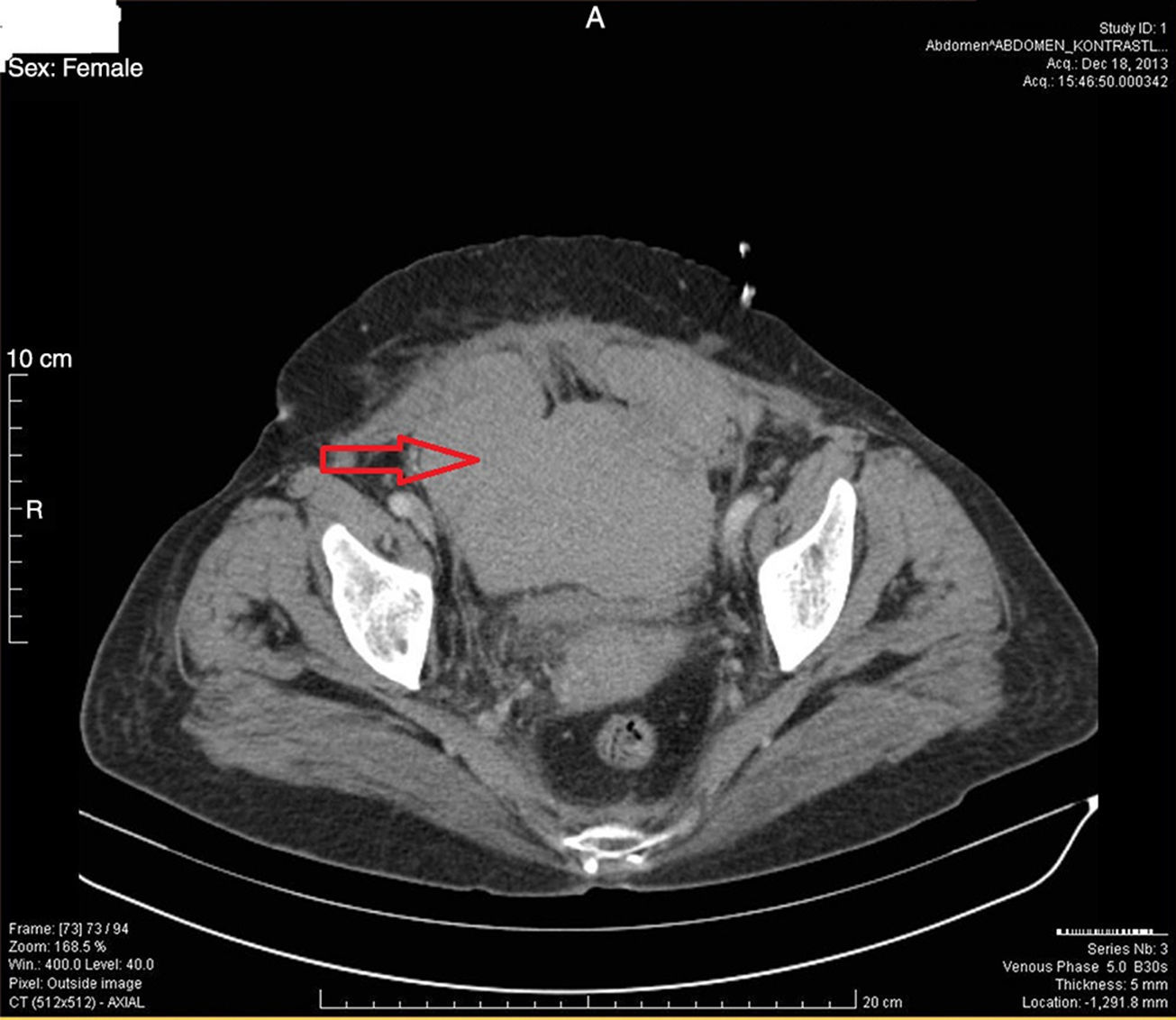
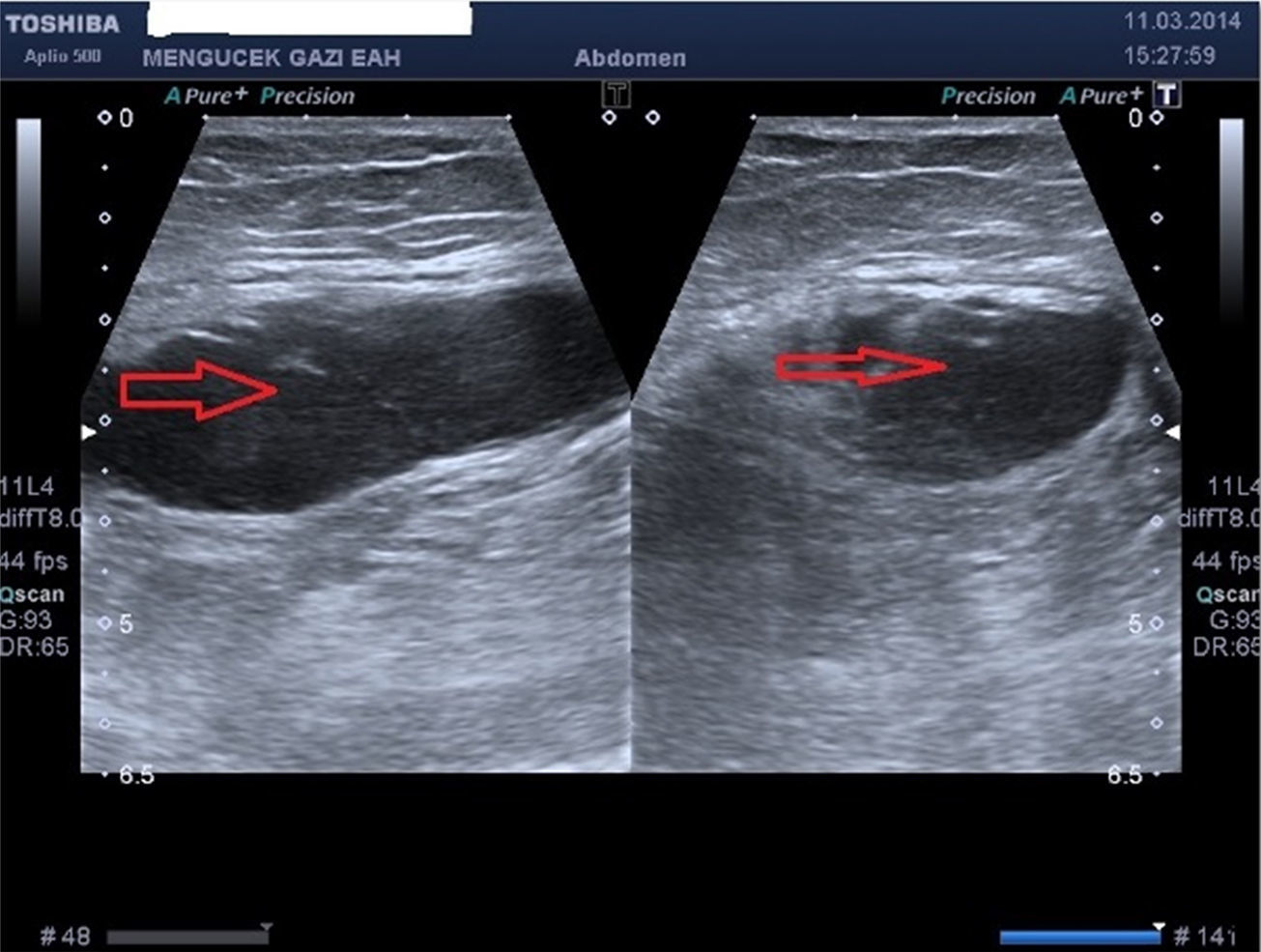
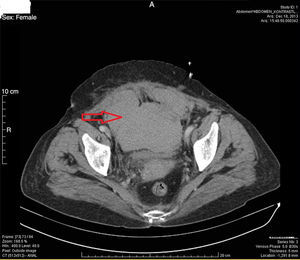
ResultadosTrece pacientes fueron mujeres. La media de edad fue de 63,3±18,7 años (rango, 22-87 años). La media del IMC fue de 27,8±3,5 (rango, 20,9-33,7). Trece pacientes acudieron al servicio de urgencias y todos los demás a la clínica ambulatoria. Trece pacientes fueron hospitalizados. La media de duración de la hospitalización fue de 9,3±8,1 días (rango, 1-30). En 4 pacientes que no fueron hospitalizados, se utilizó un protocolo de seguimiento ambulatorio con controles en la primera semana y en los meses 1-6. Estos pacientes presentaron menos dolor que los pacientes hospitalizados y se les administraron fármacos antiinflamatorios no esteroideos. Seis pacientes fueron clasificados en el grupo de grado i, 5 pacientes en el grupo de grado ii y 6 pacientes en el grupo de grado iii. Cinco pacientes no estaban siendo tratados con anticoagulantes, antiagregantes plaquetarios (clopidogrel), etc. La mayoría de los pacientes (8 individuos) presentaban una masa dolorosa a la palpación en el cuadrante inferior derecho. Un total de 15 pacientes presentaban el signo de Carnett y 11 pacientes el signo de Fothergill. Se utilizó una TC (fig. 2) después de la ecografía (fig. 3) para el diagnóstico en 10 pacientes. Seis pacientes fueron diagnosticados con el empleo tan solo de ecografía. De los 12 pacientes en los que pudieron determinarse los niveles de los factores de la coagulación, tan solo uno presentaba déficits de factor vii-viii. Se utilizaron concentrados de hematíes para aumentar los niveles de hemoglobina y/o plasma fresco congelado para neutralizar el efecto de la cumadina en 8 pacientes. En 15 pacientes se llevó a cabo un tratamiento médico. En un paciente se aplicó una embolización arterial realizada mediante radiología intervencionista. Un paciente que presentaba un síndrome compartimental abdominal fue operado y falleció al sexto día de postoperatorio. Sin embargo, el HEVR no fue la única causa de las hospitalizaciones prolongadas, ni la única causa de la muerte. Las hospitalizaciones prolongadas son causadas generalmente por comorbilidades. Las demás causas de muerte son comorbilidades como infarto de miocardio, enfermedad pulmonar obstructiva crónica y hemorragia intracerebral. La tasa de mortalidad del HEVR fue del 5,8%; todos los datos se presentan en la tabla 1.
Historias clínicas de los pacientes
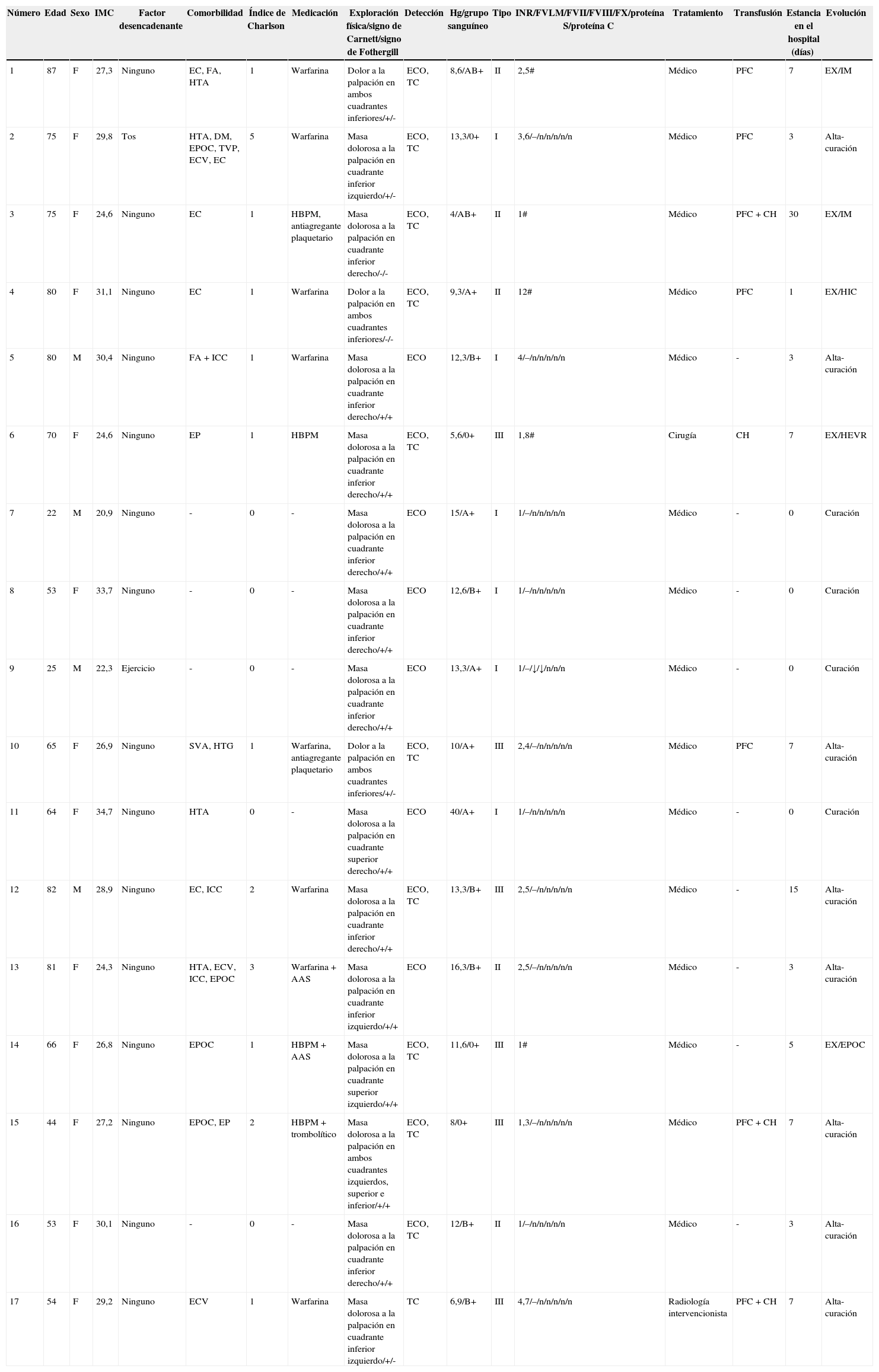
| Número | Edad | Sexo | IMC | Factor desencadenante | Comorbilidad | Índice de Charlson | Medicación | Exploración física/signo de Carnett/signo de Fothergill | Detección | Hg/grupo sanguíneo | Tipo | INR/FVLM/FVII/FVIII/FX/proteína S/proteína C | Tratamiento | Transfusión | Estancia en el hospital (días) | Evolución |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 87 | F | 27,3 | Ninguno | EC, FA, HTA | 1 | Warfarina | Dolor a la palpación en ambos cuadrantes inferiores/+/- | ECO, TC | 8,6/AB+ | II | 2,5# | Médico | PFC | 7 | EX/IM |
| 2 | 75 | F | 29,8 | Tos | HTA, DM, EPOC, TVP, ECV, EC | 5 | Warfarina | Masa dolorosa a la palpación en cuadrante inferior izquierdo/+/- | ECO, TC | 13,3/0+ | I | 3,6/–/n/n/n/n/n | Médico | PFC | 3 | Alta-curación |
| 3 | 75 | F | 24,6 | Ninguno | EC | 1 | HBPM, antiagregante plaquetario | Masa dolorosa a la palpación en cuadrante inferior derecho/-/- | ECO, TC | 4/AB+ | II | 1# | Médico | PFC+CH | 30 | EX/IM |
| 4 | 80 | F | 31,1 | Ninguno | EC | 1 | Warfarina | Dolor a la palpación en ambos cuadrantes inferiores/-/- | ECO, TC | 9,3/A+ | II | 12# | Médico | PFC | 1 | EX/HIC |
| 5 | 80 | M | 30,4 | Ninguno | FA+ICC | 1 | Warfarina | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO | 12,3/B+ | I | 4/–/n/n/n/n/n | Médico | - | 3 | Alta-curación |
| 6 | 70 | F | 24,6 | Ninguno | EP | 1 | HBPM | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO, TC | 5,6/0+ | III | 1,8# | Cirugía | CH | 7 | EX/HEVR |
| 7 | 22 | M | 20,9 | Ninguno | - | 0 | - | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO | 15/A+ | I | 1/–/n/n/n/n/n | Médico | - | 0 | Curación |
| 8 | 53 | F | 33,7 | Ninguno | - | 0 | - | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO | 12,6/B+ | I | 1/–/n/n/n/n/n | Médico | - | 0 | Curación |
| 9 | 25 | M | 22,3 | Ejercicio | - | 0 | - | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO | 13,3/A+ | I | 1/–/↓/↓/n/n/n | Médico | - | 0 | Curación |
| 10 | 65 | F | 26,9 | Ninguno | SVA, HTG | 1 | Warfarina, antiagregante plaquetario | Dolor a la palpación en ambos cuadrantes inferiores/+/- | ECO, TC | 10/A+ | III | 2,4/–/n/n/n/n/n | Médico | PFC | 7 | Alta-curación |
| 11 | 64 | F | 34,7 | Ninguno | HTA | 0 | - | Masa dolorosa a la palpación en cuadrante superior derecho/+/+ | ECO | 40/A+ | I | 1/–/n/n/n/n/n | Médico | - | 0 | Curación |
| 12 | 82 | M | 28,9 | Ninguno | EC, ICC | 2 | Warfarina | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO, TC | 13,3/B+ | III | 2,5/–/n/n/n/n/n | Médico | - | 15 | Alta-curación |
| 13 | 81 | F | 24,3 | Ninguno | HTA, ECV, ICC, EPOC | 3 | Warfarina+AAS | Masa dolorosa a la palpación en cuadrante inferior izquierdo/+/+ | ECO | 16,3/B+ | II | 2,5/–/n/n/n/n/n | Médico | - | 3 | Alta-curación |
| 14 | 66 | F | 26,8 | Ninguno | EPOC | 1 | HBPM+AAS | Masa dolorosa a la palpación en cuadrante superior izquierdo/+/+ | ECO, TC | 11,6/0+ | III | 1# | Médico | - | 5 | EX/EPOC |
| 15 | 44 | F | 27,2 | Ninguno | EPOC, EP | 2 | HBPM+trombolítico | Masa dolorosa a la palpación en ambos cuadrantes izquierdos, superior e inferior/+/+ | ECO, TC | 8/0+ | III | 1,3/–/n/n/n/n/n | Médico | PFC+CH | 7 | Alta-curación |
| 16 | 53 | F | 30,1 | Ninguno | - | 0 | - | Masa dolorosa a la palpación en cuadrante inferior derecho/+/+ | ECO, TC | 12/B+ | II | 1/–/n/n/n/n/n | Médico | - | 3 | Alta-curación |
| 17 | 54 | F | 29,2 | Ninguno | ECV | 1 | Warfarina | Masa dolorosa a la palpación en cuadrante inferior izquierdo/+/- | TC | 6,9/B+ | III | 4,7/–/n/n/n/n/n | Radiología intervencionista | PFC+CH | 7 | Alta-curación |
AAS: ácido acetilsalicílico; CH: concentrados de hematíes; DM: diabetes mellitus; EC: enfermedad coronaria; ECV: enfermedad cerebrovascular; EP: embolia pulmonar; EPOC: enfermedad pulmonar obstructiva crónica; EX: exitus; F: femenino; FA: fibrilación auricular; HBPM: heparina de bajo peso molecular; HEVR: hematoma espontáneo de la vaina del recto; Hg: hemoglobina; HIC: hemorragia intracerebral; HTA: hipertensión arterial; HTG: hipertrigliceridemia; ICC: insuficiencia cardiaca congestiva; IM: infarto de miocardio; IMC: índice de masa corporal; M: masculino; n: normal; PFC: plasma fresco congelado; SVA: sustitución valvular auricular; TVP: trombosis venosa profunda; #: no disponible.
El HEVR tiene una tasa de mortalidad elevada y se observa con frecuencia en mujeres ancianas, en especial las que están siendo tratadas con anticoagulantes. Es frecuente que los pacientes refieran dolor abdominal y que presenten masas abdominales palpables. Se investigaron diversos factores etiológicos como el asma, la hipertensión, el embarazo y el empleo de warfarina. Los pacientes con dolor abdominal agudo pueden ser diagnosticados erróneamente de apendicitis, diverticulitis o perforación8,9. Además, estos pacientes pueden ser operados inadvertidamente. Esto podría tener como consecuencia el retraso en el establecimiento del diagnóstico preciso. Esta enfermedad se observa con frecuencia en las mujeres10; un 76,5% de los pacientes de nuestro estudio fueron mujeres. El HEVR se observa sobre todo en la parte inferior del abdomen, tal como indica el estudio de Anyfantakis et al.11. Nosotros observamos el HEVR habitualmente en el cuadrante inferior derecho (47%). Debe realizarse un diagnóstico diferencial para descartar la apendicitis aguda, que es la causa de dolor abdominal agudo que se registra con mayor frecuencia. Por encima de la línea arqueada, la vaina posterior del recto tiene un efecto de contención; por debajo de la línea arqueada, hay una zona débil de la fascia transversalis y el peritoneo, y este puede ser el motivo por el que el HEVR se observa sobre todo en la parte inferior del abdomen. Además, los cambios de la longitud del músculo durante el movimiento se observan sobre todo en los cuadrantes inferiores, y pueden ser, pues, causas probables de las roturas de los vasos epigástricos inferiores. De igual modo, el HEVR puede diagnosticarse erróneamente a causa de los signos de irritación peritoneal, puesto que está próximo al peritoneo12.
Aunque el uso de una heparina de bajo peso molecular sola rara vez da lugar a un hematoma del recto, en comparación con lo que ocurre con el empleo de warfarina; esta complicación se dio en el presente estudio. El uso de una heparina de bajo peso molecular sola podría ser causa de una lesión yatrogénica de vasos epigástricos inferiores durante la inyección subcutánea en el abdomen. Para la administración de estos fármacos, las inyecciones en la región deltoidea pueden ser más seguras que las inyecciones en el abdomen. El nivel de los factores de la coagulación se encuentra dentro del rango normal a las 72-96h de finalizada la administración de la warfarina. Teniendo en cuenta este hecho, se verificaron sistemáticamente los niveles de factores de los pacientes tratados con anticoagulantes, antiagregantes plaquetarios, etc., el día 7 después de la última dosis de esos fármacos. Tan solo un paciente presentó niveles de factores bajos. Como consecuencia de un déficit de factores, pueden observarse hemorragias intraabdominales o intraarticulares, así como hemorragias intramusculares como el hematoma del recto. En la literatura, por lo que se refiere a estos grupos de pacientes, solamente hay un caso descrito en el que se determinaron los niveles de factores en sangre y se diagnosticó un nivel bajo de factor vii y de factor x13.
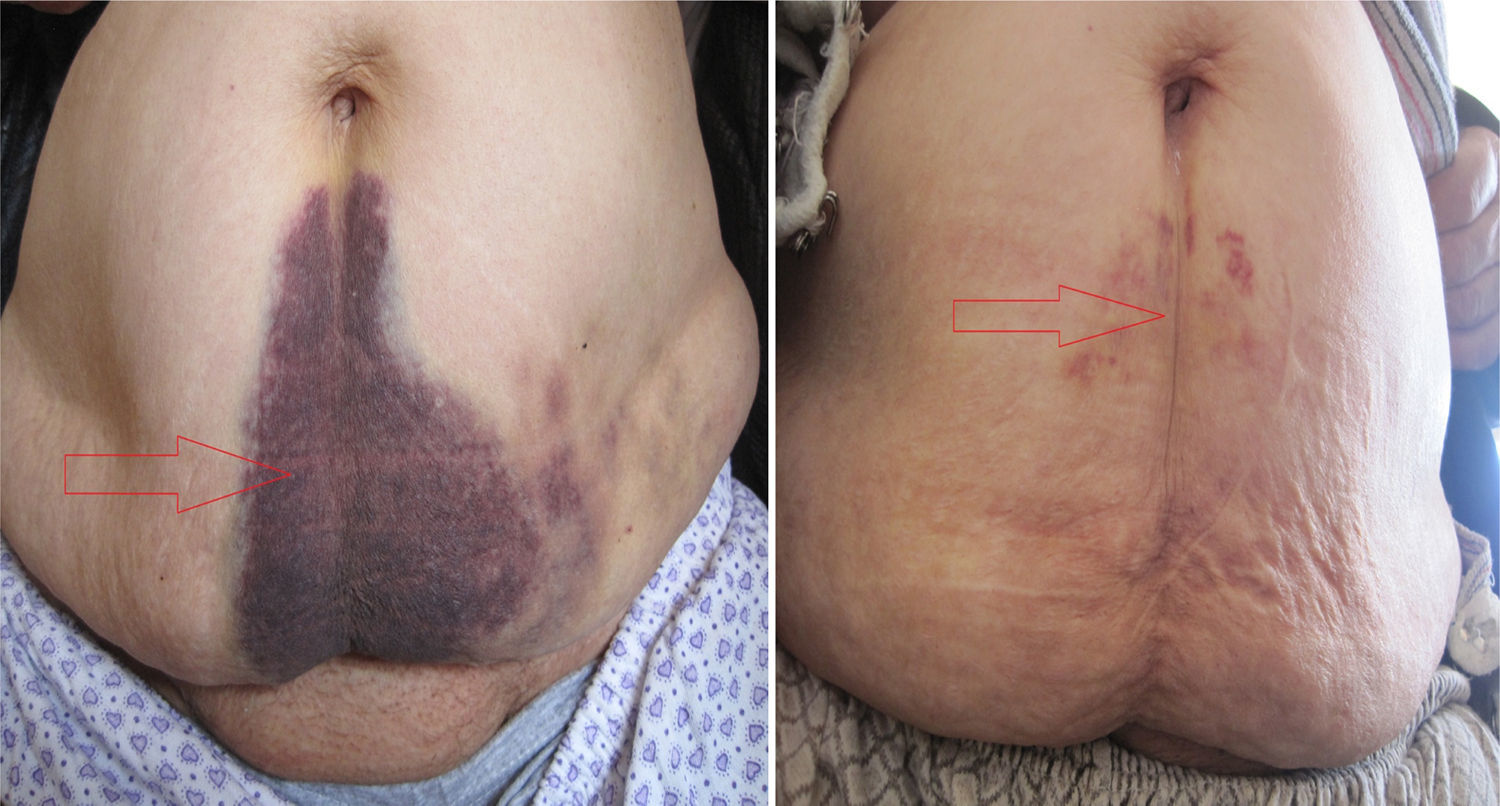
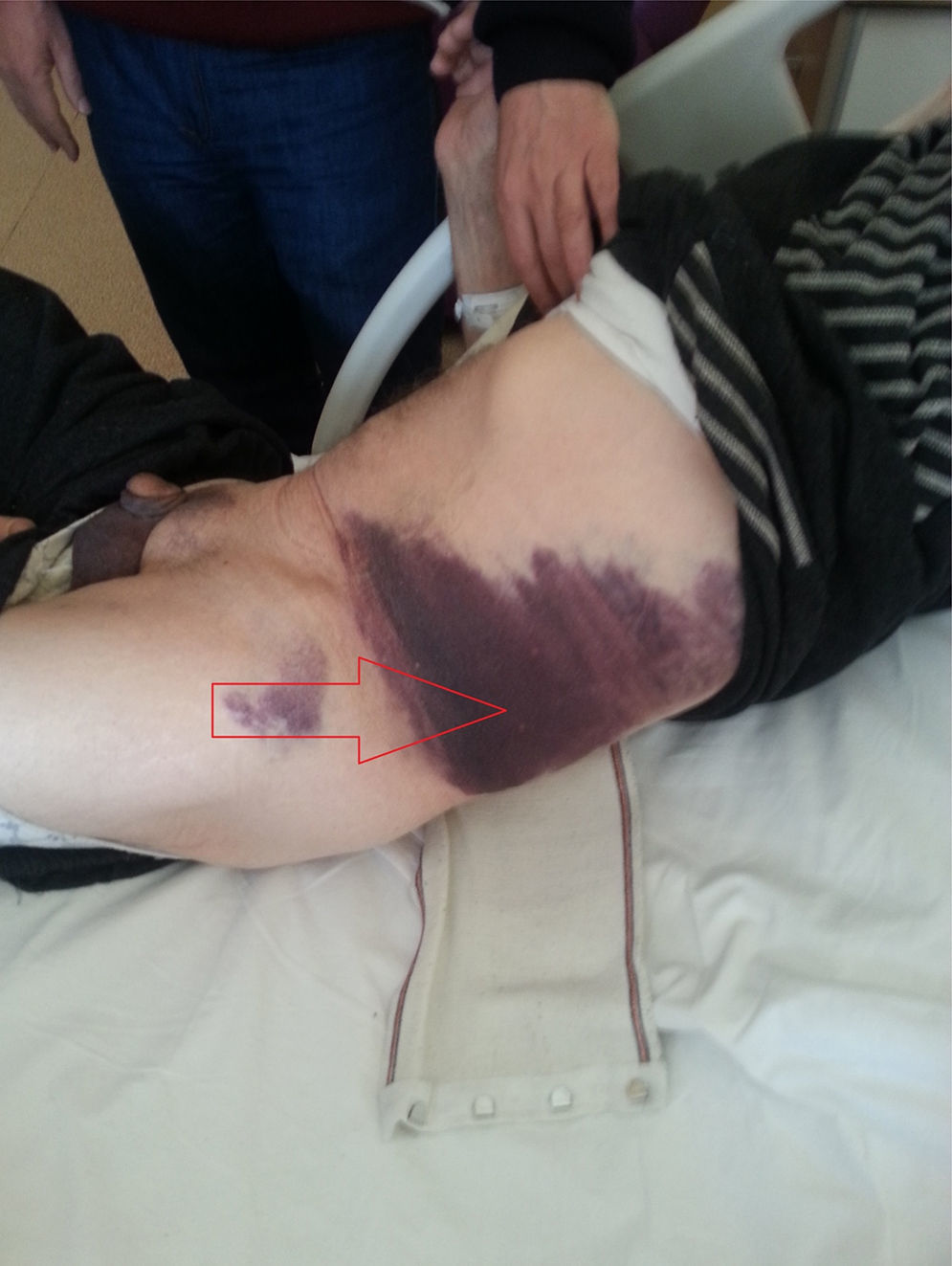
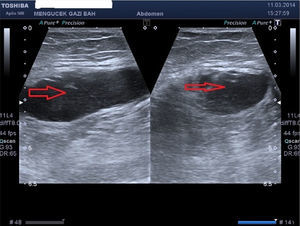
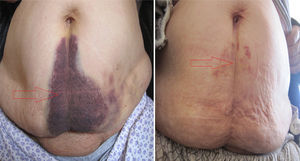
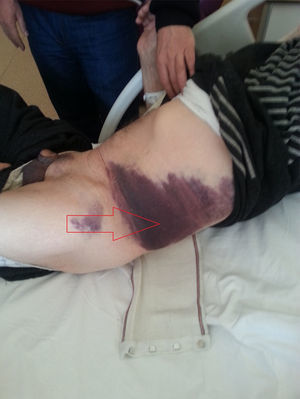
En el diagnóstico del HEVR puede usarse la ecografía y/o la TC, como se hizo en nuestro estudio. La ecografía tiene ventajas en cuanto a la medición del hematoma durante el periodo de seguimiento. Ante una sospecha del diagnóstico, puede ser útil la verificación de los valores de INR, así como el signo de Carnett14 y el signo de Fothergill15. En el signo de Carnett, el dolor abdominal se reduce al poner en tensión los músculos de la pared abdominal. Un signo positivo muestra la presencia de enfermedades de la pared abdominal, como el hematoma del recto; un signo negativo indica enfermedades intraabdominales como la apendicitis aguda16. En el signo de Fothergill, las masas palpables no atraviesan la línea media y no cambian de posición con la flexión del músculo recto. Un signo positivo indica un hematoma del recto. Anyfantakis et al.11 observaron que el 85,7% de los pacientes con HEVR presentaban un signo de Carnett y que el 57,1% tenían un signo de Fothergill; estos porcentajes son similares a los que nosotros observamos. Todos los pacientes de nuestro estudio fueron diagnosticados entre 1 y 3h después del ingreso, y el tratamiento se inició inmediatamente después. Los signos tardíos del HEVR son la equimosis periumbilical (fig. 4), que indica una rotura intraperitoneal de vasos sanguíneos y el signo de Grey Turner (equimosis en el flanco; fig. 5), que indica una extensión extraperitoneal de la sangre17. Cherry y Mueller observaron una frecuencia del 20% de equimosis abdominal. La equimosis, que no puede apreciarse en la fase aguda, puede ser en cambio prominente en la fase crónica4. En nuestro estudio, se obtuvo una regresión rápida de la equimosis con la ayuda de agentes fibrinolíticos locales, como el condroitín polisulfato (fig. 4).
Excepto en las lesiones de grado iii, no se recomienda una intervención quirúrgica. En vez de la cirugía, se aconseja el empleo de tratamientos médicos, como reposo en cama, suspensión de los anticoagulantes, hidratación, reposición de sangre cuando se reduce la hemoglobina y plasma fresco congelado en caso de sobredosis de warfarina. Anyfantakis et al.11 trataron médicamente al 85,7% de sus pacientes, una cifra similar a la de nuestro estudio. La intervención quirúrgica se recomienda tan solo en los pacientes con lesiones de grado iii hemodinámicamente inestables, y tras ella se aplica una hidratación enérgica y transfusiones de sangre. Sin embargo, en este grupo de pacientes debe aplicarse el método menos invasivo de la arteriografía con embolización selectiva de arterias epigástricas, antes de la cirugía, ya que las intervenciones de cirugía abierta eliminan el efecto de contención de la sangre y, por tanto, pueden agravar la hemorragia3. La cirugía abierta puede usarse cuando la radiología intervencionista no logra controlar la hemorragia, cuando el hematoma está infectado y cuando se produce un síndrome compartimental3. La embolización es una técnica segura y efectiva. Rimola et al. utilizaron el cateterismo en 12 pacientes y no observaron ninguna recaída del sangrado durante un periodo de seguimiento de 19±18 días. Aunque ese estudio es el más amplio realizado hasta la fecha respecto a la embolización percutánea, el número de pacientes no fue lo suficientemente elevado como para poder comparar la embolización con la cirugía18. McBeath et al. utilizaron cirugía abierta en pacientes con HEVR por un síndrome compartimental y una insuficiencia renal secundaria. Se evacuó el hematoma, se resolvió el síndrome compartimental y se evitó la insuficiencia renal19. La determinación de la presión intraabdominal puede ser útil para diferenciar a los pacientes que son candidatos a cirugía. En nuestro estudio, una paciente en la que la presión intraabdominal aumentó hasta 20mm H20 fue intervenida quirúrgicamente. Se evacuó el hematoma, que se extendía intraperitonealmente desde el músculo recto derecho, y la presión intraabdominal se redujo. No se observó ningún vaso sangrante. La paciente fue ingresada en la UCI y falleció en el sexto día del postoperatorio. Tenía una lesión de grado iii e inestabilidad hemodinámica. Las lesiones de grado i se resuelven en un periodo de aproximadamente un mes, las de grado ii en un plazo de entre 2 y 4 meses, y las de grado iii tardan más de 3 meses en resolverse. La clasificación basada en la TC puede ser útil para evaluar el pronóstico. Tal como era de prever, las lesiones de grado iii son las que tienen peor pronóstico.
En este estudio, la decisión de revertir la anticoagulación en pacientes en los que hay un motivo importante para utilizarla constituye un dilema difícil de resolver. Teniendo en cuenta los riesgos y beneficios, después de establecer un diagnóstico exacto, se suspendió de inmediato el tratamiento anticoagulante. El momento en el que debe reinstaurarse el tratamiento anticoagulante es un aspecto crucial. En nuestra serie, después de alcanzar una situación hemodinámicamente estable, se reinició el tratamiento anticoagulante. El juicio clínico es importante en estos casos. En el estudio de Cherry y Mueller, se produjo una recaída del hematoma en 2 de los 41 pacientes después de reinstaurar los anticoagulantes4. Nosotros no observamos la formación de nuevos hematomas ni un aumento del tamaño de los existentes. Los clínicos deben tomar las decisiones después de evaluar los riesgos y los beneficios del tratamiento anticoagulante.
Este es el primer y único estudio que se ha diseñado de forma prospectiva. Según lo indicado por las búsquedas bibliográficas realizadas en PubMed y Google Scholar, este estudio es el tercero más grande publicado por lo que respecta al número de pacientes (después del de Smithson et al.3 con 24 pacientes y el de Dag et al.20 con 22 pacientes).
ConclusionesEl HEVR constituye una situación de urgencia médica, y una forma de presentación atípica puede retrasar el diagnóstico y el tratamiento. El diagnóstico precoz es importante para alcanzar una tasa de mortalidad baja. A pesar de que los tratamientos médicos son los más importantes, pueden ser necesarias una embolización arterial mediante radiología intervencionista o intervenciones más radicales como la cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses