La cirugía es el tratamiento aceptado en la pancreatitis aguda infectada, aunque la mortalidad sigue siendo elevada. Como alternativa, el manejo en etapas se ha propuesto como alternativa para mejorar los resultados. El drenaje percutáneo inicial permitiría demorar la cirugía, y mejorar los resultados postoperatorios. Pocos centros a nivel nacional han publicado sus resultados tras la cirugía por pancreatitis aguda.
ObjetivoRevisar los resultados obtenidos tras el tratamiento quirúrgico de pancreatitis aguda durante un período de 12 años, con especial interés en la mortalidad postoperatoria.
Material y métodosHemos recogido la experiencia en el tratamiento quirúrgico de la pancreatitis aguda grave (PAG) en el Hospital Universitari de Bellvitge desde 1999 hasta 2011. Para analizar los resultados, consideramos 2 períodos de estudio, anterior y posterior a 2005. Realizamos un estudio descriptivo y un análisis de factores de riesgo de mortalidad postoperatoria.
ResultadosSe ha intervenido a 143 pacientes por PAG, realizándose necrosectomía o desbridamiento de necrosis pancreática o peripancreática, o laparotomía exploradora en caso de hallar isquemia intestinal masiva. La mortalidad postoperatoria ha sido del 25%. Los factores de riesgo fueron la edad avanzada (superior a 65 años), la presencia de fallo orgánico, la esterilidad de la muestra intraoperatoria obtenida y la cirugía precoz (< 7 días). El único factor de riesgo de mortalidad en el estudio multivariante fue el tiempo desde el inicio de la clínica a la cirugía menor o igual a 7 días. Asimismo, demostramos que un 50% de estos pacientes presentaron infección en algún cultivo intraoperatorio.
ConclusionesLa infección pancreática puede aparecer en cualquier momento de la evolución de la enfermedad, incluso en fases tempranas. La cirugía en PAG comporta una elevada mortalidad, y la demora de la misma es un factor a tener en cuenta para mejorar los resultados.
Surgery is the accepted treatment for infected acute pancreatitis, although mortality remains high. As an alternative, a staged management has been proposed to improve results. Initial percutaneous drainage could allow surgery to be posponed, and improve postoperative results. Few centres in Spain have published their results of surgery for acute pancreatitis.
ObjectiveTo review the results obtained after surgical treatment of acute pancreatitis during a period of 12 years, focusing on postoperative mortality.
Material and methodsWe have reviewed the experience in the surgical treatment of severe acute pancreatitis (SAP) at Bellvitge University Hospital from 1999 to 2011. To analyse the results, 2 periods were considered, before and after 2005. A descriptive and analitical study of risk factors for postoperative mortality was performed
ResultsA total of 143 patients were operated on for SAP, and necrosectomy or debridement of pancreatic and/or peripancreatic necrosis was performed, or exploratory laparotomy in cases of massive intestinal ischemia. Postoperative mortality was 25%. Risk factors were advanced age (over 65 years), the presence of organ failure, sterility of the intraoperative simple, and early surgery (< 7 days). The only risk factor for mortality in the multivariant analysis was the time from the start of symptoms to surgery of<7days; furthermore, 50% of these patients presented infection in one of the intraoperative cultures.
ConclusionsPancreatic infection can appear at any moment in the evolution of the disease, even in early stages. Surgery for SAP has a high mortality rate, and its delay is a factor to be considered in order to improve results.
El tratamiento de la pancreatitis aguda grave (PAG) se ha modificado significativamente durante los últimos años. La resección pancreática se defendió durante los años 70 y 80, a pesar de comportar una mortalidad postoperatoria muy elevada1–4. Se suponía que la resección del páncreas podría contribuir a minimizar el daño sistémico desencadenado. Sin embargo, más tarde se evidenció que la cascada inflamatoria iniciada no se detenía tras la resección pancreática. Diversos avances contribuyeron a planificar mejor el tratamiento de la pancreatitis aguda. Entre ellos, la utilización de la tomografía axial computarizada5,6, la aparición de los antibióticos de amplio espectro y la mejora de las técnicas de medicina intensiva7,8. Por último, la introducción de la necrosectomía abierta, con sus diversas variantes, ayudó a mejorar la supervivencia de esta dolencia9–13. Más tarde, con la celebración de la Conferencia de Atlanta de 199214, se pusieron las bases para el manejo de los pacientes con pancreatitis aguda. A pesar de ello, durante los años siguientes persistieron las diferencias en el tratamiento de la necrosis. Así, mientras algunos autores seguían defendiendo la cirugía en casos de necrosis estéril15,16 o la cirugía precoz17,18, otros abogaban por demorar la intervención quirúrgica19,20 o por seleccionar los pacientes únicamente infectados21. La aparición de las guías clínicas de las diferentes sociedades internacionales22–24 ayudó a los clínicos a uniformizar el manejo de la pancreatitis aguda.
De acuerdo con las guías clínicas vigentes, en el momento actual, los pacientes con necrosis pancreática o peripancreática infectada y sepsis grave siguen siendo tributarios de cirugía22,24,25. El desbridamiento del tejido necrótico pancreático o peripancreático es el objetivo de la intervención. Recientemente, se ha demostrado que el tratamiento en fases de la necrosis infectada comporta una menor tasa de complicaciones mayores, con una similar mortalidad y estancia hospitalaria que el abordaje clásico mediante laparotomía26,27. Se propone un manejo inicial endoscópico o percutáneo, y una cirugía posterior según la evolución, hecho que recogen las guías clínicas más recientes28–31. Sin embargo, sigue habiendo preguntas sin resolver en torno al tratamiento de la pancreatitis aguda infectada: ¿debemos intervenir los casos con deterioro rápido del paciente?, ¿es posible la infección de la necrosis durante la primera semana del ingreso? Y en ese caso, ¿deberíamos operar a los pacientes con necrosis pancreática infectada durante la primera semana? El objetivo de este estudio es definir los factores de riesgo de morir tras la cirugía por pancreatitis aguda, y analizar la evolución en el manejo de dicha enfermedad en nuestro centro durante un período de 12 años.
Material y métodosPoblación a estudioEntre 1999 y 2011 hemos atendido 1.419 episodios de pancreatitis, en 1.046 pacientes, ingresados en la Unidad de Cirugía Hepatobiliopancreática, en el Hospital Universitari de Bellvitge, en L¿Hospitalet de Llobregat, Barcelona. Nuestro centro es el hospital de referencia de alta complejidad para una población de 2 millones de habitantes. Todos los casos fueron sistemáticamente recogidos en una base de datos, de forma prospectiva. De acuerdo con los criterios de la Conferencia de Atlanta, 495 casos fueron clasificados como PAG14 y 143 de ellos fueron intervenidos, siendo estos últimos la población de estudio.
Variables analizadas y definicionesSe analizaron 265 variables por paciente entre datos demográficos, etiológicos, sobre el curso clínico, detalles intraoperatorios y del postoperatorio de cada paciente. La base de datos ha sido rellenada de forma prospectiva32,33. Definimos fallo orgánico de acuerdo con los criterios definidos por Büchler de insuficiencia respiratoria, insuficiencia renal, shock, hemorragia digestiva, y coagulación vascular diseminada e hipocalcemia13. Definimos como PAG a aquella que se asocia a fallo orgánico o complicaciones locales, de acuerdo con los criterios de Atlanta de 199214. Definimos como cirugía precoz a la que se realizó el 7.° día del inicio de la clínica o antes, y como cirugía tardía a la realizada posteriormente. Definimos cultivo tisular intraoperatorio al resultado del cultivo de la necrosis pancreática y de la grasa peripancreática, como ya se comentó en un estudio previo34.
Manejo preoperatorioEl control y el manejo de los pacientes con pancreatitis aguda han sido llevados a cabo íntegramente por la Unidad de Cirugía Hepatobiliopancreática de nuestro centro. Los pacientes afectos de PAG fueron tratados mediante reposición de fluidos intravenosos, aspiración nasogástrica en caso de vómitos y nutrición parenteral total, sin profilaxis antibiótica, siguiendo los resultados de estudios previos publicados35. En caso de aparición de insuficiencia respiratoria o inestabilidad hemodinámica, el paciente fue trasladado a la Unidad de Cuidados Intensivos, para su control y manejo médico. La realización de tomografía computarizada (TC) fue programada a las 72 h del ingreso, realizándose de forma más precoz en casos de duda diagnóstica. A los pacientes con sospecha de infección pancreática se les realizó punción percutánea guiada por TC de la necrosis pancreática o de la grasa peripancreática o de las colecciones, para estudio microbiológico (tinción de Gram y cultivo).
Se indicó cirugía al identificar infección en el Gram o en el cultivo, o bien ante la evidencia de hemocultivos positivos, por la presencia de gas en la TC, o bien ante el empeoramiento súbito del paciente, por el equipo de cirugía dedicado a dicha enfermedad. Durante los primeros años del estudio, se intervino a diversos pacientes en ausencia de infección ante un fracaso orgánico persistente e irreversible.
Técnica operatoriaLa cirugía fue planificada de acuerdo con los hallazgos de la TC abdominal, realizando una necrosectomía quirúrgica10, preferiblemente con colecistectomía (figs. 1 y 2). Se inició la intervención con una laparotomía subcostal bilateral, con acceso a la celda pancreática a través del epiplón gastrocólico. En casos de afectación cefálica, se asoció una maniobra de Kocher para desbridar la necrosis cefálica. La intervención finalizó con la colocación de drenajes en el cuerpo pancreático, así como en la zona cefálica. Se instauró un sistema de lavado continuo con suero fisiológico a alto ritmo (24 l de suero fisiológico al día) durante los primeros días, y progresivamente se disminuyó dependiendo de la evolución clínica del paciente. Los cultivos intraoperatorios fueron obtenidos durante diferentes momentos en la cirugía36. Tras la laparotomía, y antes de la movilización, se cogió muestra del líquido intraabdominal. Una vez abierta la celda pancreática se obtuvieron muestras de grasa peripancreática y necrosis pancreática. En caso de realizar colecistectomía, se remitió muestra para cultivo de bilis. Tras la intervención, el paciente se remitió a Cuidados Intensivos, con tratamiento antibiótico de amplio espectro.
Se realizó un estudio estadístico descriptivo inicial. A continuación, se realizó un estudio comparativo entre variables cualitativas según chi-cuadrado o Fisher y variables cuantitativas según test U de Mann Whitney. Finalmente se diseñó un modelo de regresión logística binaria siendo la variable dependiente mortalidad postoperatoria. Se utilizó el paquete estadístico SPSS 12.0®, y el valor estadísticamente significativo considerado fue de p<0,05 en todos los casos. Creamos una variable, según el momento de la intervención, considerando período 1 al anterior a junio de 2005, y período 2 al posterior a julio de 2005.
ResultadosEstudio descriptivoDurante el período de estudio, 143 pacientes fueron intervenidos en nuestro centro por pancreatitis aguda. Se operó a 90 pacientes en el período 1 (64%) y a 53 (36%) en el período 2. La mayoría fueron hombres (63%), siendo la causa más frecuente la pancreatitis aguda litiásica (52%) (tabla 1). Con respecto al manejo preoperatorio, 77 pacientes (54%) fueron remitidos de otros hospitales del entorno, y a 49 pacientes (34%) se les había administrado algún antibiótico profiláctico. Evidenciamos que en un 20% habían presentado algún episodio de pancreatitis aguda previamente. Los antecedentes patológicos más relevantes fueron cardiopatía isquémica (13/9%), broncopatía severa (10/7%), insuficiencia cardíaca (6/4%) y cirrosis hepática (3/2%).
Análisis descriptivo de pacientes intervenidos por pancreatitis aguda grave
| Datos demográficos | |
| Edad (media, años) | 61,82 |
| Hombre/mujer (%) | 88/51 |
| Origen de pacientes (pacientes de zona/trasladados) n (%) | 66 (46,2)/77 (53,8) |
| Etiología de la pancreatitis aguda n (%) | |
| Biliar | 75 (52,4) |
| Alcohol | 30 (21) |
| Post-CPRE | 9 (6,3) |
| Hipertrigliceridemia | 2 (1,4) |
| Idiopática | 11 (11,9) |
| Postoperatoria | 1 (0,7) |
| Tiempo de clínica hasta la intervención (≤ 7 días/>7 días) | 44(30)/99 (70) |
| Datos clínicos y de laboratorio al ingreso media (rango); DE | |
| Presión arterial media (mmHg) | 100,96 (60-165); 24,01 |
| Frecuencia cardíaca (lpm) | 83,72 (45-150); 22,19 |
| Frecuencia respiratoria | 23,29 (12-34); 6,25 |
| PaO2(mmHg) | 78,9 (70-178); 23,8 |
| pH arterial | 7,39 (7,19-7,55); 0,68 |
| pH venoso | 7,38 (7,21-7,55); 0,74 |
| HCO3(mmol/l) | 24,5 (9,5-34,5); 5 |
| Exceso de bases (mmol/l) | 0,19 (-16-9,4); 4.9 |
| Hematocrito (%) | 41,5 (16,6-55); 7,3 |
| Leucocitos (num/l) | 15.929 (7.000-34.000); 6.276,5 |
| Plaquetas (num/l) | 233 (33-424); 86 |
| Serum amilasa (μkat/l) | 77,7 (1-1.749); 175,5 |
| Amilasa orina (μkat/l) | 439,8 (8-2.116); 556,2 |
| Creatinina plasmática (μmol/l) | 125,7 (37-726); 102 |
| Na plasmático (mmol/l) | 138 (124-160); 5,1 |
| K plasmático (mmol/l) | 3,9 (2,3-5,8); 0,6 |
| Urea plasmática (mmol/l) | 8,5 (1,3-331); 5,6 |
| Glucosa plasmática (mmol/l) | 10,8 (2,3-108); 10,27 |
| Calcio plasmático (mmol/l) | 1,86 (0,75-2,6); 0,38 |
| PCR (24 h)(mg/l) | 301,6 (26-681); 111,7 |
| Fallo orgánico n (%) | |
| Fallo orgánico | 70 (49) |
| Día en que aparece el fallo orgánico (≤ 48h/>48h) | 44 (67,7)/21 (32,3) |
| Resultado del estudio radiológico n (%) | |
| Necrosis pancreática | 54 (52) |
| Extensión de la necrosis n (%) | |
| < 30% | 23 (35,4) |
| 30-50% | 15 (23,1) |
| >50% | 27 (41,5) |
| Morbilidad postoperatoria | 55 (38,5) |
| Infección de catéter | 38 (26) |
| Infección urinaria | 26 (18) |
| Infección respiratoria | 20 (14) |
| Fístula biliar | 9 (6) |
| Fístula intestinal | 9 (6) |
| Hemorragia digestiva alta | 6 (4) |
| Hemoperitoneo | 6 4) |
| Eventración | 6 (4) |
| Fístula pancreática | 6 (4) |
| Necrosis del colon | 2 (1) |
| Necrosis gástrica | 1 (1) |
| Estenosis biliar | 1 (1) |
| Reintervención | 26 (18,2) |
| Mortalidad postoperatoria | 36 (25,2) |
| Estancia postoperatoria mediaEstancia hospitalaria total media | 45 (1-389)55,3 (1-434) |
Fuente: H. U. Bellvitge, 1999-2011.
n=143.
En el momento del ingreso, los hallazgos en la analítica revelaron un recuento leucocitario medio de 15.928, creatinina media de 125 (μmol/l), y PCR medio de 301 (mg/l). En cuanto a la evolución, en el momento de la cirugía, 70 (50%) pacientes presentaban fracaso de algún parénquima. En concreto, un 44% de los pacientes presentaron insuficiencia respiratoria, un 20% shock y 29% insuficiencia renal. En total, 30 pacientes (20%) presentaron fracaso de 3 órganos. El momento de aparición del fracaso orgánico medio fue el 4.° día (1-22), apareciendo este durante las primeras 48 h en un 30% (tabla 1). Se les realizó TC a todos los pacientes estudiados. La punción guiada por TC con aguja fina se llevó a cabo en 103 pacientes (72%). Se intervino a 34 (33%) pacientes a pesar de que el resultado del Gram era negativo.
En cuanto al manejo previo a la cirugía, desde 2007 hemos contabilizado la colocación de drenaje percutáneo a 52 pacientes, siendo finalmente intervenidos 15 de ellos. Asimismo, se ha realizado desbridamiento de colecciones o necrosectomía por vía endoscópica en 18, requiriendo cirugía en 5 casos. El tiempo medio transcurrido desde el inicio de la clínica hasta la cirugía fue de 15,6 días (1-89), siendo inferior a 7 días en 44 casos (31%) e inferior a 12 días en 69 (49%). La cirugía practicada consistió en necrosectomía (75%), o desbridamiento de necrosis encapsulada o pseudoquiste infectados (25%), y se practicó colecistectomía de forma simultánea en 97 (68%). En 6 pacientes se evidenció isquemia intestinal masiva durante la laparotomía. En cuanto a la microbiología recogida durante la cirugía, el cultivo tisular (necrosis pancreática o grasa peripancreática) se registró en 78 pacientes. En 59 (75%) de ellos se evidenció infección y en 19 (25%) el cultivo fue estéril.
Morbimortalidad postoperatoriaLa estancia hospitalaria media postoperatoria fue de 45 días (1-389). En 55 (38%) se registró algún tipo de complicación postoperatoria relacionada directamente con la cirugía practicada, y se reintervino a 26 pacientes (18%). Las complicaciones más frecuentemente registradas fueron la infección de catéter (26%), la infección urinaria (18%) y la infección respiratoria (14%). Entre las complicaciones digestivas pudimos constatar fístula biliar (9 pacientes), intestinal (9 pacientes) y fístula pancreática (6 pacientes) (tabla 1). La mortalidad postoperatoria fue del 25% (36 pacientes). Dividimos la serie según la evolución postoperatoria, y evidenciamos que el grupo de pacientes que fallecieron tenían una edad más avanzada (67 vs. 60 años; p=0,01), una función renal preoperatoria más deteriorada (creatinina 161μmol/l vs. 113μmol/l; p=0,04), y un hematocrito preoperatorio superior (44 vs. 40%; p=0,02). El tiempo entre el inicio de la clínica y la cirugía fue inferior en el grupo de pacientes que fallecieron (11 vs. 17 días; p=0,01).
En el estudio bivariante, diversos factores se asociaron con mayor mortalidad postoperatoria: la edad avanzada, la presencia de fallo orgánico, la precocidad en la aparición del fracaso orgánico (< 48h), la esterilidad de los cultivos intraoperatorios, y un tiempo corto desde el inicio de la clínica hasta la intervención (tabla 2). No obstante, evidenciamos que la administración de antibióticos de forma profiláctica no influía en la mortalidad. Del mismo modo, aquellos pacientes que habían necesitado varios desbridamientos no presentaban una mayor mortalidad que aquellos intervenidos únicamente en una ocasión. Por último, la mortalidad en los pacientes intervenidos sin drenaje percutáneo previo (27%) fue superior a la mortalidad de los pacientes intervenidos tras la colocación de un drenaje percutáneo (6,7%), sin ser esta diferencia estadísticamente significativa (p=0,08).
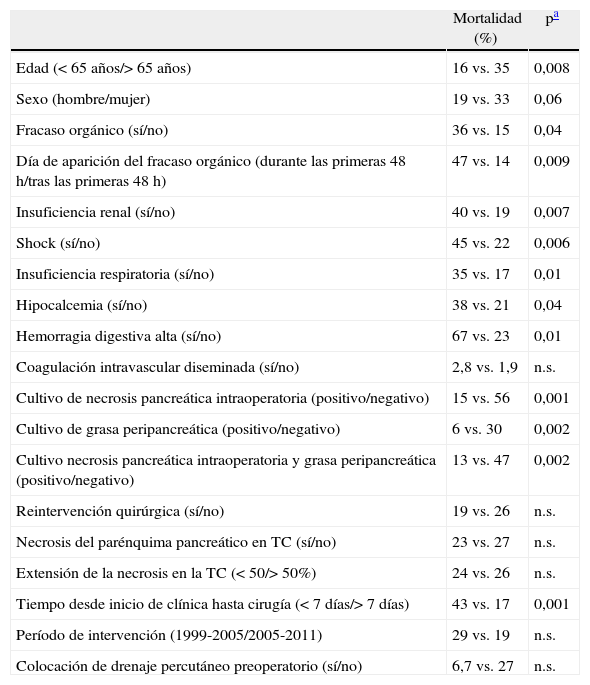
Factores asociados con mortalidad tras cirugía por pancreatitis aguda grave
| Mortalidad (%) | pa | |
| Edad (< 65 años/> 65 años) | 16 vs. 35 | 0,008 |
| Sexo (hombre/mujer) | 19 vs. 33 | 0,06 |
| Fracaso orgánico (sí/no) | 36 vs. 15 | 0,04 |
| Día de aparición del fracaso orgánico (durante las primeras 48h/tras las primeras 48h) | 47 vs. 14 | 0,009 |
| Insuficiencia renal (sí/no) | 40 vs. 19 | 0,007 |
| Shock (sí/no) | 45 vs. 22 | 0,006 |
| Insuficiencia respiratoria (sí/no) | 35 vs. 17 | 0,01 |
| Hipocalcemia (sí/no) | 38 vs. 21 | 0,04 |
| Hemorragia digestiva alta (sí/no) | 67 vs. 23 | 0,01 |
| Coagulación intravascular diseminada (sí/no) | 2,8 vs. 1,9 | n.s. |
| Cultivo de necrosis pancreática intraoperatoria (positivo/negativo) | 15 vs. 56 | 0,001 |
| Cultivo de grasa peripancreática (positivo/negativo) | 6 vs. 30 | 0,002 |
| Cultivo necrosis pancreática intraoperatoria y grasa peripancreática (positivo/negativo) | 13 vs. 47 | 0,002 |
| Reintervención quirúrgica (sí/no) | 19 vs. 26 | n.s. |
| Necrosis del parénquima pancreático en TC (sí/no) | 23 vs. 27 | n.s. |
| Extensión de la necrosis en la TC (< 50/> 50%) | 24 vs. 26 | n.s. |
| Tiempo desde inicio de clínica hasta cirugía (< 7 días/> 7 días) | 43 vs. 17 | 0,001 |
| Período de intervención (1999-2005/2005-2011) | 29 vs. 19 | n.s. |
| Colocación de drenaje percutáneo preoperatorio (sí/no) | 6,7 vs. 27 | n.s. |
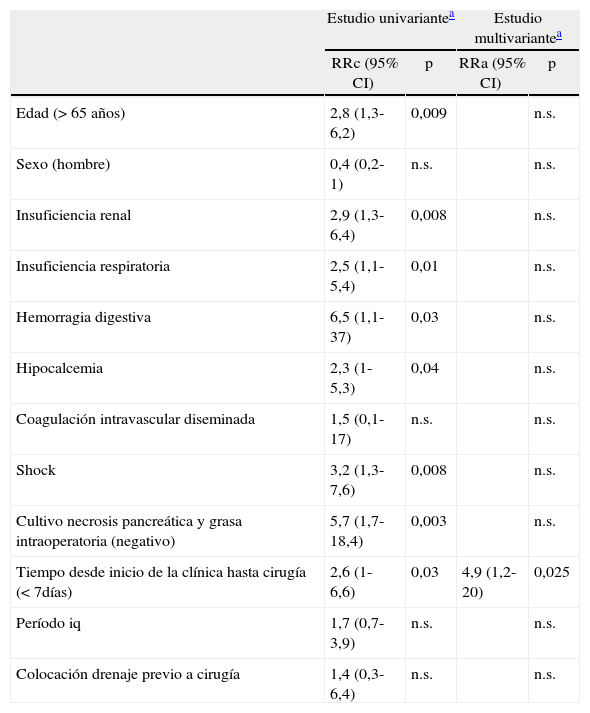
Los factores de riesgo de mortalidad en el análisis univariante fueron: la edad superior a 65 años, el cultivo de la necrosis pancreática y la grasa intraoperatoria negativo, un tiempo desde inicio clínica hasta cirugía menor a 7 días y la presencia de fracaso orgánico previo a la cirugía. Al analizar el fracaso orgánico, evidenciamos que la mortalidad era superior en presencia de insuficiencia renal, insuficiencia respiratoria, shock, hemorragia digestiva, o hipocalcemia. El análisis multivariante demostró que únicamente el tiempo desde el inicio de la clínica hasta la cirugía igual o menor a 7 días fue un factor de riesgo de mortalidad tras la intervención. El fracaso orgánico y la esterilidad de los cultivos operatorios, a pesar de ser relevantes, dejaron de ser causa de riesgo de mortalidad en el estudio multivariante (tabla 3). Por último, analizamos la serie según el momento de la cirugía, desde el inicio de la clínica. Evidenciamos que los pacientes intervenidos durante la primera semana habían presentado fracaso orgánico en el 48% de los casos, similar a los intervenidos posteriormente. Sin embargo, en un 80% de los intervenidos precozmente, el fracaso orgánico se instauró durante los primeros 2 días del ingreso. La infección se demostró en un 50% de los intervenidos precozmente, y en un 84% de los intervenidos a partir del día 8 del inicio de la clínica.
Factores de riesgo de mortalidad tras cirugía por pancreatitis aguda grave
| Estudio univariantea | Estudio multivariantea | |||
| RRc (95% CI) | p | RRa (95% CI) | p | |
| Edad (> 65 años) | 2,8 (1,3-6,2) | 0,009 | n.s. | |
| Sexo (hombre) | 0,4 (0,2-1) | n.s. | n.s. | |
| Insuficiencia renal | 2,9 (1,3-6,4) | 0,008 | n.s. | |
| Insuficiencia respiratoria | 2,5 (1,1-5,4) | 0,01 | n.s. | |
| Hemorragia digestiva | 6,5 (1,1-37) | 0,03 | n.s. | |
| Hipocalcemia | 2,3 (1-5,3) | 0,04 | n.s. | |
| Coagulación intravascular diseminada | 1,5 (0,1-17) | n.s. | n.s. | |
| Shock | 3,2 (1,3-7,6) | 0,008 | n.s. | |
| Cultivo necrosis pancreática y grasa intraoperatoria (negativo) | 5,7 (1,7-18,4) | 0,003 | n.s. | |
| Tiempo desde inicio de la clínica hasta cirugía (< 7días) | 2,6 (1-6,6) | 0,03 | 4,9 (1,2-20) | 0,025 |
| Período iq | 1,7 (0,7-3,9) | n.s. | n.s. | |
| Colocación drenaje previo a cirugía | 1,4 (0,3-6,4) | n.s. | n.s. | |
IC 95%: intervalo de confianza 95%; RRa: riesgo relativo absoluto; RRc: riesgo relativo crudo;
Comparamos los 90 pacientes intervenidos durante el primer período del estudio frente a los 52 intervenidos en el segundo (tabla 4). A los pacientes intervenidos durante el primer período de estudio se les atendió en una situación más precaria, ya que un 60% presentaban fracaso orgánico, frente al 30% en el segundo período (p=0,001). Por otra parte, durante el primer período de estudio se intervino a los pacientes más precozmente: el tiempo desde el inicio de la clínica hasta la cirugía fue menor o igual a 7 días en un 38% de los pacientes del primer período de estudio, frente a un 19% de los pacientes del segundo período del estudio (p=0,021). El análisis evidenció una mayor mortalidad durante el primer período de estudio respecto al segundo período, a pesar de no ser diferencias estadísticamente significativas (tabla 4).
Resultados según el período de estudio
| Período 1999-2005 (%) | Período 2005-2011 (%) | p | n (pacientes) | |
| Edad superior a 65 años | 47 | 40 | n.s. | 63 |
| Fracaso orgánico | 60 | 30 | 0,001 | 70 |
| Insuficiencia renal | 37 | 17 | 0,015 | 42 |
| Insuficiencia respiratoria | 54 | 29 | 0,005 | 63 |
| Hipocalcemia | 32 | 9 | 0,002 | 34 |
| Cultivo necrosis pancreática estéril | 30 | 16 | n.s. | 16 |
| Cultivo necrosis pancreática y grasa peripancreática estéril | 26 | 17 | n.s. | 19 |
| Complicaciones postoperatorias | 51 | 17 | < 0,0001 | 55 |
| Reintervención | 25 | 8 | 0,013 | 26 |
| Intervención igual o antes del 7.° día desde el inicio de la clínica | 38 | 19 | 0,021 | 44 |
| Mortalidad postoperatoria | 29 | 19 | n.s. | 36 |
Hasta el momento, ha habido pocos trabajos a nivel nacional que muestren sus resultados en la cirugía por PAG37–40. El objetivo del estudio presentado fue, por una parte, revisar los factores que comportaron mayor mortalidad postoperatoria tras la cirugía y, por otra, analizar la evolución del tratamiento de la PAG en nuestro centro. El manejo de este tipo de pacientes requiere un equipo multidisciplinar, con el fin de poder obtener buenos resultados, tal y como lo refleja la guía del Club Pancreático Español29. En nuestro centro, el manejo de dichos pacientes recae desde el primer día del ingreso sobre el Servicio de Cirugía. Ello ha comportado una gran implicación de nuestro colectivo en dicha enfermedad32–35. Tal y como se ha comentado, ante un paciente con sospecha de infección pancreática y signos de sepsis, se realiza de forma sistemática una TC con punción. La cirugía se plantea al evidenciar infección en el Gram o bien en el cultivo percutáneo realizado, sea cual sea el momento evolutivo desde el ingreso22,24. En nuestra experiencia, el 75% de los pacientes con muestra intraoperatoria remitida tenían infección (59/78), mientras que en el 25% las muestras de tejido pancreático y peripancreático eran estériles (19/78). La punción para diagnosticar infección en los casos de necrosis pancreática asociada a signos de sepsis o fracaso orgánico se llevó a cabo independientemente del momento evolutivo de la pancreatitis. Así, la mitad de los pacientes intervenidos durante la primera semana presentaron infección pancreática o peripancreática (10/20). Durante los primeros años de la serie presentada, y siguiendo la práctica del momento, se indicó cirugía en casos por pancreatitis estéril con mala evolución, a pesar de no confirmar la infección. En concreto, al 26% de los pacientes del primer período y al 17% de los del segundo período se les intervino por pancreatitis estéril, con diferencias no estadísticamente significativas. Dicha práctica fue abandonada tras la aparición de diversas evidencias científicas en contra de la cirugía por pancreatitis estéril41.
Por otra parte, al comparar los 2 períodos quirúrgicos se evidencia mayor porcentaje de fracaso orgánico en el momento de la intervención y la mayor precocidad al intervenirse en el primer período. Probablemente, la experiencia adquirida en el manejo de estos pacientes durante estos años ha contribuido a disminuir la morbilidad postoperatoria (51 vs. 17%; p<0,0001) de forma estadísticamente significativa. Del mismo modo, evidenciamos una disminución en la tasa de reintervenciones, en el segundo período (25 vs. 8%; p=0,013)). Durante el segundo período registramos un descenso en la mortalidad postoperatoria (29 vs. 19%), aunque dicha diferencia no sea estadísticamente significativa. La selección de los pacientes y su manejo más dirigido, en el contexto de un abordaje multidisciplinario, han contribuido a la mejoría de los resultados.
Factores pronósticos de mortalidad postoperatoriaRecientes estudios han definido la edad avanzada, el fallo orgánico, la cirugía precoz o el porcentaje de necrosis pancreática como factores de riesgo de mortalidad tras la cirugía42–45. Como hemos comentado, la situación sistémica del paciente en el momento de la cirugía juega un papel fundamental en la evolución de la enfermedad, ya que tanto la infección como la esterilidad de la pancreatitis han sido demostradas como situaciones de riesgo de mortalidad en estos pacientes42. Diversas series demuestran que los pacientes con necrosis estéril intervenida presentaban una elevada morbimortalidad41. En una serie propia previamente publicada34, la mortalidad tras cirugía por pancreatitis estéril fue de 40%, frente a un 20% en los casos de necrosis infectada. En la misma línea, en el análisis univariante presentado se evidencia que la cirugía debe evitarse en necrosis estéril, puesto que supone mayor mortalidad. Como es sabido, la infección de la necrosis pancreática se podrá confirmar únicamente con la punción preoperatoria percutánea guiada46. Siguiendo las guías clínicas actuales28,47, en nuestro centro los pacientes con sospecha de infección pancreática se analizan con punción guiada. Ahora bien, algunos autores no hallan beneficio en la punción en presencia de necrosis glandular48,49, a pesar de que es una prueba con una sensibilidad del 88% y una especificidad del 90%50.
Indicación quirúrgica y evolución de la técnicaLos beneficios de la cirugía son la extracción del tejido necrótico infectado, con el consecuente control de la sepsis. Sin embargo, el momento de la indicación quirúrgica debe ser analizado con detalle. Si bien la infección pancreática durante la primera semana ha quedado demostrada y, por tanto, existe base teórica para el desbridamiento, en ese momento la necrosis pancreática no está bien definida y la situación del paciente suele ser muy lábil, por lo que el desbridamiento no es óptimo y la mortalidad en ese período, elevada36. Un estudio aleatorizado comparando cirugía precoz frente a cirugía demorada19 evidenció que la mortalidad era menor en aquellos pacientes en los que la cirugía se retrasó. Diversos estudios posteriores avalan estos resultados20,51,52, comparando mortalidad tras cirugía antes del día 1453,54 o del 2855 desde el ingreso. Los resultados previos de nuestro grupo34 siguen en esta línea, demostrando mejores resultados si esperamos 12 días desde el inicio de la clínica. En la misma línea, el grupo multicéntrico holandés publicó una mortalidad que llega al 78% tras la cirugía precoz56. En nuestra experiencia, los pacientes intervenidos durante la primera semana desde el inicio del cuadro fallecen en un 43% de los casos, siendo el momento de la cirugía la variable con más influencia en el análisis de la mortalidad postoperatoria.
En el otro extremo, es decir, con el manejo sin drenaje ni cirugía en necrosis pancreática, los resultados tampoco son halagadores. En su estudio, van Santvoort56 muestra con detalle el flujo de los pacientes con necrosis pancreática. La mortalidad entre los 63 pacientes con necrosis pancreática y fracaso orgánico que se trataron de forma conservadora (no drenados ni intervenidos) fue del 37%. Así pues, el manejo nihilista de algunos grupos también queda en entredicho.
En un planteamiento intermedio, entre la cirugía de entrada y el tratamiento conservador sin drenaje ni cirugía, estaría el manejo en etapas o «step up approach». En un estudio aleatorizado, el grupo holandés demostró menos complicaciones mayores tras el manejo en etapas, a pesar de presentar una mortalidad y estancia hospitalaria similares en el grupo de cirugía de entrada26,27. A pesar de no demostrar diferencias estadísticamente significativas en cuanto a la mortalidad, este planteamiento ha sido adoptado por la mayoría de grupos al aportar al paciente la ventaja de demorar la cirugía. Ahora bien, analizando a fondo dicho estudio evidenciamos que todos los pacientes incluidos fueron intervenidos a partir del día 12 desde el inicio de la clínica, por lo que desconocemos cuál sería la aplicación de esta filosofía en los primeros días del ingreso. En una extensa revisión, van Baal57 analiza los resultados del manejo mediante drenaje percutáneo. Pocos grupos utilizan el tratamiento mediante drenaje percutáneo durante los primeros días desde el inicio de la clínica58–61. En otro ámbito, al analizar los motivos del fracaso en el manejo en etapas, el grupo hindú de Chandigarh62 demostró que la presencia de insuficiencia renal, un score APACHE II elevado y la presencia de infección multibacteriana eran los factores que acarreaban mayor riesgo de conversión a cirugía. Probablemente, en un futuro se podrá prever en qué pacientes el manejo en etapas fracasará. Así pues, en el momento actual, el manejo del paciente con PAG infectada, en presencia de fracaso orgánico durante la primera semana del inicio del cuadro, sigue siendo controvertido.
ConclusionesLa cirugía por pancreatitis aguda comporta una elevada mortalidad, que se ve agravada si se lleva a cabo durante la primera semana desde el inicio de los síntomas. La complejidad en el manejo de estos pacientes obliga a un enfoque multidisciplinar en centros de referencia, con cirujanos con especial dedicación a dicha enfermedad que puedan coordinar el tratamiento, hecho que mejora los resultados de forma significativa. Por último, en el momento actual, el tratamiento de la pancreatitis aguda debe contemplar un amplio abanico de posibilidades terapéuticas que implica a diversos servicios médicos como los de radiología intervencionista, endoscopia avanzada y medicina intensiva, con el objetivo de mejorar los resultados. La aplicación del tratamiento en etapas como alternativa a la cirugía de entrada, en el manejo de estos pacientes, probablemente mejorará los resultados, aunque hacen falta más estudios de calidad para confirmar dicho aspecto.