El objetivo de este estudio consistió en identificar los factores asociados a la recurrencia y supervivencia del liposarcoma retroperitoneal primario.
MétodosSe analizó retrospectivamente una base de datos prospectiva de 35 pacientes con liposarcoma retroperitoneal primario tratados quirúrgicamente entre 2004-2015. Los criterios de exclusión fueron tumores recurrentes y metastásicos. Se analizó la supervivencia global (SG) y la supervivencia libre de enfermedad. Los datos de los pacientes se compararon entre los pacientes con o sin recurrencia dentro de los 12 meses posteriores a la cirugía. Los factores de riesgo se determinaron mediante análisis de regresión logística.
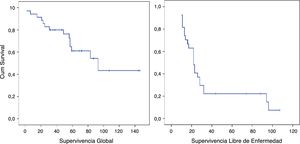
ResultadosLa SG a los 5 años fue del 61,1%. La supervivencia libre de enfermedad al año y a los 3 años fue del 68,6% al año y del 17,1%respectivamente. La SG en el grupo con recurrencia precoz fue del 36,4% a los 5 años frente al 71,3% en el grupo sin recurrencia precoz (p=0,011). La recurrencia precoz se asoció a una disminución de la SG (HR=4,05; IC95%: 1,27-12,96; p=0,018). La multifocalidad y márgenes quirúrgicos R1 estuvieron asociados a la recurrencia precoz. Los factores asociados a la recurrencia fueron el subtipo histológico, multifocalidad, grado histológico y márgenes quirúrgicos. La cirugía en bloque presentó un efecto protector frente a la recurrencia precoz y estuvo asociada a una mayor supervivencia libre de enfermedad y SG.
ConclusionesEste estudio pone de manifiesto la importancia del abordaje quirúrgico agresivo en el tratamiento del liposarcoma retroperitoneal, especialmente en aquellos pacientes con características histopatológicas que empobrecen el pronóstico.
The aim of this study is to identify factors associated to recurrence and survival in primary retroperitoneal liposarcomas.
MethodsProspective database of 35 patients with primary retroperitoneal liposarcoma treated 2004-2015 were retrospectively analyzed. Exclusion criteria were recurrent and metastatic tumors. Overall survival (OS) and disease-free survival were reviewed. Patient data were compared between patients with or without recurrence within 12 months after surgery. Risk factors were determined using logistic regression analysis.
ResultsFive-year OS was 61.1%. One and three-year disease-free survival were 68.6% and 17.1% respectively. OS in the early recurrence group was 36.4 months compared with 43.2 months in the group without early recurrence (P=.011). Early recurrence was associated with a reduction in OS (HR=4.05; CI95%: 1.27-12.96; P=.018). Multifocality and microscopic positive margins R1 were associated with early recurrence. Histologic subtype, margin of resection, histologic grade and multifocality were factors associated with recurrence. Contiguously involved organ resection had a beneficial effect on early recurrence and was associated with an increase in disease-free survival and OS. Adjuvant treatments had no protective effect on recurrence.
ConclusionsThis study underlines the crucial role aggressive surgical approach in retroperitoneal Liposarcoma treatment, especially in those patients with histological characteristics that adversely the prognosis.
Los tumores sarcomatosos representan el 1% de los tumores en adultos. Únicamente el 12-20% de los casos tienen una localización retroperitoneal1–3. Estos tumores presentan una incidencia de entre 1 y 5 casos por 1.000.000 de habitantes3,4.
El liposarcoma (LPS) es el tipo histológico más frecuente suponiendo alrededor del 50% de los sarcomas retroperitoneales (SRP)1 y está dividido en los subtipos histológicos bien diferenciado (LPS BD), mixoide/células redondas (LPS Mix), pleomórfico (LPS Pl), desdiferenciado (LPS DD) y mixto5.
Desde un punto de vista clínico, estos tumores son difíciles de detectar debido a su crecimiento silente. Así, pueden alcanzar un tamaño desproporcionado, comprimiendo las estructuras vitales cercanas6.
La recurrencia locorregional es la principal causa de mortalidad4,7. Las metástasis a distancia en el momento del diagnóstico son raras; con mayor frecuencia se localizan en el pulmón o el hígado y su ocurrencia se ha cifrado en alrededor del 10%8.
La cirugía es el tratamiento más efectivo en los SRP9. Obtener márgenes sin afectación tumoral es el principal objetivo a alcanzar, llegándose a realizar grandes resecciones multiviscerales para garantizar tal fin4,10,11. El tamaño de estos tumores y su relación con las diferentes estructuras de la cavidad abdominal dificultan la escisión total con márgenes libres de afectación tumoral10.
El uso de la radioterapia no está exento de controversia. Tradicionalmente, se ha considerado útil con el control local asociado a la cirugía; sin embargo, deben desarrollarse estudios prospectivos que respalden su uso12. La quimioterapia se ha limitado a tumores recurrentes y metastásicos debido a su efectividad limitada13.
El comportamiento de los LPS retroperitoneales está poco estudiado. En la literatura suele incluirse en estudios donde se agrupa, bien con LPS de otra localización, bien con el global de tumores retroperitoneales debido a su baja frecuencia. Este estudio se basó en los resultados obtenidos de un centro de referencia regional para esta enfermedad.
MétodosSe analizó retrospectivamente una base de datos prospectiva de 40 pacientes con LPS retroperitoneal entre 2004 y 2015.
Los criterios de inclusión fueron: LPS retroperitoneal primario, edad mayor a 18 años, índice Karnofsky mayor del 70%, ASA I, II y III.
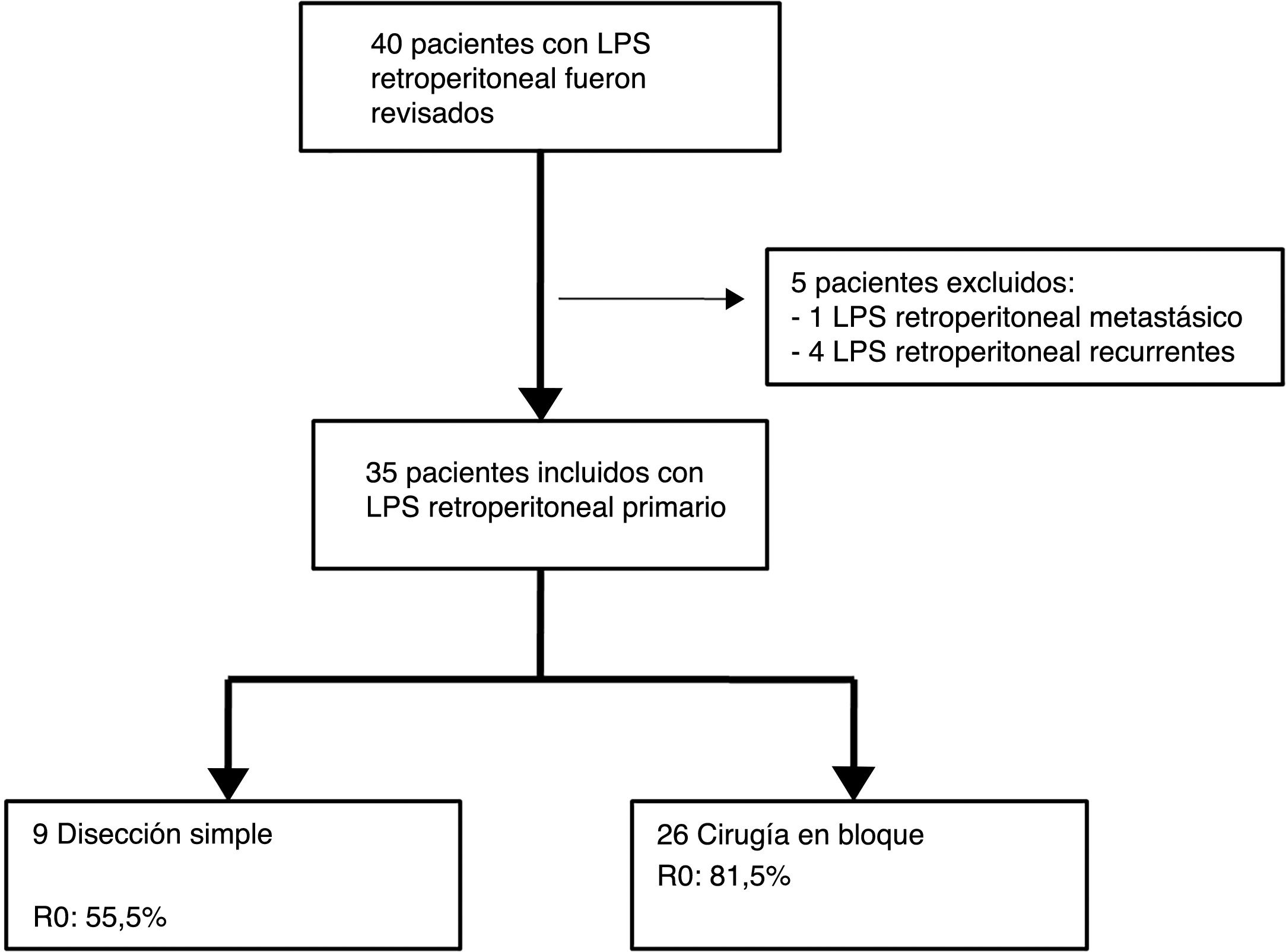
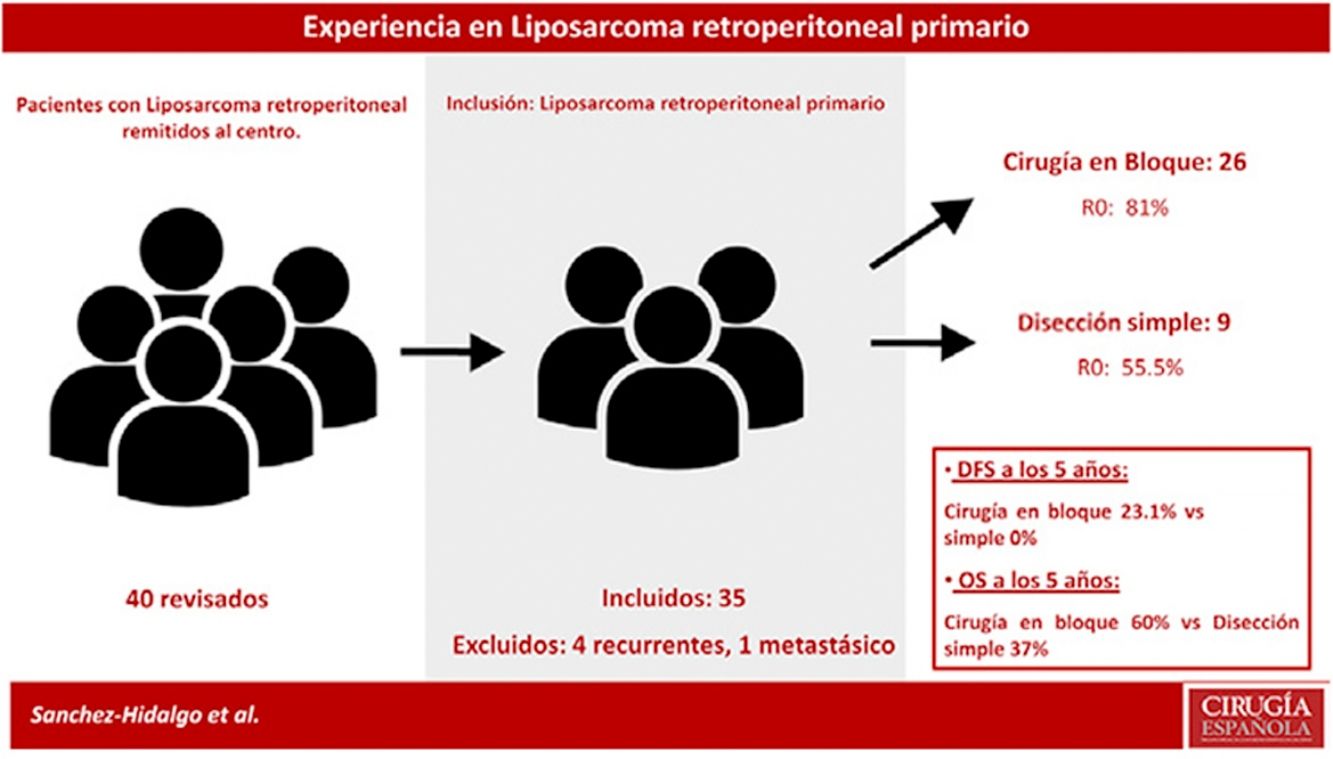
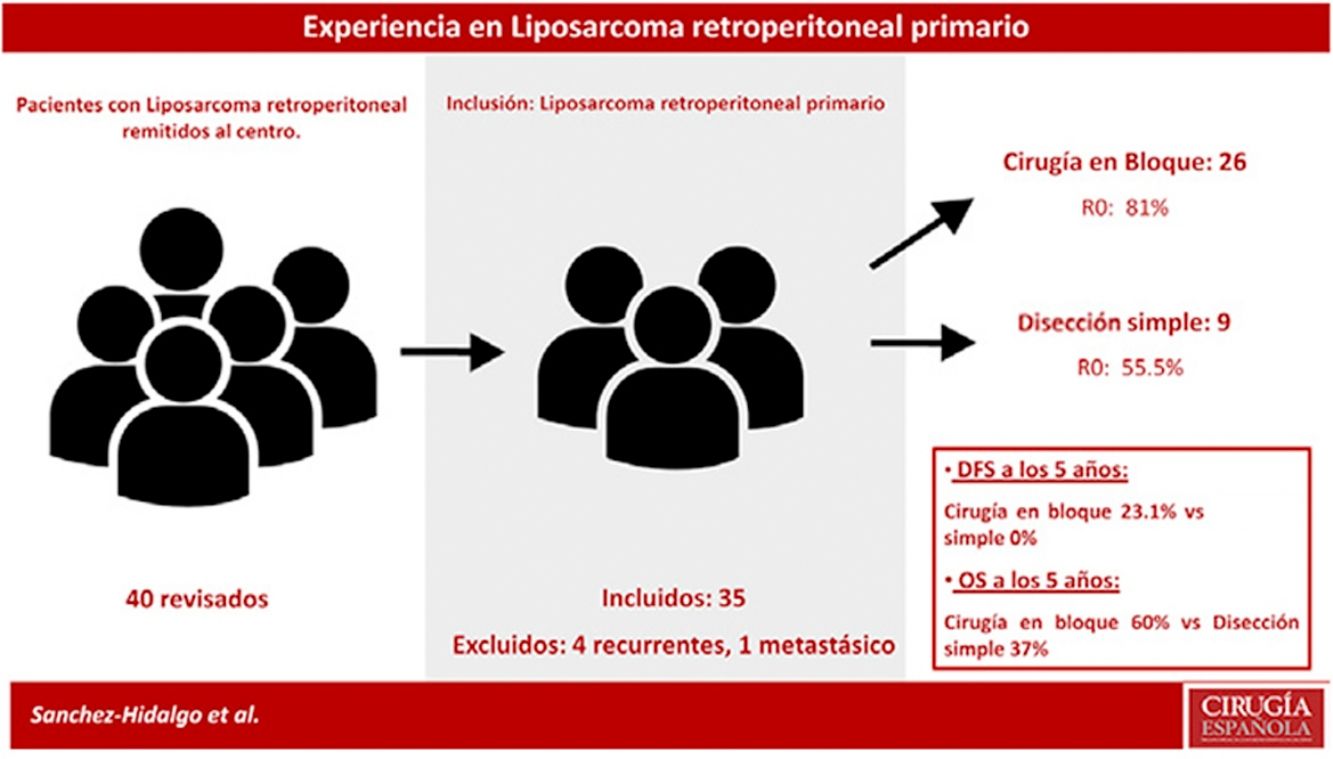
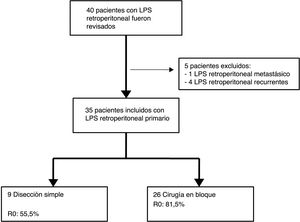
Los criterios de exclusión fueron: LPS recurrente o LPS mestastásico. Se excluyeron 5 pacientes: un paciente con LPS retroperitoneal metastásico primario y 4 pacientes afectados por LPS recurrente procedentes de otros centros (n=35) (fig. 1).
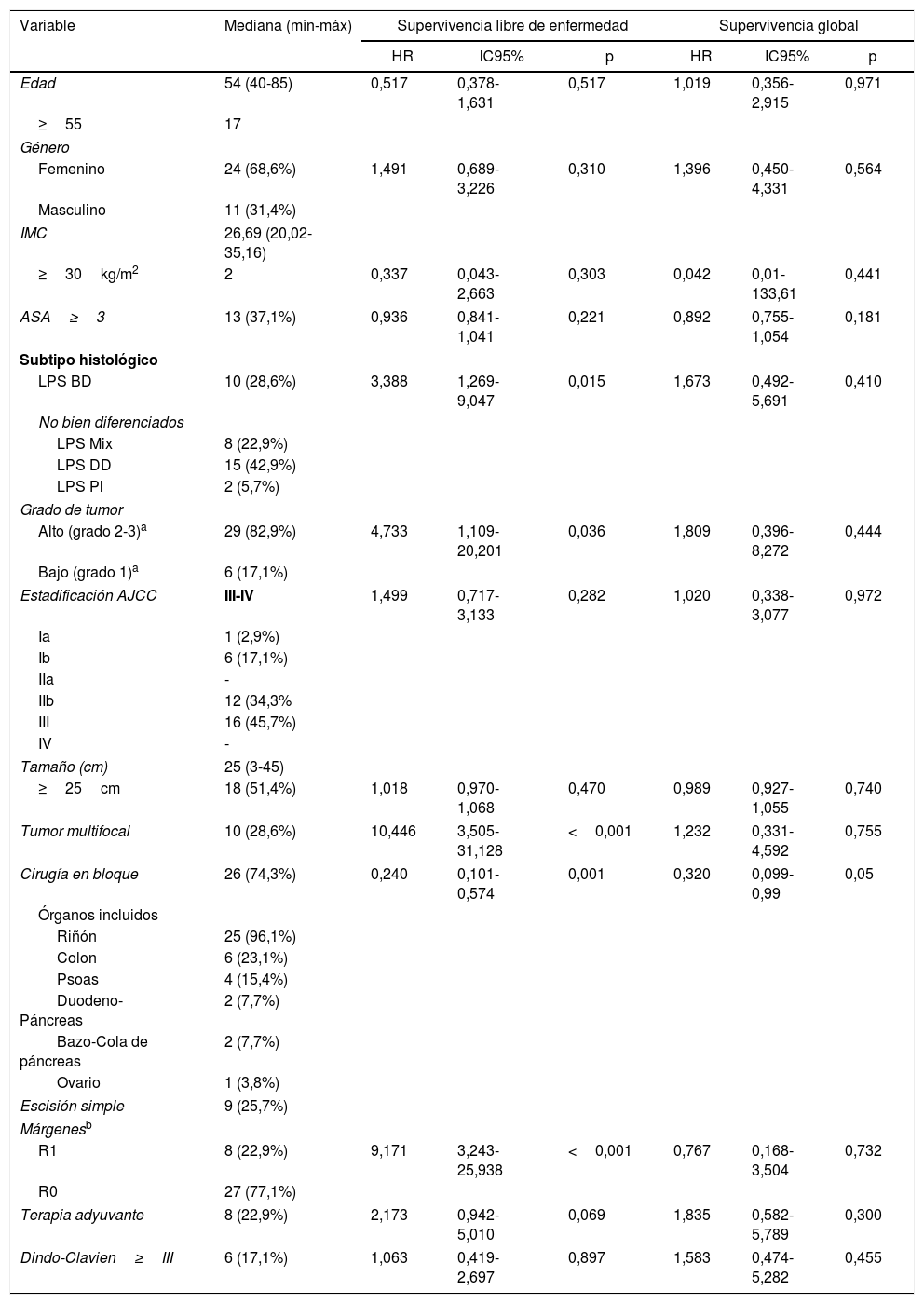
Para definir las características de los pacientes se utilizaron las variables edad, sexo, índice de masa corporal y sistema de clasificación ASA (tabla 1).
Características de los pacientes y su influencia en la supervivencia
| Variable | Mediana (mín-máx) | Supervivencia libre de enfermedad | Supervivencia global | ||||
|---|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | ||
| Edad | 54 (40-85) | 0,517 | 0,378-1,631 | 0,517 | 1,019 | 0,356-2,915 | 0,971 |
| ≥55 | 17 | ||||||
| Género | |||||||
| Femenino | 24 (68,6%) | 1,491 | 0,689-3,226 | 0,310 | 1,396 | 0,450-4,331 | 0,564 |
| Masculino | 11 (31,4%) | ||||||
| IMC | 26,69 (20,02-35,16) | ||||||
| ≥30kg/m2 | 2 | 0,337 | 0,043-2,663 | 0,303 | 0,042 | 0,01-133,61 | 0,441 |
| ASA≥3 | 13 (37,1%) | 0,936 | 0,841-1,041 | 0,221 | 0,892 | 0,755-1,054 | 0,181 |
| Subtipo histológico | |||||||
| LPS BD | 10 (28,6%) | 3,388 | 1,269-9,047 | 0,015 | 1,673 | 0,492-5,691 | 0,410 |
| No bien diferenciados | |||||||
| LPS Mix | 8 (22,9%) | ||||||
| LPS DD | 15 (42,9%) | ||||||
| LPS Pl | 2 (5,7%) | ||||||
| Grado de tumor | |||||||
| Alto (grado 2-3)a | 29 (82,9%) | 4,733 | 1,109-20,201 | 0,036 | 1,809 | 0,396-8,272 | 0,444 |
| Bajo (grado 1)a | 6 (17,1%) | ||||||
| Estadificación AJCC | III-IV | 1,499 | 0,717-3,133 | 0,282 | 1,020 | 0,338-3,077 | 0,972 |
| Ia | 1 (2,9%) | ||||||
| Ib | 6 (17,1%) | ||||||
| IIa | - | ||||||
| IIb | 12 (34,3% | ||||||
| III | 16 (45,7%) | ||||||
| IV | - | ||||||
| Tamaño (cm) | 25 (3-45) | ||||||
| ≥25cm | 18 (51,4%) | 1,018 | 0,970-1,068 | 0,470 | 0,989 | 0,927-1,055 | 0,740 |
| Tumor multifocal | 10 (28,6%) | 10,446 | 3,505-31,128 | <0,001 | 1,232 | 0,331-4,592 | 0,755 |
| Cirugía en bloque | 26 (74,3%) | 0,240 | 0,101-0,574 | 0,001 | 0,320 | 0,099-0,99 | 0,05 |
| Órganos incluidos | |||||||
| Riñón | 25 (96,1%) | ||||||
| Colon | 6 (23,1%) | ||||||
| Psoas | 4 (15,4%) | ||||||
| Duodeno-Páncreas | 2 (7,7%) | ||||||
| Bazo-Cola de páncreas | 2 (7,7%) | ||||||
| Ovario | 1 (3,8%) | ||||||
| Escisión simple | 9 (25,7%) | ||||||
| Márgenesb | |||||||
| R1 | 8 (22,9%) | 9,171 | 3,243-25,938 | <0,001 | 0,767 | 0,168-3,504 | 0,732 |
| R0 | 27 (77,1%) | ||||||
| Terapia adyuvante | 8 (22,9%) | 2,173 | 0,942-5,010 | 0,069 | 1,835 | 0,582-5,789 | 0,300 |
| Dindo-Clavien≥III | 6 (17,1%) | 1,063 | 0,419-2,697 | 0,897 | 1,583 | 0,474-5,282 | 0,455 |
AJCC: American Joint Comittee on Cancer; BD: bien diferenciado; DD: desdiferenciado; IMC: índice de masa corporal; LPS: liposarcoma; Mix: mixoide; Pl: pleomórfico.
Análisis univariado realizado mediante la prueba de regresión de Cox. Significación estadística p<0,05.
Las variables en relación con el tumor fueron: tamaño (diámetro), multifocalidad, subtipo histológico según las clasificación de las OMS5 (LPS BD, LPS Mix, LPS Pl, o LPS DD), grado de desdiferenciación (alto grado: grado 2 o 3 de la FNCLCC; bajo grado: grado 1 de la FNCLCC14) y estadio según la AJCC 7th edition15.
El tratamiento y manejo fueron aprobados por el Comité multidisciplinario de Sarcomas del Hospital.
La técnica quirúrgica fue definida como disección simple cuando se realizó la disección del plano existente entre el tumor y las vísceras adyacentes. La resección en bloque consistió en una cirugía agresiva con extirpación de órganos (principalmente resección de riñón y del peritoneo adyacente) con el objetivo de obtener un amplio margen de tejido sano rodeando la zona tumoral. Los márgenes fueron considerados R0 cuando no se observó tejido tumoral residual y además existía un margen de tejido sano circundante, la afectación de los márgenes de la pieza quirúrgica por tejido microscópico tumoral se definió como R1 y la presencia de residuo tumoral macroscópico como R2.
Los pacientes no recibieron tratamientos previos.
La quimioterapia adyuvante con régimen de ifosfamida y adriamicina se utilizó de manera aislada o junto a radioterapia adyuvante con dosis medias de 45Gy en el lecho quirúrgico marcado con grapas.
La morbilidad postoperatoria fue agrupada en la escala de Dindo-Clavien durante los 30 primeros días tras la intervención16.
Se recolectaron los datos de supervivencia global (SG) y supervivencia libre de enfermedad (SLE). La recurrencia precoz se definió como la reaparición de la enfermedad dentro de los 12 meses de la cirugía, diagnosticada mediante pruebas radiológicas.
Análisis estadísticoSe realizó un análisis descriptivo estándar para definir las características principales del grupo de estudio.
Las curvas para SG y SLE se construyeron utilizando el método de Kaplan-Meier, y se utilizó la prueba de log-rank para el análisis comparativo. Se realizó un análisis univariante para SG y SLE utilizando el modelo de regresión de riesgos proporcionales de Cox (HR).
Se compararon todos los parámetros relevantes entre el grupo que experimentó recidiva precoz dentro de los 12 meses tras la cirugía y el grupo que no, y se utilizó la prueba exacta de Fisher de acuerdo con el tamaño de la muestra. Para las variables continuas, se utilizó la prueba t de Student o la prueba de Mann-Whitney, según la distribución de la muestra comprobada mediante la prueba de Shapiro-Wilk. Los factores que mostraron una p≤0,05 se incluyeron en un análisis de regresión logística binaria. Además, se realizó un estudio comparativo entre el grupo de disección simple y el grupo de cirugía en bloque.
Todos los contrastes fueron bilaterales y se consideraron como significativos aquellos con p<0,05.
Todos los participantes dieron su consentimiento para ser incluidos en el estudio, y el protocolo de estudio fue aprobado por el Comité de Ética de Investigación.
ResultadosLas características principales de nuestra cohorte se resumen en la tabla 1 (n=35).
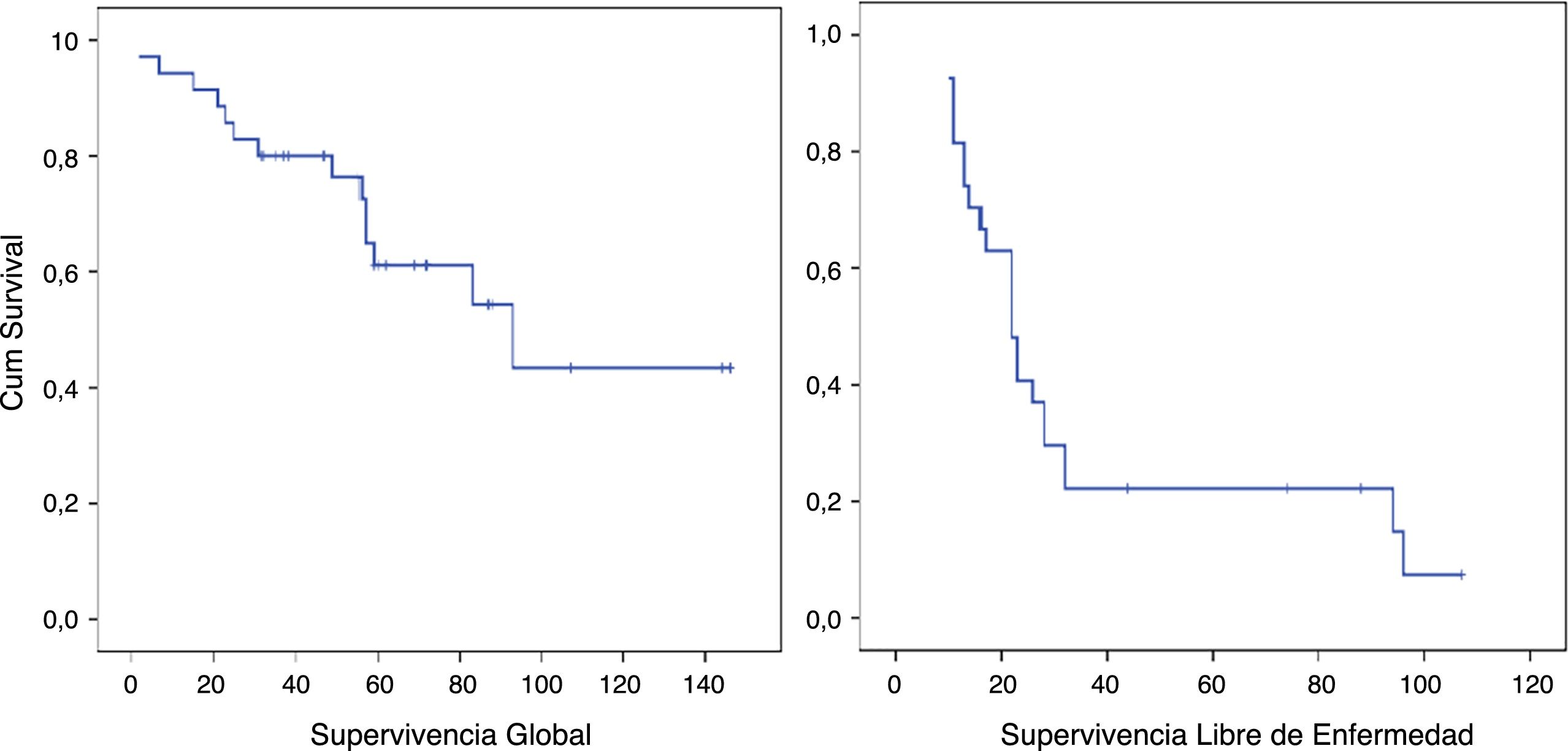
La SG mediana del grupo fue de 93 meses (IC95%: 44,90-141,02) con una SG a los 5 años del 61,1%. La SLE mediana fue de 22 meses (IC95%: 19,86-41,17). La SLE en el primer año fue de un 85,6% y un 22,2% a los 36 meses. (Los pacientes con márgenes microscópicamente afectados R1 se excluyeron). La tasa de recurrencia precoz fue del 31,4% (fig. 2).
En el análisis univariante, los factores con efectos negativos sobre la SLE fueron el subtipo histológico no bien diferenciado, alto grado, presencia de tumor multifocal y márgenes R1 (tabla 1). No hubo pacientes con márgenes R2.
La aplicación de quimioterapia con radioterapia o sin ella en aquellos pacientes con mal pronóstico (tumor desdiferenciado y/o márgenes R1) no mejoró los resultados (SLE y SG) y no tuvo efecto protector en cuanto a la recurrencia precoz (tabla 1).
La cirugía en bloque con extirpación de vísceras adyacentes mostró un efecto preventivo en cuanto a la SLE (HR=0,240; IC95%: 0,101-0,574; p=0,001) y fue el único factor que influyó positivamente en la SG (HR=0,320; IC95%: 0,099-0,99; p=0,05; tabla 1).
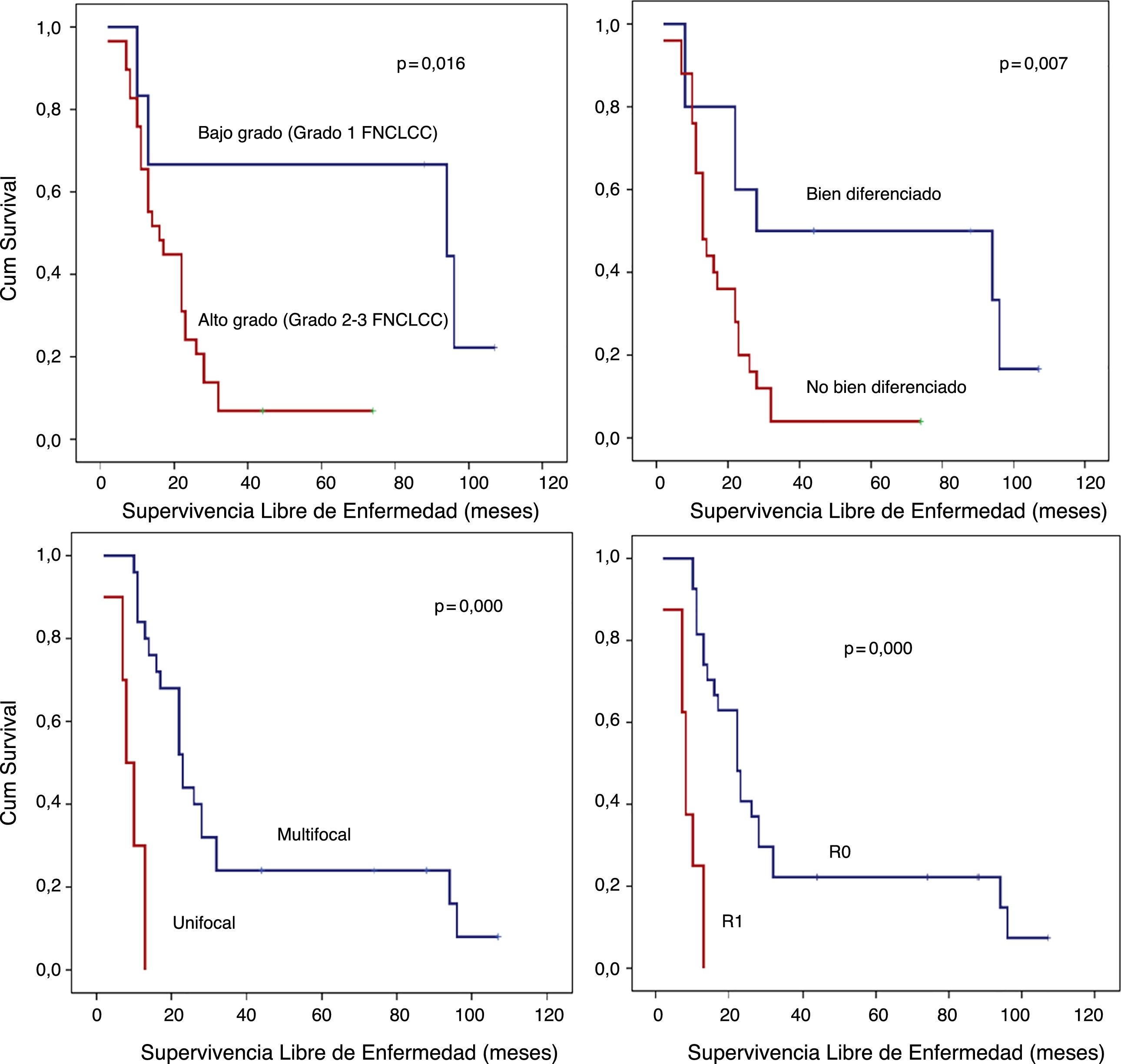
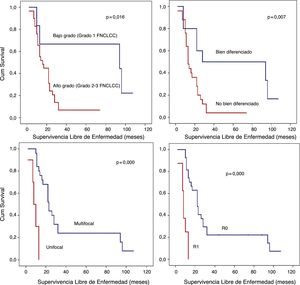
Análisis SLE detallado (fig. 3):
- A)
Los pacientes con LPS retroperitoneales de bajo grado presentaron una SLE a los 5 años del 66,7%; sin embargo, en aquellos con LPS de alto grado fue inferior al 10% (p=0,016).
- B)
Los pacientes con LPS retroperitoneales no bien diferenciados (LPS Mix, LPS DD o LPS Pl) presentaron un pronóstico precario en términos de la SLE a 5 años (<10%) en comparación con aquellos con LPS retroperitoneales bien diferenciados (50%; p=0,007).
- C)
Otro punto de interés histopatológico en términos de SLE fue la multifocalidad. El grupo de pacientes sin tumor multifocal presentaron una SLE a un año del 84% y una SLE a los 5 años del 24%. Sin embargo, el grupo con LPS retroperitoneales multifocales presentaron una SLE a un año del 30% y una SLE a 5 años del 0% (p=0,001).
- D)
Cuando se logró un margen R0, la SLE a un año fue casi del 81%, sin embargo, en el caso de márgenes R1, fue aproximadamente del 25% (p=0,001).
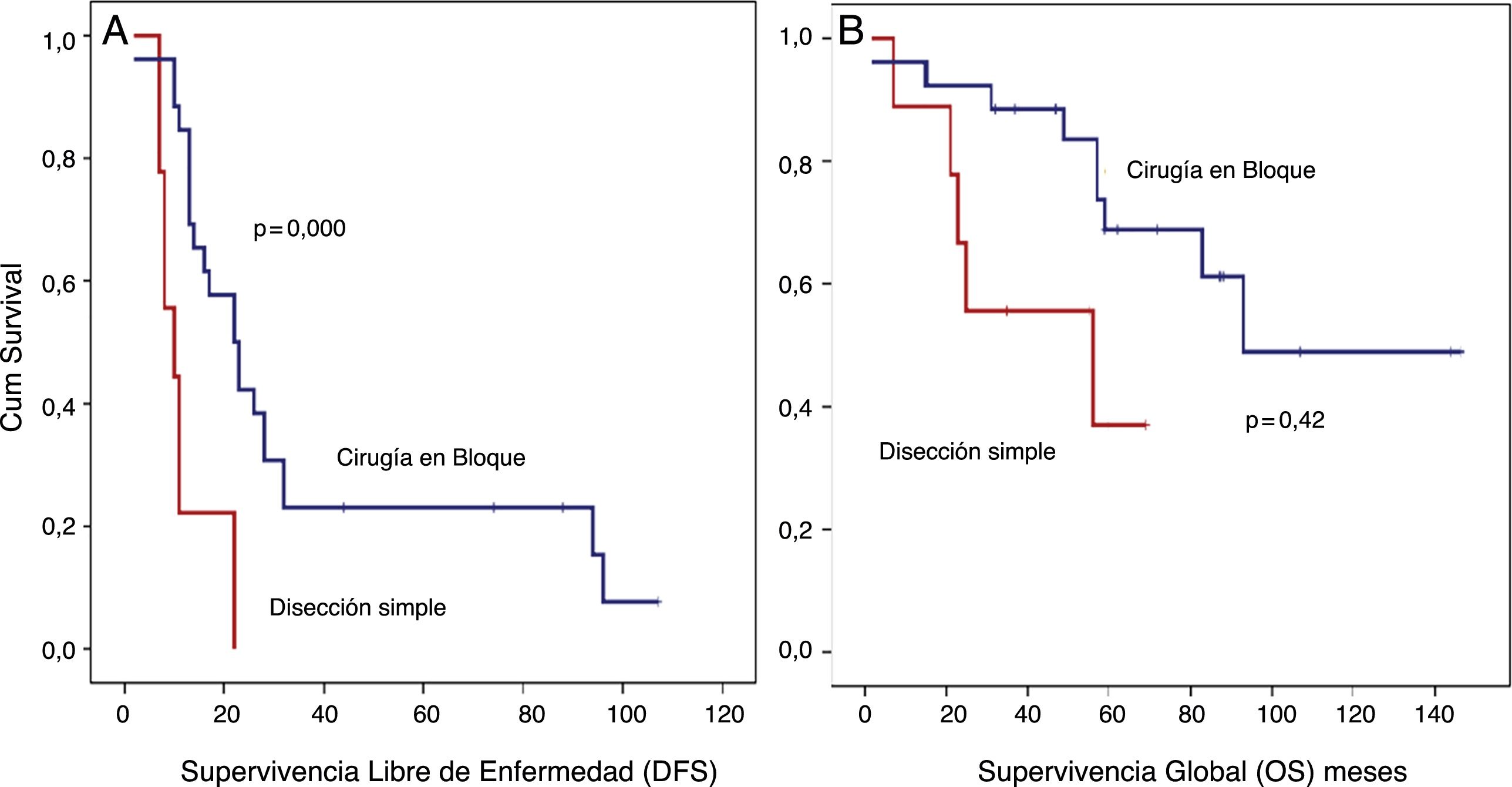
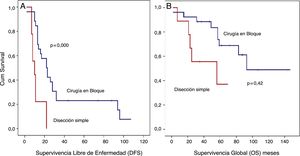
Análisis SLE detallado (fig. 4):
Los pacientes tratados con disección simple presentaron una SLE a 5 años del 0%, mientras que en el grupo tratado mediante cirugía en bloque fue del 23,1% (p=0,001). El grupo tratado con disección simple presentó una SG a 5 años cercana al 37%, mientras que el grupo tratado mediante cirugía en bloque presentó una SG a 5 años cercana al 70% (p=0,042) (fig. 4). No se observaron diferencias en el análisis comparativo entre ambos grupos. Se obtuvieron márgenes R0 en el grupo tratado mediante cirugía en bloque en 21 pacientes (81%) y en 5 pacientes (55,5%) cuando se realizó una disección simple.
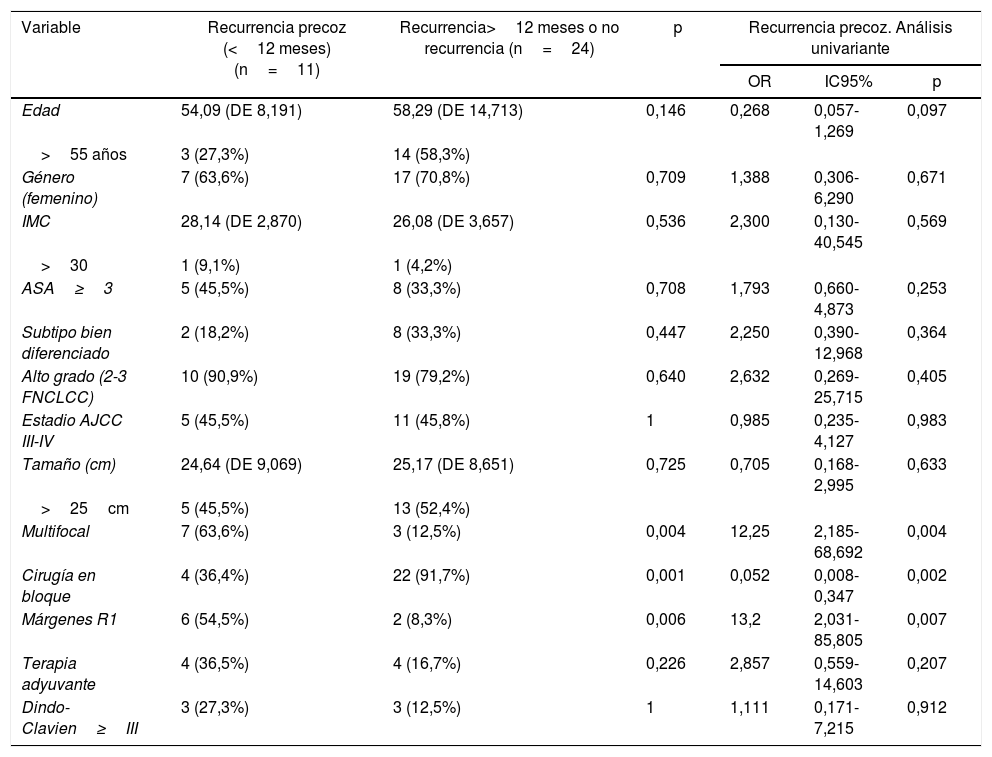
Otro punto de interés fue la influencia de diferentes factores clínicos en la recurrencia precoz (tabla 2).
Factores implicados en la recurrencia precoz del liposarcoma retroperitoneal
| Variable | Recurrencia precoz (<12 meses) (n=11) | Recurrencia>12 meses o no recurrencia (n=24) | p | Recurrencia precoz. Análisis univariante | ||
|---|---|---|---|---|---|---|
| OR | IC95% | p | ||||
| Edad | 54,09 (DE 8,191) | 58,29 (DE 14,713) | 0,146 | 0,268 | 0,057-1,269 | 0,097 |
| >55 años | 3 (27,3%) | 14 (58,3%) | ||||
| Género (femenino) | 7 (63,6%) | 17 (70,8%) | 0,709 | 1,388 | 0,306-6,290 | 0,671 |
| IMC | 28,14 (DE 2,870) | 26,08 (DE 3,657) | 0,536 | 2,300 | 0,130-40,545 | 0,569 |
| >30 | 1 (9,1%) | 1 (4,2%) | ||||
| ASA≥3 | 5 (45,5%) | 8 (33,3%) | 0,708 | 1,793 | 0,660-4,873 | 0,253 |
| Subtipo bien diferenciado | 2 (18,2%) | 8 (33,3%) | 0,447 | 2,250 | 0,390-12,968 | 0,364 |
| Alto grado (2-3 FNCLCC) | 10 (90,9%) | 19 (79,2%) | 0,640 | 2,632 | 0,269-25,715 | 0,405 |
| Estadio AJCC III-IV | 5 (45,5%) | 11 (45,8%) | 1 | 0,985 | 0,235-4,127 | 0,983 |
| Tamaño (cm) | 24,64 (DE 9,069) | 25,17 (DE 8,651) | 0,725 | 0,705 | 0,168-2,995 | 0,633 |
| >25cm | 5 (45,5%) | 13 (52,4%) | ||||
| Multifocal | 7 (63,6%) | 3 (12,5%) | 0,004 | 12,25 | 2,185-68,692 | 0,004 |
| Cirugía en bloque | 4 (36,4%) | 22 (91,7%) | 0,001 | 0,052 | 0,008-0,347 | 0,002 |
| Márgenes R1 | 6 (54,5%) | 2 (8,3%) | 0,006 | 13,2 | 2,031-85,805 | 0,007 |
| Terapia adyuvante | 4 (36,5%) | 4 (16,7%) | 0,226 | 2,857 | 0,559-14,603 | 0,207 |
| Dindo-Clavien≥III | 3 (27,3%) | 3 (12,5%) | 1 | 1,111 | 0,171-7,215 | 0,912 |
Comparación de las variables continuas mediante la prueba t de Student y la U de Mann-Whitney. Comparación de las variables cualitativas mediante la prueba de Fisher. Análisis univariante realizado mediante análisis de regresión logística binaria.
En el grupo afectado por recurrencia precoz, la multifocalidad fue más frecuente (63,6%) que en el grupo opuesto, donde los tumores multifocales estuvieron presentes solo en el 12,5% de los casos (p=0,004). Otras características del tumor como el tamaño, el subtipo histológico y el grado no mostraron diferencias estadísticamente significativas entre ambos grupos.
El grupo tratado mediante cirugía en bloque mostró un índice de recurrencia precoz más bajo que el otro grupo de tratamiento (36,4 vs. 91,7%; p=0,001). La tasa de recurrencia precoz fue mayor en el grupo con márgenes R1 que en el grupo R0 (91,7 vs. 45,5%; p=0,006). La morbilidad asociada a la cirugía (Dindo-Clavien>3) no influyó en la tasa de recurrencia (p>0,05).
Ni la quimioterapia ni la radioterapia mejoraron la tasa de recurrencia precoz.
En el análisis univariado (tabla 2), la presencia de tumores multifocales y márgenes R1 se asoció con recurrencia temprana. Por otro lado, la resección de órganos contiguamente involucrada demostró ser efectiva contra la recurrencia temprana (OR=0,052; IC95%: 0,008-0,347; p=0,002).
La SG mediana en el grupo que presentó una recurrencia precoz fue de 42,2 meses (IC95%: 26,6-57,8) en comparación con la SG mediana de 105,7 meses en el grupo que no la presentó (IC95%: 84,1-127,3) (p=0,011). Las tasas de SG a 3 y 5 años en el grupo de recurrencia precoz fueron de un 54,5 y 36,4% respectivamente, en comparación con un 91,7 y 71,3% en el grupo sin recurrencia precoz.
La recurrencia precoz se asoció a una disminución de la supervivencia global (HR=4,05; IC95%: 1,27-12,96; p=0,018).
DiscusiónLas características demográficas en esta cohorte de participantes fueron similares a las de un grupo previamente estudiado4,7,17–20.
La recurrencia precoz (<12 meses) tras la cirugía se estableció como un factor de riesgo relacionado con SG (HR=4,05; IC95%: 1,27-12,96; p=0,018). El grupo de pacientes afectados por recurrencia precoz presentó una SG a los 5 años del 36,4%, en comparación con el 71,3% del grupo no afectado. Estas diferencias ponen de manifiesto el impacto de la recurrencia precoz en el pronóstico vital de los pacientes (p=0,011).
El subtipo histológico LPS DD fue el más común (≈43%) en nuestra muestra, difiriendo de los datos publicados por Singer et al.7 y Bonvalot et al.4 donde el LPS BD fue el más común. Nuestros datos tienen especial relevancia ya que se ha demostrado que la probabilidad de no recurrencia es mayor con el subtipo LPS BD (69%) que con LPS Mix7. Esto tiene gran importancia al evaluar la SG y la SLE en nuestra muestra debido a que los subtipos histológicos agresivos confieren un peor pronóstico.
El principal problema relacionado con estos tumores es la elevada frecuencia de recurrencias locorregionales y el impacto de estas en el pronóstico vital de los pacientes7.
Se ha demostrado previamente la relación entre un mayor grado de desdiferenciación y una disminución en SLE y SG en los SRP4,8,21,22. Nuestro trabajo muestra que el 90% de los pacientes afectados por recurrencia precoz presentaban tumores con grado de la FNCLCC 2-3, en contraste con el 79,2% entre aquellos pacientes sin recurrencia precoz; Sin embargo, esta diferencia no es estadísticamente significativa. Anteriormente se ha observado que los LPS grado 3 de la FNCLCC se asociaron con una tasa de recurrencia local del 20% durante los 12 primeros meses posteriores a la cirugía13. La presencia de tumores grado 2-3 de la FNCLCC ha demostrado estar relacionada con una disminución en la SLE en estudios similares de SRP7,23–26. Sin embargo, en este estudio no se ha observado una asociación entre la desdiferenciación y la disminución de la SG. Esta relación se ha demostrado con anterioridad en otros estudios de SRP7,23–26. En el trabajo de Gronchi et al.3, la SG en aquellos pacientes con LPS BD grado 1 de la FNCLCC fue del 92,9%, mientras que entre aquellos con grado 2 LPS DD fue del 56,5% y del 21,2% entre aquellos con LPS DD grado 3. De forma similar, hemos observado que la SG a 5 años fue del 100% para los LPS grado 1 de la FNCLCC y del 53,7% para los LPS grados 2 y 3. Sin embargo, estas diferencias no fueron estadísticamente significativas, probablemente debido al pequeño tamaño de la muestra.
La presencia de multifocalidad al diagnóstico se asoció a la recurrencia precoz (p=0,004). Probablemente, esta relación entre la recurrencia precoz y la multifocalidad se justifica por la gran dificultad para obtener una extirpación completa con márgenes R0 en estos casos; al estudiar este fenómeno, en el caso de tumores unifocales se obtuvo R0 en el 96%, mientras que en el grupo con tumores multifocales los márgenes R0 supusieron el 30% (p=0,001). Además, la multifocalidad se ha establecido como un factor de riesgo estadísticamente significativo relacionado con una disminución de la SLE. Esto también se ha demostrado en el estudio realizado por el Multi-Institutional Collaborative RPS Working Group en 201513. Aunque no hemos encontrado relación entre la multifocalidad y la SG, otros estudios han demostrado esta relación mostrando una disminución en la SG de los SRP13,17,23. Además, la multifocalidad ya se incluido en el Multi-Institutional Retroperitoneal Sarcoma Nomogram27.
En el análisis multivariante realizado por Gronchi et al.13, los márgenes histológicos R0/R1 se han relacionado con un mejor pronóstico en el caso de los SRP (SG y SLE) en comparación con los márgenes R2. En nuestro estudio, los márgenes R1 se asociaron con una disminución en la SLE y con la recurrencia precoz. Cuando hubo márgenes R1, la SLE a un1 año estuvo cerca del 25%, mientras que en el caso de los márgenes R0 fue de cerca del 81%; se debe considerar que este 75% de las recaídas en el primer año probablemente estén relacionadas con una persistencia de la enfermedad y resalta la implicación de los márgenes R1 en la recurrencia precoz. Nuestros datos respaldan el análisis multivariante realizado por Bonvalot et al.4, que encontraron una relación entre los márgenes histológicos afectados, la recurrencia (HR=1,88; IC95%: 1,18-2,98; p=0,008) y una disminución de la SG (HR=1,70; IC95%: 1,07-2,72; p=0,03). Se ha demostrado con anterioridad que la presencia de márgenes R1 (microscópico positivo) o R2 (enfermedad residual macroscópica) y la técnica quirúrgica son factores importantes para la recurrencia4,13.
Aunque la cirugía está establecida como principal tratamiento para estos tumores, aún no se ha determinado la extensión de tejido a extirpar. En consecuencia, existen diferencias significativas entre los diferentes centros quirúrgicos, incluso en aquellos de referencia internacional13. El objetivo de las resecciones extensas que incluyen órganos no afectados es obtener márgenes sin células tumorales residuales microscópicas y, en consecuencia, mejorar la SLE. Sin embargo, la anatomía retroperitoneal complica la realización de este complejo procedimiento quirúrgico. En un número considerable de centros se realiza un abordaje altamente agresivo denominado «complete compartmental resection». Esta técnica utilizada en el tratamiento de SRP incluye la resección de colon en el frente, músculo psoas en la zona posterior y el riñón incluido en la pieza4,7,23, logrando una tasa de recurrencia local a los 3 años del 10% sin mejoría en la SG. En nuestro estudio, la cirugía en bloque fue un factor protector relacionado con la SLE y la SG, y disminuyó la recidiva precoz (OR=0,052; IC95%: 0,008-0,347; p=0,002) con tasas de morbilidad similares a las de otros estudios4, lo que relaciona una mayor supervivencia global tras la cirugía en bloque, contrariamente a lo observado en estudios previos4,10,11.
En Miura et al.28, la quimioterapia demostró no tener un efecto significativo sobre la SG en los SRP, como se había observado en otros estudios previos13,19. En nuestro estudio, la terapia adyuvante se indicó en aquellos pacientes cuyo pronóstico se vio negativamente afectado por factores como la cirugía subóptima por la presencia de márgenes R1 o debido a subtipos histológicos agresivos, sin mostrar mejoría en cuanto a la recidiva precoz, SLE y SG.
Anteriormente, un número importante de estudios ha mostrado un impacto positivo de la radioterapia adyuvante en el control de la recidiva local en SRP4,13,28. Actualmente, se está llevando a cabo el ensayo clínico multicéntrico EORTC, ahora en fase iii, que compara el efecto de la radioterapia adyuvante y la cirugía versus la cirugía cómo única terapia. Las conclusiones de este estudio serán especialmente valiosas para determinar la efectividad de cada una de estas estrategias en el tratamiento de los SRP. Por otro lado, la radioterapia intraoperatoria ha demostrado su efectividad reduciendo la recaída local29.
Nuestros resultados deben interpretarse con cautela en vista del pequeño tamaño de la muestra. Además, el reducido número de pacientes incluidos en este estudio no permitió realizar un análisis multivariante.
En conclusión, la recurrencia precoz se asocia fundamentalmente a una cirugía subóptima con márgenes afectados por el tumor incluso microscópicos. La relación entre la multifocalidad y la recurrencia temprana probablemente se deba a la dificultad de obtener márgenes amplios libres de células tumorales.
En el LPS retroperitoneal, las características del tumor como el subtipo histológico, el grado de desdiferenciación y la multifocalidad han demostrado ser importantes factores relacionados con la SLE. Los márgenes R1 se han asociado con una disminución de la SLE.
Este estudio subraya el papel crucial de un abordaje quirúrgico agresivo en el tratamiento de los LPS retroperitoneales debido a la importancia de obtener márgenes R0. La cirugía en bloque ha demostrado ser una medida preventiva eficaz frente a la recurrencia precoz, y se ha relacionado con un aumento de la SLE y de la SG.
FinanciaciónLos autores declaran que no han recibido ninguna financiación para completar este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.