El objetivo principal es determinar la supervivencia global y la supervivencia libre de enfermedad de pacientes intervenidos de liposarcoma retroperitoneal, comparándolos en función de los subtipos histológicos bien diferenciado y desdiferenciado. Los objetivos secundarios son analizar descriptivamente las características clínicas de estos pacientes e identificar otras variables independientes que puedan modificar significativamente estos perfiles de supervivencia.
MétodosSe realiza un estudio observacional y analítico mediante una cohorte histórica retrospectiva, seguida prospectivamente. Los criterios de inclusión fueron: cirugía de liposarcoma de localización retroperitoneal, subtipos histológicos bien diferenciado y desdiferenciado, entre enero de 2002 y mayo de 2019. Se incluyeron un total de 32 pacientes. Se utilizó el estimador de Kaplan-Meier para resumir los datos y la prueba log-rank para el análisis comparativo.
ResultadosLa supervivencia global a los 5 años fue del 59%. No se encontraron diferencias entre los pacientes con subtipo bien diferenciado con respecto al desdiferenciado (p=0,834). La supervivencia libre de enfermedad a los 2 años fue del 59% en los bien diferenciados y del 26% en los desdiferenciados, siendo estas diferencias estadísticamente significativas (p=0,005). Ninguna de las otras variables estudiadas modificó significativamente estos perfiles de supervivencia.
ConclusionesLa supervivencia libre de enfermedad de los liposarcomas retroperitoneales desdiferenciados es significativamente menor que en los bien diferenciados, pero no puede afirmarse que haya diferencias en la supervivencia global.
The main objective is to establish the overall survival and disease-free survival profiles regarding the patients with retroperitoneal liposarcoma, making a comparison based on the well-differentiated and dedifferentiated histological subtypes. The secondary objectives are to descriptively analyze the clinical characteristics of said patients and to identify and analyze other independent variables that might modify these survival profiles significantly.
MethodsAn observational and analytical study was performed using a retrospective historical cohort that was followed prospectively. The inclusion criteria consisted of: the procedure of liposarcoma located in the retroperitoneum, the well-differentiated and dedifferentiated histological subtypes, between January 2002 and May 2019. As a result, 32 patients took part in this study's sample. Kaplan–Meier estimator was used to summarize the results and log-rank test was used in the comparative analysis.
ResultsThe overall survival at 5 years was around 59%. No differences were found between the patients with a well-differentiated subtype compared to the dedifferentiated ones (p=0.834). The disease-free survival at 2 years was 59% regarding the well-differentiated and 26% regarding the dedifferentiated, with these differences being statistically significant (p=0.005). None of the other studied variables modified these survival profiles significantly.
ConclusionsDedifferentiated retroperitoneal liposarcomas show less disease-free survival than well-differentiated liposarcomas. However, regarding overall survival no differences can be claimed.
Aunque los sarcomas son neoplasias raras1, aproximadamente un tercio de los tumores malignos del retroperitoneo son sarcomas2,3, siendo la estirpe más común (40-50%) el liposarcoma (LPS)4. El LPS se clasifica en 4 subtipos histológicos en función de las características morfológicas y aberraciones citogenéticas: bien diferenciado (o tumor lipomatoso atípico), desdiferenciado, mixoide/células redondas y pleomórfico5, siendo los dos primeros los más frecuentemente encontrados en el retroperitoneo (90%)6. Debido a su localización, los liposarcomas retroperitoneales (LPSR) suelen diagnosticarse tardíamente, cuando ya han alcanzado un gran tamaño e invadido numerosas estructuras viscerales adyacentes7. La tasa de metástasis a distancia, incluso para los de alto grado, es relativamente baja (10-15%), por lo que la mortalidad del LPSR se relaciona más con su agresividad local8.
En base a esto, se afirma que el factor pronóstico más importante en los LPSR es la resección quirúrgica completa9–11, teniendo la quimioterapia y/o radioterapia un papel condicionado al tipo de cirugía, recidiva o tamaño de la pieza12,13. La escisión tumoral completa no es sencilla y en muchas ocasiones no pueden conseguirse márgenes libres. Esto explica la alta tasa de recidiva y la morbimortalidad asociada a resecciones quirúrgicas amplias y multiviscerales que presentan este tipo de tumores14. Sin embargo, incluso con resecciones amplias parece ser que el curso de la enfermedad difiere en función del subtipo histológico del LPSR, siendo más benévolo en el LPSR bien diferenciado (LPSRBD) que en el desdiferenciado (LPSRDD)15,16. Por tanto, podría plantearse que los primeros, por su potencial de baja malignidad, pudieran manejarse de manera más conservadora, evitando resecciones amplias y mutilantes y reduciendo la morbilidad17. No obstante, un seguimiento laxo del paciente puede implicar un gran riesgo de recidiva, con la consecuente morbimortalidad añadida, por lo que existen resultados contradictorios según los trabajos publicados2,5,10,18,19. Además, existe un porcentaje nada desdeñable de reintervención por aumento del grado histológico al analizar la pieza quirúrgica completa3,20,21. Esto dificulta el establecer un protocolo diagnóstico-terapéutico y pronóstico adecuado para estos pacientes.
Así pues, partiendo de la hipótesis de que los pacientes con LPSRBD tienen mejor pronóstico que aquellos con LPSRDD, se plantea como objetivos principales de este estudio el determinar la supervivencia global y la supervivencia libre de enfermedad en aquellos pacientes afectos de sarcoma retroperitoneal, distinguiendo entre ambas entidades histopatológicas y comparándolas entre sí, además de analizar las características clínicas de los pacientes de la cohorte y de identificar otras variables independientes que puedan influir en su pronóstico.
MétodosSe diseña un estudio observacional y analítico mediante una cohorte histórica retrospectiva a la que se sigue prospectivamente. Esta cohorte la componen 32 pacientes intervenidos de LPSR primario de subtipos histológicos bien diferenciado y desdiferenciado de nuestro centro, entre enero de 2002 y mayo de 2019.
Todas las variables se obtuvieron retrospectivamente de informes clínicos, radiológicos, quirúrgicos, oncológicos y anatomopatológicos recogidos en el historial clínico de los pacientes, con la autorización formal del Comité de Ética para la Investigación Biomédica responsable, adoptando en todo momento las debidas consideraciones y condiciones indicadas por este organismo.
Las variables cualitativas consideradas para los análisis fueron: sexo (hombre/mujer), aparición de recidiva durante el estudio (sí/no), estatus vital (vivo/muerto), antecedentes médicos de otra neoplasia maligna (sí/no), afectación de bordes quirúrgicos del tumor primario (R0, libre/R1, afecto), recidiva precoz (aparición de recidiva en menos de 2 años tras extirpación del tumor primario; sí/no), presencia de metástasis (no/ganglionares/a distancia), resección visceral en la intervención del tumor primario (tumorectomía simple/nefrectomía/multivisceral con afectación de dos o más órganos) y tratamiento del tumor primario (cirugía/cirugía más quimioterapia adyuvante/cirugía más radioterapia adyuvante). Por su parte, las variables cuantitativas fueron: edad al diagnóstico (años), edad al exitus (años), número de recidivas, tamaño tumoral (diámetro máximo del tumor primario en cm), supervivencia global (años) y supervivencia libre de enfermedad (años).
Análisis estadísticoPara la comparación de proporciones entre las variables cualitativas se utilizaron tablas de contingencia y la prueba estadística de Ji cuadrado, o en su defecto, test exacto de Fisher cuando el tamaño muestral no permitiera aplicar el primero. Para la comparación de medias de las variables cuantitativas se utilizó la prueba t de Student, previa comprobación de distribución normal mediante Saphiro-Wilk; en los casos en los que no pudieron ser aplicados se recurrieron a pruebas no paramétricas, concretamente la U de Mann-Whitney.
Para el análisis de supervivencia global y del periodo libre de enfermedad se utilizaron estimaciones de Kaplan-Meier para resumir y representar las funciones de supervivencia y la prueba de log-rank para el análisis comparativo.
En todos los casos el contraste de hipótesis fue bilateral y se consideró estadísticamente significativo un valor de p<0,05.
Para realizar todos los cálculos y estimaciones estadísticas del estudio se utilizó el programa IBM® SPSS Statistics 25.
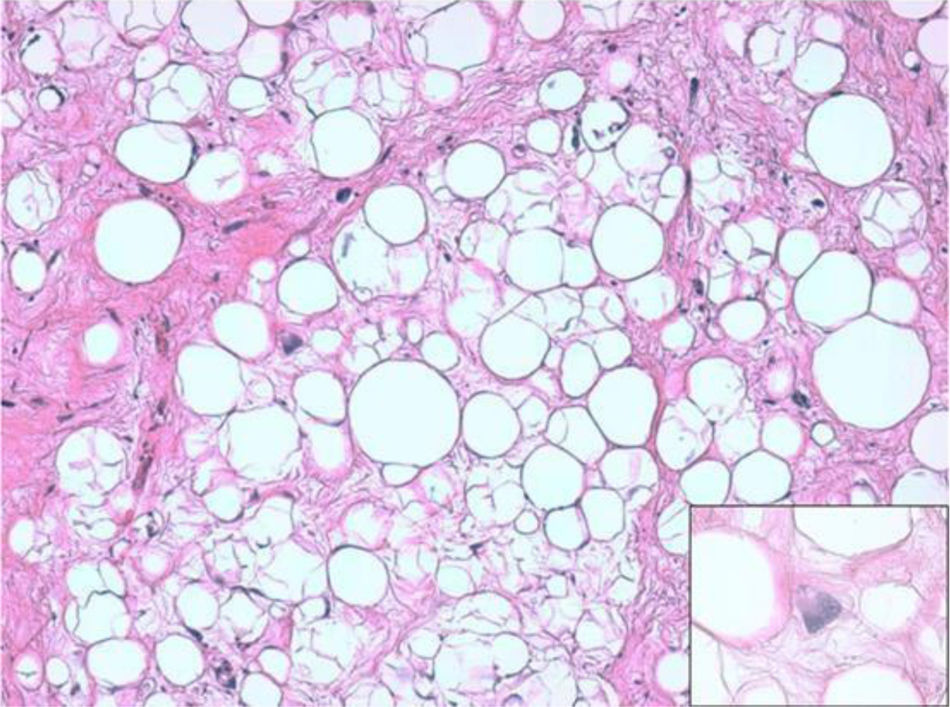
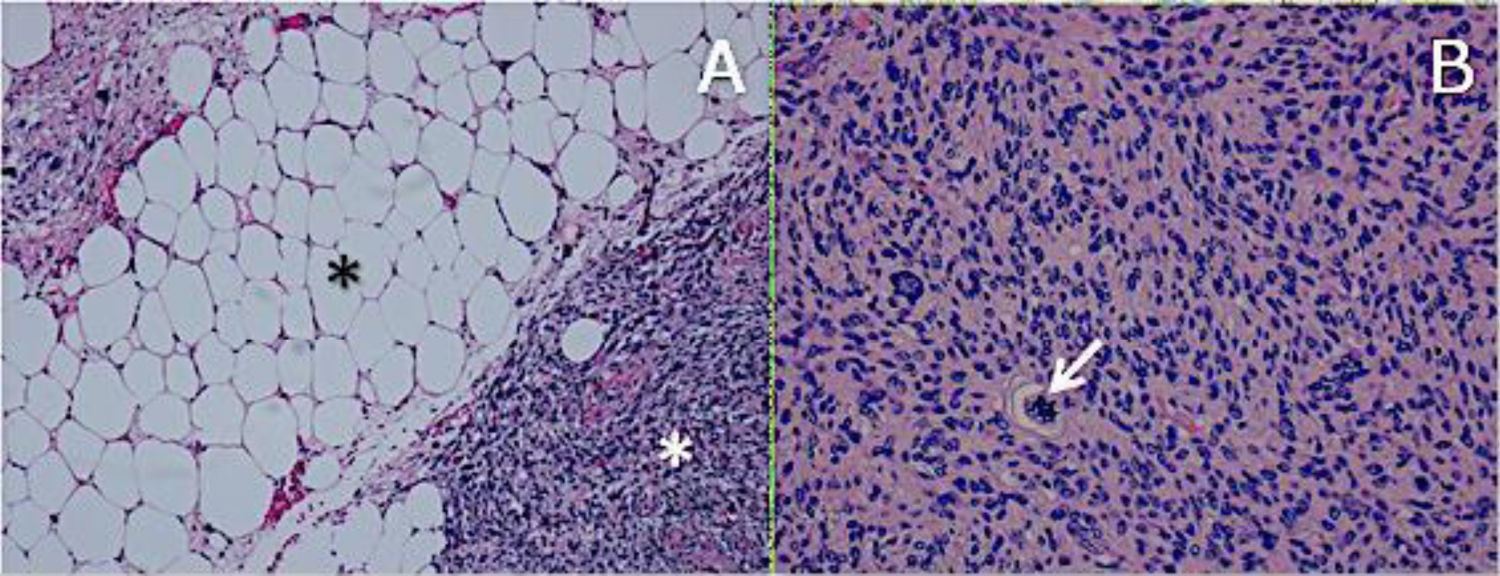
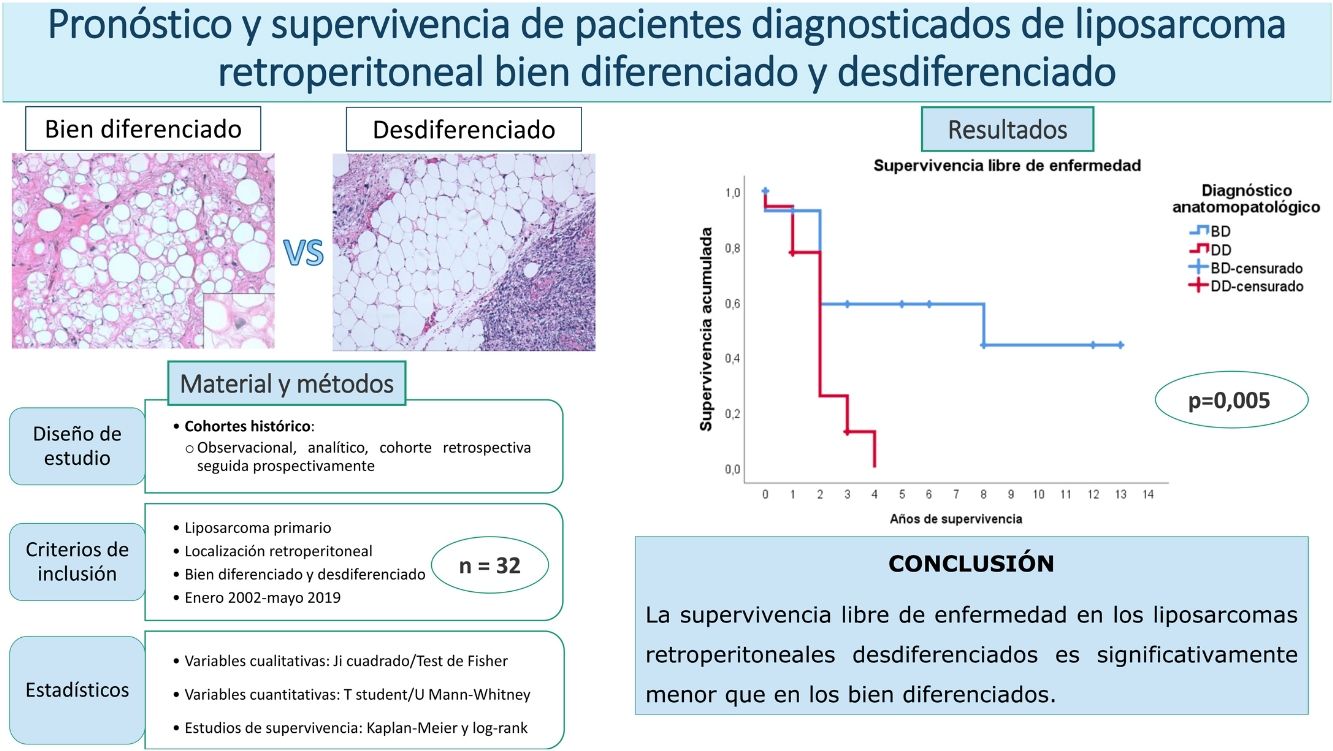
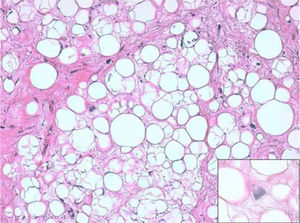
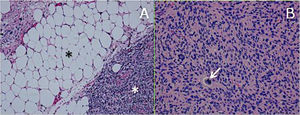
ResultadosHistológicamente, el LPSRBD (fig. 1) es una neoplasia lipogénica de malignidad intermedia constituida por adipocitos atípicos (con variabilidad en el tamaño, la forma y con núcleos hipercromáticos) y células estromales atípicas. Por el contrario, el LPSRDD (fig. 2) es una neoplasia lipogénica maligna, en la que existe una transición abrupta entre células lipogénicas atípicas y células sarcomatosas no lipogénicas con amplia variación del componente lipogénico.
A. Liposarcoma desdiferenciado H-E 100×. Transición abrupta de liposarcoma bien diferenciado (asterisco negro) a sarcoma no lipogénico de alto grado (asterisco blanco). B. Liposarcoma desdiferenciado H-E 200×. Sarcoma de alto grado con células pleomórficas y mitosis atípicas (flecha blanca).
Los datos descriptivos de la muestra vienen reflejados en las tablas 1 y 2. Al compararlas en función del subtipo histológico, las variables mantienen en general una distribución homogénea. Sin embargo, sí destaca que el tamaño tumoral fue mayor en el tipo desdiferenciado, siendo esta diferencia estadísticamente significativa. En relación con esto, puede apreciarse que los tumores de esta estirpe histológica requirieron intervenciones más agresivas, sobre todo en lo que a la nefrectomía se refiere, aunque sin encontrarse diferencias significativas.
Estudio descriptivo 1: variables cuantitativas. Expresadas según la mediana y análisis estadístico en función del diagnóstico histológico. Entre paréntesis, rango intercuartílico entre primer y tercer cuartil
| Total 32 | BD 14(43,8%) | DD 18(56,3%) | Valor p | |
|---|---|---|---|---|
| Edad al diagnóstico(años) | 57,50(50,3-67,8) | 59(48,8-68,5) | 56(50,8-66,8) | p=0,864 |
| Tamaño(cm) | 23,50(18,6-31,3) | 20,50(15,3-25,3) | 28(19,7-35,5) | p=0,013 |
| Edad muerte(años) | 63(56-84) | 62,50(48,5-75,8) | 63(56,5-86) | p=0,634 |
| Númerorecidivas | 1,5(0-2,8) | 0(0-2) | 2(1-3) | * |
BD: bien diferenciado; DD: desdiferenciado.
Resaltado en negrita, resultados estadísticamente significativos.
* No valorable mediante estos análisis estadísticos.
Estudio descriptivo 2: variables cualitativas y análisis estadístico en función del diagnóstico histológico
| Total 32 | BD 14(43,8%) | DD 18(56,3%) | Valor p | ||
|---|---|---|---|---|---|
| Sexo | Hombre | 11 (34,4%) | 5 (35,7%) | 6 (33,3%) | p=1,000 |
| Mujer | 21 (65,6%) | 9 (64,3%) | 12 (66,7%) | ||
| Márgenes quirúrgicos | Libres (R0) | 16 (50%) | 7 (50%) | 9 (50%) | p=1,000 |
| Afectos (R1) | 16 (50%) | 7 (50%) | 9 (50%) | ||
| Antecedentes de patología maligna | Sí | 4 (12,5%) | 1 (7,1%) | 3 (16,7%) | p=0,613 |
| No | 28 (87,5%) | 13 (92,9%) | 15 (83,3%) | ||
| Recidiva precoz (<2años) | Sí | 17 (53,1%) | 5 (35,7%) | 12 (66,7%) | p=0,121 |
| No | 11 (34,4%) | 7 (50%) | 4 (22,2%) | ||
| Resección visceral | A: No | 6 (18,8%) | 5 (35,7%) | 1 (5,6%) | A vs. B: p=0,060A vs. C: p=0,138B vs. C:p=1,000 |
| B: Riñón | 18 (56,3%) | 6 (42,9%) | 12 (66,7%) | ||
| C: Multivisceral | 8 (25,0%) | 3 (21,4%) | 5 (27,8%) | ||
| Tratamiento | Qx | 23 (71,9%) | 11 (78,6%) | 12 (66,7%) | - |
| Qx+QT | 4 (12,5%) | 1 (7,1%) | 3 (16,7%) | ||
| Qx+RT | 5 (15,6%) | 2 (14,3%) | 3 (16,7%) | ||
| Metástasis | No | 30 (93,8%) | 13 (92,9%) | 17 (94,4%) | * |
| Ganglionar | 1 (3,1%) | 1 (7,1%) | 0 | ||
| Visceral | 1 (3,1%) | 0 | 1 (5,6%) | ||
| Recidiva | Sí | 21 (65,6%) | 6 (42,9%) | 15 (83,3%) | * |
| No | 11 (34,4%) | 8 (57,1%) | 3 (16,7%) | ||
| Estatus | Vivo | 17 (53,1%) | 8 (57,1%) | 9 (50%) | * |
| Muerto | 15 (46,9%) | 6 (42,9%) | 9 (50%) |
BD: bien diferenciado; DD: desdiferenciado; Qx: cirugía; QT: quimioterapia; RT: radioterapia.
* No valorable mediante estos análisis estadísticos.
Aunque se han presentado en el estudio descriptivo, las variables señaladas con un asterisco (*) dependen del factor tiempo para desarrollarse, que no es homogéneo para todos los pacientes, por lo que no pueden ser analizadas mediante los estadísticos previos y para ello se utilizarán estudios de supervivencia. Puede intuirse, no obstante, que los pacientes con fenotipo desdiferenciado presentaron recidiva en un porcentaje mayor, siendo estas además más precoces y numerosas, aunque estos datos deben analizarse con cautela debido al sesgo anteriormente comentado.
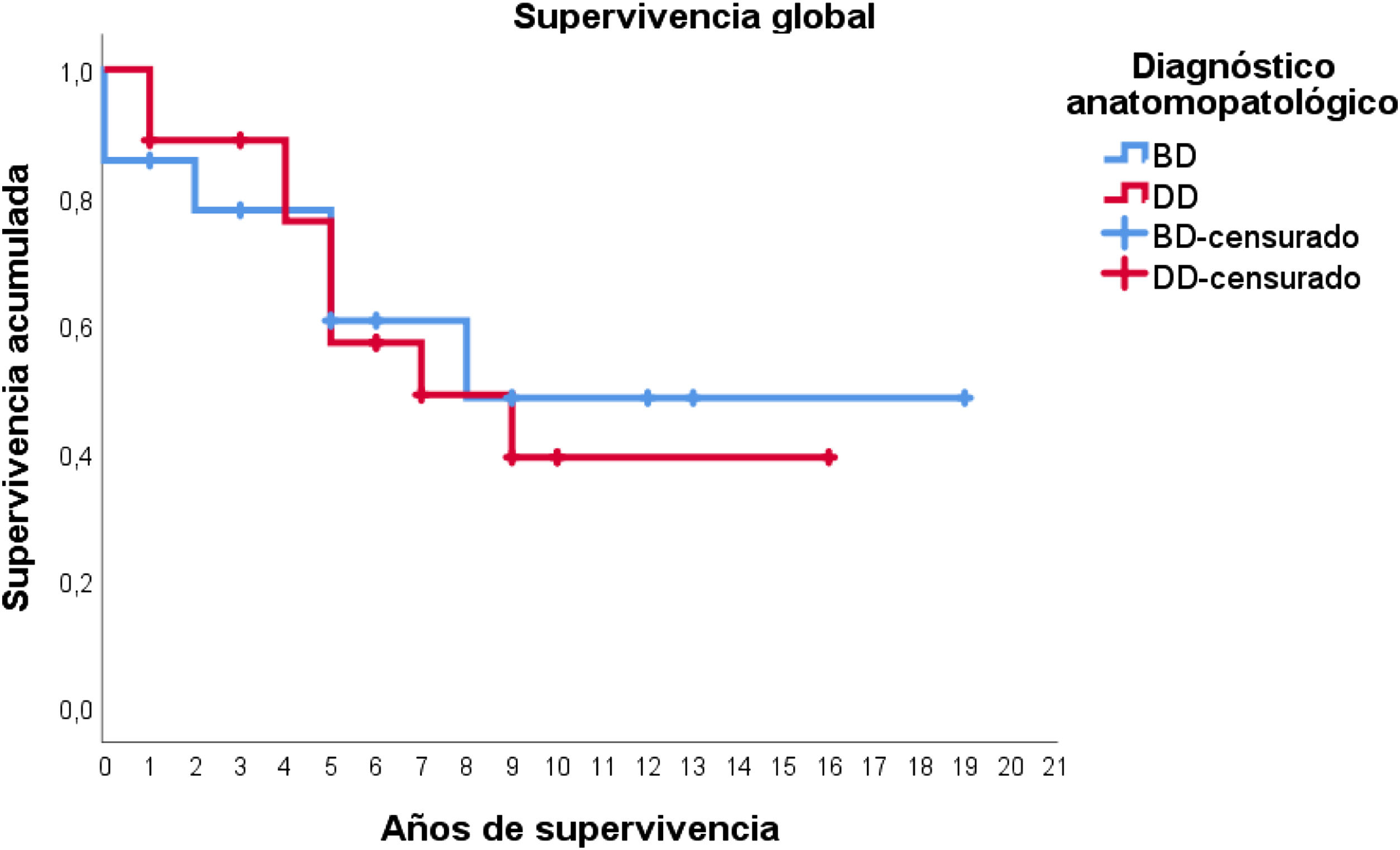
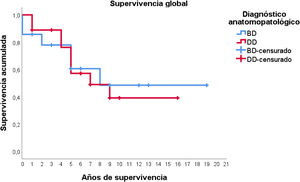
Con respecto a los estudios de supervivencia, la media estimada de supervivencia global fue de 10,8 años (IC95%: 7,9-13,6), con una supervivencia a los 5 años del 59%, aproximadamente. Los pacientes diagnosticados de LPSRBD tuvieron una media de supervivencia estimada de 11,2 años (IC95%: 6,7-15,7), mientras que en el subtipo desdiferenciado la media fue de 9,3 años (IC95%: 6,4-12,2). Como puede apreciarse en la figura 3, ambas curvas de supervivencia son similares, no encontrándose diferencias significativas en la comparación mediante la prueba de log-rank (p=0,834).
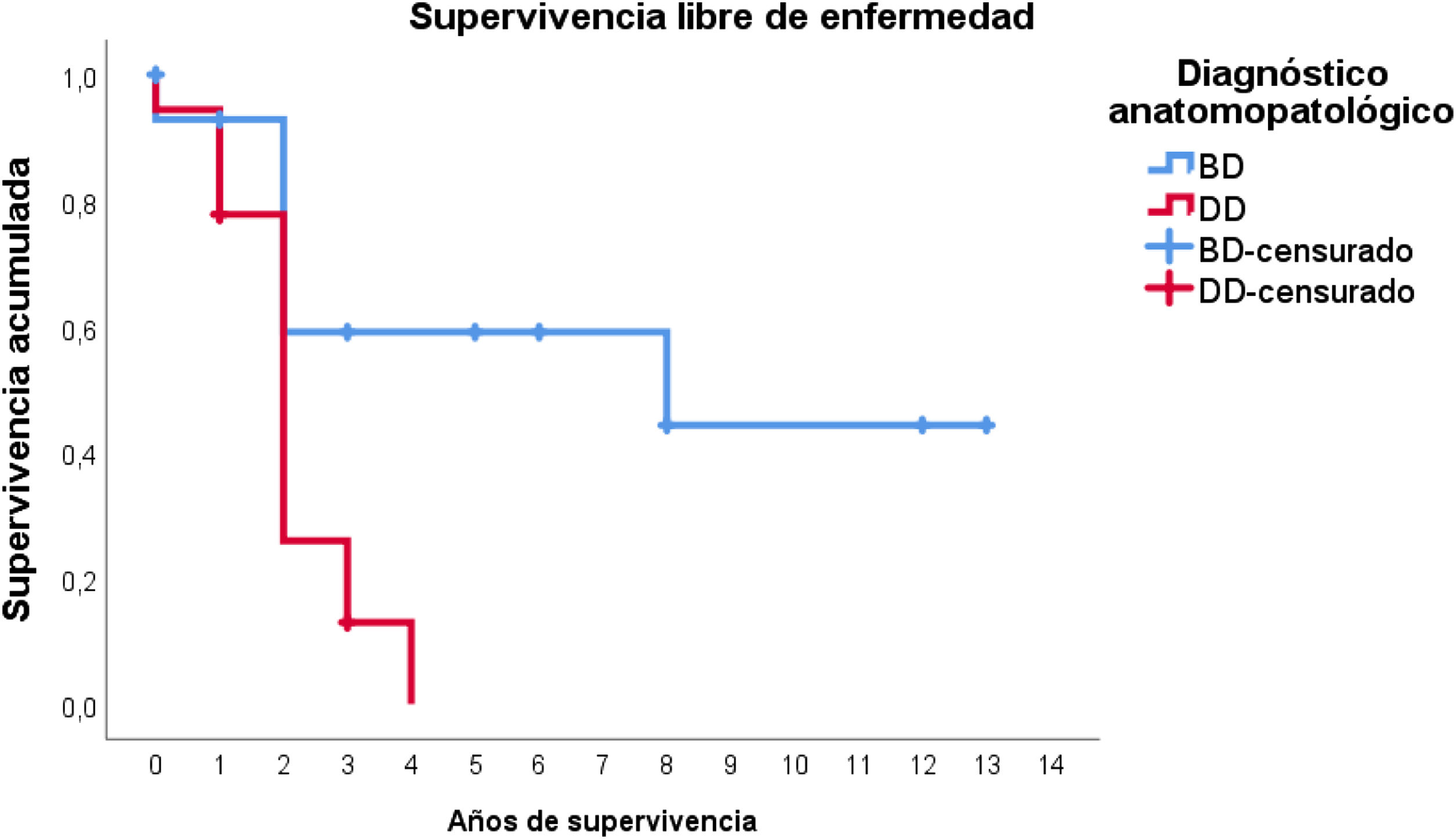
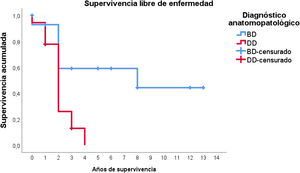
Por otra parte, en lo que respecta a la supervivencia libre de enfermedad, globalmente la media estimada fue de 4,7 años (IC95%: 2,9-6,5). No obstante, la distribución en función del tipo histológico es muy diferente: en el LPSRBD la media de la supervivencia libre de enfermedad fue de 7,6 años (IC95%: 4,6-10,7), mientras que en el LPSRDD la media fue de tan solo 2,1 años (IC95%: 1,6-2,6).
En este caso, puede observarse (fig. 4) que las curvas de supervivencia difieren globalmente en su morfología, resultando estas diferencias estadísticamente significativas según la prueba de log-rank (p=0,005). En los pacientes con tumores desdiferenciados en ningún caso se superaron los 4 años de seguimiento sin que apareciera recidiva; de hecho, tan solo 3 pacientes de este grupo terminaron el estudio sin presentarla. Por el contrario, del grupo de pacientes con tumores bien diferenciados tan solo un paciente presentó una recidiva tardía más allá de los 2 años de seguimiento (a los 8 años). Esto conlleva que la supervivencia libre de enfermedad a los 2 años sea del 59% en los bien diferenciados, mientras que en los desdiferenciados ascienda a apenas el 26%, aproximadamente.
Con respecto a las otras variables estudiadas, ninguna parece influir significativamente en la supervivencia global ni en la supervivencia libre de enfermedad. No se ha realizado el análisis de supervivencia de las variables «metástasis» ni de «antecedentes médicos de otros procesos malignos» debido al reducido número de casos.
DiscusiónDesde un punto de vista sociodemográfico, nuestra cohorte presenta una mediana de edad similar a otros grupos publicados pero con una prevalencia ligeramente superior de mujeres21. Además, la presencia de patología maligna previa solamente se evidencia en 4 pacientes, sin existir en ningún caso asociación entre el tipo de tumor previo y la aparición de LPRS. Aunque la aparición de sarcomas está descrita como una complicación de la radioterapia, el liposarcoma es excepcional en estos casos, predominando otras estirpes celulares y en localizaciones distintas al retroperitoneo22.
Histopatológicamente, el LPSRDD fue el más frecuente, lo que contrasta con otros grupos, fundamentalmente anglosajones9,10, siendo más coincidentes con las series españolas3,11. Así mismo, nuestros datos concuerdan con una recurrencia mayor y otorgan potencia estadística a la afirmación de que subtipos histológicos peor diferenciados confieren un pronóstico más sombrío, ya que en el grupo de LPRPDD ningún paciente superó los 4 años de estudio sin presentar recidiva.
Por otra parte, en 4 de los casos estudiados se produjeron recurrencias de la enfermedad muy precoces, con tipos histológicos que habían progresado en grado de malignidad y evolucionado en tipo histológico, y que requirieron a posteriori confirmación molecular del diagnóstico emitido con las tinciones de rutina. Actualmente, las técnicas de patología molecular constituyen una herramienta esencial en el manejo de estos casos8,23, y en otros trabajos publicados del grupo de Gronchi24 ya se plantea la necesidad de tipificar molecularmente tumores primarios con evolución desfavorable.
Diversos grupos han estudiado el efecto de la recurrencia precoz y lo han relacionado con una menor supervivencia global3,5,9. Sin embargo, esto no ha podido ser demostrado en nuestro estudio; si bien la supervivencia global a los 5 años fue del 53% en el grupo con recurrencia precoz (en menos de 2 años) frente al 75% del grupo sin ella, estas diferencias no resultaron estadísticamente significativas.
Dado que los LPSR son tumores que pueden alcanzar un gran tamaño, la intención quirúrgica implica resecciones viscerales extensas para obtener márgenes quirúrgicos amplios libres de tumor, ya que es uno de los factores de mejor pronóstico en todas las series publicadas al aumentar la supervivencia libre de enfermedad20,25. En este sentido, un 25% de los pacientes incluidos en este estudio requirieron resección multivisceral, y en solo un 19% se realizó escisión simple del tumor sin resecar ningún órgano, de los cuales solamente uno era de estirpe desdiferenciada. Pese a que estos datos son interesantes, existiendo consenso en que una cirugía adecuada en un centro especializado es el tratamiento más eficaz, no hay una extensión de tumor definida a extirpar para garantizar R019,20,26. En nuestro desarrollo experimental los pacientes con amplias resecciones tumorales que incluyeron riñón o más vísceras no implicaron mejoras estadísticamente significativas en los estudios de supervivencia. No obstante, se deben manejar estos resultados con cautela, ya que las resecciones más agresivas se realizaron en mayor medida en tumores histológicamente desfavorables. Así mismo, hay que tener en consideración las complicaciones derivadas de la extirpación renal: 2 de nuestros pacientes desarrollaron insuficiencia renal terminal, aunque no hemos encontrado estudios que evalúen este hecho en otras cohortes.
Acompañando a estos datos, hay que indicar que el estudio microscópico de los márgenes quirúrgicos reveló una afectación tumoral de estos en el 50% de los casos, correspondiendo el mismo porcentaje del 50% entre tumores bien diferenciados y desdiferenciados. Gronchi et al.25 y Chouliaras et al.26 han demostrado que obtener márgenes quirúrgicos libres está asociado a un mejor pronóstico. Sin embargo, en nuestro estudio las estimaciones de supervivencia no muestran diferencias significativas entre ambas curvas.
Aunque hay disparidad en los trabajos publicados, parece que el tratamiento radioterápico puede ser más positivo que el quimioterápico, tal y como se ha evidenciado en estudios con grandes tamaños muestrales12,13. En nuestro estudio fueron pocos los pacientes tratados con radioterapia o quimioterapia adyuvante en el tratamiento del tumor primario (4 y 5 pacientes, respectivamente), reservándose la adyuvancia para las recidivas en la mayoría de los casos. Además, la decisión de aplicar terapia adyuvante se debió a tumores difíciles de resecar y con amplia afectación de los márgenes quirúrgicos, en los que los resultados de la cirugía no fueron satisfactorios. Por todo ello, con estos datos no es posible extrapolar conclusiones al respecto, siendo necesarios ensayos dirigidos con mayor tamaño muestral y un diseño más adecuado.
Entre las limitaciones de nuestro estudio hay que indicar que el tamaño muestral no fue muy elevado, lo que implica una limitación a la hora de aplicar pruebas estadísticas para demostrar diferencias significativas (aumento de error tipo II). Además, la revisión retrospectiva tiene tendencia natural al sesgo. Estos hechos nos impiden establecer determinadas conclusiones firmes extrapolables con respecto a los factores pronósticos y de supervivencia, por lo que los resultados deben ser tomados siempre con cautela y como una aproximación, debiendo comprobarse con otros trabajos con metodología más apropiada.
En definitiva, el único factor estudiado que modificó significativamente el pronóstico de estos pacientes fue el subtipo histológico del tumor. Es por ello por lo que planteamos que los factores histopatológicos intrínsecos al tumor son fundamentales y condicionan en gran medida los resultados de la cirugía con intención curativa; por tanto, su adecuado diagnóstico histológico es de vital importancia en el manejo terapéutico de estos pacientes. No obstante, son necesarios más estudios para unificar criterios en el manejo diagnóstico y terapéutico de estos tumores que permitan aumentar la supervivencia y reducir la morbimortalidad de estos pacientes, ya que, de momento, los liposarcomas siguen teniendo por lo general un pronóstico sombrío.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos manifestar nuestro más sincero agradecimiento al Prof. Dr. D. José Peña Amaro, catedrático de Histología de la Universidad de Córdoba, por sus consejos en la redacción de este trabajo y por marcar un camino sin la menor injerencia; y a doña Concepción Cabello Laguna, celadora de autopsias del Servicio de Anatomía Patológica del Hospital Universitario Reina Sofía de Córdoba, por la ayuda prestada en la búsqueda de los casos incluidos en este estudio.