La asociación de ileostomía disminuye la gravedad de las complicaciones tras anastomosis rectal baja pero puede alargar la estancia postoperatoria. El objetivo del presente estudio es averiguar si un estoma derivativo modifica la estancia postoperatoria o las complicaciones, en pacientes intervenidos bajo un régimen de rehabilitación multimodal perioperatoria (RHMM).
MétodosAnalizamos a 104 pacientes intervenidos de resección con anastomosis por adenocarcinoma rectal con cuidados de RHMM: 66 varones y 38 mujeres, mediana de edad de 64 años (RIQ: 55-75). En el grupo A, se incluyó a los que se asoció ileostomía derivativa y en el B a aquellos sin ileostomía.
ResultadosGrupo A = 58, grupo B = 46 pacientes sin diferencias en edad, ASA, IMC, factores de riesgo, ni en el tipo de abordaje, laparoscópico en un 34%, si bien hubo más neoadyuvancia en el grupo A: 77,5 frente a 36,9%. En este grupo, la intervención habitual fue la exéresis total del mesorrecto (96%) y en el B la subtotal (90%). No hubo diferencias en las complicaciones postoperatorias (34,4 frente a 28,2%; p = 0,322) ni en la de dehiscencias anastomóticas (8,3 frente a 10,8%; p = 0,475), o íleo prolongado (20,7 frente a 10,9%; p = 0,140). Tampoco las hubo en la estancia postoperatoria (7,9 frente a 6,9 días; p = 0,058), reingresos (7 frente a 13,6%; p = 0,22), o en la estancia total incluyendo reingresos (8,4 frente a 9,1 días; p = 0,49).
ConclusionesLa asociación de una ileostomía no alarga la EP ni incrementa las complicaciones en pacientes intervenidos de resección rectal en régimen de RHMM.
The association of a loop ileostomy decreases the severity of complications after rectal surgery but can increase the postoperative stay. The aim of this study is to investigate if a diverting ileostomy influences the postoperative outcomes in a series of patients included in a multimodal rehabilitation program (MMRP).
MethodsWe analyzed a series of 104 patients that underwent elective surgery with primary anastomosis for rectal adenocarcinoma using a MMRP: 66 men and 38 women, with a median age of 64 (IQR: 55-75) years. Group A included patients with an associated loop ileostomy, and Group B, those without a protective stoma.
ResultsGroup A = 58, group B = 46 patients without differences in age, ASA, BMI and other risk factors, nor in the surgical approach (laparoscopic in 34%), although there were more neoadjuvant treatments in group A: 77.5 vs. 36.9%; P=.001. In group A, the most common operation was total mesorectal excision (96%) and in the B, a subtotal mesorectal excision (90%). There were no differences in postoperative complications (Group A 34.4 vs. group B28.2%; P=.322), anastomotic leaks (8.3 vs. 10.8%; P=.475), or postoperative ileus (20.7 vs. 10.9%; P=.140), neither in postoperative stay (7.9 vs. 6.9 days; P= .058, readmissions (7 vs. 13.6%; P= .22), or postoperative stay, including readmissions (8.4 vs. 9.1 days; P= .49).
ConclusionsThe association of a loop ileostomy does not extend the length of stay nor increases the rate of complications in patients that underwent a rectal resection with anastomosis included in a MMRP.
La resección con anastomosis es la técnica más empleada actualmente en el tratamiento quirúrgico del cáncer de recto, consiguiendo preservarse la función esfinteriana anal en más del 70% de casos1. Sin embargo, cuanto más baja es una anastomosis, mayor es la tasa de dehiscencias anastomóticas, y la realización de un estoma derivativo (generalmente una ileostomía) reduce su morbilidad2–4, aunque se ha referido que incrementa la estancia postoperatoria5. Dado que la cirugía colorrectal ha estado entre las primeras en la implementación de los cuidados perioperatorios incentivados de forma estandarizada, con la consiguiente reducción en complicaciones y estancias6–9, cabe preguntarse si la realización de un estoma derivativo interfiere con la evolución y estancia postoperatoria en pacientes intervenidos mediante cirugía de cáncer de recto cuando se siguen estos cuidados, siendo el objetivo de nuestro estudio.
MétodosAnalizamos retrospectivamente una base de datos prospectiva de pacientes operados electivamente efectuando una anastomosis primaria colorrectal o coloanal por adenocarcinoma de recto desde enero de 2007 hasta noviembre de 2011. Todos los pacientes fueron intervenidos quirúrgicamente en 2 centros de referencia (uno de ellos universitario), por el mismo equipo quirúrgico. Los pacientes fueron divididos en un grupo A formado por aquellos pacientes a los que se asoció un estoma y en un grupo B, por aquellos sin estoma.
Realizamos el cálculo del tamaño muestral asumiendo que los pacientes con estoma asociado tendrían una estancia 2 días superior por término medio a aquellos sin estoma. Así, considerando un 5% de significación estadística con una potencia del 80% se requerían unos 50 pacientes por brazo.
Todos los pacientes siguieron un protocolo de rehabilitación multimodal perioperatoria (RHMM) y una vía clínica previamente aprobados por el Comité Ético de Investigación clínica local (tabla 1), y la información específica acerca de la posibilidad de realización de un estoma y su marcado fue dada respectivamente por un cirujano colorrectal y por un estomaterapeuta. Las intervenciones fueron realizadas o supervisadas directamente por cirujanos con dedicación específica a la coloproctología (European Board). Se excluyó del estudio a los pacientes a los que se les realizó una amputación abdominoperineal, una intervención de Hartmann o microcirugía endoscópica transanal. El estoma se realizó cuando se hizo una escisión total del mesorrecto (ETM) y, a criterio del cirujano, cuando se estimó un riesgo aumentado de dehiscencia de sutura.
Componentes del protocolo de RHMM
| • Información preoperatoria de los cuidados perioperatorios y específica del estoma |
| • Preparación de colon anterógrada solamente si se prevé efectuar un estoma derivativo. En el resto, enema de limpieza |
| • Profilaxis antibiótica y de la enfermedad tromboembólica venosa |
| • Reducción del impacto de la anestesia general y prevención del estrés quirúrgico |
| • Ingesta preoperatoria de glucosa (no constante) |
| • Anestésicos con mínimo efecto residual postoperatorio |
| • Optimización de la fluidoterapia (1.500ml/24 h en el postoperatorio) |
| • Mantenimiento de la normotermia |
| • Técnicas mínimamente invasivas (incisiones pequeñas, laparoscopia) |
| • No empleo de sonda nasogástrica |
| • Analgesia perioperatoria multimodal |
| • No empleo de opiáceos |
| • Analgesia epidural (excepto en abordaje laparoscópico) |
| • Reanudación de la ingesta oral en las primeras 12 h |
| • Incentivación respiratoria |
| • Movilización precoz |
| • Control diario del estoma por estomaterapeuta |
RHMM: rehabilitación multimodal.
Se obtuvieron de forma prospectiva datos generales demográficos, comorbilidades, variables relacionadas con el tumor, parámetros operatorios, morbilidad y duración de la estancia. Dichos datos se recogieron y analizaron usando el programa estadístico SPSS (versión 20) para Windows (SPSS Inc., Chicago, IL, EE. UU.). El análisis estadístico se efectuó mediante el test de la t de Student para datos independientes o el de la U de Mann-Whitney para variables numéricas, según fuese apropiado, y el test de chi-cuadrado o el exacto de Fisher para variables cualitativas. Se consideró un valor de p<0,05 como estadísticamente significativo.
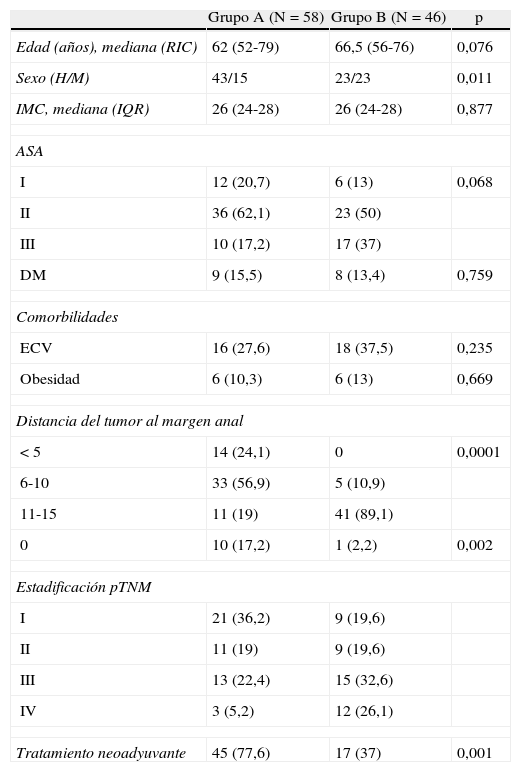
ResultadosSe incluyó un total de 104 pacientes, 66 (66,3%) hombres y 38 (37%) mujeres, de una mediana de edad de 64 (RIC: 55-75) años. Realizamos una ileostomía asociada en 58 (65%) de casos (tabla 2). Hubo significativamente más varones en el grupo A y en este grupo la anastomosis fue significativamente más baja. Hubo más pacientes con enfermedad metastásica en el grupo sin estoma (B), y este grupo recibió asimismo menos terapia neoadyuvante.
Características de los pacientes y tumores
| Grupo A (N=58) | Grupo B (N=46) | p | |
| Edad (años), mediana (RIC) | 62 (52-79) | 66,5 (56-76) | 0,076 |
| Sexo (H/M) | 43/15 | 23/23 | 0,011 |
| IMC, mediana (IQR) | 26 (24-28) | 26 (24-28) | 0,877 |
| ASA | |||
| I | 12 (20,7) | 6 (13) | 0,068 |
| II | 36 (62,1) | 23 (50) | |
| III | 10 (17,2) | 17 (37) | |
| DM | 9 (15,5) | 8 (13,4) | 0,759 |
| Comorbilidades | |||
| ECV | 16 (27,6) | 18 (37,5) | 0,235 |
| Obesidad | 6 (10,3) | 6 (13) | 0,669 |
| Distancia del tumor al margen anal | |||
| < 5 | 14 (24,1) | 0 | 0,0001 |
| 6-10 | 33 (56,9) | 5 (10,9) | |
| 11-15 | 11 (19) | 41 (89,1) | |
| 0 | 10 (17,2) | 1 (2,2) | 0,002 |
| Estadificación pTNM | |||
| I | 21 (36,2) | 9 (19,6) | |
| II | 11 (19) | 9 (19,6) | |
| III | 13 (22,4) | 15 (32,6) | |
| IV | 3 (5,2) | 12 (26,1) | |
| Tratamiento neoadyuvante | 45 (77,6) | 17 (37) | 0,001 |
Los datos son números con porcentajes entre paréntesis salvo cuando se indica.
DM: diabetes mellitus; ECV: enfermedades cardiovasculares; H: hombre; IMC: índice de masa corporal; M: mujer; RIC: rango intercuartil.
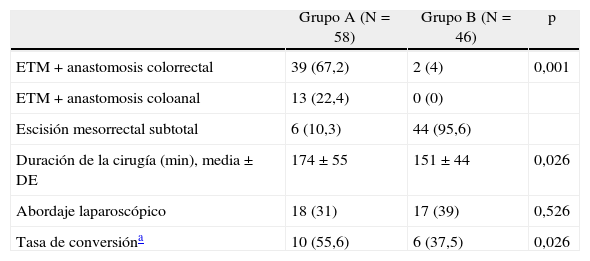
Se efectuó una ETM en 52 (89,6%) pacientes del grupo A vs. 2 (4,3%) del grupo B; p<0,001. Se efectuó un abordaje laparoscópico en 35 (34%) de pacientes, sin diferencias entre grupos con relación a la tasa de conversión. La duración de la intervención fue ligeramente menor en el grupo sin ileostomía derivativa (tabla 3).
Variables quirúrgicas
| Grupo A (N=58) | Grupo B (N=46) | p | |
| ETM+anastomosis colorrectal | 39 (67,2) | 2 (4) | 0,001 |
| ETM+anastomosis coloanal | 13 (22,4) | 0 (0) | |
| Escisión mesorrectal subtotal | 6 (10,3) | 44 (95,6) | |
| Duración de la cirugía (min), media±DE | 174±55 | 151±44 | 0,026 |
| Abordaje laparoscópico | 18 (31) | 17 (39) | 0,526 |
| Tasa de conversióna | 10 (55,6) | 6 (37,5) | 0,026 |
Los datos son números con porcentajes entre paréntesis.
DE: desviación estándar; ETM: escisión total del mesorrecto.
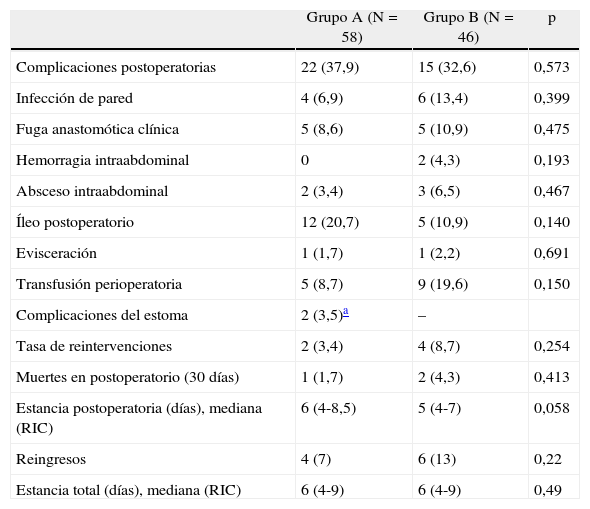
No hubo diferencias estadísticamente significativas entre grupos respecto a la mortalidad perioperatoria, complicaciones globales, tasa de fugas anastomóticas, infecciones de pared ni intraabdominales, íleo postoperatorio ni reintervenciones. La mediana de estancia postoperatoria fue de 6 días en el grupo A frente a 5 del grupo B, sin diferencias significativas (tabla 4). Tampoco las hubo con relación a la tasa de reingresos o estancia postoperatoria global, incluyendo la de dichas readmisiones. Las causas más comunes de reingresos fueron abscesos pélvicos, suboclusión intestinal e infección de pared abdominal.
Resultados perioperatorios
| Grupo A (N=58) | Grupo B (N=46) | p | |
| Complicaciones postoperatorias | 22 (37,9) | 15 (32,6) | 0,573 |
| Infección de pared | 4 (6,9) | 6 (13,4) | 0,399 |
| Fuga anastomótica clínica | 5 (8,6) | 5 (10,9) | 0,475 |
| Hemorragia intraabdominal | 0 | 2 (4,3) | 0,193 |
| Absceso intraabdominal | 2 (3,4) | 3 (6,5) | 0,467 |
| Íleo postoperatorio | 12 (20,7) | 5 (10,9) | 0,140 |
| Evisceración | 1 (1,7) | 1 (2,2) | 0,691 |
| Transfusión perioperatoria | 5 (8,7) | 9 (19,6) | 0,150 |
| Complicaciones del estoma | 2 (3,5)a | – | |
| Tasa de reintervenciones | 2 (3,4) | 4 (8,7) | 0,254 |
| Muertes en postoperatorio (30 días) | 1 (1,7) | 2 (4,3) | 0,413 |
| Estancia postoperatoria (días), mediana (RIC) | 6 (4-8,5) | 5 (4-7) | 0,058 |
| Reingresos | 4 (7) | 6 (13) | 0,22 |
| Estancia total (días), mediana (RIC) | 6 (4-9) | 6 (4-9) | 0,49 |
Los datos son números con porcentajes entre paréntesis.
RIC: rango intercuartil.
Los cuidados perioperatorios incentivados, RHMM o fast-track, son un conjunto de medidas orientadas a reducir la morbilidad y estancias hospitalarias7. De hecho, pueden mejorar los resultados de forma notable, haciendo tambalear muchas actitudes basadas en la tradición quirúrgica8–10.
La cirugía colorrectal ha sido una de las áreas de la cirugía en las que se ha iniciado este tipo de actuaciones, debido a su prevalencia, a su repercusión en costos y estancias y a la potencial capacidad de actuar reduciendo complicaciones en este campo11–13. En concreto, la del cáncer de recto es además el paradigma del cambio tanto por la capacitación y especialización de los cirujanos como por la importancia de un grupo multidisciplinar en su tratamiento14.
Es conocido el riesgo de fallos de sutura y fístulas anastomóticas conforme la anastomosis colorrectal es más distal, por lo que existe un cuerpo de doctrina que avala la protección de dicha anastomosis con un estoma derivativo, que no reduce la frecuencia de fugas sino que disminuye su morbilidad asociada2–4. Sin embargo, la práctica de un estoma no está exenta de complicaciones específicas que pueden incrementar la estancia hospitalaria y las complicaciones globales5.
Nuestra hipótesis de trabajo es, sin embargo, que con la asociación de un programa de RHMM, y en el seno de un grupo multidisciplinario con cirujanos y estomaterapeuta especialmente dedicados, la morbilidad y las estancias hospitalarias no se ven influidas por una cirugía que incluya un estoma.
Para analizarlo, estudiamos 2 cohortes de pacientes, obtenidos de una base de datos prospectiva, intervenidos mediante resección anterior de recto y anastomosis por cirujanos especializados en cirugía colorrectal. En los del primer grupo se había efectuado una ileostomía derivativa y en el segundo, no. Ello lleva implícito un sesgo inherente a la mayor gravedad potencial de la cirugía en los pacientes del primero ya que, por protocolo, se asoció el estoma en los casos en los que se realizó una ETM y, por tanto, la anastomosis más baja y, además, cuando existieron dudas de su integridad si la exéresis mesorrectal fue subtotal; pero además, este grupo de pacientes recibió quimiorradioterapia neoadyuvante en un porcentaje muy superior ya que uno de los criterios para administrarla es que el tumor esté bajo la reflexión peritoneal, lo que grava a los pacientes del primer grupo. Sin embargo, el hecho de que no hubiese diferencias en el riesgo quirúrgico (ASA) entre ambos grupos, en su índice de masa corporal o en el porcentaje de abordaje laparoscópico en ambos, hace que las muestras de pacientes puedan ser comparables.
No solamente Cartmell et al.5 evidenciaron un incremento de estancias empleando un estoma derivativo. También en 2006, King et al. compararon la cirugía colorrectal abierta frente a la laparoscópica y el impacto de la creación de un estoma en la estancia hospitalaria, concluyendo que este alargaba 3-4 días el postoperatorio ingresado, independientemente de la técnica empleada o de si se había usado un protocolo de RHMM15 si bien este trabajo no analizaba específicamente pacientes con cáncer de recto. Tanto en nuestro estudio como en el recientemente publicado por Wignett et al.16, la realización de un estoma no afectó las estancias ni las complicaciones, readmisiones o tasa de fugas anastomóticas. Quizás la combinación de la RHMM con una atención específica y continuada por el estomaterapeuta como se efectúa en nuestra práctica, pueda influir en la reducción de estancias en este grupo al igual que refirieron en la Cleveland Clinic17 o más recientemente Younis et al.18, concluyendo que el retraso en el alta hospitalaria secundario al manejo del estoma puede reducirse de forma significativa mediante un programa de RHMM. También Chaudhri et al. compararon la información convencional con la específica pre- y postoperatoria respecto al estoma por el profesional especializado y concluyeron que esta reducía la estancia en 2 días19.
La tasa de readmisiones ha sido sujeto de debate, ya que un alta demasiado precoz podría aumentarlas. Sin embargo, tanto en las revisiones sistemáticas de la literatura8–12 como en nuestro propio estudio, no ha habido diferencias entre los grupos y ello, considerando el sesgo de mayor riesgo potencial de dehiscencia anastomótica en el grupo sujeto a ileostomía por la mayor frecuencia de empleo en él de la quimiorradioterapia y de que necesariamente se trate de anastomosis más bajas2–4,20. Evidentemente, los pacientes con estoma deberán ser readmitidos más adelante para su cierre, lo que genera una estancia hospitalaria añadida, riesgos particulares y costes adicionales. Sin embargo, la reducción de la gravedad de las complicaciones anastomóticas compensa estas desventajas21. Así, solamente el 3,4% de pacientes del grupo con estoma precisó una reintervención en el postoperatorio frente al 8,7% cuando esta no se efectuó.
Nuestra tasa de mortalidad, fugas anastomóticas y morbilidad global es similar a la de otras series de la literatura15–17,22–25 y el empleo actual de protocolos de fast-track está más que justificado, habida cuenta de las ventajas clínicas que ofrecen y, como nuestra serie evidencia, la estancia global de los pacientes, con una mediana de 6 días, es prácticamente la mitad que la objetivada en un estudio reciente de la Asociación Española de Cirujanos26.
En conclusión, la adición de un estoma de protección en las anastomosis colorrectales de más riesgo no implica un incremento de estancias operatorias ni complicaciones cuando se efectúa en el seno de un programa de RHMM.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.