La seguridad y los resultados oncológicos de los pacientes tratados con stents cólicos como puente a la cirugía (PAC) son controvertidos. El objetivo de este estudio es evaluar los efectos sobre los resultados quirúrgicos y oncológicos de los stents como PAC de las neoplasias colorrectales oclusivas potencialmente resecables.
MétodosAnálisis retrospectivo de los pacientes intervenidos por neoplasia colorrectal oclusiva potencialmente resecable con o sin enfermedad a distancia entre septiembre de 2002 y octubre de 2015, comparando los pacientes tratados con stent como PAC (grupo Stent) con los intervenidos de forma urgente (grupo Cirugía).
ResultadosVeinte pacientes fueron intervenidos directamente, mientras que se intentó la colocación de un stent en 57 pacientes. En el grupo Stent hubo más intervenciones laparoscópicas (64,9 vs. 5%, p<0,001), más anastomosis primarias (91,2 vs. 55%, p=0,001), menos estomas (10,5 vs. 50%, p=0,001) y una estancia postoperatoria más corta (7 vs. 12 días, p=0,014). La morbilidad a los 30 días fue menor en el grupo Stent, pero no de forma significativa (29,8 vs. 50%, p=0,104), aunque sí lo fue la mortalidad (1,8 vs. 20%, p=0,015). Respecto a los resultados oncológicos, no se encontraron diferencias significativas al comparar la supervivencia global, el intervalo libre de enfermedad, la supervivencia libre de recidiva local o a distancia ni la supervivencia libre de progresión.
ConclusionesLa utilización de stents cólicos como PAC de las neoplasias colorrectales oclusivas potencialmente resecables parece proporcionar mejores resultados quirúrgicos y resultados oncológicos equiparables a los de los pacientes intervenidos directamente.
The outcomes of patients treated with colonic stents as a bridge to surgery (BTS) have recently been questioned in terms of safety and long-term oncologic outcomes. The aim of this study is to evaluate the effects on surgical and oncologic outcomes of colonic stents as a BTS for potentially resectable obstructive colorectal cancer.
MethodsWe conducted a retrospective analysis of patients operated on for potentially resectable obstructive colorectal cancer with or without distant disease between September 2002 and October 2015, comparing the patients treated with a colonic stent as a BTS (Stent group) with those directly operated on (Surgery group).
ResultsTwenty patients underwent urgent surgery, while stent placement as a BTS was attempted in 57 patients. The Stent group had more patients treated with a laparoscopic approach (64.9 vs. 5%, P<.001), higher primary anastomosis rate (91.2 vs. 55%, P=.001), less need for stomata (10.5 vs. 50%, P=.001) and shorter postoperative hospital stay (7 vs. 12 days, P=.014). Thirty-day morbidity was reduced in the Stent group, although not significantly (29.8 vs. 50%, P=.104). However, 30-day mortality was significantly lower (1.8 vs. 20%, P=.015). Regarding the long-term oncologic outcomes, no significant differences were found when comparing overall survival, disease-free survival, local recurrence-free survival, distant recurrence-free survival or progression-free survival.
ConclusionsColonic stenting as a BTS for potentially resectable obstructive colorectal cancer seems to offer better surgical and equal long-term oncologic outcomes when compared to those of patients directly operated on.
Hasta un 30% de las neoplasias colorrectales comienzan con un cuadro clínico oclusivo1,2. El abordaje de estas neoplasias clásicamente ha implicado una laparotomía urgente, con una baja tasa de anastomosis primarias y una elevada morbilidad3. En 1990, Dohmoto et al. publicaron su técnica para el manejo paliativo de los tumores estenosantes de recto, que consistía en la colocación de un stent para repermeabilizar la luz rectal4. El procedimiento rápidamente se popularizó y su indicación se extendió al tratamiento de las oclusiones cólicas neoplásicas como puente al tratamiento quirúrgico definitivo. La principal ventaja de colocar un stent sería la descompresión cólica5, permitiendo así convertir una cirugía urgente en una semielectiva con la consecuente reducción en morbimortalidad6,7. Sin embargo, el procedimiento no está exento de riesgos8,9. El éxito depende en gran medida del realizador y las complicaciones pueden ser graves, siendo una de las más temidas la perforación cólica, con la consecuente peritonitis fecaloidea. De hecho, 3 ensayos clínicos fueron cancelados debido a la alta tasa de complicaciones10–12. Además, los resultados oncológicos de los pacientes intervenidos tras la colocación de un stent también han sido cuestionados, ya que teóricamente la manipulación de la neoplasia podría favorecer la diseminación tumoral13,14. En los últimos años se han publicado artículos contradictorios, y mientras que algunos demuestran un incremento en las tasas de recurrencia, la supervivencia global no parece modificarse15–20. En general, estos estudios incluyen pocos pacientes e intervalos de seguimiento cortos.
El objetivo del presente estudio es evaluar los efectos que tiene sobre los resultados tanto quirúrgicos como oncológicos la colocación de un stent como puente a la cirugía (PAC) en los pacientes con neoplasias colorrectales oclusivas (NCO).
MétodosRealizamos un estudio retrospectivo, observacional y anonimizado de todos los pacientes intervenidos en nuestro hospital por cáncer colorrectal desde septiembre de 2002 a octubre de 2015, previa autorización del mismo por el Comité Ético. Se seleccionaron para el análisis todos los pacientes clínicamente ocluidos y que radiológicamente presentaban una obstrucción cólica en el momento del diagnóstico, ya fuera solo con enfermedad local o también diseminada, pero considerada siempre como potencialmente resecable. Los criterios para clasificar a un paciente como clínicamente ocluido fueron presentar en el momento del diagnóstico distensión, cierre intestinal y/o vómitos, mientras que los criterios para calificarlo como radiológicamente ocluido fueron disponer de una radiografía simple o una TC que mostrasen signos radiológicos de obstrucción cólica. La enfermedad se consideró potencialmente resecable cuando así fue establecido por el comité multidisciplinar en el que se discuten estos casos en nuestro centro, básicamente cuando toda la enfermedad podía ser resecada sin la necesidad de quimioterapia o radioterapia conversivas, independientemente de si finalmente se utilizaron tratamientos de intervalo. De este modo, se excluyeron los pacientes con carcinomatosis peritoneal, con enfermedad metastásica extrahepática y extrapulmonar o con enfermedad hepática o pulmonar extensa (considerada irresecable por volumen o localización y relación con estructuras vasculares, considerada resecable pero que precisaría de modulación hepática preoperatoria o cirugía hepática extrema, o con afectación ganglionar mediastínica o insuficiente reserva pulmonar postoperatoria).
La decisión de intervenir de forma urgente o colocar un stent como PAC la tomó el equipo quirúrgico de guardia, y los stents fueron colocados por un equipo de endoscopistas experimentados siguiendo la técnica through-the-scope y bajo control fluoroscópico21. Los diferentes tipos de stent colocados fueron Wallstent®, Wallflex® (Boston Scientific, Natick, Massachusetts, Estados Unidos), Evolution® (Cook Medical, Limerick, Irlanda) y Hanarostent® (MI-Tech, Seúl, Corea). El procedimiento se consideró un éxito técnico cuando finalizó con el stent colocado en la luz cólica, y se consideró también un éxito clínico cuando se consiguió la descompresión cólica y posteriormente durante la cirugía no se detectaron complicaciones locales atribuibles a la colocación del stent o a la migración del mismo.
El seguimiento de los pacientes se realizó siguiendo las guías clínicas de nuestro hospital, con controles clínicos, analíticos y radiológicos cada 3 meses durante los 2 primeros años y a partir de entonces cada 6. Para el análisis de supervivencia global se utilizó el tiempo desde la intervención quirúrgica hasta el fallecimiento por cualquier causa. La supervivencia libre de enfermedad se calculó utilizando el tiempo que los pacientes sin enfermedad residual tras la intervención (R0) tardaron en presentar cualquier tipo de recurrencia. De forma similar se definieron la supervivencia libre de recidiva local (para los pacientes sin enfermedad local tras la intervención), la supervivencia libre de recidiva a distancia (para los pacientes sin enfermedad a distancia tras la intervención) y la supervivencia libre de progresión (para los pacientes con enfermedad residual tras la intervención R1 o R2).
Las variables continuas se presentan como media (desviación estándar) cuando siguen una distribución normal (comprobado mediante el test de Kolmogorov-Smirnov), y cuando no, como mediana (rango intercuartílico). Para el análisis estadístico se ha utilizado el paquete informático SPSS® versión 20.0.0 (IBM, Armonk, Nueva York, Estados Unidos). Las variables categóricas se han comparado usando el test de Pearson o el test exacto de Fisher en función de las frecuencias esperadas. Las variables continuas se han comparado usando el test de la t de Student para aquellas que presentan una distribución normal o el test U de Mann-Whitney para las que no. Para el análisis de supervivencia se ha utilizado el método de Kaplan-Meier, comparando grupos con el test log-rank. En todos los casos se ha considerado la significación estadística cuando p<0,05.
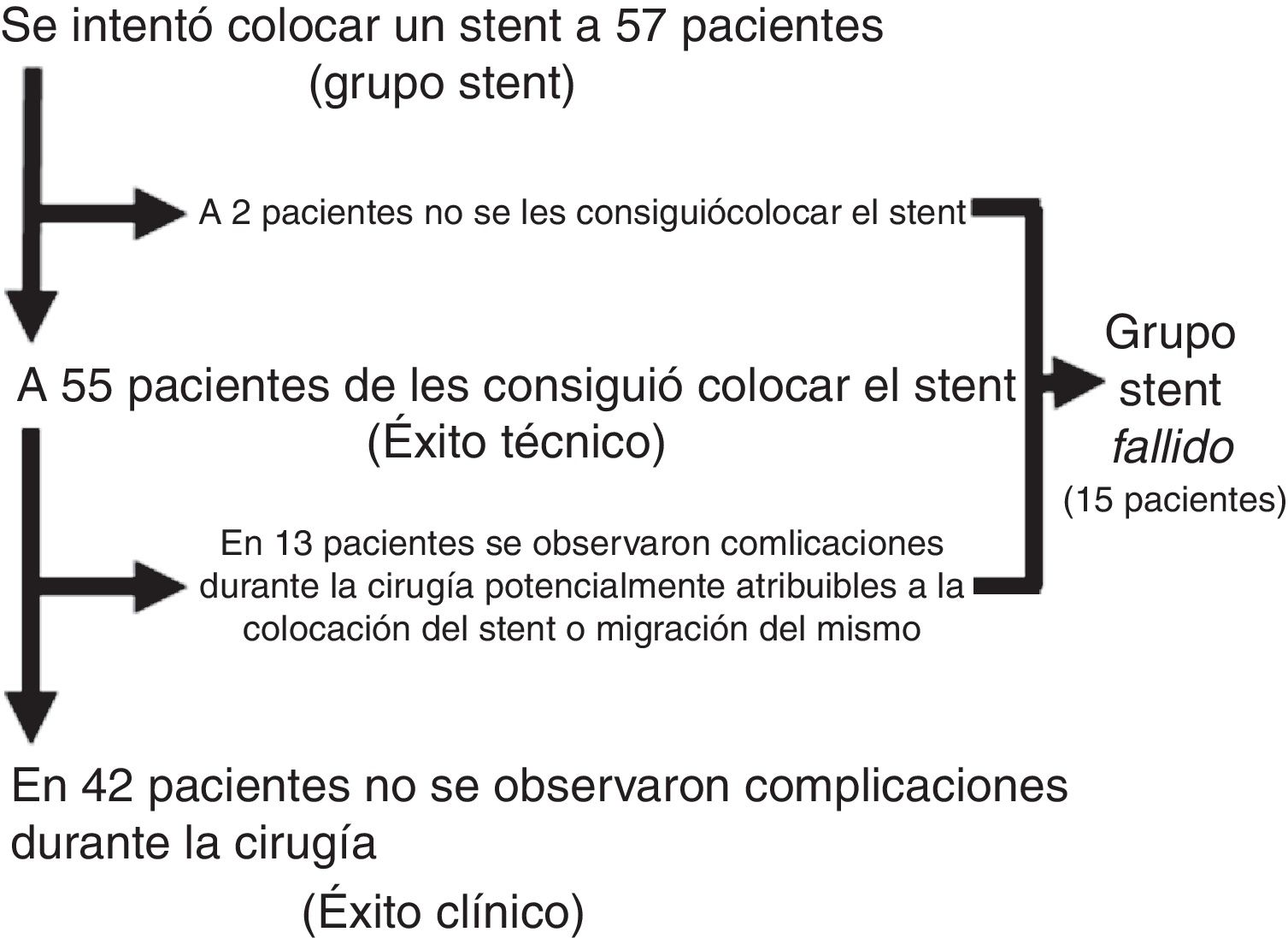
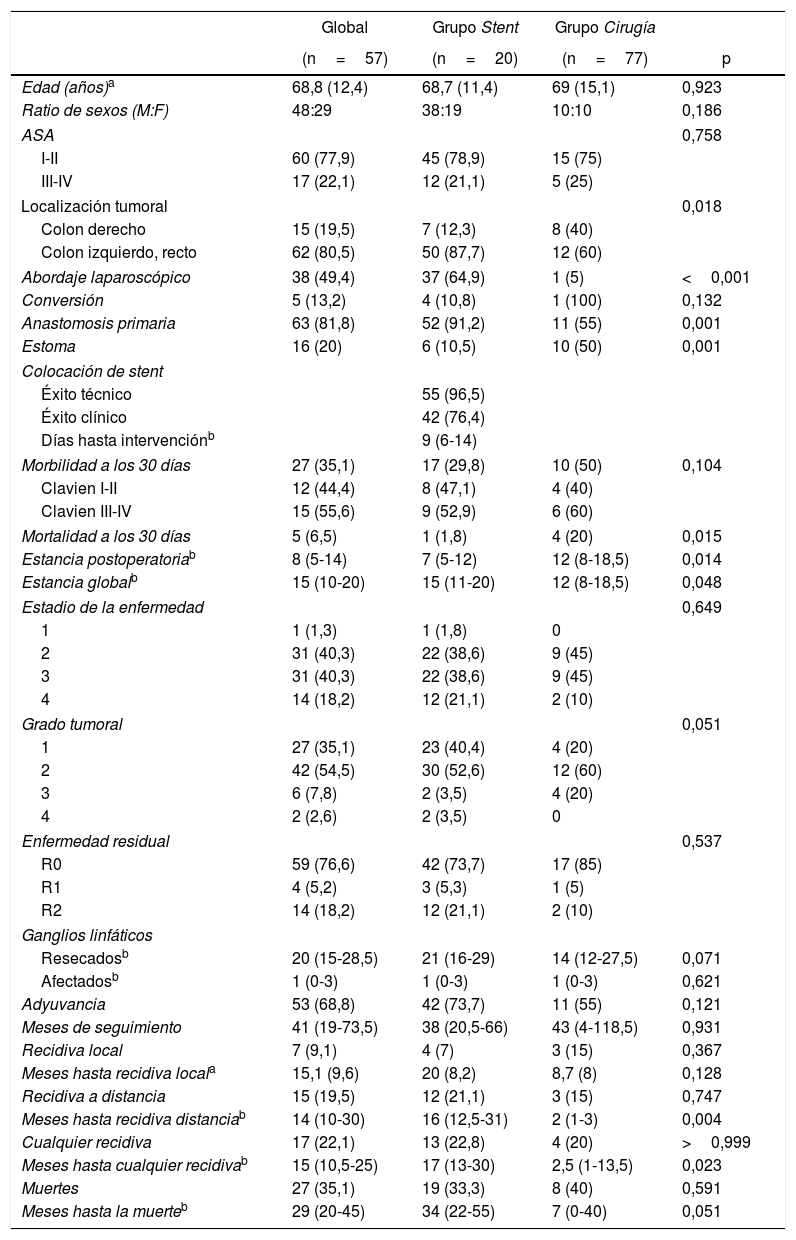
ResultadosDe acuerdo con los criterios de inclusión, identificamos 77 pacientes intervenidos por NCO potencialmente resecables. De estos, 20 pacientes (26%) fueron intervenidos directamente (grupo Cirugía), mientras que en 57 (74%, grupo Stent) se intentó la colocación de un stent como PAC. Las características de los pacientes y los resultados quirúrgicos están resumidos en la tabla 1. Una mayor proporción de pacientes del grupo Cirugía tenían NCO que afectaban al colon derecho, y la mayoría de los pacientes con NCO de colon izquierdo fue tratada mediante la colocación de un stent como PAC (80,6%). En el grupo Stent, en 2 pacientes no se consiguió su colocación (en uno porque no se consiguió pasar la guía y en otro porque se halló una perforación), por lo que fueron intervenidos de forma urgente. Sin embargo, dado que el diseño del estudio es por intención de tratamiento, para el análisis estadístico se mantuvieron dentro del grupo Stent. La mediana (rango intercuartílico) de días desde la colocación del stent hasta la intervención electiva fue de 9 (6-14). Durante la cirugía, en 13 de los 55 pacientes se apreciaron complicaciones que pudieron atribuirse a la manipulación cólica durante o tras la colocación del stent (inflamación, ulceración, perforación) o a la migración del mismo (tasa de éxito clínico 76,4%). Casi la mitad de los pacientes de nuestro estudio fue intervenida laparoscópicamente, siendo la proporción bastante mayor en el grupo Stent (64,9 vs. 5%, p<0,001), con una tasa global de conversión a laparotomía del 13,2% (100% en el grupo Cirugía). La mitad de los pacientes del grupo Cirugía necesitaron un estoma terminal o lateral, y la anastomosis primaria pudo realizarse en un 55% de los pacientes. En cambio, solo el 10,5% de los pacientes del grupo Stent necesitó estoma y la anastomosis primaria se realizó en el 91,2% (p=0,001 en ambos casos). La morbilidad a los 30 días fue superior en el grupo Cirugía, aunque sin alcanzar significación estadística, con una distribución similar de las complicaciones de acuerdo con la escala Clavien-Dindo22. La mortalidad a los 30 días fue significativamente mayor en el grupo Cirugía (20 vs. 1,8%, p=0,015). La estancia hospitalaria global fue superior en el grupo Stent, al contrario que la estancia postoperatoria (15 vs. 12 días, p=0,048 y 7 vs. 12 días, p=0,014, respectivamente). Todas estas intervenciones se limitaron al tratamiento de la enfermedad local.
Características de los pacientes, resultados quirúrgicos, características anatomopatológicas y resultados oncológicos
| Global | Grupo Stent | Grupo Cirugía | ||
|---|---|---|---|---|
| (n=57) | (n=20) | (n=77) | p | |
| Edad (años)a | 68,8 (12,4) | 68,7 (11,4) | 69 (15,1) | 0,923 |
| Ratio de sexos (M:F) | 48:29 | 38:19 | 10:10 | 0,186 |
| ASA | 0,758 | |||
| I-II | 60 (77,9) | 45 (78,9) | 15 (75) | |
| III-IV | 17 (22,1) | 12 (21,1) | 5 (25) | |
| Localización tumoral | 0,018 | |||
| Colon derecho | 15 (19,5) | 7 (12,3) | 8 (40) | |
| Colon izquierdo, recto | 62 (80,5) | 50 (87,7) | 12 (60) | |
| Abordaje laparoscópico | 38 (49,4) | 37 (64,9) | 1 (5) | <0,001 |
| Conversión | 5 (13,2) | 4 (10,8) | 1 (100) | 0,132 |
| Anastomosis primaria | 63 (81,8) | 52 (91,2) | 11 (55) | 0,001 |
| Estoma | 16 (20) | 6 (10,5) | 10 (50) | 0,001 |
| Colocación de stent | ||||
| Éxito técnico | 55 (96,5) | |||
| Éxito clínico | 42 (76,4) | |||
| Días hasta intervenciónb | 9 (6-14) | |||
| Morbilidad a los 30 días | 27 (35,1) | 17 (29,8) | 10 (50) | 0,104 |
| Clavien I-II | 12 (44,4) | 8 (47,1) | 4 (40) | |
| Clavien III-IV | 15 (55,6) | 9 (52,9) | 6 (60) | |
| Mortalidad a los 30 días | 5 (6,5) | 1 (1,8) | 4 (20) | 0,015 |
| Estancia postoperatoriab | 8 (5-14) | 7 (5-12) | 12 (8-18,5) | 0,014 |
| Estancia globalb | 15 (10-20) | 15 (11-20) | 12 (8-18,5) | 0,048 |
| Estadio de la enfermedad | 0,649 | |||
| 1 | 1 (1,3) | 1 (1,8) | 0 | |
| 2 | 31 (40,3) | 22 (38,6) | 9 (45) | |
| 3 | 31 (40,3) | 22 (38,6) | 9 (45) | |
| 4 | 14 (18,2) | 12 (21,1) | 2 (10) | |
| Grado tumoral | 0,051 | |||
| 1 | 27 (35,1) | 23 (40,4) | 4 (20) | |
| 2 | 42 (54,5) | 30 (52,6) | 12 (60) | |
| 3 | 6 (7,8) | 2 (3,5) | 4 (20) | |
| 4 | 2 (2,6) | 2 (3,5) | 0 | |
| Enfermedad residual | 0,537 | |||
| R0 | 59 (76,6) | 42 (73,7) | 17 (85) | |
| R1 | 4 (5,2) | 3 (5,3) | 1 (5) | |
| R2 | 14 (18,2) | 12 (21,1) | 2 (10) | |
| Ganglios linfáticos | ||||
| Resecadosb | 20 (15-28,5) | 21 (16-29) | 14 (12-27,5) | 0,071 |
| Afectadosb | 1 (0-3) | 1 (0-3) | 1 (0-3) | 0,621 |
| Adyuvancia | 53 (68,8) | 42 (73,7) | 11 (55) | 0,121 |
| Meses de seguimiento | 41 (19-73,5) | 38 (20,5-66) | 43 (4-118,5) | 0,931 |
| Recidiva local | 7 (9,1) | 4 (7) | 3 (15) | 0,367 |
| Meses hasta recidiva locala | 15,1 (9,6) | 20 (8,2) | 8,7 (8) | 0,128 |
| Recidiva a distancia | 15 (19,5) | 12 (21,1) | 3 (15) | 0,747 |
| Meses hasta recidiva distanciab | 14 (10-30) | 16 (12,5-31) | 2 (1-3) | 0,004 |
| Cualquier recidiva | 17 (22,1) | 13 (22,8) | 4 (20) | >0,999 |
| Meses hasta cualquier recidivab | 15 (10,5-25) | 17 (13-30) | 2,5 (1-13,5) | 0,023 |
| Muertes | 27 (35,1) | 19 (33,3) | 8 (40) | 0,591 |
| Meses hasta la muerteb | 29 (20-45) | 34 (22-55) | 7 (0-40) | 0,051 |
ASA: American Society of Anesthesiologists; F: femenino; M: masculino.
Los valores en paréntesis son porcentajes, salvo:
Respecto a las características anatomopatológicas de los tumores resecados (tabla 1), no se encontraron diferencias en la estadificación ni en el grado tumoral. La distribución de pacientes con enfermedad residual R0, R1 y R2 fue similar en ambos grupos. Durante el periodo de seguimiento (tabla 1), 17 pacientes presentaron algún tipo de recidiva: 2 pacientes solo local, 10 pacientes solo a distancia y 5 pacientes ambas, siendo estas recurrencias más precoces en el grupo Cirugía.
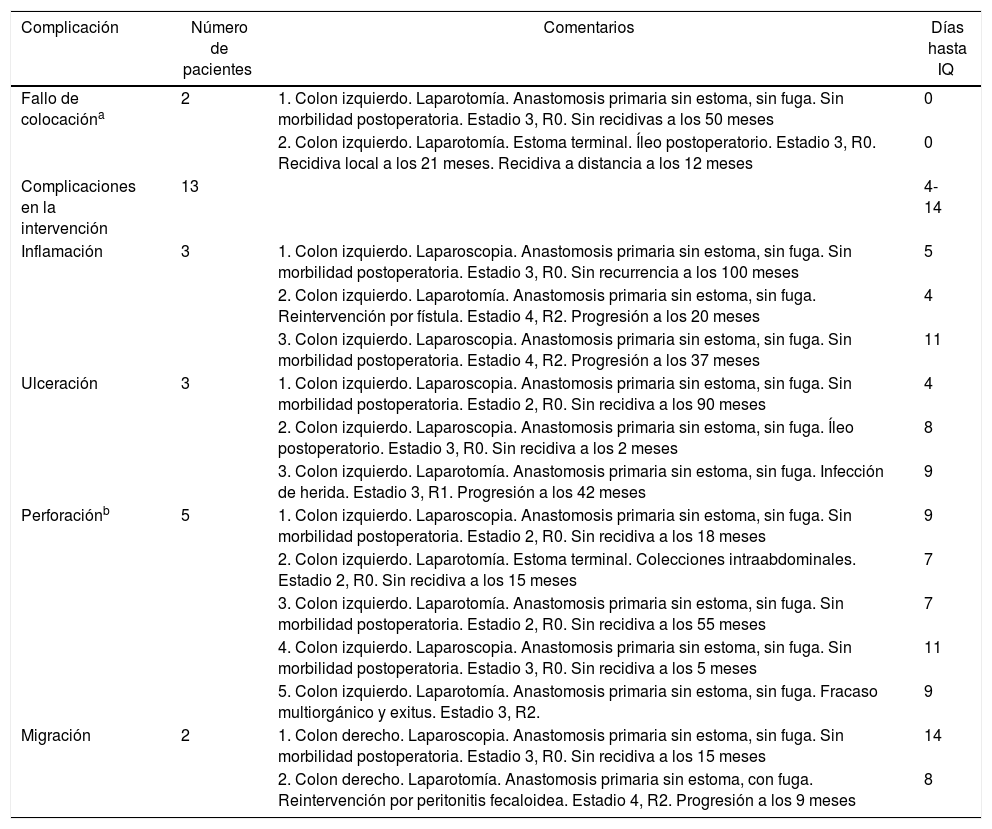
La figura 1 muestra los resultados de los procedimientos de colocación de stents y los diferentes subgrupos generados. Tras el análisis anterior, se definió un nuevo grupo de pacientes, el grupo Stent Fallido (n=15), formado por los pacientes a los que no se les consiguió colocar el stent y los pacientes a los que se les colocó, pero en los que se constataron complicaciones atribuibles a la colocación o migración del mismo. Las características de dichos pacientes se resumen en la tabla 2. Este grupo se comparó con los 62 pacientes restantes, con los 42 considerados como éxitos clínicos de la colocación del stent y con los 20 del grupo Cirugía (tabla 3). Los resultados de este segundo análisis se discuten más adelante.
Grupo Stent Fallido
| Complicación | Número de pacientes | Comentarios | Días hasta IQ |
|---|---|---|---|
| Fallo de colocacióna | 2 | 1. Colon izquierdo. Laparotomía. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 3, R0. Sin recidivas a los 50 meses | 0 |
| 2. Colon izquierdo. Laparotomía. Estoma terminal. Íleo postoperatorio. Estadio 3, R0. Recidiva local a los 21 meses. Recidiva a distancia a los 12 meses | 0 | ||
| Complicaciones en la intervención | 13 | 4-14 | |
| Inflamación | 3 | 1. Colon izquierdo. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 3, R0. Sin recurrencia a los 100 meses | 5 |
| 2. Colon izquierdo. Laparotomía. Anastomosis primaria sin estoma, sin fuga. Reintervención por fístula. Estadio 4, R2. Progresión a los 20 meses | 4 | ||
| 3. Colon izquierdo. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 4, R2. Progresión a los 37 meses | 11 | ||
| Ulceración | 3 | 1. Colon izquierdo. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 2, R0. Sin recidiva a los 90 meses | 4 |
| 2. Colon izquierdo. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Íleo postoperatorio. Estadio 3, R0. Sin recidiva a los 2 meses | 8 | ||
| 3. Colon izquierdo. Laparotomía. Anastomosis primaria sin estoma, sin fuga. Infección de herida. Estadio 3, R1. Progresión a los 42 meses | 9 | ||
| Perforaciónb | 5 | 1. Colon izquierdo. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 2, R0. Sin recidiva a los 18 meses | 9 |
| 2. Colon izquierdo. Laparotomía. Estoma terminal. Colecciones intraabdominales. Estadio 2, R0. Sin recidiva a los 15 meses | 7 | ||
| 3. Colon izquierdo. Laparotomía. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 2, R0. Sin recidiva a los 55 meses | 7 | ||
| 4. Colon izquierdo. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 3, R0. Sin recidiva a los 5 meses | 11 | ||
| 5. Colon izquierdo. Laparotomía. Anastomosis primaria sin estoma, sin fuga. Fracaso multiorgánico y exitus. Estadio 3, R2. | 9 | ||
| Migración | 2 | 1. Colon derecho. Laparoscopia. Anastomosis primaria sin estoma, sin fuga. Sin morbilidad postoperatoria. Estadio 3, R0. Sin recidiva a los 15 meses | 14 |
| 2. Colon derecho. Laparotomía. Anastomosis primaria sin estoma, con fuga. Reintervención por peritonitis fecaloidea. Estadio 4, R2. Progresión a los 9 meses | 8 |
IQ: intervención quirúrgica.
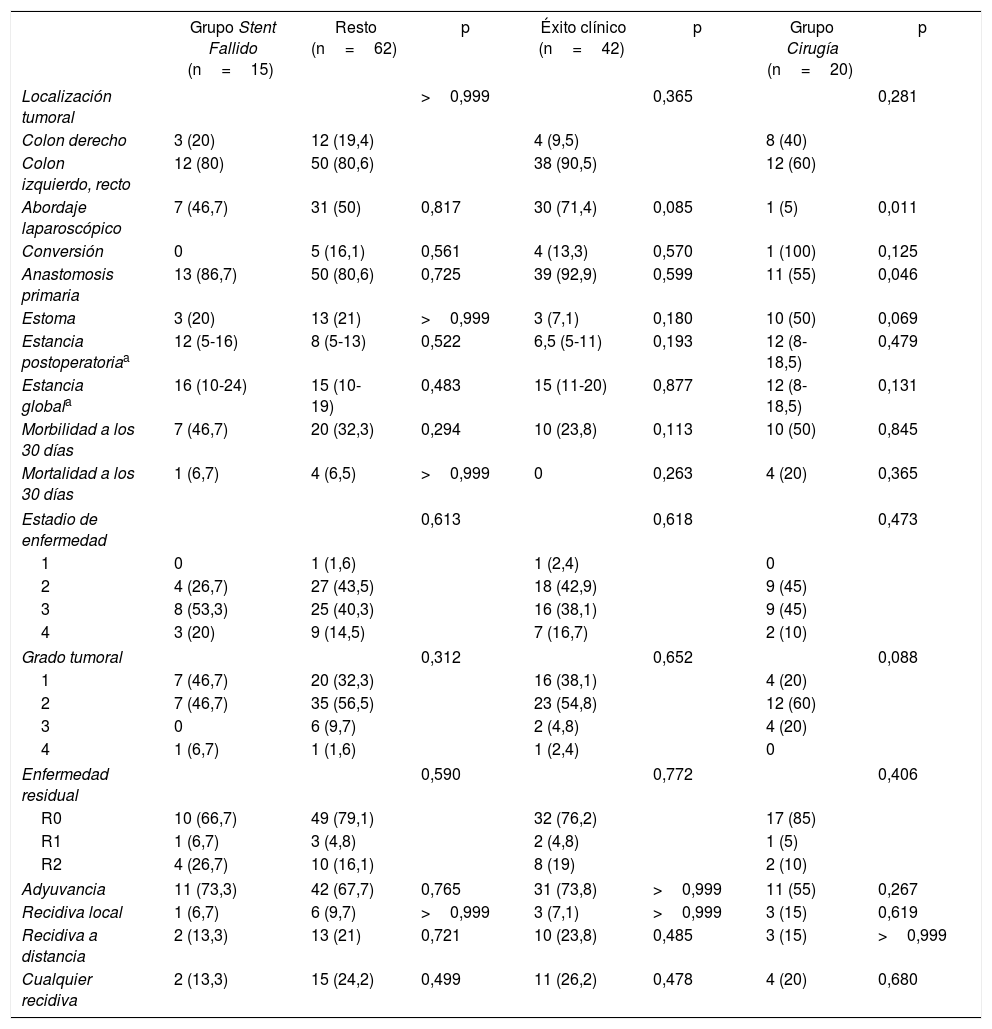
Comparación del grupo Stent Fallido
| Grupo Stent Fallido (n=15) | Resto (n=62) | p | Éxito clínico (n=42) | p | Grupo Cirugía (n=20) | p | |
|---|---|---|---|---|---|---|---|
| Localización tumoral | >0,999 | 0,365 | 0,281 | ||||
| Colon derecho | 3 (20) | 12 (19,4) | 4 (9,5) | 8 (40) | |||
| Colon izquierdo, recto | 12 (80) | 50 (80,6) | 38 (90,5) | 12 (60) | |||
| Abordaje laparoscópico | 7 (46,7) | 31 (50) | 0,817 | 30 (71,4) | 0,085 | 1 (5) | 0,011 |
| Conversión | 0 | 5 (16,1) | 0,561 | 4 (13,3) | 0,570 | 1 (100) | 0,125 |
| Anastomosis primaria | 13 (86,7) | 50 (80,6) | 0,725 | 39 (92,9) | 0,599 | 11 (55) | 0,046 |
| Estoma | 3 (20) | 13 (21) | >0,999 | 3 (7,1) | 0,180 | 10 (50) | 0,069 |
| Estancia postoperatoriaa | 12 (5-16) | 8 (5-13) | 0,522 | 6,5 (5-11) | 0,193 | 12 (8-18,5) | 0,479 |
| Estancia globala | 16 (10-24) | 15 (10-19) | 0,483 | 15 (11-20) | 0,877 | 12 (8-18,5) | 0,131 |
| Morbilidad a los 30 días | 7 (46,7) | 20 (32,3) | 0,294 | 10 (23,8) | 0,113 | 10 (50) | 0,845 |
| Mortalidad a los 30 días | 1 (6,7) | 4 (6,5) | >0,999 | 0 | 0,263 | 4 (20) | 0,365 |
| Estadio de enfermedad | 0,613 | 0,618 | 0,473 | ||||
| 1 | 0 | 1 (1,6) | 1 (2,4) | 0 | |||
| 2 | 4 (26,7) | 27 (43,5) | 18 (42,9) | 9 (45) | |||
| 3 | 8 (53,3) | 25 (40,3) | 16 (38,1) | 9 (45) | |||
| 4 | 3 (20) | 9 (14,5) | 7 (16,7) | 2 (10) | |||
| Grado tumoral | 0,312 | 0,652 | 0,088 | ||||
| 1 | 7 (46,7) | 20 (32,3) | 16 (38,1) | 4 (20) | |||
| 2 | 7 (46,7) | 35 (56,5) | 23 (54,8) | 12 (60) | |||
| 3 | 0 | 6 (9,7) | 2 (4,8) | 4 (20) | |||
| 4 | 1 (6,7) | 1 (1,6) | 1 (2,4) | 0 | |||
| Enfermedad residual | 0,590 | 0,772 | 0,406 | ||||
| R0 | 10 (66,7) | 49 (79,1) | 32 (76,2) | 17 (85) | |||
| R1 | 1 (6,7) | 3 (4,8) | 2 (4,8) | 1 (5) | |||
| R2 | 4 (26,7) | 10 (16,1) | 8 (19) | 2 (10) | |||
| Adyuvancia | 11 (73,3) | 42 (67,7) | 0,765 | 31 (73,8) | >0,999 | 11 (55) | 0,267 |
| Recidiva local | 1 (6,7) | 6 (9,7) | >0,999 | 3 (7,1) | >0,999 | 3 (15) | 0,619 |
| Recidiva a distancia | 2 (13,3) | 13 (21) | 0,721 | 10 (23,8) | 0,485 | 3 (15) | >0,999 |
| Cualquier recidiva | 2 (13,3) | 15 (24,2) | 0,499 | 11 (26,2) | 0,478 | 4 (20) | 0,680 |
Los valores en paréntesis son porcentajes, salvo:
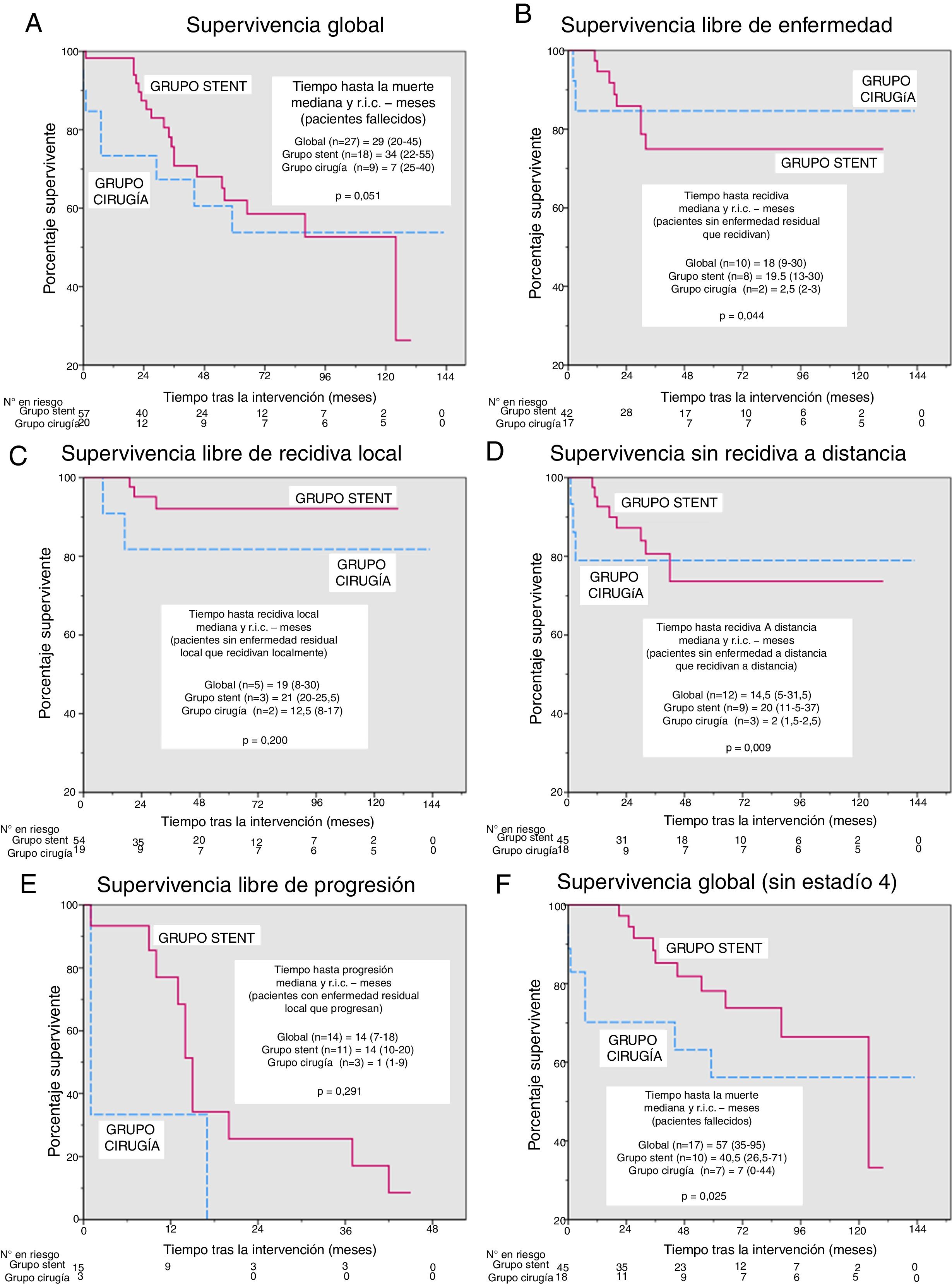
En el análisis de supervivencia no encontramos diferencias significativas en la supervivencia global (fig. 2 A), la supervivencia libre de enfermedad (fig. 2 B), la supervivencia libre de recidiva local o a distancia (fig. 2 C y D) o la supervivencia libre de progresión (fig. 2 E) tras una mediana (rango intercuartílico) de seguimiento de 41 meses (19-73,5). Sin embargo, el tiempo hasta cada tipo de evento (fig. 2 A-E) fue menor en el grupo Cirugía, siendo las diferencias significativas en el tiempo hasta cualquier tipo de recidiva y el tiempo hasta recidiva a distancia (2,5 vs. 19,5 meses, p=0,044 y 2 vs. 20 meses, p=0,009, respectivamente). Para la supervivencia global, tras excluir a los pacientes en estadio 4 (fig. 2 F), el tiempo hasta la defunción se volvió significativamente menor en el grupo Cirugía (7 vs. 40,5 meses, p=0,025).
Curvas de Kaplan-Meier y comparación del tiempo hasta cada evento. Excepto para las supervivencias globales, las muertes se han considerado casos censurados. A: supervivencia global, p=0,736 (test log-rank). Además, para los pacientes que murieron durante el periodo de estudio, el tiempo hasta la muerte (mediana y rango intercuartílico [RIC]) se ha comparado usando el test de la U de Mann-Whitney. B: supervivencia libre de enfermedad, p=0,780 (test log-rank). Además, para los pacientes que quedaron sin enfermedad residual y presentaron recidivas durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. C: supervivencia libre de recidiva local, p=0,233 (test log-rank). Además, para los pacientes que no quedaron sin enfermedad residual local y presentaron recidiva local durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. D: supervivencia libre de recidiva a distancia, p=0,859 (test log-rank). Además, para los pacientes que no quedaron sin enfermedad residual a distancia y presentaron recidiva a distancia durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. E: supervivencia libre de progresión, p=0,155 (test log-rank). Además, para los pacientes que quedaron con enfermedad residual y progresaron durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. F: supervivencia global excluyendo los pacientes en estadio 4, p=0,287 (test log-rank). Además, para los pacientes que murieron durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney.
El presente estudio demuestra una clara superioridad de los resultados postoperatorios del grupo de pacientes tratados con stents cólicos como PAC, mientras que la supervivencia y las recurrencias a largo plazo permanecieron similares en ambos grupos.
Desde la introducción de la técnica de la descompresión cólica mediante la colocación de un stent y la publicación de unos resultados iniciales sorprendentes y probablemente demasiado optimistas23, la valoración de este tratamiento ha pasado en los últimos años del entusiasmo al escepticismo debido a la publicación de las posibles complicaciones secundarias al procedimiento y, más recientemente, al rechazo con la aparición de estudios que evidencian unos pobres resultados oncológicos a largo plazo24,25.
En nuestra serie, 57 pacientes de un total de 77 fueron tratados con un stent como PAC. Esta diferencia en el tamaño de los grupos traduce principalmente las preferencias personales de los cirujanos de nuestro hospital, probablemente porque en nuestro centro no existe la percepción de una alta tasa de complicaciones con la colocación de los stents, al contrario de lo constatado en la literatura y que ha sido motivo de cancelación de varios ensayos clínicos10–12.
Los pacientes tratados con stents pudieron evitar ser intervenidos de forma urgente. En el caso de la obstrucción cólica, la cirugía urgente suele implicar la realización de una laparotomía amplia y, especialmente en los tumores que afectan al colon izquierdo y el recto, la imposibilidad de realizar una anastomosis primaria. Estas laparotomías urgentes asocian una elevada morbimortalidad, y muchos de los estomas realizados nunca serán reconstruidos26. La mayoría de los pacientes del grupo Stent fueron intervenidos por vía laparoscópica, realizándose más anastomosis primarias, y la estancia postoperatoria fue significativamente menor. Sin embargo, si se añaden los días de hospitalización desde la colocación del stent hasta la intervención quirúrgica, la ventaja en estancia se invierte. A pesar de ello hay que tener en cuenta que la mitad de los pacientes del grupo Cirugía necesitarían al menos otro ingreso para la reconstrucción del tránsito intestinal, añadiendo estancia y sin estar exento de posibles complicaciones, con el consecuente incremento en el coste económico de todo el proceso27–31.
Dado que la anastomosis primaria no está habitualmente contraindicada en las oclusiones de colon derecho, se atribuyen menos ventajas potenciales a resolver dichas oclusiones mediante la colocación de stents32,33, y probablemente este sea el motivo por el que encontramos más pacientes con neoplasias de colon derecho en el grupo Cirugía. Sin embargo, los beneficios aquí demostrados, evitando una intervención urgente y permitiendo el abordaje laparoscópico, justificarían también el tratamiento de aquellas con stents.
Cabe recalcar que incluso cuando la colocación o el funcionamiento de los stents se consideraron fallidos por complicaciones locales observadas durante la intervención quirúrgica, simplemente el hecho de ser portador de un stent y, por tanto, haber resuelto la oclusión permitió el abordaje laparoscópico (aunque en un porcentaje menor que en el grupo de pacientes con éxito clínico) e incrementó la tasa de anastomosis primaria respecto a la de los pacientes que no eran portadores de stents. Las otras ventajas observadas en el grupo Stent al compararlo con el grupo Cirugía y que pueden atribuirse al tipo de abordaje son menos evidentes en el grupo Stent Fallido.
Si las complicaciones observadas durante la colocación de los stents (n=1, ya que la incapacidad para colocarlo no se considera complicación) y durante las intervenciones (n=13) se contabilizan como complicaciones del procedimiento, su morbilidad sería del 24,6%, con una tasa de perforación del 10,5%. La morbilidad y la mortalidad postoperatorias del grupo Stent Fallido fueron del 46,7 y 6,7%, respectivamente. Estos valores, aunque puedan parecer elevados, son inferiores a los observados en el grupo Cirugía y, por lo tanto, incluso cuando la colocación del stent no se consideró exitosa el proceso asistencial de estos pacientes fue más seguro que el aquellos intervenidos directamente.
La razón principal para desarrollar este estudio fue evaluar el efecto que la colocación de los stents cólicos tiene sobre los resultados oncológicos a largo plazo. A pesar de que algunos autores han publicado un incremento en las tasas de recidiva tanto local como a distancia en los pacientes tratados con stents, este efecto no se ha observado en nuestros pacientes, en los que ambas tasas de recidiva son similares a las del grupo Cirugía. Respecto al análisis de supervivencia, no encontramos diferencias significativas entre las diferentes curvas de Kaplan-Meier (fig. 2). Los niveles de ARN tumoral circulante aumentan tras la colocación de un stent cólico34, aunque no se ha podido demostrar que esto implique un peor pronóstico. De manera similar, un experimento reciente en ratones muestra que la colocación de stents cólicos provoca diseminación metastásica35, aunque los autores admiten limitaciones importantes en el diseño y la metodología del estudio que impiden extrapolar los resultados a la práctica clínica en humanos. Algunos estudios publicados concluyen que hay una mayor tasa de recidiva y que estas recidivas ocurren antes en los pacientes tratados con stents, sin que esto se traduzca en una reducción de la supervivencia global. Hasta la fecha solo existe un metaanálisis que evalúe los resultados oncológicos a largo plazo de los pacientes tratados con stents cólicos36, y concluye que la colocación de stents como PAC no afecta negativamente ni a la supervivencia global, ni al intervalo libre de enfermedad ni a las tasas de recidiva respecto a los pacientes tratados con cirugía urgente. Los resultados aquí presentados concuerdan con dicho metaanálisis y apoyan aún más el uso de los stents antes de la cirugía, ya que los resultados a corto plazo son mejores y los pacientes tratados directamente con cirugía presentan las recidivas de forma más temprana, aunque no haya diferencias en la supervivencia global.
A pesar de los avances conseguidos en los últimos años en el tratamiento del cáncer colorrectal metastásico, existen discrepancias interinstitucionales respecto a qué enfermedad se considera resecable y curable o no. En nuestro centro consideramos como resecables a todos aquellos pacientes en los que puede conseguirse una resección completa de toda la enfermedad presente, tanto local como a distancia, sin necesidad de terapias de conversión. Sin embargo, para evitar controversias, realizamos un segundo análisis de supervivencia excluyendo a los 14 pacientes con enfermedad en estadio 4. Los resultados obtenidos no difieren a efectos prácticos de los anteriores, y en cualquier caso apoyan todavía más el uso de stents, ya que al analizar la supervivencia global, las curvas se separan más y la diferencia entre grupos en el tiempo hasta el fallecimiento se vuelve significativa (fig. 2 F).
Nuestro estudio tiene varias limitaciones, principalmente porque es observacional y retrospectivo sin ningún tipo de control o aleatorización. El hecho de que no hubiese un criterio establecido sobre qué pacientes debían ser tratados con stent o no podría haber creado un sesgo de selección que explicaría el mayor número de pacientes tratados con stents y la mayor proporción de pacientes con neoplasias de colon derecho en el grupo Cirugía. Por otro lado, limitar el estudio a los casos de neoplasias potencialmente resecables ha reducido notablemente el número de pacientes incluidos, ya que un gran número de los que comienzan con oclusión tienen enfermedad irresecable local o a distancia y la cirugía se considera, por tanto, paliativa. Incluso así, nuestros números son similares e incluso mayores que los de muchos estudios publicados37–39, con el valor añadido de que aportan el prolongado tiempo de seguimiento y el hecho de que al analizar solo pacientes con enfermedad potencialmente resecable, los posibles efectos perjudiciales de los stents, si existen, deberían quedar más patentes.
En conclusión, la utilización de stents como PAC para las NCO potencialmente resecables permite convertir una cirugía urgente en electiva, facilitando el abordaje mínimamente invasivo y la realización de anastomosis primarias, y reduciendo la necesidad de estomas y la morbimortalidad asociadas a la cirugía. Además, parece proporcionar resultados oncológicos a largo plazo comparables a los de los pacientes intervenidos directamente. Aunque estos resultados concuerdan con los de un metaanálisis reciente, serían necesarios estudios prospectivos aleatorizados bien diseñados para alcanzar un mayor nivel de evidencia científica.
AutoríaTodos los autores hemos leído y aprobado el manuscrito y cumplimos con los requisitos para la autoría. Antònia Crespí Mir y Juan Manuel Romero Marcos han participado en el diseño del estudio, la adquisición y recogida de datos, el análisis y la interpretación de los resultados, la redacción del artículo y la aprobación de la versión final, colaborando de igual manera en la producción del manuscrito. Anabel de la Llave Serralvo ha participado en el diseño del estudio y en la adquisición y recogida de datos. Carlos Dolz Abadía y José Andrés Cifuentes Ródenas han participado en el análisis e interpretación de los resultados y en la revisión crítica y aprobación de la versión final.
Conflicto de interesesEl Dr. Dolz participó en 2012 en un estudio patrocinado por Cook Medical. El resto de los autores declaramos no tener ningún conflicto de intereses.
Los autores quieren mostrar su agradecimiento a todo el personal de los departamentos de Cirugía y Gastroenterología por su contribución al desarrollo de este estudio. Requieren mención especial por su inestimable colaboración los Dres. José M. Olea, Larry Hershon y Silvia Tejada, así como Xavier Roca.
Parte de este manuscrito fue presentado como comunicación oral en la XX Reunión Nacional de la Asociación Española de Cirujanos (Granada, octubre de 2015).






![Curvas de Kaplan-Meier y comparación del tiempo hasta cada evento. Excepto para las supervivencias globales, las muertes se han considerado casos censurados. A: supervivencia global, p=0,736 (test log-rank). Además, para los pacientes que murieron durante el periodo de estudio, el tiempo hasta la muerte (mediana y rango intercuartílico [RIC]) se ha comparado usando el test de la U de Mann-Whitney. B: supervivencia libre de enfermedad, p=0,780 (test log-rank). Además, para los pacientes que quedaron sin enfermedad residual y presentaron recidivas durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. C: supervivencia libre de recidiva local, p=0,233 (test log-rank). Además, para los pacientes que no quedaron sin enfermedad residual local y presentaron recidiva local durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. D: supervivencia libre de recidiva a distancia, p=0,859 (test log-rank). Además, para los pacientes que no quedaron sin enfermedad residual a distancia y presentaron recidiva a distancia durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. E: supervivencia libre de progresión, p=0,155 (test log-rank). Además, para los pacientes que quedaron con enfermedad residual y progresaron durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. F: supervivencia global excluyendo los pacientes en estadio 4, p=0,287 (test log-rank). Además, para los pacientes que murieron durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. Curvas de Kaplan-Meier y comparación del tiempo hasta cada evento. Excepto para las supervivencias globales, las muertes se han considerado casos censurados. A: supervivencia global, p=0,736 (test log-rank). Además, para los pacientes que murieron durante el periodo de estudio, el tiempo hasta la muerte (mediana y rango intercuartílico [RIC]) se ha comparado usando el test de la U de Mann-Whitney. B: supervivencia libre de enfermedad, p=0,780 (test log-rank). Además, para los pacientes que quedaron sin enfermedad residual y presentaron recidivas durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. C: supervivencia libre de recidiva local, p=0,233 (test log-rank). Además, para los pacientes que no quedaron sin enfermedad residual local y presentaron recidiva local durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. D: supervivencia libre de recidiva a distancia, p=0,859 (test log-rank). Además, para los pacientes que no quedaron sin enfermedad residual a distancia y presentaron recidiva a distancia durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. E: supervivencia libre de progresión, p=0,155 (test log-rank). Además, para los pacientes que quedaron con enfermedad residual y progresaron durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney. F: supervivencia global excluyendo los pacientes en estadio 4, p=0,287 (test log-rank). Además, para los pacientes que murieron durante el periodo de estudio, el tiempo hasta la muerte (mediana y RIC) se ha comparado usando el test de la U de Mann-Whitney.](https://static.elsevier.es/multimedia/0009739X/0000009600000007/v1_201808070420/S0009739X18301040/v1_201808070420/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

