Los materiales sintéticos permanentes son de elección en la actualidad para la reparación de las hernias de la pared abdominal. Sin embargo, no son ideales y se describen complicaciones relacionadas con ellos a corto y largo plazo. Fruto de la investigación y desarrollo de nuevos materiales han surgido los implantes biológicos derivados de la matriz extracelular (IBMEC). En los últimos años han aparecido varios tipos de IBMEC, cada uno con características propias de manufacturación y diferentes a los demás. En este trabajo se analiza el panorama actual de los IBMEC xenogénicos disponibles en nuestro medio, el laberinto que suponen, las incógnitas que plantean a largo plazo y la experiencia clínica disponible en las hernias incisionales e inguinales.
Permanent synthetic materials are currently of choice for abdominal wall hernia repair. However, they are not ideal as short- and long-term complications with these have been reported. Extracellular matrix-derived biological implants (EMDBI) have emerged as a result of research and development into new materials. Several types of EMDBI have appeared in the last few years, each with its own manufacture characteristics and different from the rest. The current panorama of the xenogeneic EMDBI available in Spain is analysed, their complications, the unknown factors arising in the long-term, and the clinical experience available on incisional and inguinal hernias.
Hoy en día colocar una malla sintética permanente parece el mejor método para la reparación de las hernias1–4. La mayoría de las mallas sintéticas hacen más «fuerte» la pared abdominal, pero la respuesta biológica al material puede dar lugar a complicaciones (fístula intestinal, contracción de la malla, adherencias intraperitoneales, sensación de «presencia» de la malla y/o aumento de rigidez de la pared abdominal)5–10.
Las infecciones del material sintético protésico son «temibles» para paciente y cirujano. El microorganismo se adhiere al polímero y genera un biofilm que asegura su supervivencia y garantiza una infección crónica11. La morbilidad y los costes asociados a una malla sintética infectada hacen que el cirujano evite colocarla en ambientes contaminados o con riesgo elevado.
Un foco de intensa investigación es minimizar las complicaciones relacionadas con los materiales sintéticos12. Buscar materiales alternativos que consigan una reparación del defecto duradera y estable en una única operación (especialmente en contextos de contaminación bacteriana), con una pared abdominal funcional y una mejor calidad de vida para el paciente, ha llevado a la era actual de los denominados implantes biológicos derivados de la matriz extracelular (IBMEC). Los IBMEC pueden ser de origen humano -alogénicos- (no permitidos en España) o de origen animal (bovino, porcino) –xenogénicos- (permitidos en España). Las razones para su uso en la hernia son: evitar la infección aguda y/o crónica, la inflamación crónica, y la formación de tejido denso fibroso con un material que finalmente será integrado/biodegradado13. Sus beneficios potenciales son muy atractivos e incluyen una mínima respuesta inflamatoria, reducción de la formación de adherencias y disminución del riesgo de infección en ambientes contaminados o potencialmente contaminados.
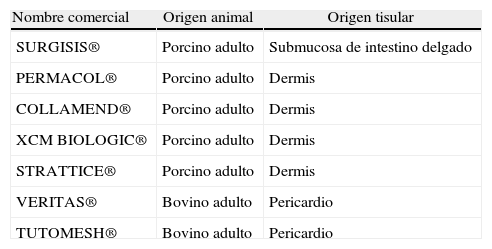
En los últimos años han aparecido en nuestro país varios tipos de IBMEC xenogénicos, cada uno con características propias de manufacturación y diferentes a los demás (tabla 1). En contrapartida, los IBMEC están gravados con unos costes económicos muy altos. El objetivo de este trabajo es analizar los IBMEC xenogénicos disponibles en nuestro medio, el laberinto que suponen, las incógnitas que plantean a largo plazo y la experiencia clínica disponible en las hernias incisionales e inguinales.
Tipos de implantes biológicos derivados de la matriz extracelular xenogénicos disponibles para la reparación herniaria en España
| Nombre comercial | Origen animal | Origen tisular |
| SURGISIS® | Porcino adulto | Submucosa de intestino delgado |
| PERMACOL® | Porcino adulto | Dermis |
| COLLAMEND® | Porcino adulto | Dermis |
| XCM BIOLOGIC® | Porcino adulto | Dermis |
| STRATTICE® | Porcino adulto | Dermis |
| VERITAS® | Bovino adulto | Pericardio |
| TUTOMESH® | Bovino adulto | Pericardio |
Las diferencias en el proceso de obtención y manufacturación de los IBMEC determina para cada implante unas propiedades intrínsecas que pueden dar lugar a respuestas biológicas diferentes tras su implantación in vivo. Hablar exclusivamente de los IBMEC como «matrices acelulares» o «andamios de colágeno» puede ser inadecuado si no se conocen bien las características específicas de cada implante y su comportamiento biológico. Pero, ¿qué es lo que hace del conocimiento de estos materiales y de su correcta elección un auténtico laberinto?:
El origen del materialLos IBMEC derivan de matrices extracelulares (MEC) de mamíferos. Estas MEC son geles compuestos de proteínas fibrilares (algunas estructurales como el colágeno, y otras con capacidad de conexión y reconocimiento celular, como la elastina), interconectadas a una red de cadenas de glucosaminóglicanos. Su principal función es conferir un andamiaje estructural que, combinado con el líquido intersticial, permita resistir los estreses tensiles (vía fibras), y de compresión tisulares (vía matriz hidratada). La arquitectura fibrilar anisotrópica de las MEC afecta el comportamiento celular. La conexión estrecha existente entre el citoesqueleto y la MEC permite que las células capten y respondan a cambios mecánicos de su entorno, convirtiendo señales mecánicas en señales químicas que afectarán a diferentes funciones celulares (adhesión, migración, etc.). Según la procedencia de los IBMEC (especie y edad animal; tejido de los cuales derivan, etc.), se obtienen diferentes microestructuras con propiedades también diversas. El principal reto actual es poder controlar la dinámica y la organización espacial para poder presentar las múltiples señales existentes en la MEC para su aplicación en la reparación y/o sustitución de tejidos14.
El procesamiento del materialLos materiales disponibles son procesados de diferentes maneras (en ocasiones solo conocidas por el fabricante). Destacan 3 aspectos:
- 1.
La manera de eliminar las células de la MEC, pudiendo ser: mínima (reteniendo proteínas - elastina, proteoglicanos o fibronectina -)15,16 o máxima (solo quedan las fibras de colágeno)17. Además, los IBMEC que son secados o liofilizados para su almacenamiento final antes de su uso pueden tener variaciones en el tamaño de sus poros o en la tasa de rehidratación, lo que incide en la capacidad de infiltración y vascularización del implante por el huésped17.
- 2.
El crosslinking artificial: el colágeno natural se compone de 3 cadenas polipeptídicas estabilizadas en forma de triple hélice mediante uniones intermoleculares (crosslink natural) tipo puentes de hidrógeno. Esa cadena compacta es la que confiere la elevada fuerza tensil al colágeno18. El crosslink artificial se utiliza en los IBMEC para dar estabilidad al colágeno y así reducir la eventual y rápida degradación de estos materiales «in vivo»18. Para ello, se emplean diferentes métodos: glutaraldehído, hexametilendiisocianato [HMDI], 1-etil-3 carbodiimida [EDC]. Sin embargo, no todos los IBMEC llevan crosslink artificial, hay materiales que utilizan otras metodologías de procesamiento consiguiendo persistencia clínica sin necesidad de estabilización artificial. Todos pueden determinar una respuesta celular diferente en el huésped una vez implantados.
- 3.
La esterilización del material: los IBMEC xenogénicos son esterilizados en su procesado final para asegurar la ausencia de bacterias o virus. El proceso de esterilización varía para cada material (óxido de etileno, irradiación gamma, irradiación e-beam). El proceso de esterilización usado puede variar la respuesta biológica final del material en el huésped19.
- 4.
Las propiedades mecánico-físicas: las propiedades mecánico-físicas de los IBMEC dependerán de su origen, procesado, crosslinking y esterilización. Las dimensiones y espesor variarán de unos a otros haciendo variar el módulo elástico y su resistencia. Además, las propiedades mecánicas iniciales variarán con el tiempo haciendo que no sean un buen indicador del resultado clínico final20.
La cicatrización normal siguiendo una intervención quirúrgica resulta en una inflamación aguda que se extiende aproximadamente durante 2 semanas, seguida por una fase de remodelación durante semanas o años por la lenta reorganización del tejido reparado. Cómo afecta a este proceso la adición de un IBMEC o cómo el proceso de cicatrización afecta al IBMEC variará dependiendo del tipo de producto. No hay estudios clínicos comparativos aleatorizados en este sentido21. Solo algunos productos han sido evaluados por separado a nivel experimental identificándose al menos 5 posibles respuestas biológicas:
- a)
de no incorporación del IBMEC10,15,22:
- -
Encapsulación
- -
Rechazo
- -
- b)
de incorporación del IBMEC15,16,23–28:
- -
Resorción
- -
Integración con progresiva degradación
- -
Adopción y adaptación
- -
Las incógnitas a largo plazo de los IBMEC actuales se originan, en nuestra opinión, de su propia razón de ser: la búsqueda de materiales alternativos a los biopolímeros con los que conseguir una reparación del defecto duradera y estable en una única operación (especialmente en contextos de contaminación bacteriana), con una pared abdominal funcional y una mejor calidad de vida para el paciente después de la reparación.
Restauración funcionalLa restauración funcional de la pared abdominal es esencial para el éxito clínico de la reparación de una hernia cuando se utiliza un material protésico4. Los IBMEC no son una excepción a esta necesidad. Naturalmente, y dado que hoy por hoy ningún material reproduce todas las funciones de la pared abdominal, cuando se menciona restauración funcional nos referimos básicamente a la capacidad de contención de las vísceras y, como consecuencia, a la estabilización del tronco y su repercusión en la mejoría de la respiración, el movimiento y la postura. Estas propiedades dependerán, en último término, de las características mecánicas del material. Faltan datos objetivos en lo que respecta al efecto a largo plazo sobre la función de la pared abdominal tras la utilización de los IBMEC. Una posibilidad es que los IBMEC actuales fueran poco eficaces en el restablecimiento completo a largo plazo de la capacidad de contención visceral y eventualmente llevarán al paciente a sentir malestar y empobrecimiento de su calidad de vida29. Estudios experimentales recientes parecen mostrar una disminución de las propiedades mecánicas de algunos implantes biológicos tras la infección bacteriana30. Sin embargo, también hay datos de que con el tiempo los IBMEC han mostrado «recuperar» función mecánica a medida que son «infiltrados» por células31,32. A pesar de esto, la utilidad clínica (i.e. restauración funcional) de los IBMEC finalmente dependerá de un delicado equilibrio entre la tasa de degradación y la tasa de infiltración, que puede verse afectado por el grado de infección. En consecuencia y dado que los IBMEC se publicitan para su uso especialmente en contextos de contaminación bacteriana, las propiedades mecánicas (y por tanto la respuesta funcional a largo plazo) pueden ser completamente diferentes dependiendo del escenario séptico en el que se utilicen (infección crónica, infección aguda, contaminación franca, cirugías con apertura intestinal, fístulas o peritonitis). Es evidente que se necesitan más estudios sobre el comportamiento funcional a largo plazo de los IBMEC y de las características que se han de mantener en los implantes para que la correcta función mecánica sea duradera.
DegradaciónUn material ideal para la reparación de la pared abdominal sería aquel que una vez implantado realizara la función de reparación (tisular/funcional) de la pared abdominal dañada y después desapareciese. Finalmente, la utilidad (resultados) clínica de ese material degradable dependería de un delicado equilibrio entre la tasa de degradación y la tasa de infiltración. Si el material se degrada previamente a una adecuada infiltración celular, neovascularización y depósito y diferenciación de colágeno, la calidad global y resistencia del tejido neoformado pueden ser insuficientes para asegurar una reparación duradera y estable de la pared abdominal. La degradación se puede ver afectada por la infección y el crosslinking.
InfecciónLa infección puede acelerar la tasa de degradación y por lo tanto la prevención de la infección del IBMEC se plantea como una necesidad importante. Prevenir la infección de un IBMEC puede ser un desafío particular, sobre todo porque estos implantes se indican en cirugías contaminadas o en pacientes con elevado riesgo de infección (inmunosuprimidos). Estos materiales no tienen propiedades intrínsecas de manufacturación que les hagan resistentes a la infección. Sin embargo, trabajos presentes en la literatura mencionan una cierta resistencia o capacidad de defensa de los IBMEC frente a la misma33–38. La resistencia de los IBMEC a la infección puede depender de su capacidad de liberar péptidos antimicrobianos cuando se degradan in vivo y de la estimulación rápida y precoz de la neovascularización. Sin embargo, cuando los IBMEC son colonizados por grandes inóculos de bacterias serán rápidamente degradados38. En otras palabras, la capacidad de un IBMEC de «incorporarse» con éxito en la reparación de una pared abdominal contaminada o infectada dependerá de las características de esa contaminación o infección (mayores o menores inóculos de bacterias) y de la velocidad con que se produzca la angiogénesis. Clínicamente, parece que dependiendo del grado de infección37,38 y la consecuente inflamación que esta produce (evidencias recientes sugieren que la respuesta inflamatoria a la infección puede ser tan perniciosa para el tejido como las propias bacterias que la generan)39 los IBMEC pueden alterar su arquitectura normal llevando a una degradación del implante y fracaso de la reparación. Cuando esto ocurre, no solo se quedará el paciente con su hernia original sino que se añadirá la morbilidad de una supuesta operación adicional posterior.
Todo lo anterior sugiere que los IBMEC puede que no sean una buena opción en contextos de infección con presencia de grandes inóculos de bacterias que generan procesos inflamatorios secundarios intensos. Futuras investigaciones han de incorporar el desarrollo de implantes que resistan la colonización bacteriana y que puedan minimizar respuestas inflamatorias vigorosas, para así evitar una rápida degradación en ambientes con grandes inóculos bacterianos manteniendo la suficiente capacidad de reforzar la pared abdominal y promover la remodelación tisular.
CrosslinkingComo se menciona más arriba el crosslinking fue añadido a los IBMEC con el objetivo de aumentar la durabilidad de estos materiales. Cuando se estudia en modelos experimentales15,40–46 los materiales con crosslink pueden no proporcionar la misma cantidad de infiltración celular y neovascularización que los materiales no crosslink determinando finalmente elevadas tasas de encapsulación del implante y su posible persistencia in vivo. Esta repuesta puede ser deseable si los resultados clínicos que se persiguen son congruentes con los derivados del uso de polímeros no degradables. Sin embargo, IBMEC encapsulados en teoría pueden producir las mismas complicaciones clínicas que otros materiales permanentes que reaccionan siguiendo la clásica respuesta a cuerpo extraño: migración, extrusión 10,22,47 o desestructuración del material secundaria a la inflamación crónica48.
Experiencia clínica con implantes biológicos derivados de la matriz extracelular en las hernias incisionales/ventralesProbablemente la primera publicación sobre el uso clínico de IBMEC se realiza en 199549. En el 2004 se publica el uso de estos materiales como una alternativa en la reconstrucción de la pared abdominal50. Desde entonces, la única revisión sistemática sobre la utilidad de los IBMEC en diferentes tipos de hernia de la pared abdominal ha sido publicada en 200921. En esta revisión se muestra que solo se dispone de datos en humanos con 4 tipos de IBMEC: dermis de origen humano (alogénico), dermis de origen porcino con crosslink (xenogénico), submucosa de intestino delgado (xenogénico) y pericardio bovino (xenogénico). Todos los trabajos que se revisan en el articulo suman un total de 80 publicaciones. Desafortunadamente, los datos derivados del análisis de los trabajos con materiales alogénicos (aunque orientativos) son de poca utilidad en nuestro medio para el proceso de toma de decisiones ya que, como se ha mencionado más arriba, los materiales alogénicos no se comercializan en nuestro país ni en nuestro entorno (i.e. Europa). Por lo tanto, esa revisión nos aporta datos útiles para la práctica en nuestro país de solo 3 IBMEC, constituyendo un total de 48 publicaciones. De las cuales solo 16 son sobre la hernia incisional/ventral. Varias reflexiones se extraen de este trabajo:
- 1)
las tasas de recurrencia para los materiales xenogénicos estudiados son difíciles de interpretar por la disparidad y heterogeneidad de los datos (i.e. contextos de tratamiento, materiales, pacientes, técnicas)
- 2)
la mayoría de los estudios utilizan estos materiales en contextos quirúrgicos limpios. Es posible,y dado que la mayoría de los trabajos provienen de los Estados Unidos de América, que esta circunstancia se derive de las propias características de la legislación y de los mecanismos de regulación en referencia al uso de materiales para la reparación herniaria existentes en ese país que limitan la aprobación del uso clínico de materiales en situaciones específicas (i.e. heridas infectadas) a una serie de requisitos previos51.
- 3)
la mayoría de los trabajos clínicos publicados son con un IBMEC no disponible en nuestro medio (dermis de origen humano)
- 4)
la calidad y el nivel de evidencia de los trabajos es limitada, clasificándose por los propios autores como baja.
Desde 2009 y hasta el momento de escribir este artículo hemos encontrado algunos trabajos clínicos más en la literatura de la hernia incisional/ventral utilizando el material xenogénico y tanto crosslink como no crosslink52–62. Aunque estos estudios han aumentado nuestro conocimiento clínico en los diferentes tipos de IBMEC, es posible que la utilidad y limitaciones de estos materiales no se discuta de forma amplia. En nuestra opinión, del análisis de la evidencia actual de estos materiales en la cirugía de la hernia incisional/ventral se extraen las siguientes consideraciones:
- 1)
No hay ninguna superioridad clínica irrefutable de un IBMEC sobre otro.
- 2)
Cada IBMEC «funciona» de forma diferente y puede que no sean clínicamente intercambiables.
- 3)
Aunque se necesitan datos clínicos de los resultados a largo plazo (recurrencia y calidad de vida), parece que un mensaje clínico constante es que ningún tipo de IBMEC se debe colocar en contextos de infección grave (i.e. grandes inóculos bacterianos). Se ha de recordar que una infección grave puede llegar a causar la destrucción del mejor de los tejidos conectivos naturales (i.e. fascitis necrotizante).
En el año 2010 el Ventral Hernia Working Group (VHWG) publica un sistema de gradación de la hernia incisional/ventral recomendando la intervención y el tipo de prótesis (incluidos los IBMEC) a colocar en diferentes escenarios clínicos63. Los propios autores enfatizan que su trabajo se basa en la «mejor» evidencia disponible y reconocen la debilidad actual de la misma. Además, mencionan que su sistema de gradación se debe beneficiar de un estudio critico con validación a través de la clínica y se comprometen a revisarlo a medida que evolucione la evidencia. En nuestra opinión, este sistema puede ser de ayuda para el cirujano cuando quiera utilizar un IBMEC, pero no se ha de tomar en el momento actual como la «guía» a seguir cuando se quieren utilizar o recomendar la utilización de estos materiales.
Para la reparación de la hernia incisional/ventral se describen técnicas con prótesis tanto abiertas como laparoscópicas. Las técnicas abiertas pueden ser: puenteo (inlay), suprafascial (onlay) o retrofascial (sublay-underlay). Una reparación de puenteo significa no realizar cierre del defecto. Una reparación suprafascial o retrofascial constituyen un refuerzo con el material protésico de una reparación fascial previa. Las técnicas laparoscópicas son en su mayoría puenteos.
En la actualidad, los materiales biológicos se utilizan tanto para la reparación abierta suprafascial como retrofascial y se acepta que los IBMEC no son efectivos cuando se utilizan como puenteo para reparar un orificio herniario en cirugía abierta28,64,65, la razón es que se requiere un cierre previo del defecto para promover una adecuada infiltración celular y angiogénesis. Si esto puede limitar el uso de los IBMEC en la reparación laparoscópica de la hernia incisional/ventral solo lo dirán estudios con resultados a largo plazo.
Experiencia clinica con implantes biológicos derivados de la matriz extracelular en las hernias inguinalesEn la revisión sistemática sobre la utilidad de los IBMEC publicada en 2009 y mencionada más arriba se incluyen 13 trabajos que hacen referencia al uso de materiales biológicos xenogénicos en la reparación de la hernia inguinal. Los datos que se extraen de estos trabajos son difíciles de interpretar por su disparidad/limitación en la indicación (aunque hay trabajos en contextos contaminados la mayoría se realizan en situaciones de cirugía limpia) y en el tipo de material (la mayoría de los trabajos son con submucosa de intestino delgado), siendo de utilidad limitada en el proceso de la toma de decisiones clínicas. Desde la publicación de la revisión sistemática ha aparecido algún trabajo clínico más en el contexto de las hernias inguinales66–68. Al igual que se menciona para la hernia incisional/ventral, creemos que hoy por hoy la utilización de los IBMEC en la cirugía de la hernia inguinal debe hacerse desde las premisas de que no son materiales intercambiables en su aplicación clínica, no existiendo superioridad de ninguno sobre los demás y que no deben colocarse en casos de infecciones con grandes inóculos bacterianos.
Técnica de reparaciónLa tendencia actual en la reparación de la hernia inguinal es la incorporación de la cirugía laparoscópica, bien mediante un abordaje transabdominopreperitoneal (TAPP) o mediante un abordaje totalmente extraperitoneal (TEP)69,70. En los casos en que se indique un abordaje laparoscópico no queda claro con los datos actuales si los IBMEC pueden tener utilidad ahora o en el futuro66.
SumarioLas mallas sintéticas son claramente el material de elección en muchas cirugías de la pared abdominal4,71. Clínicamente hay datos de que los IBMEC pueden ser efectivos, aunque los trabajos clínicos de grado máximo de evidencia (nivel i) son prácticamente inexistentes y no hay consenso de cómo o cuando usar los implantes biológicos y no hay datos a largo plazo de los efectos derivados de su aplicación (respuesta funcional/durabilidad). Desde el punto de vista experimental los estudios en general son buenos pero en ocasiones los parámetros estudiados son redundantes y con seguimientos cortos, lo que hace difícil su interpretación y traslación a la practica diaria.
En el contexto previo puede ser razonable utilizar los implantes biológicos solo en casos seleccionados donde las mallas sintéticas convencionales estén contraindicadas (inmunocomprometidos, situaciones de cirugías contaminadas o con infecciones crónicas sin grandes inóculos bacterianos). No se recomienda su uso en situaciones de infección con grandes inóculos bacterianos. Las indicaciones de su uso es posible que se vayan expandiendo, pero son necesarios estudios prospectivos y aleatorizados con seguimientos largos, que determinen la eficacia, aplicabilidad, relación riesgo/beneficio y calidad de vida derivados del uso de estos materiales72. Los registros de su uso también aportaran datos que sirvan de guía73.
En ausencia de una evidencia científica robusta la elección de un IBMEC en la reparación de defectos de la pared abdominal se basará en factores como: el tipo de hospital y recursos económicos de que disponga, el tipo de defecto de pared y el escenario clínico al que se asocie (relación coste-efectividad), el propio desarrollo progresivo de los IBMEC y de manera más importante, de las preferencias del cirujano, de su nivel de conocimientos y experiencia con estos materiales y obviamente, de las preferencias del paciente después de una amplia información del «estado del arte» de las diferentes opciones.
FinanciaciónEste trabajo ha recibido soporte parcial por el Ministerio de Ciencia e Innovación. Instituto de Salud Carlos III. PI10/01431.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.