La afectación microscópica de los márgenes de resección es un factor pronóstico fundamental en la cirugía del cáncer de páncreas. Sin embargo, su definición anatomopatológica no está estandarizada. Este estudio pretende identificar el porcentaje real de pacientes con resecciones R1 al analizar las piezas quirúrgicas con un protocolo estandarizado y evaluar sus implicaciones sobre la supervivencia.
Pacientes y métodosSerie de 100 pacientes consecutivos intervenidos por adenocarcinoma ductal de páncreas y resecciones macroscópicamente completas, divididos en 2 grupos: pre- y posprotocolo, según se intervinieran antes o después de la aplicación de un protocolo estandarizado de las piezas de resección.
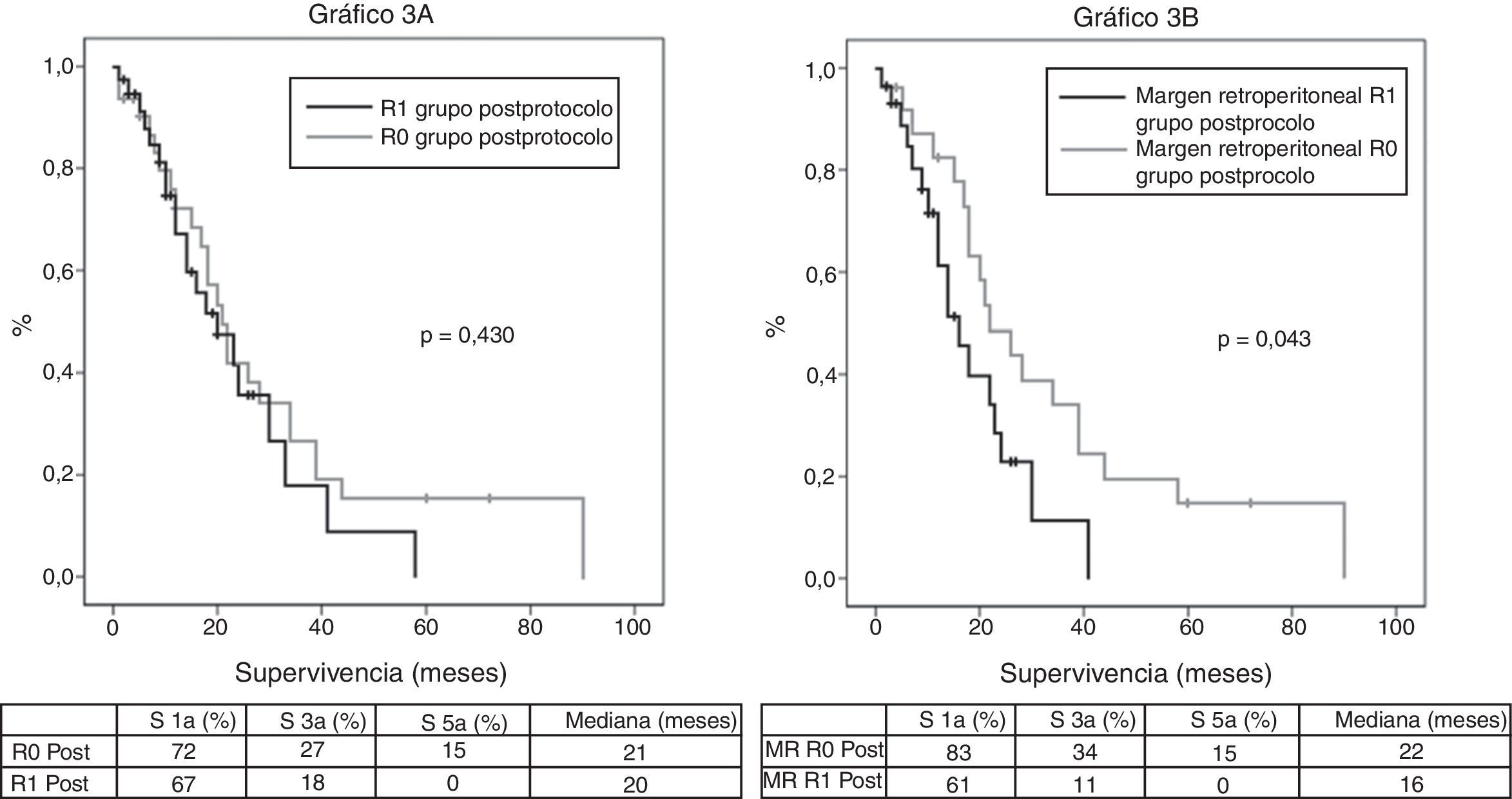
ResultadosEn el grupo preprotocolo la tasa de resecciones R0 fue del 78%, mientras que tras la aplicación del mismo, se redujo al 47% (p=0,003). El margen posterior retroperitoneal es el que se encuentra afectado con mayor frecuencia. En los casos con tumores localizados en cabeza de páncreas y analizados con el protocolo estandarizado, la detección del margen retroperitoneal afecto (R1) influye de forma negativa en la supervivencia. La mediana de supervivencia del grupo R0 fue de 22 meses frente a 16 meses en los que presentaban margen afecto (HR: 2,044; IC 95% 1,00-4,16; p=0,043).
ConclusionesLa aplicación de un protocolo estandarizado para el estudio del margen retroperitoneal en el cáncer de páncreas incrementa la proporción de pacientes R1. En los pacientes con cáncer de cabeza de páncreas, la afectación del margen posterior retroperitoneal reduce significativamente la supervivencia.
Involvement of surgical resection margins is a fundamental prognostic factor in pancreatic oncological surgery. However, there is a lack of standardized histopathology definition. The aims of this study are to investigate the real rate of R1 resections when surgical specimens are evaluated according to a standardized protocol and to study its survival implications.
Patients y methodsOne hundred consecutive surgically resected patients with pancreatic ductal adenocarcinoma were included in the study. They were further divided in 2 groups: pre-protocol, evaluated before the introduction of the standardized protocol and post-protocol, analyzed with the standardized protocol.
ResultsR0 resection rate in the pre-protocol group was 78%, falling to 47% after the introduction of the standardized protocol (p=0,003). The posterior retroperitoneal margin was the most frequently involved margin. In cases with tumors located at the pancreatic head and analyzed according to the standardized protocol R1 involvement negatively affected survival. Median survival in the R0 group was 22 months versus 16 in those with the margin involved (HR: 2.044; IC 95% 1,00-4,16; P=.043).
ConclusionsStandardized evaluation of the retroperitoneal margins in pancreatic cancer increases the rate of R1 patients. In cases with pancreatic cancer located at the pancreatic head involvement of posterior retroperitoneal margin significantly decreases survival.
El adenocarcinoma ductal de páncreas es un tumor biológicamente muy agresivo. Menos del 25% de los casos son tributarios de tratamiento quirúrgico con intención curativa, única opción que permite alcanzar supervivencia a largo plazo.
Uno de los factores que más podrían influir en los resultados de la cirugía oncológica es la afectación de los márgenes de resección, tanto de forma microscópica (R1) como macroscópica (R2). Por eso sorprende que, a diferencia de lo que sucede en otros tipos de tumores, en el cáncer de páncreas muchos pacientes con resecciones oncológicas tengan igualmente unas altas tasas de recurrencia local y baja supervivencia, independientemente de que las resecciones quirúrgicas sean R0 o R1. La falta de relación clara y directa entre la afectación microscópica de los márgenes de resección y la supervivencia que se ha puesto de manifiesto en diferentes series y un metaanálisis 1–7 podría ser reflejo de la gran variabilidad de la tasa de afectación de los márgenes que presentan las series, que oscila entre el 16 y el 85%6,8. Esta variabilidad conduce a pensar en la falta de protocolos estandarizados en el análisis histopatológico de las piezas de resección, lo que hace probable que se estén infraestimando las verdaderas tasas de resecciones R1.
El objetivo de este estudio pretende identificar el porcentaje real de pacientes con resecciones R1 al analizar las piezas quirúrgicas con un protocolo estandarizado y, además, evaluar el efecto pronóstico de la afectación microscópica del margen sobre la supervivencia.
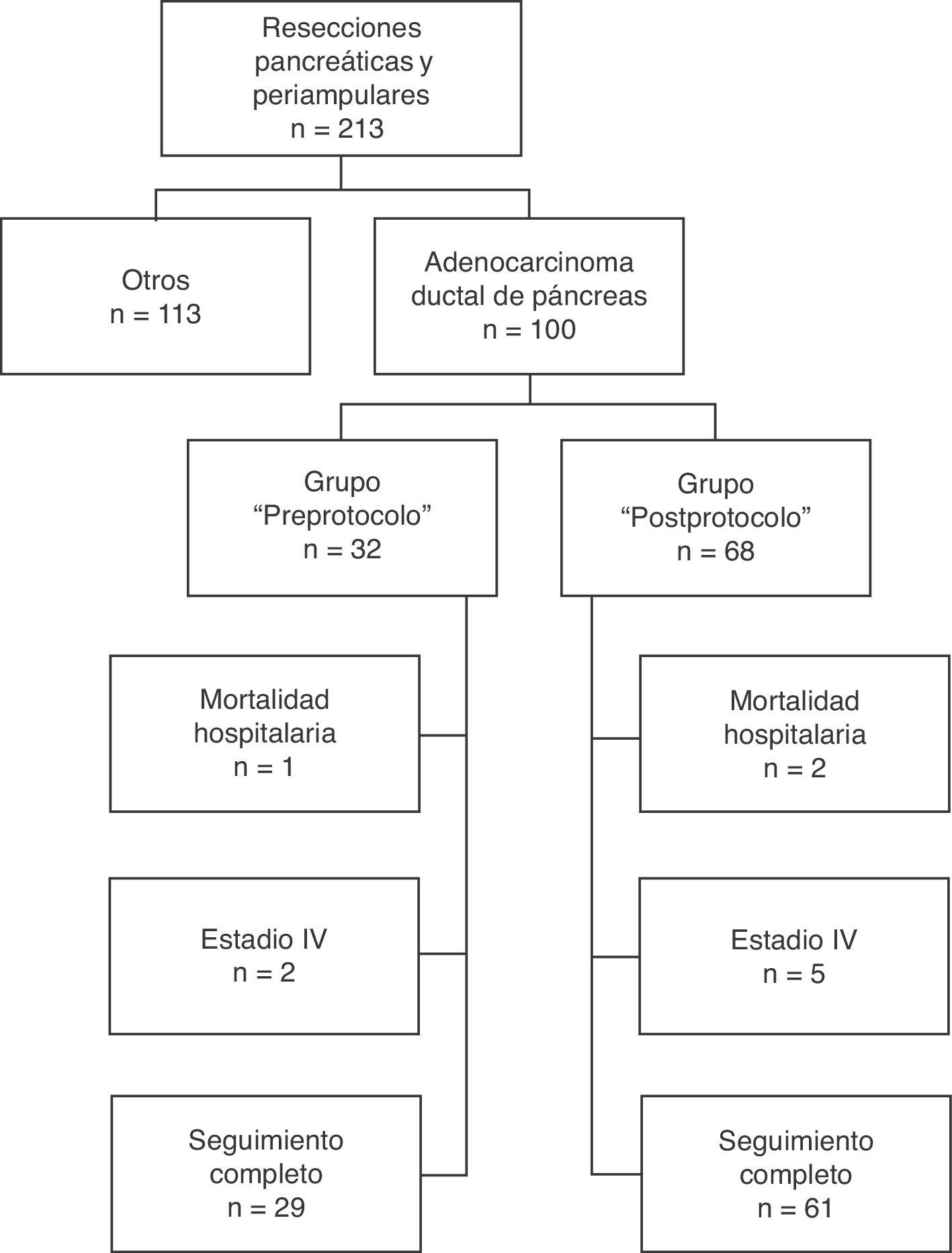
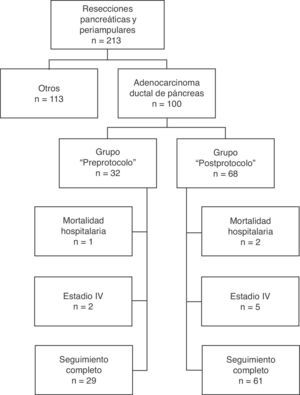
Pacientes y métodosSelección de pacientesTodos los pacientes han sido intervenidos de forma consecutiva en la Unidad de Cirugía Hepato-Bilio-Pancreática del Hospital Clínico Universitario de Valencia durante un periodo de 14 años (1 de enero de 1999 a 31 de diciembre de 2012) e incluidos en una base de datos de forma prospectiva. De las 213 resecciones pancreáticas realizadas con intención curativa, en 100 casos se realizó por adenocarcinoma ductal de páncreas, constituyendo estos pacientes el grupo de estudio. A finales de 2003, al constatar en los informes anatomopatológicos de los pacientes intervenidos hasta entonces una alta tasa de resecciones R0 pero la misma baja supervivencia que en la literatura, y en el contexto de un grupo multidisciplinar de tumores del área hepatobiliopancreática, se decidió revisar el procedimiento de manejo y tallado de las piezas realizado hasta entonces y desarrollar un protocolo estandarizado de las piezas de resección9. Tras su desarrollo e implantación por parte del Servicio de Anatomía Patológica se inició su aplicación a principios de 2004. En consecuencia, en nuestro estudio los pacientes incluidos se dividen en 2 grupos: aquellos intervenidos antes del año 2004, grupo «preprotocolo» en los que las piezas se analizaron sin un protocolo estandarizado y aquellos intervenidos desde el 2004, grupo «posprotocolo». El diagrama de flujo de pacientes incluidos en este estudio, observacional de cohortes, se muestra en la figura 1.
Manejo quirúrgico y seguimientoTodos los pacientes fueron evaluados previamente en un comité multidisciplinario donde se decide la indicación quirúrgica y se evalúa la potencial resecabilidad. Las indicaciones, evaluación de la resecabilidad y las técnicas quirúrgicas utilizadas ya han sido publicadas previamente10. El seguimiento se realizó con citaciones periódicas por parte del Servicio de Cirugía o por el Servicio de Oncología Médica. La fecha de muerte se identifica por conocimiento directo en los pacientes que fallecen en el hospital, en la Unidad de Cuidados Paliativos o en Hospitalización Domiciliaria y por contacto telefónico con los familiares en el resto de los casos.
Protocolo anatomopatológicoEn los pacientes del grupo preprotocolo, el análisis de las piezas de resección se realizó según el criterio personal del patólogo asignado a cada caso. En los pacientes operados tras la implantación del protocolo estandarizado, grupo posprotocolo, todas las piezas han sido responsabilidad de 2 patólogos (AF y MCGM) que las han evaluado según un protocolo estandarizado de tallado, estudio e informe anatomopatológico publicado por nuestro grupo9. Básicamente, dicho protocolo consiste en que tras las preceptivas 24-48h de fijación de la pieza quirúrgica, el patólogo identifica y pinta con tintas de diferentes colores según un código establecido los diferentes márgenes de resección que incluyen: margen de transección pancreática y margen de resección circunferencial (MRC) que comprende a su vez el margen circunferencial medial o vascular y el margen circunferencial posterior o retroperitoneal en la duodenopancreatectomía cefálica (DPC) y el margen posterior en la resecciones de cuerpo-cola de páncreas o totales. A continuación, se toman muestras de los márgenes luminales (biliar, gástrico o duodenal y yeyunal) y se buscan todas las posibles adenopatías. Posteriormente, se realiza una sección perpendicular a la pared duodenal a nivel de la ampolla de Vater, incluyendo la pared duodenal y el páncreas y, seguidamente, secciones paralelas a la anterior separadas por una distancia de unos 5mm aproximadamente hacia el estómago (proximales) y hacia el duodeno (distales), obteniendo secciones seriadas de todo el páncreas resecado. El examen histopatológico incluye el tipo tumoral, la localización, tamaño, grado de extensión y de diferenciación, invasión vascular, linfática y perineural, número total de ganglios examinados y ganglios positivos. En nuestro protocolo se considera R1 la presencia de tumor residual microscópico a una distancia ≤ 1mm, en cualquiera de los márgenes analizados.
Análisis estadísticoEl análisis descriptivo de las variables cuantitativas se presenta como media y desviación estándar o mediana y rango, y el de las variables cualitativas en forma de porcentaje. Se ha empleado la prueba de chi2 para la comparación de las variables dicotómicas y la t de Student para las variables continuas. Se realizan las curvas de Kaplan Meier para el estudio de supervivencia y se utiliza el test de log rank para la comparación de las curvas. Se consideró significativo en todos los tests realizados un valor de p<0,05.
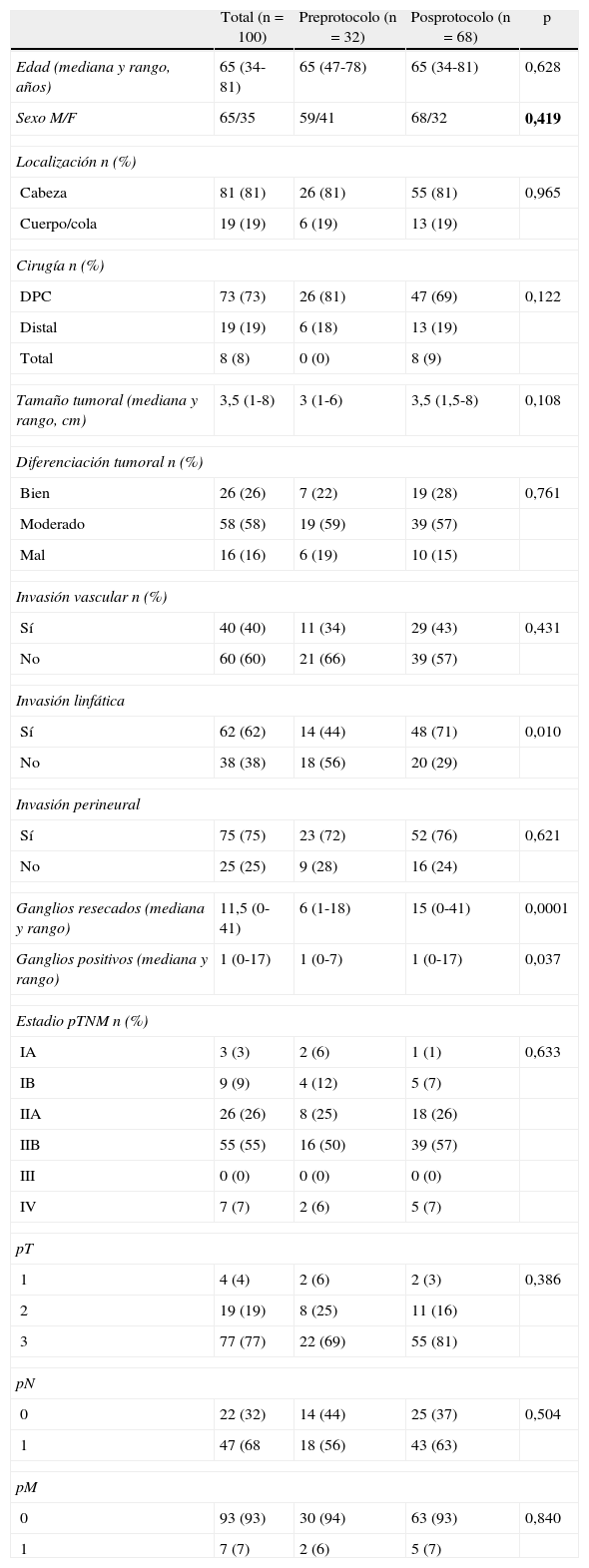
ResultadosCaracterísticas clínicas e histopatológicas.De los 100 pacientes incluidos, el 65% eran de sexo masculino y el 35% femenino, con una edad media de 64,6±8 años. El grupo preprotocolo está constituido por 32 pacientes y el grupo posprotocolo por 68 casos. Las características demográficas, localización tumoral, tipo de intervención y estudio histológico se muestran en la tabla 1. Se observan diferencias significativas en el grupo posprotocolo con una mayor proporción de casos con invasión linfática, un mayor número de ganglios examinados y de ganglios positivos.
Características clínicas e histopatológicas de la serie y por grupos
| Total (n=100) | Preprotocolo (n=32) | Posprotocolo (n=68) | p | |
| Edad (mediana y rango, años) | 65 (34-81) | 65 (47-78) | 65 (34-81) | 0,628 |
| Sexo M/F | 65/35 | 59/41 | 68/32 | 0,419 |
| Localización n (%) | ||||
| Cabeza | 81 (81) | 26 (81) | 55 (81) | 0,965 |
| Cuerpo/cola | 19 (19) | 6 (19) | 13 (19) | |
| Cirugía n (%) | ||||
| DPC | 73 (73) | 26 (81) | 47 (69) | 0,122 |
| Distal | 19 (19) | 6 (18) | 13 (19) | |
| Total | 8 (8) | 0 (0) | 8 (9) | |
| Tamaño tumoral (mediana y rango, cm) | 3,5 (1-8) | 3 (1-6) | 3,5 (1,5-8) | 0,108 |
| Diferenciación tumoral n (%) | ||||
| Bien | 26 (26) | 7 (22) | 19 (28) | 0,761 |
| Moderado | 58 (58) | 19 (59) | 39 (57) | |
| Mal | 16 (16) | 6 (19) | 10 (15) | |
| Invasión vascular n (%) | ||||
| Sí | 40 (40) | 11 (34) | 29 (43) | 0,431 |
| No | 60 (60) | 21 (66) | 39 (57) | |
| Invasión linfática | ||||
| Sí | 62 (62) | 14 (44) | 48 (71) | 0,010 |
| No | 38 (38) | 18 (56) | 20 (29) | |
| Invasión perineural | ||||
| Sí | 75 (75) | 23 (72) | 52 (76) | 0,621 |
| No | 25 (25) | 9 (28) | 16 (24) | |
| Ganglios resecados (mediana y rango) | 11,5 (0-41) | 6 (1-18) | 15 (0-41) | 0,0001 |
| Ganglios positivos (mediana y rango) | 1 (0-17) | 1 (0-7) | 1 (0-17) | 0,037 |
| Estadio pTNM n (%) | ||||
| IA | 3 (3) | 2 (6) | 1 (1) | 0,633 |
| IB | 9 (9) | 4 (12) | 5 (7) | |
| IIA | 26 (26) | 8 (25) | 18 (26) | |
| IIB | 55 (55) | 16 (50) | 39 (57) | |
| III | 0 (0) | 0 (0) | 0 (0) | |
| IV | 7 (7) | 2 (6) | 5 (7) | |
| pT | ||||
| 1 | 4 (4) | 2 (6) | 2 (3) | 0,386 |
| 2 | 19 (19) | 8 (25) | 11 (16) | |
| 3 | 77 (77) | 22 (69) | 55 (81) | |
| pN | ||||
| 0 | 22 (32) | 14 (44) | 25 (37) | 0,504 |
| 1 | 47 (68 | 18 (56) | 43 (63) | |
| pM | ||||
| 0 | 93 (93) | 30 (94) | 63 (93) | 0,840 |
| 1 | 7 (7) | 2 (6) | 5 (7) | |
Distal: pancreatectomía corporocaudal; DPC: duodenopancreatectomía cefálica; Total: duodenopancreatectomía total.
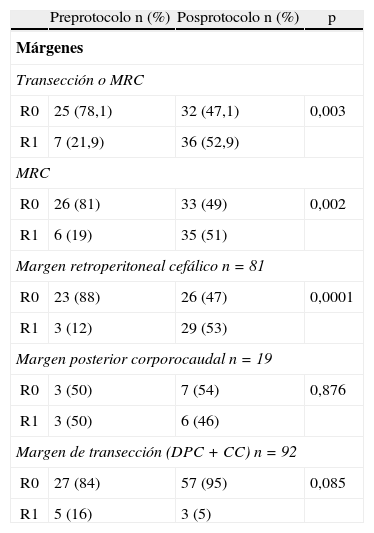
El estudio de los márgenes de resección y las tasas de R0/R1 se presentan en la tabla 2. En el grupo preprotocolo la tasa de R0 fue del 78%, pasando al 47% tras la aplicación del protocolo estandarizado (p=0,003). En la evaluación de los diferentes márgenes analizados, la afectación del margen circunferencial fue significativamente superior en el grupo posprotocolo (51 versus 19%; p=0,002). Esta diferencia se obtiene a partir de la afectación del margen posterior retroperitoneal en las DPC, ya que ni el margen posterior de las resecciones corporocaudales ni los márgenes de transección en todos los tipos de resecciones son significativamente diferentes entre los grupos de estudio.
Estudio de los márgenes de resección y tasas de R0/R1
| Preprotocolo n (%) | Posprotocolo n (%) | p | |
| Márgenes | |||
| Transección o MRC | |||
| R0 | 25 (78,1) | 32 (47,1) | 0,003 |
| R1 | 7 (21,9) | 36 (52,9) | |
| MRC | |||
| R0 | 26 (81) | 33 (49) | 0,002 |
| R1 | 6 (19) | 35 (51) | |
| Margen retroperitoneal cefálico n=81 | |||
| R0 | 23 (88) | 26 (47) | 0,0001 |
| R1 | 3 (12) | 29 (53) | |
| Margen posterior corporocaudal n=19 | |||
| R0 | 3 (50) | 7 (54) | 0,876 |
| R1 | 3 (50) | 6 (46) | |
| Margen de transección (DPC+CC) n=92 | |||
| R0 | 27 (84) | 57 (95) | 0,085 |
| R1 | 5 (16) | 3 (5) | |
Cefálico: tumores localizados en cabeza del páncreas; Corporocaudal: tumores localizados en cuerpo/cola del páncreas; DPC+CC: duodenopancreatectomías + resecciones corporocaudales (se excluyen pancreatectomías totales); MRC: margen circunferencial.
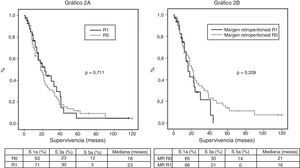
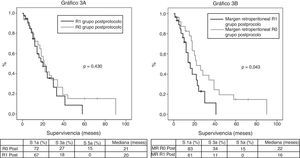
De los 100 pacientes de la serie, se ha excluido para el estudio de supervivencia a 10 pacientes: 3 por mortalidad postoperatoria y 7 por considerarse estadio IV con implantes peritoneales o hepáticos microscópicos detectados en la anatomía patológica definitiva. En consecuencia, en esta fase del estudio el grupo preprotocolo queda formado por 29 pacientes y el grupo posprotocolo por 61. La supervivencia global de la serie a 1, 3 y 5 años fue del 73, 29, y 11% respectivamente, con una mediana de 20 meses. Al analizar toda la serie, incluyendo pacientes preprotocolo y posprotocolo, no existen diferencias significativas entre la supervivencia de los pacientes R0 frente a R1 (fig. 2A). Tampoco se han encontrado diferencias en la supervivencia entre los pacientes R0 y R1 al analizar el margen retroperitoneal de los casos con tumores de cabeza de páncreas (incluyendo ambos grupos conjuntamente, pre- y posprotocolo) (fig. 2B), ni tampoco al analizar las diferencias entre los pacientes R0 o R1 solo en el grupo posprotocolo (fig. 3A). Sin embargo, al evaluar el margen retroperitoneal en los pacientes con tumores de cabeza de páncreas estudiados con el protocolo estandarizado, sí se aprecia una clara diferencia estadísticamente significativa en la supervivencia (fig. 3B), más favorable en los casos con margen retroperitoneal R0.
A) Curvas de supervivencia global de la serie, analizados según el margen R0/R1. Hazard ratio: 0,916 (IC 95% 0,56-1,47). B) Curvas de supervivencia de los pacientes con tumores en cabeza de páncreas de toda la serie, analizados según la afectación del margen retroperitoneal (MR). Hazard ratio: 1,414 (IC 95% 0,81-2,45).
A) Curvas de supervivencia de los pacientes del grupo posprotocolo (Post), analizados según la presencia de un margen R0 y R1. Hazard ratio: 1,275 (IC 95% 0,69-2,35). B) Curvas de supervivencia de los pacientes con tumores en cabeza de páncreas del grupo posprotocolo (Post), analizados según la afectación del margen retroperitoneal (MR). Hazard ratio: 2,044 (IC 95% 1,00-4,16).
La amplia variabilidad en las tasas de afectación de los márgenes de resección quirúrgica en el cáncer de páncreas refleja probablemente la falta de protocolos estandarizados. En cirugía oncológica, se ha asociado la obtención de márgenes de resección libres de tumor con una buena técnica quirúrgica y, en general, cifras bajas de resecciones R1 se consideran reflejo de una alta calidad y radicalidad de la cirugía. Sin embargo, una serie de trabajos2,6 cuestionan esta relación en el cáncer de páncreas. Cuando se han implantado protocolos estandarizados para el análisis de las piezas quirúrgicas, se demuestra que muchas de las piezas que se calificaban como R0 eran en realidad R12. Aunque la primera referencia en la que se detecta este problema es de 19934, con una tasa de R1 del 51%, han sido 2 trabajos más recientes los que realmente han hecho saltar la alarma. El primero señala claramente la ausencia de protocolos estandarizados e identifica una tasa de R1 en cáncer de páncreas del 85%6. El segundo, de mayor impacto por el título escogido para su publicación, Most pancreatic resections are R1 resections es el del grupo de Esposito y Büchler que pasa de una tasa de R1 del 14% cuando las piezas no se analizan de acuerdo con un protocolo al 76% cuando sí se analizan con el protocolo histopatológico estandarizado2. La importancia clínica de esta observación es capital ya que cuando examinamos estudios aleatorizados que han influido en el tratamiento del cáncer de páncreas resecado, como el estudio ESPAC, observar cifras bajas de afectación R1 (19%)11,12 y participación de múltiples hospitales (61 centros de 11 países) hace pensar que en realidad no se ha realizado un examen estandarizado de las piezas y, por tanto, se han infraestimado las tasas de resección no oncológica.
Nuestra serie confirma, en consonancia con los trabajos de Verbecke6 y Esposito2, que un protocolo estandarizado de análisis de los márgenes de resección incrementa la tasa de resecciones R1, que en ausencia de este análisis, se considerarían como R0. Hay varios aspectos diferenciales en nuestro trabajo con respecto a otras series. Primero, únicamente incluimos cáncer de páncreas13. Aunque todos los tumores del área periampular y pancreática deberían analizarse con este protocolo histopatológico estandarizado, en los tumores de duodeno o de la papila raramente se alcanzará el margen de resección circunferencial. Se ha preferido esta selección al ser un grupo más homogéneo que permite minimizar posibles sesgos al analizar la supervivencia y su relación con los márgenes de resección. Segundo, la definición utilizada de R1. Para los autores norteamericanos, de acuerdo a la UICC/American Joint Comission on Cancer System14,15, el tumor debe alcanzar el borde de transección para considerarse R1, mientras que para la mayoría de los autores europeos, siguiendo los criterios de la Royal College of Pathologists16–18 y que en nuestro protocolo hemos adoptado, se define R1 cuando la distancia entre el tumor y el margen de resección es igual o inferior a 1mm. No obstante, en un trabajo sobre la relación pronóstica entre la distancia del tumor al margen de resección y la supervivencia, se concluye que la distancia mínima para establecer un pronóstico más favorable ha de ser mayor de 1,5mm19.
Nuestra experiencia con el estudio de los márgenes de resección de forma estandarizada comienza entre 2003 y 2004 al cuestionarnos la veracidad de nuestra alta tasa de resecciones «oncológicas» R0, teniendo unas tasas de supervivencia a 5 años del 10%, similares a la mayoría de los estudios de la literatura, y al no encontrar diferencias en la supervivencia entre los pacientes con resecciones R0 y R120. La introducción de un protocolo estandarizado para el análisis de las piezas quirúrgicas ha evidenciado que nuestra tasa de resecciones R0 era ficticia. Esto significa que el análisis detallado de las piezas quirúrgicas puede llegar a invertir las tasas de resección oncológica, pasando de tener una mayoría de resecciones R0, a una mayoría de resecciones R1. Y esto, por supuesto, realizado por los mismos cirujanos y sin cambiar la técnica quirúrgica, es decir sin que estos resultados se puedan atribuir al factor cirujano.
En el cáncer de páncreas, incluso con las series recientes que han analizado las piezas quirúrgicas con un protocolo estandarizado, no se ha conseguido aclarar cuál es el verdadero impacto del factor R1 en la supervivencia a largo plazo. Mientras que en algunas series sí afecta la supervivencia de forma significativa13,18,21,22, en otras no se consigue observar dicha afectación2,3,5,8. En nuestro trabajo, la invasión microscópica del margen circunferencial es particularmente importante ya que la resección R1 tiene un efecto desfavorable en la supervivencia. Esta significación se revela a expensas del margen posterior retroperitoneal en los pacientes con tumores de cabeza de páncreas, cuando se analizan las piezas con el protocolo estandarizado, ya que ni este margen en las resecciones corporocaudales ni el margen de transección son significativamente diferentes antes o después de la aplicación del protocolo. En el caso de las resecciones corporocaudales, porque la afectación posterior es fácilmente observable por el patólogo con o sin protocolo estandarizado y, en el caso del margen de transección, porque al analizarse una sección de este margen de forma intraoperatoria, en caso de resultar positivo, se amplía, por lo que pocas veces es positivo en el estudio definitivo. Además, la significación se revela solo al analizar los pacientes con tumores de cabeza de páncreas (fig. 3B) y no cuando se analizan todos los pacientes del protocolo estandarizado (fig. 3A) ya que al incluir en este último grupo pacientes con resecciones de cuerpo-cola y pancreatectomías totales, se pierde la significación estadística.
A pesar de que en nuestra investigación obtenemos resultados significativos con el estudio estandarizado de las piezas quirúrgicas en el cáncer de páncreas, debemos reconocer una serie de limitaciones. Se trata de un análisis retrospectivo de una sola institución, en el que se incluyen no solo DPC sino también resecciones corporocaudales y pancreatectomías totales. Además, no hemos estudiado el patrón de recurrencia o la causa de muerte, ni tampoco si los pacientes recibieron o no quimioterapia postoperatoria.
En conclusión, en este trabajo hemos observado que la tasa de resecciones oncológicas R0, pasa de un 78% cuando las piezas de resección se analizan sin un protocolo estandarizado al 47% cuando se aplica dicho protocolo. En los pacientes con cáncer de cabeza de páncreas la invasión microscópica del margen posterior retroperitoneal afecta de forma significativa a la supervivencia. Estos hallazgos, concordantes con los de otros grupos quirúrgicos muy consolidados2,17,18,21, justifican la necesidad de realizar nuevos estudios destinados a reducir la tasa de R1. El empleo de terapias neoadyuvantes más eficaces23, o el abordaje inicial de la arteria mesentérica superior24, modificación técnica que parece que pueda conseguir algunos milímetros más de tejido retroperitoneal, podrían ser estrategias útiles para ampliar el margen de resección y, en consecuencia, mejorar nuestros resultados.
Presentaciones a congresosVersiones preliminares de esta investigación se han presentado en los congresos siguientes:
- -
XVI Reunión Nacional de Cirugía, San Sebastián, octubre 2007.
- -
X Reunión del Club Español Biliopancreático, Santander, septiembre 2007.
- -
2nd International Conference Advances in Surgery. Discussions from the cutting edge, Barcelona, diciembre 2010.
Los autores declaran no tener ningún conflicto de intereses.