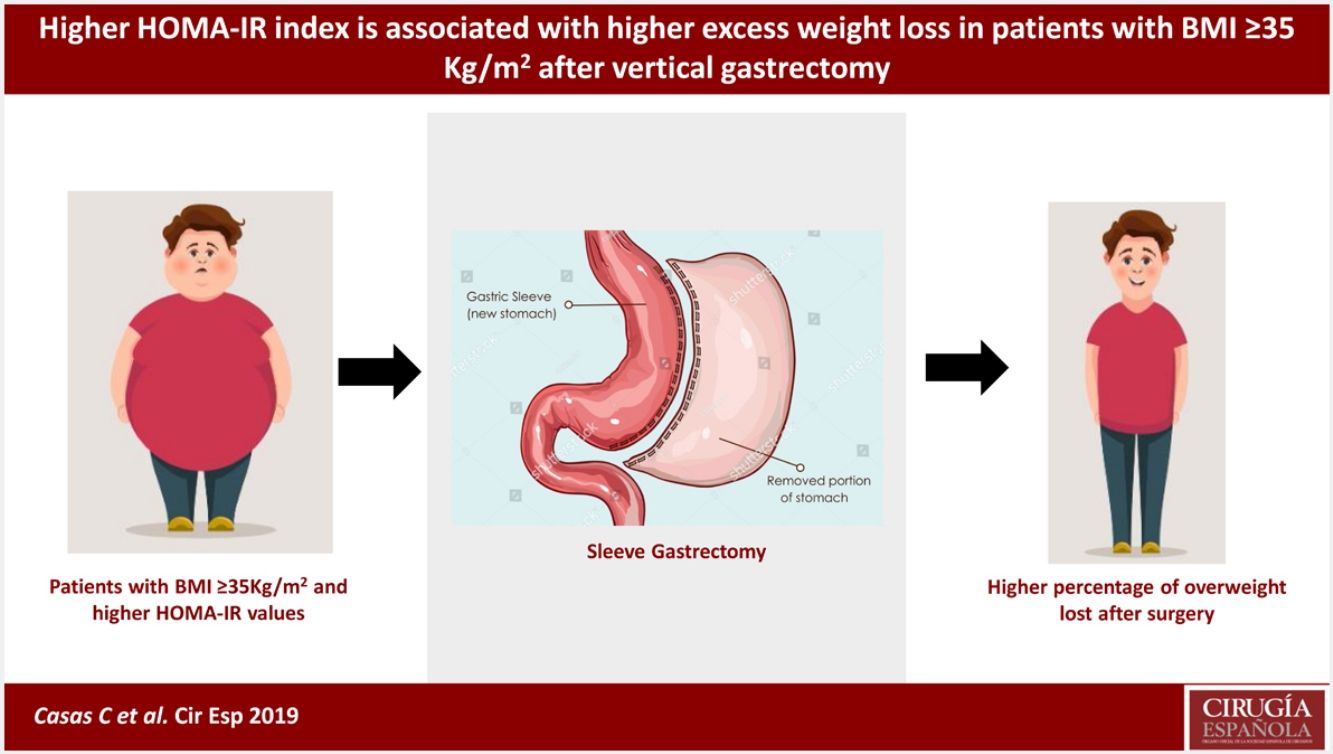
La cirugía bariátrica es considerada la herramienta más efectiva para el tratamiento de la obesidad severa. No está claro si los pacientes con resistencia a la insulina responden igual que otras personas. Nuestro objetivo es evaluar la asociación entre el índice HOMA-IR prequirúrgico con el porcentaje de sobrepeso perdido (%PSP) un año poscirugía bariátrica usando la técnica gastrectomía vertical (GV).
MétodosCohorte retrospectiva incluyendo pacientes ≥18años con IMC≥35kg/m2 intervenidos por primera vez con GV entre 2014-2017 en la Clínica Avendaño, Perú. Se incluyó solo aquellos con diabetes mellitus tipo 2, hipertensión arterial o dislipidemia. Un %PSP al año ≥60% fue considerado satisfactorio. Se usó regresión Lineal y de Poisson con varianza robusta en forma cruda y ajustada para evaluar asociaciones con %PSP.
ResultadosLa muestra de 91 pacientes tuvo una mediana de 34 años y un 57,1% fueron mujeres. Un 85,7% presentó resistencia a la insulina según HOMA-IR. Al año poscirugía el 76,9% tuvo un %PSP satisfactorio. En el modelo lineal ajustado por cada año de edad adicional hubo un 0,29% menos %PSP (p=0,019), y por cada punto extra del HOMA-IR hubo 0,93% más %PSP (p=0,004). La regresión de Poisson ajustada mostró un 2% menos de éxito por cada año de edad adicional (p=0,050) y un 2% más de éxito por cada punto adicional de HOMA-IR (p=0,038).
ConclusionesSe encontró asociación entre mayor valor prequirúrgico de HOMA-IR con un mayor %PSP al año poscirugía. Es posible que la resistencia a insulina no afecte de forma adversa los resultados de la cirugía bariátrica GV.
Bariatric surgery is considered the most effective treatment for severe obesity. However, it is not clear if patients with diabetes mellitus or insulin resistance have the same response than patients without those conditions. Our objective was to evaluate association between pre-surgical HOMA-IR index and percentage of excess weight loss (EWL%) one year after bariatric surgery using sleeve gastrectomy.
MethodsRetrospective cohort including patients ≥18 years old with BMI≥35kg/m2, who underwent primary sleeve gastrectomy between 2014-2017 at the Avendaño Medical Center, Peru. Only patients with Type 2 Diabetes, Hypertension, or Dyslipidemia were included. EWL% ≥60% one year after surgery was considered satisfactory. Crude and adjusted Lineal and Poisson regression with robustness was used to assess statistical associations with EWL%.
ResultsNinety-one patients were included with a median of 34 years, and 57.1% were women. 85.7% had insulin resistance as per HOMA-IR. One year after surgery, 76.9% had a satisfactory EWL%. The lineal model showed .29% less EWL% per each extra year of life (P=.019), and .93% more EWL% per each extra HOMA-IR point (P=.004). The adjusted Poisson model showed 2% lower risk of having a satisfactory EWL% per each additional year of life (P=.050), and 2% more chance of success per each additional HOMA-IR point (P=.038).
ConclusionsThere was association between a higher pre-surgical HOMA-IR index and increased EWL% one year after surgery. It is possible that insulin resistance does not affect negatively sleeve gastrectomy outcomes.
La obesidad, definida como un índice de masa corporal (IMC) de 30kg/m2 o más, es un grave problema de salud mundial1. En el año 2016 más de 1.900 millones de adultos ≥18 años tenían sobrepeso en todo el mundo, de los cuales, 650 millones eran obesos2. La Organización Mundial de la Salud refiere que desde 1975 la obesidad se ha casi triplicado en todo el mundo2. En Lima, Perú, para el año 2010 se reportó que padecía obesidad el 11,4% de personas entre 20-29 años, y el 23,5% de adultos entre 30-59 años3. El tratamiento convencional es usualmente dieta y ejercicio4; sin embargo, un panel de consenso de los National Institutes of Health, en 1991, indicó que la cirugía bariátrica es apropiada para todos los pacientes con IMC≥40kg/m2, o con IMC 35-40kg/m2 con comorbilidades asociadas5. Yermilov et al. reportan que incluso en pacientes con IMC<40kg/m2, los resultados de la terapia médica son pobres y difíciles de mantener al largo plazo, mientras que la cirugía obtiene buenos resultados con una disminución importante de la morbimortalidad y pocos eventos adversos6. Asimismo, Livingston menciona que, en la práctica clínica, los centros de obesidad cada vez más indican tratamiento quirúrgico para pacientes con IMC entre 30 y 35kg/m2 en la medida que tengan comorbilidades metabólicas como diabetes mellitus y dislipidemia severa7.
Existen técnicas restrictivas, malabsortivas y mixtas. Las restrictivas consisten en la reducción de la capacidad del estómago, restringiendo el paso de los alimentos. Las malabsortivas producen un cruce con el intestino de manera que existe una mala absorción de los alimentos. Las mixtas son una combinación de las técnicas mencionadas8. La cirugía más común realizada en los centros bariátricos peruanos es gastrectomía vertical (GV), que es una técnica restrictiva, generalmente efectuada por vía laparoscópica4. Excepcionalmente se realiza el Switch o cruce duodenal, técnica mixta que consta de varios tiempos quirúrgicos e implica la realización de GV más un bypass en Y de Roux al duodeno, con longitudes variables de las asas9. La GV es un tipo de gastrectomía subtotal, donde se extirpa alrededor de un 80% del estómago y no necesita la creación de anastomosis de ningún tipo5. El paciente se coloca en decúbito supino, y el cirujano se posiciona entre las piernas del paciente o en el lado derecho. Se realiza neumoperitoneo y se colocan 4-5 trócares en el hemiabdomen superior. Previamente, se coloca una sonda gástrica para demarcar el tamaño de la cavidad gástrica residual. El calibre de la sonda suele ser entre 32-34Fr. Se realiza la sección de los vasos cortos desde una zona próxima al píloro hasta completar el ángulo de Hiss. La tendencia actual es iniciar la gastrectomía más cerca del píloro, comenzando la disección a 3cm del mismo, con el objeto de potenciar aún más el componente restrictivo de la operación10. El diámetro final del estómago depende de varios factores técnicos intraoperatorios, independientes del diámetro de la sonda. Larrad menciona como indicadores de éxito lograr pérdidas de exceso de peso superiores al 50% a los 5 años de seguimiento, manteniendo una buena calidad de vida (sin vómitos a repetición o diarreas permanentes) y con efectos secundarios mínimos sobre órganos o sistemas11.
La cirugía bariátrica no solo tiene como objetivo la pérdida del sobrepeso, sino que puede contribuir al manejo de otros problemas metabólicos del paciente. Schauer et al. mostraron que la cirugía bariátrica más terapia médica intensiva fue efectiva para disminuir, o en algunos casos resolver, la hiperglucemia12. Se ha encontrado que el estado metabólico no solo mejora con la cirugía, sino que también puede afectar los resultados de la misma. Dixon et al. encontraron que una menor tasa de pérdida de sobrepeso en los 12 meses posteriores a la cirugía bariátrica estaba asociada a mayor edad, mayor IMC inicial y alto nivel de insulina en plasma en ayunas13. De esta manera es importante caracterizar el estado metabólico de los pacientes antes de someterlos a cirugía bariátrica. Una forma es la evaluación del modelo homeostático para resistencia a la insulina (HOMA-IR) desarrollado por Matthews et al., y ampliamente utilizado en investigación14,15. Por estas razones el objetivo del presente estudio es demostrar si existe asociación entre el índice de HOMA-IR prequirúrgico con el porcentaje de pérdida de peso un año después de cirugía bariátrica usando la técnica de gastrectomía vertical (GV) en los pacientes con IMC≥35kg/m2 y que tengan alteraciones metabólicas.
MétodosSe realizó un estudio de tipo cohorte retrospectiva basado en la revisión de historias clínicas. La población estuvo conformada por pacientes ≥18años con un IMC≥35kg/m2 intervenidos por primera vez con cirugía bariátrica, técnica GV, entre enero de 2014 a junio de 2017 en la Clínica de día Avendaño en Lima, Perú. Solo se incluyeron pacientes con diabetes mellitus tipo 2 (DM2), hipertensión arterial o dislipidemia que tuvieran registros de glucosa e insulina en ayunas prequirúrgico, y seguimiento de IMC hasta los 12 meses poscirugía. Se excluyó los pacientes reintervenidos con cualquier otra técnica bariátrica. El cálculo del tamaño muestral se basó en el estudio de Dixon et al., quienes encontraron una correlación negativa (r –0,36, p<0,01) entre el valor prequirúrgico de insulina en ayunas con el porcentaje de sobrepeso perdido al año de la cirugía bariátrica13. Considerando estos valores, un alfa de 0,05, un poder de 90% y una pérdida de 20% de participantes por data incompleta, se obtuvo un tamaño muestral mínimo de 96 pacientes.
La variable resultado del estudio fue porcentaje de sobrepeso perdido (%PSP) al año poscirugía, calculado como 100×(peso inicial–peso actual)/(peso inicial–peso ideal)11. El peso ideal (PI) se definió como 50kg+([altura en centímetros–150]×0,921) para varones, y 45,5kg+([altura en centímetros–150] ×0,921) para mujeres16. Asimismo, la variable %PSP se dicotomizó usando el punto de corte sugerido por Ortega et al., quienes consideran una pérdida≥60% como satisfactoria17. La variación ponderal también se evaluó usando porcentaje de peso total perdido al año poscirugía, calculado como 100×(peso inicial–peso actual)/(peso inicial)18,19.
La variable independiente principal fue el valor del índice HOMA-IR antes de la cirugía, calculado como nivel de insulina en ayunas (mU/l)×glucemia en ayunas (nmol/l)/22,514. El diagnóstico de resistencia a la insulina se estableció en pacientes con un índice HOMA-IR≥2,620. Como variables de ajuste se incluyeron las características prequirúrgicas del paciente: edad, sexo, peso, talla, IMC, tipo de obesidad (clase ii: 35-39,9kg/m2, clase iii: ≥40kg/m2), peso ideal, presión sistólica y diastólica y diagnóstico de DM2. Se consideró como hipertensos a aquellos con presión sistólica ≥130mmHg o diastólica ≥80mmHg cuando no referían dicho antecedente21. Se consideró dislipidemia cuando los valores de colesterol total fueron ≥200mg/dl, colesterol LDL≥130mg/dl, colesterol HDL≤40mg/dl en varones y ≤45mg/dl en mujeres22, y/o triglicéridos ≥150mg/dl23. Todos los pacientes fueron evaluados por un equipo bariátrico multidisciplinario antes de la cirugía, obteniéndose perfil lipídico, glucemia e insulinemia. Los pacientes tuvieron un programa estándar de dieta y de actividad física después de la cirugía, y fueron seguidos mensualmente.
El presente estudio sigue los principios de la declaración de Helsinki y ha sido aprobado por el Comité de Ética de la Facultad de Ciencias de la Salud de la Universidad Peruana de Ciencias Aplicadas. Primero se solicitaron todos los registros de los pacientes intervenidos con GV durante el periodo de estudio. Solo aquellos que cumplieran los criterios de selección fueron incluidos. La información fue doblemente digitada en una base de datos, y exportada a formato Stata 14.0 (College Station, TX). Las variables categóricas fueron descritas mediante frecuencias absolutas y porcentajes. Las variables numéricas se describieron usando mediana y rango intercuartílico (RIC) cuando no tuvieron distribución normal. La variable resultado %PSP se comparó de forma dicotómica (≥60% y <60%) con el resto de variables usando la prueba de Chi cuadrado cuando fueron categóricas, o la U de Mann-Whitney si fueron numéricas. Valores de p≤0,05 fueron considerados estadísticamente significativos. Luego se realizaron regresiones lineales para evaluar asociación entre %PSP (en forma numérica) y las variables de estudio, reportándose coeficientes beta. Se usaron varianzas robustas anticipando falta de normalidad. También se construyeron modelos lineales generalizados familia Poisson con varianzas robustas para evaluar la asociación con %PSP de forma dicotómica, obteniéndose riesgos relativos. Las regresiones se realizaron de forma cruda y luego multivariada incluyendo el sexo, la edad, el IMC inicial, la presencia de DM2, el HOMA-IR prequirúrgico y cualquier otra variable que tuviera una significación estadística ≤0,20 en el análisis crudo. Estas variables adicionales fueron eliminadas de los modelos finales en caso de que sus valores p ajustados fueran>0,05.
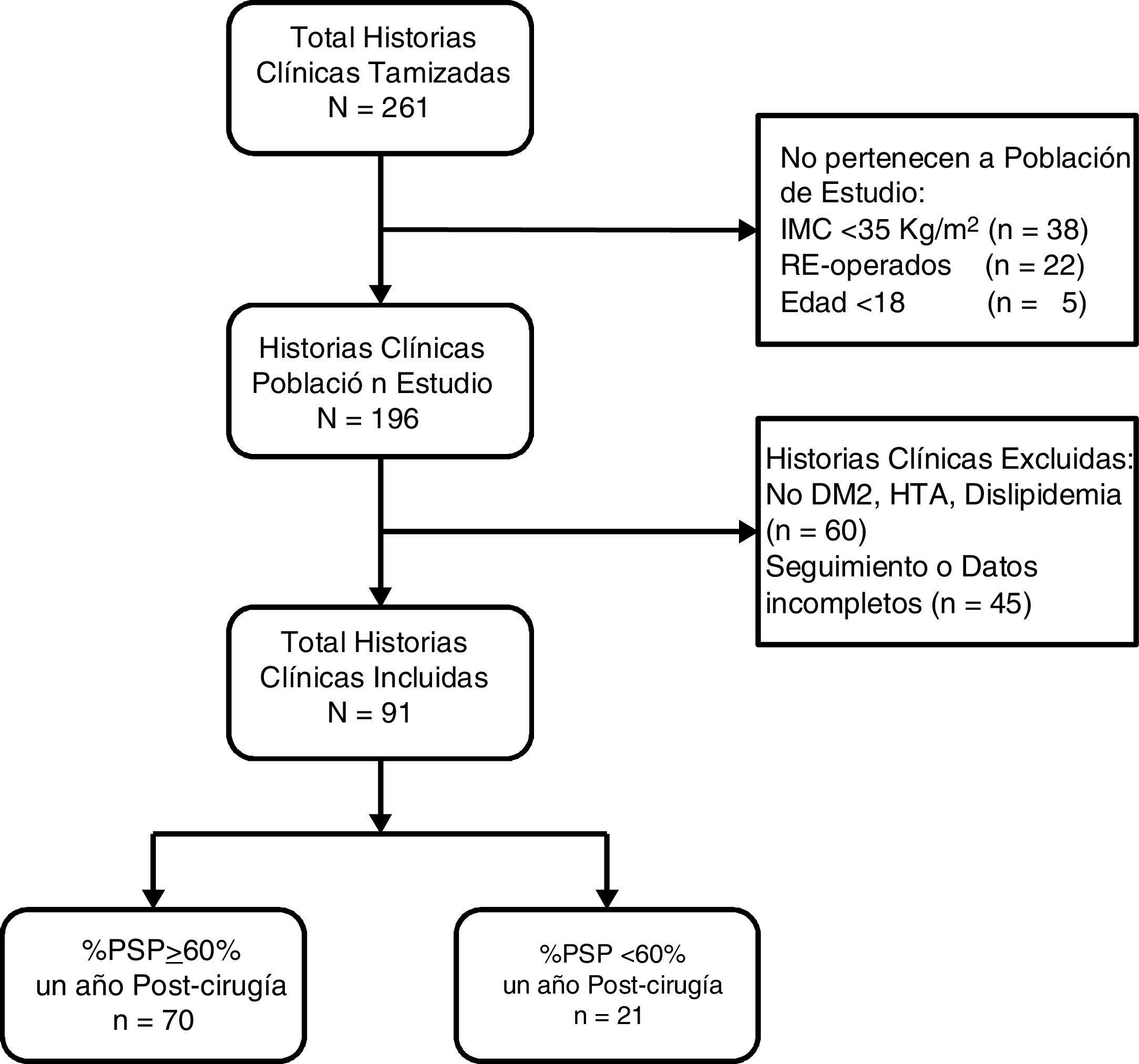
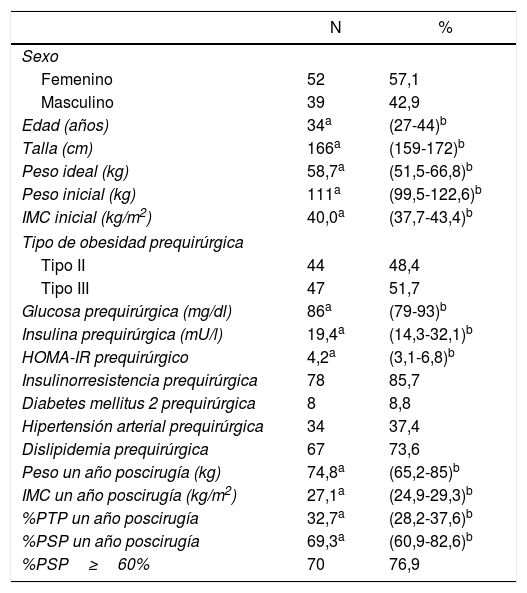
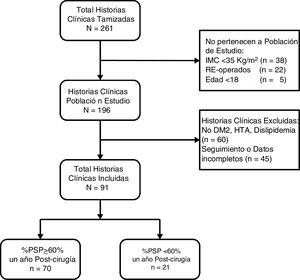
ResultadosSe revisaron 261 historias clínicas, de las cuales 196 correspondieron a pacientes operados por primera vez con IMC≥35kg/m2. Se excluyeron 60 pacientes por no presentar comorbilidades y 45 por no tener seguimiento o datos completos (fig. 1). Los 91 pacientes restantes tuvieron una mediana de edad de 34 años (RIC: 27-44) y 52 sujetos fueron mujeres (57,14%). Previo a la cirugía los pacientes tuvieron una mediana de IMC de 40,0kg/m2 (RIC: 37,7-43,4) y un 51,65% tuvo obesidad de tipo iii. Además, el 8,79% presentó DM2, el 37,36% HTA y el 73,63% tuvo dislipidemia. Solo 3 pacientes (3,3%) tuvieron estas 3 comorbilidades juntas. El HOMA-IR prequirúrgico tuvo una mediana de 4,2 (RIC: 3,1-6,8) y el 85,71% presentó resistencia a la insulina. Al año poscirugía la mediana de IMC fue 27,1kg/m2 (RIC: 24,9-29,3), la mediana de porcentaje de peso total perdido fue 32,7 (RIC: 28,2-37,6), la mediana de %PSP fue 69,3 (RIC: 60,9-82,6) y la proporción de pacientes con un %PSP≥60% fue de 76,9% (tabla 1).
Características de los pacientes con IMC≥35kg/m2 sometidos a cirugía bariátrica usando gastrectomía vertical (n=91)
| N | % | |
|---|---|---|
| Sexo | ||
| Femenino | 52 | 57,1 |
| Masculino | 39 | 42,9 |
| Edad (años) | 34a | (27-44)b |
| Talla (cm) | 166a | (159-172)b |
| Peso ideal (kg) | 58,7a | (51,5-66,8)b |
| Peso inicial (kg) | 111a | (99,5-122,6)b |
| IMC inicial (kg/m2) | 40,0a | (37,7-43,4)b |
| Tipo de obesidad prequirúrgica | ||
| Tipo II | 44 | 48,4 |
| Tipo III | 47 | 51,7 |
| Glucosa prequirúrgica (mg/dl) | 86a | (79-93)b |
| Insulina prequirúrgica (mU/l) | 19,4a | (14,3-32,1)b |
| HOMA-IR prequirúrgico | 4,2a | (3,1-6,8)b |
| Insulinorresistencia prequirúrgica | 78 | 85,7 |
| Diabetes mellitus 2 prequirúrgica | 8 | 8,8 |
| Hipertensión arterial prequirúrgica | 34 | 37,4 |
| Dislipidemia prequirúrgica | 67 | 73,6 |
| Peso un año poscirugía (kg) | 74,8a | (65,2-85)b |
| IMC un año poscirugía (kg/m2) | 27,1a | (24,9-29,3)b |
| %PTP un año poscirugía | 32,7a | (28,2-37,6)b |
| %PSP un año poscirugía | 69,3a | (60,9-82,6)b |
| %PSP≥60% | 70 | 76,9 |
%PSP: porcentaje de sobrepeso perdido; %PTP: porcentaje de peso total perdido.
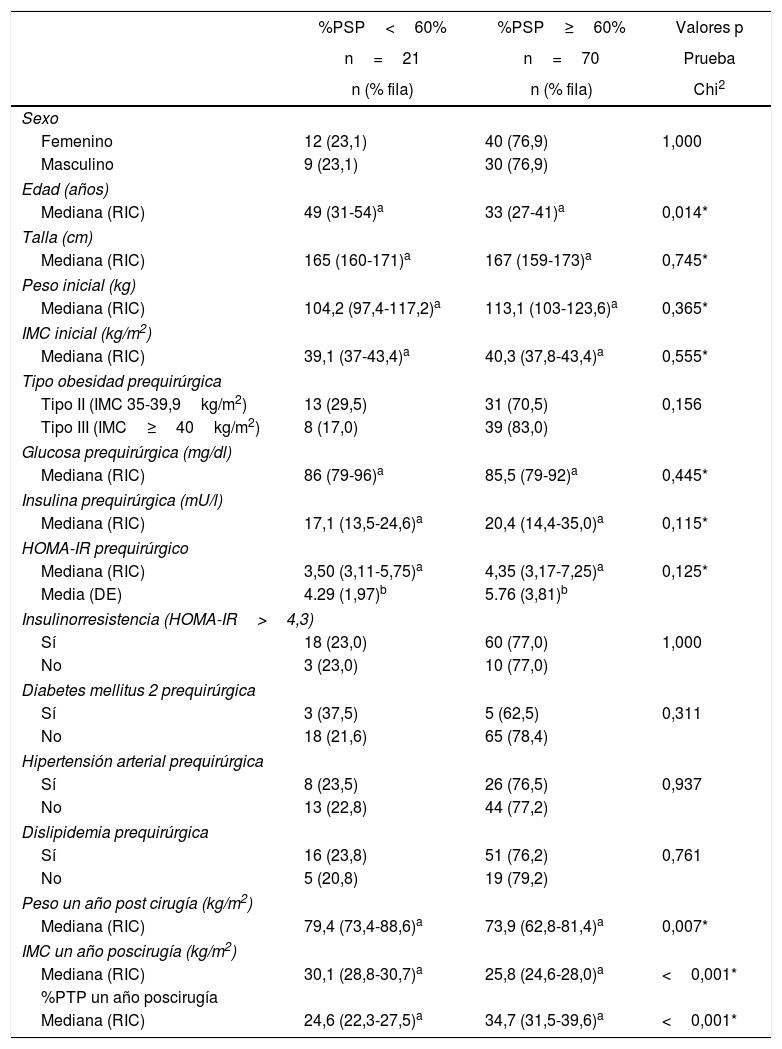
No se encontraron diferencias de sexo, peso inicial, IMC inicial, peso ideal ni tipo de obesidad entre las personas que perdieron<60% de sobrepeso y las que perdieron ≥60%. Tampoco hubo diferencias de glucemia, DM2, hipertensión, o dislipidemia prequirúrgicas. Sí se encontró que los pacientes que perdieron ≥60% de exceso de peso fueron más jóvenes (mediana de edad 33 vs. 49 años), siendo esta diferencia significativa (p=0,014). Los pacientes que perdieron≥60% de exceso de peso tuvieron una mediana más alta del HOMA-IR prequirúrgico (4,35 vs. 3,50), así como de insulina prequirúrgica (20,4 vs. 17,1), aunque las diferencias no fueron significativas (tabla 2). Estas diferencias se mantuvieron para el subgrupo de pacientes diabéticos, tanto para HOMA-IR prequirúrgico (7,89 vs. 3,37) como para insulina prequirúrgica (23,3 vs. 14,5). La presencia de mayor HOMA-IR prequirúrgico en los pacientes que tuvieron un %PSP≥60% se mantuvo de forma independiente tanto en pacientes con IMC<40kg/m2 como en aquellos con IMC≥40kg/m2.
Características de los pacientes con IMC≥35kg/m2 sometidos a cirugía bariátrica usando gastrectomía vertical según porcentaje de sobrepeso perdido (%PSP) al año poscirugía (n=91)
| %PSP<60% | %PSP≥60% | Valores p | |
|---|---|---|---|
| n=21 | n=70 | Prueba | |
| n (% fila) | n (% fila) | Chi2 | |
| Sexo | |||
| Femenino | 12 (23,1) | 40 (76,9) | 1,000 |
| Masculino | 9 (23,1) | 30 (76,9) | |
| Edad (años) | |||
| Mediana (RIC) | 49 (31-54)a | 33 (27-41)a | 0,014* |
| Talla (cm) | |||
| Mediana (RIC) | 165 (160-171)a | 167 (159-173)a | 0,745* |
| Peso inicial (kg) | |||
| Mediana (RIC) | 104,2 (97,4-117,2)a | 113,1 (103-123,6)a | 0,365* |
| IMC inicial (kg/m2) | |||
| Mediana (RIC) | 39,1 (37-43,4)a | 40,3 (37,8-43,4)a | 0,555* |
| Tipo obesidad prequirúrgica | |||
| Tipo II (IMC 35-39,9kg/m2) | 13 (29,5) | 31 (70,5) | 0,156 |
| Tipo III (IMC≥40kg/m2) | 8 (17,0) | 39 (83,0) | |
| Glucosa prequirúrgica (mg/dl) | |||
| Mediana (RIC) | 86 (79-96)a | 85,5 (79-92)a | 0,445* |
| Insulina prequirúrgica (mU/l) | |||
| Mediana (RIC) | 17,1 (13,5-24,6)a | 20,4 (14,4-35,0)a | 0,115* |
| HOMA-IR prequirúrgico | |||
| Mediana (RIC) | 3,50 (3,11-5,75)a | 4,35 (3,17-7,25)a | 0,125* |
| Media (DE) | 4.29 (1,97)b | 5.76 (3,81)b | |
| Insulinorresistencia (HOMA-IR>4,3) | |||
| Sí | 18 (23,0) | 60 (77,0) | 1,000 |
| No | 3 (23,0) | 10 (77,0) | |
| Diabetes mellitus 2 prequirúrgica | |||
| Sí | 3 (37,5) | 5 (62,5) | 0,311 |
| No | 18 (21,6) | 65 (78,4) | |
| Hipertensión arterial prequirúrgica | |||
| Sí | 8 (23,5) | 26 (76,5) | 0,937 |
| No | 13 (22,8) | 44 (77,2) | |
| Dislipidemia prequirúrgica | |||
| Sí | 16 (23,8) | 51 (76,2) | 0,761 |
| No | 5 (20,8) | 19 (79,2) | |
| Peso un año post cirugía (kg/m2) | |||
| Mediana (RIC) | 79,4 (73,4-88,6)a | 73,9 (62,8-81,4)a | 0,007* |
| IMC un año poscirugía (kg/m2) | |||
| Mediana (RIC) | 30,1 (28,8-30,7)a | 25,8 (24,6-28,0)a | <0,001* |
| %PTP un año poscirugía | |||
| Mediana (RIC) | 24,6 (22,3-27,5)a | 34,7 (31,5-39,6)a | <0,001* |
%PSP: porcentaje de sobrepeso perdido; %PTP: porcentaje de peso total perdido.
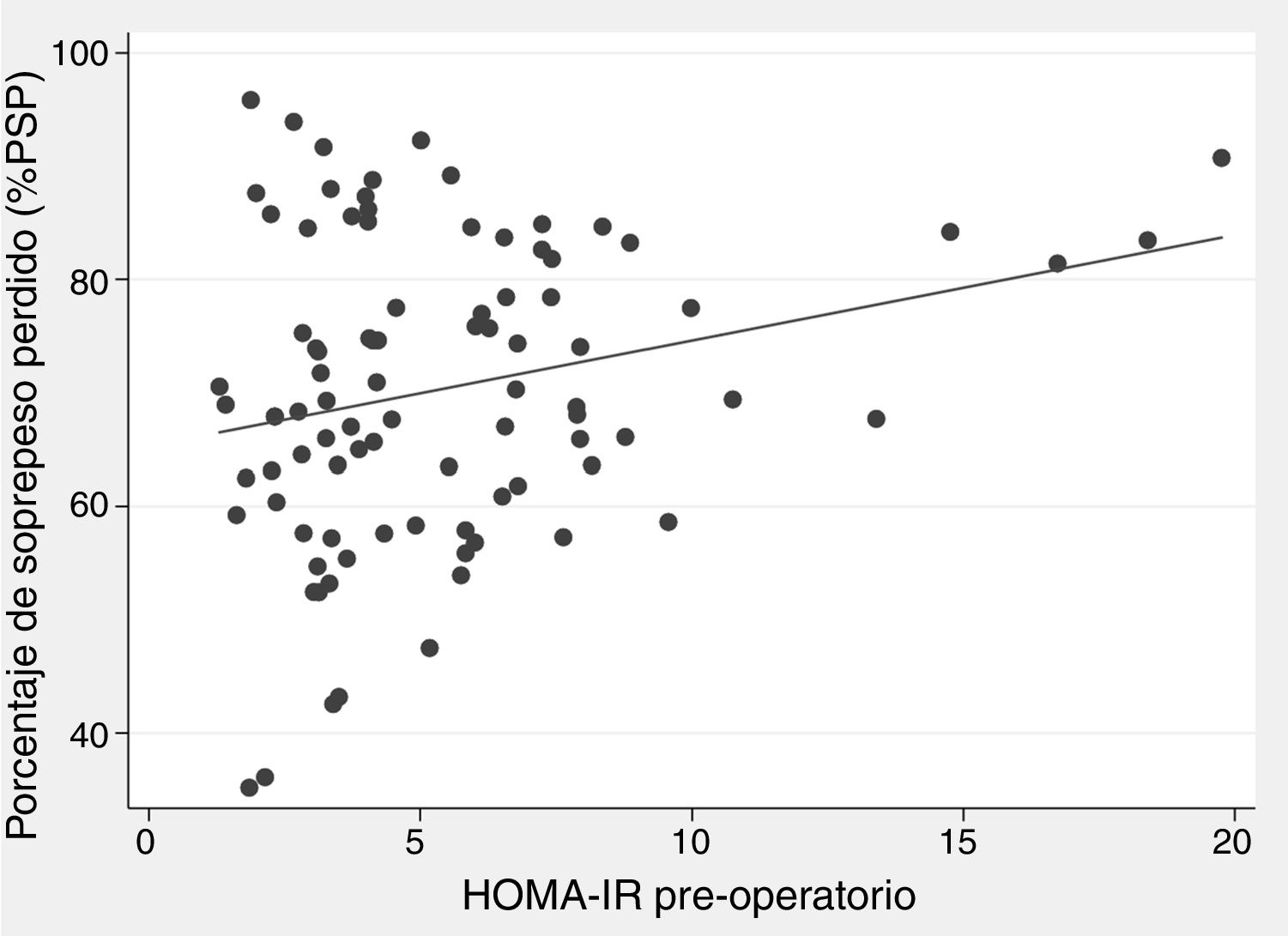
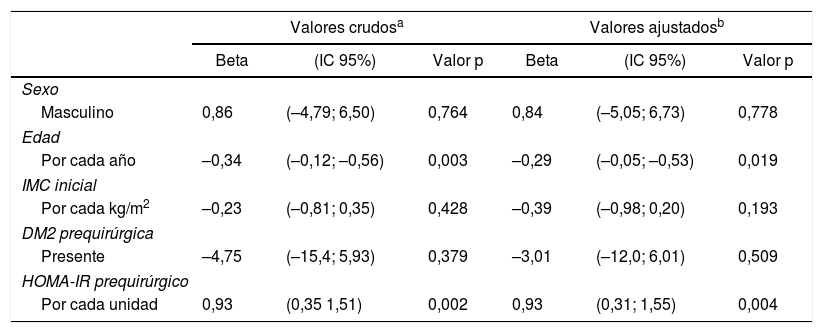
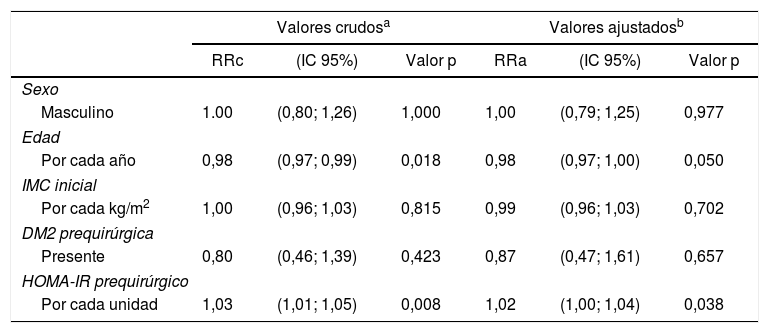
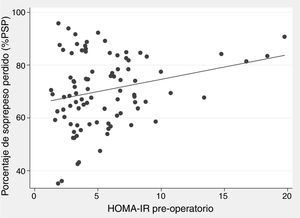
Hubo una correlación positiva entre HOMA-IR prequirúrgico y %PSP al año de cirugía, con un coeficiente beta de 0,93 y p=0,002 en la regresión lineal cruda (fig. 2), aunque el r fue tan solo 0,25. Los modelos multivariados iniciales incluyeron sexo, edad, IMC inicial, presencia de DM2 y HOMA-IR prequirúrgico. La insulina prequirúrgica no se incluyó por ser colineal con el HOMA-IR. En el modelo lineal ajustado por cada año de edad adicional hubo 0,29% menos pérdida de exceso de peso al año (p=0,019), y por cada punto extra del HOMA-IR hubo 0,93% más pérdida de exceso de peso al año (p=0,004) (tabla 3). En el modelo binario se observó que hay un 2% menos de probabilidad de obtener un %PSP satisfactorio poscirugía por cada año de edad adicional (p=0,050), y un 2% más de probabilidad por cada punto adicional de HOMA-IR prequirúrgico (p=0,038) (tabla 4).
Correlación entre las características de los pacientes con IMC≥35kg/m2 sometidos a cirugía bariátrica usando gastrectomía vertical y porcentaje de sobrepeso perdido (%PSP) al año poscirugía (n=91)
| Valores crudosa | Valores ajustadosb | |||||
|---|---|---|---|---|---|---|
| Beta | (IC 95%) | Valor p | Beta | (IC 95%) | Valor p | |
| Sexo | ||||||
| Masculino | 0,86 | (–4,79; 6,50) | 0,764 | 0,84 | (–5,05; 6,73) | 0,778 |
| Edad | ||||||
| Por cada año | –0,34 | (–0,12; –0,56) | 0,003 | –0,29 | (–0,05; –0,53) | 0,019 |
| IMC inicial | ||||||
| Por cada kg/m2 | –0,23 | (–0,81; 0,35) | 0,428 | –0,39 | (–0,98; 0,20) | 0,193 |
| DM2 prequirúrgica | ||||||
| Presente | –4,75 | (–15,4; 5,93) | 0,379 | –3,01 | (–12,0; 6,01) | 0,509 |
| HOMA-IR prequirúrgico | ||||||
| Por cada unidad | 0,93 | (0,35 1,51) | 0,002 | 0,93 | (0,31; 1,55) | 0,004 |
beta: coeficiente beta (β)-pendiente de la regresión; DM2: diabetes mellitus tipo 2; IC 95%: intervalo de confianza al 95%.
Probabilidad de perder≥60% del porcentaje de sobrepeso perdido al año poscirugía según las características de los pacientes con IMC≥35kg/m2 sometidos a cirugía bariátrica usando gastrectomía vertical (n=91)
| Valores crudosa | Valores ajustadosb | |||||
|---|---|---|---|---|---|---|
| RRc | (IC 95%) | Valor p | RRa | (IC 95%) | Valor p | |
| Sexo | ||||||
| Masculino | 1.00 | (0,80; 1,26) | 1,000 | 1,00 | (0,79; 1,25) | 0,977 |
| Edad | ||||||
| Por cada año | 0,98 | (0,97; 0,99) | 0,018 | 0,98 | (0,97; 1,00) | 0,050 |
| IMC inicial | ||||||
| Por cada kg/m2 | 1,00 | (0,96; 1,03) | 0,815 | 0,99 | (0,96; 1,03) | 0,702 |
| DM2 prequirúrgica | ||||||
| Presente | 0,80 | (0,46; 1,39) | 0,423 | 0,87 | (0,47; 1,61) | 0,657 |
| HOMA-IR prequirúrgico | ||||||
| Por cada unidad | 1,03 | (1,01; 1,05) | 0,008 | 1,02 | (1,00; 1,04) | 0,038 |
DM2: diabetes mellitus tipo 2; IC 95%: intervalo de confianza al 95%; RRa: riesgo relativo ajustado; RRc: riesgo relativo crudo.
La mayoría de autores definen un resultado satisfactorio como una pérdida de al menos el 50% de exceso de peso prequirúrgico24. Nuestro estudio, en cambio, consideró como resultado satisfactorio un %PSP≥60%, siguiendo el punto de corte usado por Ortega et al.17. Usando este umbral más estricto encontramos que el 76,9% de los pacientes alcanzaron esta meta, resultado similar al reportado en otros estudios25,26. Zhu et al. encontraron un %PSP de 77,8% en el grupo de GV y 76,2% en el grupo de banda gástrica (BG), evaluados 12 meses poscirugía. Además, observaron que una pérdida de más del 50% del exceso de peso se logró al noveno mes27, mientras que Van Dielen et al. observaron un %PSP de 26%±4% dentro de los 53±26 días poscirugía28.
Nuestros resultados mostraron que los pacientes con un mayor valor de HOMA-IR prequirúrgico presentaron un mayor %PSP al año de la cirugía. En el modelo lineal, por cada punto extra en el HOMA-IR hubo 0,93% más %PSP al año poscirugía. Sin embargo, este hallazgo contrasta con los reportes publicados sobre el tema. Papaprieto et al.29 no encontraron asociación entre la presencia prequirúrgica de resistencia a la insulina con la evolución del peso poscirugía; Kruljac et al.30 tampoco encontraron asociación entre los valores prequirúrgicos de HOMA-IR con pérdida de peso a los 6 o 12 meses poscirugía. Por otro lado, Dixon et al. encontraron una relación inversa, siendo el HOMA-IR un factor predictor de menos %PSP un año poscirugía bariátrica13. Igualmente, Faria et al.31 encontraron que los pacientes con bajos niveles de insulina prequirúrgica tuvieron una mejor respuesta, con porcentajes de pérdida de peso≥80%. Las razones de las diferencias individuales en la pérdida de peso inducida quirúrgicamente no se conocen completamente, no habiéndose encontrado estudios dirigidos específicamente a analizar los efectos de la resistencia a la insulina. En general, se considera que los pacientes con mayores niveles de glucosa en plasma producen más insulina para mantener la homeostasis. Este entorno hiperinsulinémico podría generar una resistencia a la pérdida de peso, ya que la insulina inhibe la lipólisis y promueve la lipogénesis31. Sin embargo, nosotros encontramos lo opuesto, por lo que consideramos pertinente realizar más estudios enfocados en este tema.
Una posible explicación sería que el presente trabajo solo consideró pacientes con comorbilidades (DM2, dislipidemia e hipertensión arterial), independientemente del tipo de obesidad. Sanchez et al.32 encontraron que algunos de estos factores, como la DM2, condicionan peores resultados ponderales de los pacientes sometidos a cirugía bariátrica. Aunque en el presente estudio ninguno de estos factores resultó asociado a la pérdida de exceso de peso, es posible que, al estudiar solo pacientes con comorbilidades metabólicas, la relación entre HOMA-IR y %PSP sea diferente. Otra posibilidad es que el resultado de la cirugía dependa más de que rápido se corrija el estado hiperinsulinémico de los pacientes poscirugía, en vez de correlacionarse con los niveles prequirúrgicos. Desafortunadamente no contamos con mediciones del HOMA-IR poscirugía.
También encontramos que, a mayor edad, hay menos pérdida de exceso de peso postcirugía GV, similar a los reportado por Nagao et al.33. Adicionalmente, dichos autores observaron que los pacientes con una edad≥65 tuvieron mayor riesgo de mortalidad y morbilidad después de la cirugía bariátrica. De forma similar, Faria et al.31 encontraron que los pacientes<50 años tuvieron mayor éxito poscirugía bariátrica. Una explicación para esta relación inversa entre edad y pérdida de exceso de peso sería el aumento del deterioro metabólico asociado con el incremento de la edad, lo que produciría resultados menos satisfactorios después de la cirugía. Además, existen otros predictores de pérdida de exceso de peso. Andersen et al.34 encontraron que el sexo femenino y el IMC más alto fueron predictivos de una menor pérdida de exceso del IMC. Faria et al.31 también encuentran la misma relación entre %PSP y el peso o IMC inicial. Sin embargo, nosotros no encontramos asociaciones significativas con estos factores ni con el tipo de obesidad.
Una limitación del presente estudio es que el tamaño muestral, a pesar de estar basado en un cálculo adecuado, solo fue de 91 pacientes. Ello podría comprometer el poder del estudio para considerar las asociaciones no significativas (p>0,05) como verdaderamente no asociadas. Si bien se trató de ampliar la muestra al máximo, hubo una pérdida importante de casos debido a registros incompletos, hecho usual en los estudios retrospectivos. Otra limitación es que, al no ser un estudio multicéntrico, nuestra capacidad de extrapolar los resultados a otras realidades es reducida. En nuestro país las cirugías bariátricas suelen realizarse solo en centros privados altamente especializados, por lo que solo estamos estudiando una fracción de toda la población peruana con obesidad. Sería por lo tanto necesario corroborar nuestros resultados con estudios que incluyan un mayor número de pacientes y en diferentes escenarios. También sería importante incluir pacientes que aún no hayan desarrollado comorbilidades. Finalmente, sería enriquecedor realizar estudios midiendo el índice HOMA-IR antes y después de la cirugía.
Por otro lado, este es uno de los pocos estudios que evalúa el tema, y ciertamente el primero en un país latinoamericano. El hecho que hayamos encontrado una asociación diferente a la reportada en la literatura favorece el debate sobre cómo afecta la situación metabólica del paciente a los desenlaces de la cirugía bariátrica. En el caso de que nuestros resultados se confirmasen en un futuro, estos podrían significar que el estado insulinémico del paciente no afecta de forma negativa los resultados de la cirugía y, por lo tanto, no debería impedir al paciente alcanzar una máxima efectividad del procedimiento quirúrgico, en este caso GV.
FinanciamientoLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLST declara ser cirujana de la Clínica de Día Avendaño, en la cual recibe un salario. El resto de los autores declaran no tener conflicto de intereses respecto a esta investigación.
Quisiéramos agradecer al Dr. Gustavo Salinas Sedó, Director Médico de la Clínica de Día Avendaño, por permitirnos realizar esta investigación.