El sistema hepático arterial presenta variaciones anatómicas en hasta un 45%. La identificación pre o intraoperatoria de estas anomalías anatómicas evitará morbilidad adicional a la realización de una duodenopancreatectomía. Rutinariamente son identificadas en el preoperatorio mediante tomografía computarizada (TC). En determinadas ocasiones no son informadas y solo se descubren durante la intervención quirúrgica. El acceso inicial retroperitoneal de la arteria mesentérica superior (AMS) evitará una intervención poco útil si existe invasión de arteria mesentérica superior, e identificará las variantes anatómicas con origen en arteria mesentérica superior. Estas anomalías adquieren importancia dado que su lesión inadvertida ocasionaría severo compromiso vascular y/o hemorragias perioperatorias.
Objetivos·Analizar anomalías celiaco-mesentéricas de la arteria hepática ante una duodenopancreatectomía, mediante información de tomografía computarizada multicorte (TCMD), en régimen no protocolizado,·protocolizado y con reconstrucción multidimensional, proyección de intensidad máxima (MIP), tras acceso quirúrgico inicial a AMS.
Enfermos y métodoEstudio restrospectivo de variables clínicas, anatomopatológicas y quirúrgicas de enfermos con indicación de duodenopancreatectomía en nuestro Servicio desde 2008 hasta abril de 2010.·Estudio de informes realizados tras adquisición de imágenes mediante TCMC.·Realizamos reconstrucción tridimensional, MIP, enmascarada, de todos los enfermos para identificación de anomalías arteriales.·Descripción de anomalías arteriales hepáticas tras acceso inicial a AMS.
ResultadosLa población estudiada fue de 61 enfermos. La edad fue de 65±11años.Varones 33 (54%), mujeres28 (46%). Anomalías vasculares: arteria hepática derecha (AHD) (AMS) sustitutiva (sust.), 5 (8%); AHD (AMS) accesoria (acc.), 4 (7%); arteria hepática izquierda (AHI) (arteria gástrica izquierda [AGI]) acc., 3 (5%); arteria hepática común (AHC) (AMS) sust., 3 (5%); AHD (AMS) acc.+AHI (AGI) acc., 2 (3%); AHC (aorta) sust., 1 (2%); AHD+AGD+2AHI (tronco celiaco), 1 (2%); AHC (AMS)+AHI (AGI) acc.
ConclusionesUna homogeneidad en criterios metodológicos radiológicos de forma preoperatoria, con reconstrucción tridimensional, MIP, y realización de disección de la arteria mesentérica superior de forma inicial evitaría duodenopancreatectomías que no benefician al enfermo y compromiso sanguíneo, al poder identificar las anomalías arteriales.
Up to 45% anatomical variations are found in hepatic arterial system. Identifying these anatomical anomalies before or during surgery would prevent additional morbidity in performing a duodenopancreatectomy. They are routinely identified before surgery using CT imaging, but on certain occasions they are not reported and are only discovered during the surgical operation. The initial retroperitoneal access by the superior mesenteric artery (SMA) will avoid a fairly useless intervention if there is superior mesenteric artery invasion, and will identify the anatomical variations originating in the superior mesenteric artery. These anomalies acquire importance in that their unnoticed injury could lead to severe vascular compromise and/or perioperative bleeding.
ObjectivesTo analyse celiac-mesenteric anomalies of the hepatic artery before duodenopancreatectomy using the information from multidetector computed tomography (MDCT) using a non-standardised method, a standardised method with multidimensional reconstruction, and maximum intensity projection (MIP), after initial surgical access to the SMA.
Patients and methodsA retrospective study of the clinical, histopathological and surgical variables was conducted on patients with an indication for duodenopancreatectomy in our Department from 2008 until April 2010. A study was performed on the reports made after image acquisition by MDCT. A blind, three-dimensional, MIP reconstruction was performed on all the patients to identify arterial anomalies. A description is given of hepatic artery anomalies after initial access to the SMA.
ResultsA total of 61 patients were included in the study. The mean age was 65±11 years, with 33 (54%) males and 28 (46%) females. Vascular anomalies, right hepatic artery (RHA) (SMA) substitute (subst), 5 (8%); RHA (SMA) accessory (acc), 4 (7%); left hepatic artery (LHA) (left gastric artery) (LGA) acc 3 (5%); common hepatic artery (CHA) (SMA) subst 3 (5%); RHA (SMA) acc+LHA (LGA) acc2 (3%); CHA (aorta) subst, 1 (2%); RHA+RGA+2 LHA (celiac trunk), 1 (2%); and CHA (SMA)+LHA (LGA) acc.
ConclusionOn being able to identify arterial anomalies with a mixture of preoperative radiological and methodological criteria, with three-dimensional reconstruction, MIP, and initially performing a dissection of the superior mesenteric artery could avoid duodenopancreatectomies that may not benefit the patient and compromise bleeding.
La resección quirúrgica mediante duodenopancreatectomía cefálica (DPC) constituye la única opción curativa para carcinomas de páncreas y peripancreáticos, y terapéutica en procesos inflamatorios de mala evolución o con ausencia de diagnóstico definitivo. La morbilidad perioperatoria asociada es de hasta un 20-30%. Es importante por lo tanto identificar la presencia de alteraciones anatómicas arteriales que, en hasta un 45% de la población, no están identificadas, lo que puede aumentar la morbilidad perioperatoria asociada1.
Habitualmente las alteraciones anatómicas arteriales son identificadas mediante tomografía computarizada (TC) de forma preoperatoria. Sin embargo, en ocasiones la identificación es solo posible durante la intervención quirúrgica, y a veces esto no ocurre, produciéndose lesiones arteriales inadvertidas que pueden producir isquemia hepática o compromiso vascular en la anastomosis bilioentérica.
La excesiva actividad asistencial, la falta de interés en algunos casos y la no consolidación de Grupos de Estudio multidisciplinares hacen posible que no dispongamos de la información anatómica preoperatoria necesaria. En nuestro trabajo intentamos describir esta situación de déficit de información radiológica preoperatoria, solucionada por el abordaje inicial de la arteria mesentérica superior (AMS), y que podría ser resuelto definitivamente con la reconstrucción tridimensional de las imágenes obtenidas mediante TC multicorte (TCMC), con el deseo de que pueda servir para mejorar la estrategia diagnóstica perioperatoria ante una DPC.
El abordaje inicial de la AMS para su disección, como primera actitud antes de realizar la resección pancreática durante una DPC nos permitirá: a) identificar las variaciones anatómicas arteriales y evitar morbilidad adicional perioperatoria; b)·evidenciar infiltración arterial neoplásica no filiada preoperatoriamente evitando someter a una cirugía innecesaria al enfermo; c)·realizar linfadenectomías más extensas y d)·evitar sangrados innecesarios mediante el acceso a vasos pancreatoduodenales. Presentamos los enfermos intervenidos en nuestro Servicio a los que se realizó abordaje inicial de la AMS durante una DPC, para describir alteraciones anatómicas arteriales no descritas preoperatoriamente.
Realizamos además reconstrucción tridimensional, proyección de intensidad máxima (MIP), de las imágenes obtenidas en la TCMC preoperatoria, para conocer el poder de esta técnica, de forma que pueda ser incluida en el protocolo de estudio de extensión preoperatorio.
Enfermos y métodosPoblación estudiadaEstudio retrospectivo de los enfermos intervenidos quirúrgicamente con enfermedad pancreática y peripancreática incluidos desde enero de 2008 hasta abril de 2010 para la realización de DPC con acceso inicial a la AMS e intención curativa.
Variables estudiadasAnomalías de arteria hepática radiológicasIdentificación de anomalías arteriales e infiltración neoplásica descritas en informe de TCMC preoperatoria. Para el estudio diagnóstico y la estadificación utilizamos el tomógrafo multicorte Brillance CT Philips, con cortes tomográficos de hasta 0,9mm de grosor. En 5 pacientes se realizó además reconstrucciones 3D volume rendering (VRD), y en 12 pacientes se obtuvieron reconstrucciones multiplanares y en plano curvo con algoritmo MIP.
En los enfermos estudiados con TCMC se usó un grosor de corte de 3mm, con reconstrucción a 0,9mm en el área anatómica de interés. Se realizaron 2 adquisiciones abdominopélvicas a los 25 y 50 s, fase arterial y portal, tras la inyección de un bolo de contraste yodado no iónico en infusión rápida, 100ml a 2,5-3ml/s, a través de una vía venosa periférica. Se realizó una adquisición torácica para completar la estadificación tumoral.
Por vía oral se utilizó contraste neutro, 1 l de agua/h, para la distensión adecuada de la cavidad gástrica, duodeno y yeyuno.
Identificación retrospectiva enmascarada de anomalías arteriales e infiltración de AMS, mediante revisión de imágenes de TC preoperatorias disponibles, y reconstrucción tridimensional, MIP, en estación de trabajo.
Clasificación de anomalías anatómicas de la arteria hepática. Utilizamos los métodos descritos por:
- -
Michels2: tipo 1, anatomía convencional; tipo 2, arteria hepática izquierda (AHI) sustitutiva con origen en arteria gástrica izquierda (AGI); tipo 3, arteria hepática derecha (AHD) sustitutiva con origen en AMS; tipo 4, combinación de tipos 2 y 3; tipo 5, AHI accesoria con origen en AGI; tipo 6, AHD accesoria con origen en AMS; tipo 7, combinación de tipos 5 y 6; tipo 8, AHD sustitutiva y AHI accesoria de AGI; tipo 9, arteria hepática común con origen en AMS; tipo 10, arteria hepática común con origen en AGI.
- -
Hiatt et al.3: tipo 1: patrón normal (la arteria hepática tiene su origen en el tronco celiaco, para dividirse en arterias gastroduodenal y arteria hepática propia. Distalmente la arteria hepática propia se dividirá en ramas hepáticas derecha e izquierda); tipo 2: AHI accesoria o sustitutiva con origen en AGI; tipo 3: AHD sustitutiva o accesoria con origen en AMS; tipo 4: AHD con origen en AMS y AHI con origen en AGI; tipo 5: arteria hepática común con origen en AMS; tipo 6: arteria hepática común de aorta.
En todos los enfermos realizamos laparotomía subcostal bilateral. Tras exploración de cavidad abdominal para descartar la existencia de metástasis hepáticas que contraindicarían la continuación del proceso, se procedió a la movilización y descenso del ángulo cólico hepático y colon transverso, junto a maniobra de Kocher extensa, que nos permitió liberar del retroperitoneo a región ventral, el duodeno y cabeza del páncreas para exponer los grandes vasos, hasta margen lateral izquierdo de aorta y proceder a linfadenectomía interaortocava con límite craneal en tronco celiaco y caudal en arteria mesentérica inferior. Identificación en su origen, de AMS, en ángulo formado por región lateral izquierda de vena cava inferior y borde superior de vena renal izquierda. Disección de AMS y exéresis de tejido linfograso, para su aislamiento de vena porta y región pancreática, en su recorrido retropancreático y región caudal pancreática, con ligadura de arteria pancreaticoduodenal inferior, hasta su entrada en mesenterio. La afectación de>del 50% de la circunferencia del tronco celiaco o AMS, y la oclusión de la vena mesentérica superior o confluencia mesentericoportal sin posibilidad de resección o reconstrucción contraindicaría la resección quirúrgica (fig. 1).
ResultadosDesde 2008 hasta abril de 2010, 61 enfermos fueron incluidos para la realización de duodenopancreatectomía cefálica con desarrollo de un programa de abordaje inicial retroperitoneal a AMS. La edad fue de 65±11 años siendo varones 33 (54%) y mujeres, 28 (46%).
El diagnóstico histológico fue de: adecocarcinoma de páncreas, 28 (44%); tumor carcinoide, 1 (2%); ampuloma, 8 (13%); adenocarcinoma de duodeno, 1 (2%); neoplasia endocrina maligna, 2 (3%); pancreatitis crónica, 5 (8%); colangiocarcinoma, 6 (9%); cistoadenocarcinoma mucinoso, 1 (2%); tumor sólido seudopapilar, 1 (2%) (tabla 1).
La distribución anatómica arterial hepática fue normal en 41 enfermos, (67%). Las anomalías vasculares fueron: arteria hepática derecha sustitutiva desde AMS, 5 (8%); AHD accesoria desde AMS, 4 (7%); arteria hepática izquierda accesoria desde AGI, 3 (5%); arteria hepática común sustitutiva desde AMS, 3 (5%); AHD accesoria desde AMS +AHI accesoria desde AGI, 2 (3%); AHC desde aorta, 1 (2%): AHD+AGD+2AHI desde tronco celiaco, 1 (2%); AHC de AMS+AHI accesoria de AGI, 1 (2%) (tabla 2).
Anomalías arteriales respecto a los sistemas de clasificación de Michels y Hiatt
| Anomalía arteriales (origen arterial) (tipo) | HGCR (n/%) | Michels | Hiatt |
| Normal | 41 (67%) | 1 | 1 |
| AHD (AMS) (sust) | 5 (8%) | 3 | 3 |
| AHI (AGI) (acc) | 3 (5%) | 5 | 2 |
| AHD (AMS) (acc) | 4 (7%) | 6 | 3 |
| AHD (AMS) (acc)+AHI (AGI) (acc) | 2 (3%) | 7 | 4 |
| AHC (AMS) (sust) | 3 (5%) | 9 | 5 |
| AHC (aorta) (sust) | 1 (2%) | - | 6 |
| AHD+AGD+AHI2 (tronco celiaco) (sust) | 1 (2%) | - | - |
| AHC(AMS)+AHI (AGI) (acc) | 1 (2%) | - | - |
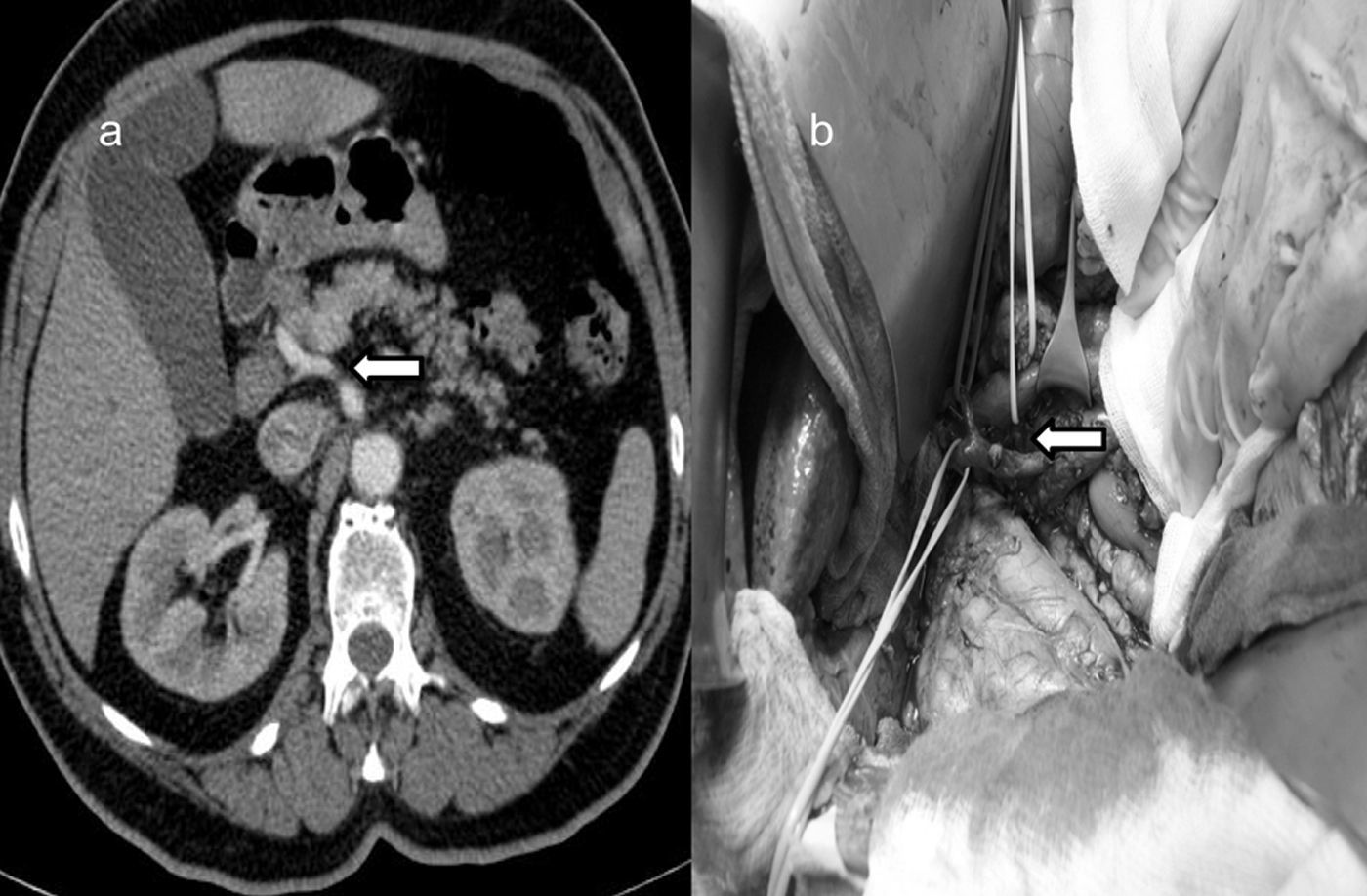
En 6 enfermos se describió infiltración de la arteria mesentérica tras abordaje inicial a AMS. No fue descrito en el informe inicial de TCMC, en el 100% de las ocasiones. Tras estudio retrospectivo con TCMC y reconstrucción MIP, solo en un enfermo, con imágenes de TC preoperatorio realizado en otro centro, no existió diagnóstico preoperatorio.
DiscusiónAnomalías de arteria hepáticaLa distribución anatómica anómala de la arteria hepática ocurre en hasta un 45% de los enfermos. Sería conveniente conocer esta distribución para evitar problemas ante la realización de una duodenopancreatectomía, ya que añadiríamos a la morbilidad elevada de este procedimiento, la posibilidad de episodios de hemorragia perioperatoria y procesos de isquemia. En situación de normalidad el tronco celiaco es el origen de la AGI, arteria hepática común y arteria esplénica. La arteria hepática común se bifurca en la arteria gastroduodenal y la arteria hepática propia. La arteria hepática propia se divide en AHD y AHI4–8.
Las alteraciones anatómicas de la arteria hepática pueden ser alteraciones accesorias, que son aquellas que originándose en un lugar diferente al normal, se presentan junto al vaso de presencia clásica. También pueden ser alteraciones sustitutivas, cuando se originan en un sitio diferente a la normalidad y se hallan presentes en ausencia del vaso de disposición normal.
Han sido diferentes sistemas de clasificación los utilizados para identificar las variaciones anatómicas de la arteria hepática, realizadas por autores como Michels2, tras estudio de 200 autopsias, o modificaciones posteriores realizadas por Hiatt3, en estudio de 1.000 trasplantes hepáticos. Adicionalmente se han añadido situaciones anatómicas no convencionales de forma aislada8.
- -
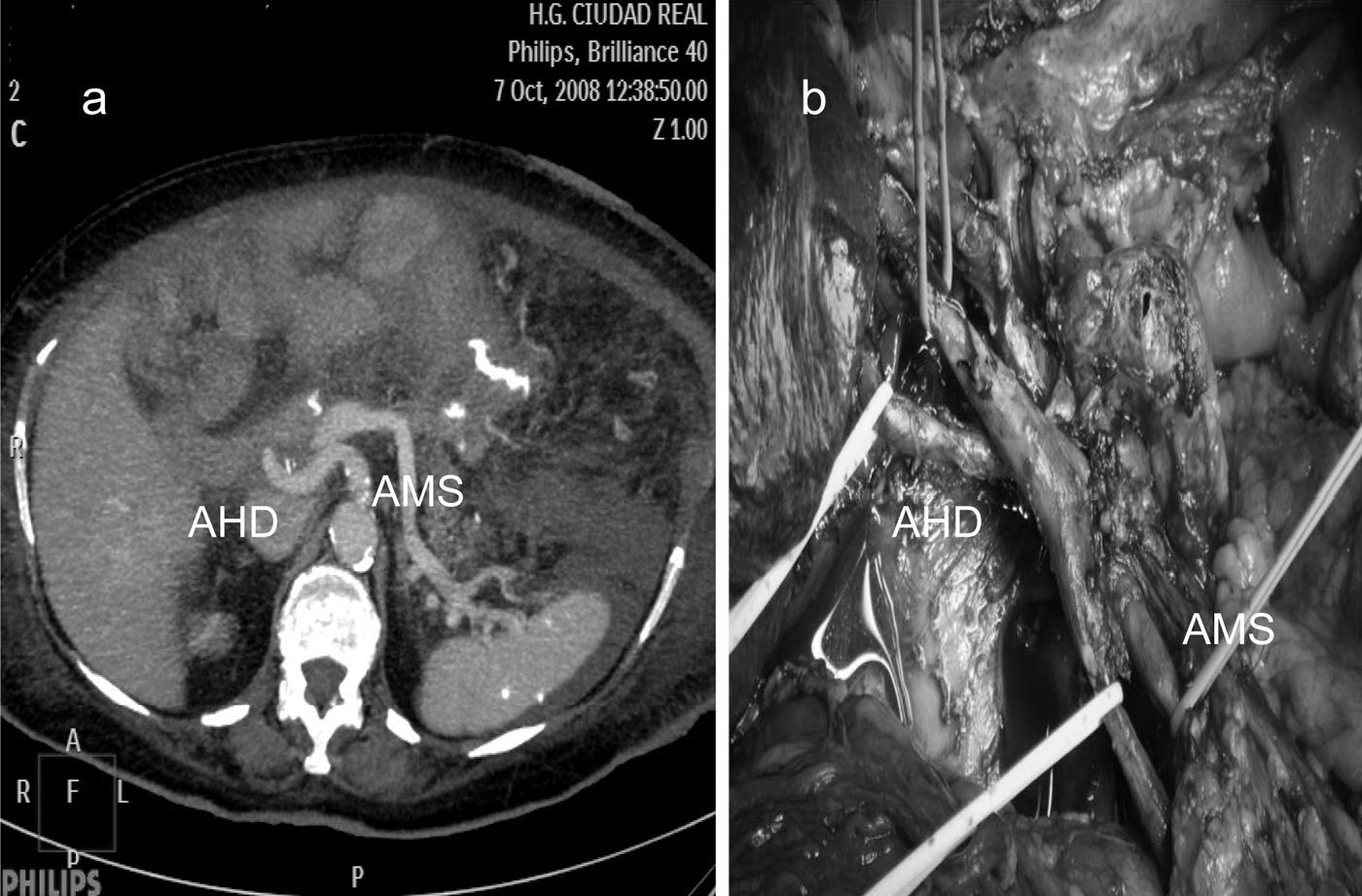
Arteria hepática derecha sustitutiva. Es la variación anatómica de la arteria hepática más frecuente (11-21%). Su origen es la AMS. En nuestra muestra ocurrió en 5 enfermos (8%). Su recorrido en todos los casos fue retropancreático, retroportal con entrada a ligamento hepatoduodenal posterolateral a la vía biliar, tipo 1. Pero también puede tener un recorrido a través de la cabeza pancreática, tipo 2, o entre esta y la vena porta, tipo 34. Su identificación perioperatoria evitará daños como hemorragia intra o postoperatoria y fenómenos de isquemia, con riesgo de complicación en anastomosis bilioentérica (fig. 2).
- -
AHD y AHI accesorias. Ocurre cuando se adicionan AHD de AMS y AHI de AGI, a las ramas AHD y AHI de localización normal. Ocurre con una frecuencia de 0,8-8%, y en nuestra muestra ocurrió en 2 enfermos (3%).
- -
Arteria hepática común sustitutiva. Denominado tronco hapatomesentérico ocurre con un rango entre 0,4-4,5%. La arteria hepática común tiene su origen en la AMS. Su recorrido craneal puede ser ventral a la superficie pancreática, a través del parénquima pancreático o detrás de la cabeza pancreática ascendiendo medial a la vía biliar en la localización normal de la arteria gastroduodenal. En nuestros enfermos ocurrió en 3 ocasiones (5%) (fig. 3).
- -
Arteria hepática común desde aorta. Descrita como variación anatómica según Hiatt (tipo 6, 0,2%), en nuestro caso ocurrió en un enfermo (2%).
- -
AHI accesoria desde AGI. Corresponde a variación anatómica tipo 5 de Michels (8-18%), y tipo 2 de Hiatt (9,7%). Describimos 3 enfermos que presentaron esta anomalía (5%).
- -
AHD, arteria gastroduodenal, 2 AHI con origen en tronco celiaco. Variación anatómica que ocurrió en un caso (2%), no descrita en los sistemas de clasificación estudiados.
- -
Arteria hepática común con origen en AMS, junto a AHI desde AGI. Variación anatómica que ocurrió en un caso (2%). Tampoco está descrita en los sistemas de clasificación estudiados.
Por lo tanto debido a la presencia en hasta un 45% de estas anomalías arteriales, es importante su diagnóstico bien preoperatorio bien intraoperatorio para evitar complicaciones. Los métodos a nuestro alcance, que en conjunto nos permitieron identificar la totalidad de las variaciones anatómicas fueron:
Tomografía computarizada multicorte: con posterior reconstrucción tridimensional, proyección de intensidad máximaLa TCMC supone un aumento de calidad respecto a la TC helicoidal en relación con el diagnóstico y estadificación de lesiones periampulares. Las ventajas aportadas son adquisición de volúmenes, velocidad del estudio, aprovechamiento del contraste usado y la posibilidad de reconstrucción tridimensional. Existen varias técnicas de reconstrucción tridimensional como son: shaded surface display (SSD), VRD y MIP.
La MIP es una técnica de representación tridimensional, que evalúa cada unidad de volumen, voxel, y selecciona puntos de máxima intensidad. Materiales de alta intensidad como calcio intraarterial o prótesis vasculares pueden ocultar información en relación con el contraste endovascular.
La mayor precisión en la valoración de la resecabilidad tumoral de la TCMC se debe a una mayor resolución y a la capacidad de realizar reconstrucciones multiplanares. Los inconvenientes que puede presentar son: necesidad de estaciones de trabajo, formación por parte del radiólogo y tiempo adecuado, que muchas veces por el exceso de trabajo no existe, para la realización reconstrucciones multiplanares y volumétricas9–12.
En nuestro estudio se realizó una revisión de la información radiológica evidenciada preoperatoriamente, en la que no existía un protocolo exhaustivo de estadificación para lesiones periampulares, aunque sí de la adquisición de imágenes, por lo que no se incluyó en todas las ocasiones información de las variantes anatómicas arteriales hepáticas. Se realizó reconstrucción solo en una serie de enfermos. En 5 pacientes se realizaron además reconstrucciones VRD, y en 12 pacientes se obtuvieron reconstrucciones multiplanares y en plano curvo con algoritmo MIP. Esto justifica que solo en 2 enfermos (11%), se informara de la existencia de anomalías de la arteria hepática.
En posterior estudio enmascarado, protocolizado de forma multidisciplinar, con relación a la adquisición de imágenes y hallazgos necesarios para informar, la anatomía arterial hepática se evaluó con imágenes coronales, sagitales en combinación con imágenes axiales, mediante técnica de reconstrucción MIP. Esta homogenización nos permitió identificar las anomalías en 18 de los 20 enfermos. Los 2 casos no identificados se debieron a la no posibilidad de reconstrucción de imágenes de otros centros (tabla 3).
Descripción de anomalías arteriales peripancreáticas, con relación a los métodos de información que hemos dispuesto
| Caso | Acceso inicial a AMS (origen) (tipo) | TC preoperatoria (origen) (tipo) | TC enmascarada postoperatoria,con reconstrucción de imágenes, MIP (origen) (tipo) |
| 1 | AHD (AMS) (acc) | No descrito | No descrito. Otro centro |
| 2 | AHD (AMS) (acc) | No descrito | Descrito |
| 3 | AHD (AMS) (acc) | No descrito | AHD (AMS)+AHI (AGI) |
| 4 | - | AHI (AGI) (acc) | AHI (AGI) (acc) |
| 5 | AHC (AMS) (sust) | No descrito | Descrito |
| 6 | - | No descrito | AHD+AGD+2AHI (tronco celiaco) |
| 7 | AHD (AMS) (sust) | No descrito | Descrito |
| 8 | AHD (AMS) (sust) | No descrito | Descrito |
| 9 | - | No descrito | AHI (AGI) (acc) |
| 10 | AHC (AMS) (sust) | No descrito | Otro centro (no descrito) |
| 11 | AHD (AMS) (acc) | No descrito | Descrito |
| 12 | AHC (aorta) (sust) | AHC (aorta) | Descrito |
| 13 | AHD (AMS) (acc) | No descrito | Descrito |
| 14 | AHD (AMS) (sust) | No descrito | Descrito |
| 15 | AHI (AGI) (acc) | No descrito | Descrito |
| 16 | AHD (AMS) (sust) | Descrito | Descrito |
| 17 | AHD (AMS) (sust) | Descrito | Descrito |
| 18 | AHC (AMS) (sust) | Descrito | Descrito |
| 19 | AHC (AMS)+AHI (AGI) (acc) | No descrito | Descrito |
| 20 | AHD (AMS) (acc)+AHI (AGI) (acc) | No descrito | Descrito |
acc: accesoria; AGD: arteria gástrica derecha; AGI: arteria gástrica izquierda; AHC: arteria hepática común; AHD: arteria hepática derecha; AHI: arteria hepática izquierda; AMS: AMS; MIP: proyección de intensidad máxima; sust: sustitutiva; TC: tomografía computarizada.
Pessaux et al.13, en 2003, describieron esta modificación de la resección de la lámina retroportal durante la realización de una duodenopancreatectomía, que permitió una linfadenectomía más extensa y la identificación de anomalías arteriales. Además se reduce el sangrado perioperatorio con el control de los vasos pancreaticoduodenales inferiores y evita resecciones inútiles por infiltración de la AMS. Puede ser de enorme ayuda su aplicación cuando se sospecha infiltración de la AMS, cuando existe AHD con origen en AMS, o bien cuando existe infiltración de venas porta y VMS, y la neoplasia periampular se extiende al cuerpo pancreático. Tradicionalmente tras maniobra de Kocher mediante palpación se intentaba identificar tanto infiltración neoplásica como la existencia de anomalías arteriales, existiendo una escasa precisión. Con el acceso inicial a AMS conseguiremos un diagnóstico exacto14–17.
Todas las anomalías de la arteria hepática con origen en AMS fueron identificadas. La AHD con origen en AMS fue la más frecuente (8%), siendo del tipo 1 en todas las ocasiones. Si existiera recorrido intraparenquimatoso o infiltración neoplásica de la arteria hepática anómala se recomienda su reconstrucción evitando así fenómenos de isquemia.
ConclusionesLa excesiva carga asistencial de los Servicios de Radiodiagnóstico puede justificar en muchas ocasiones no conseguir reconstrucción de imágenes, como la reconstrucción tridimensional, MIP, estudiada en nuestra población, que aumentaría nuestra información anatómica vascular preopeatoria y con relación a invasión vascular.
La creación de equipos multidisciplinares que unifiquen y exijan criterios de búsqueda y hallazgos radiológicos protocolizados con estos fines, en enfermos susceptibles de realizarles una duodenopancreatectomía cefálica, nos permitirá conseguir una información y estadificación preoperatoria adecuada18,19.
En todos los casos sería recomendable utilizar el abordaje inicial durante la DPC de la AMS para identificar anomalías anatómicas arteriales, consiguiendo no lesionarlas con lo que evitaremos fenómenos de isquemia parenquimatosa hepática, insuficiencia vascular perianastomótica. Conseguiremos reducir el sangrado perioperatorio con el acceso inicial a la AMS y vasos arteriales pancreatoduodenales. Por último, también evitaremos un tratamiento quirúrgico agresivo con la identificación de la infiltración neoplásica de la AMS, no evidenciada preoperatoriamente13–17.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte del contenido del manuscrito fue presentado en el Congreso Nacional de Cirugía, 2010, Madrid.