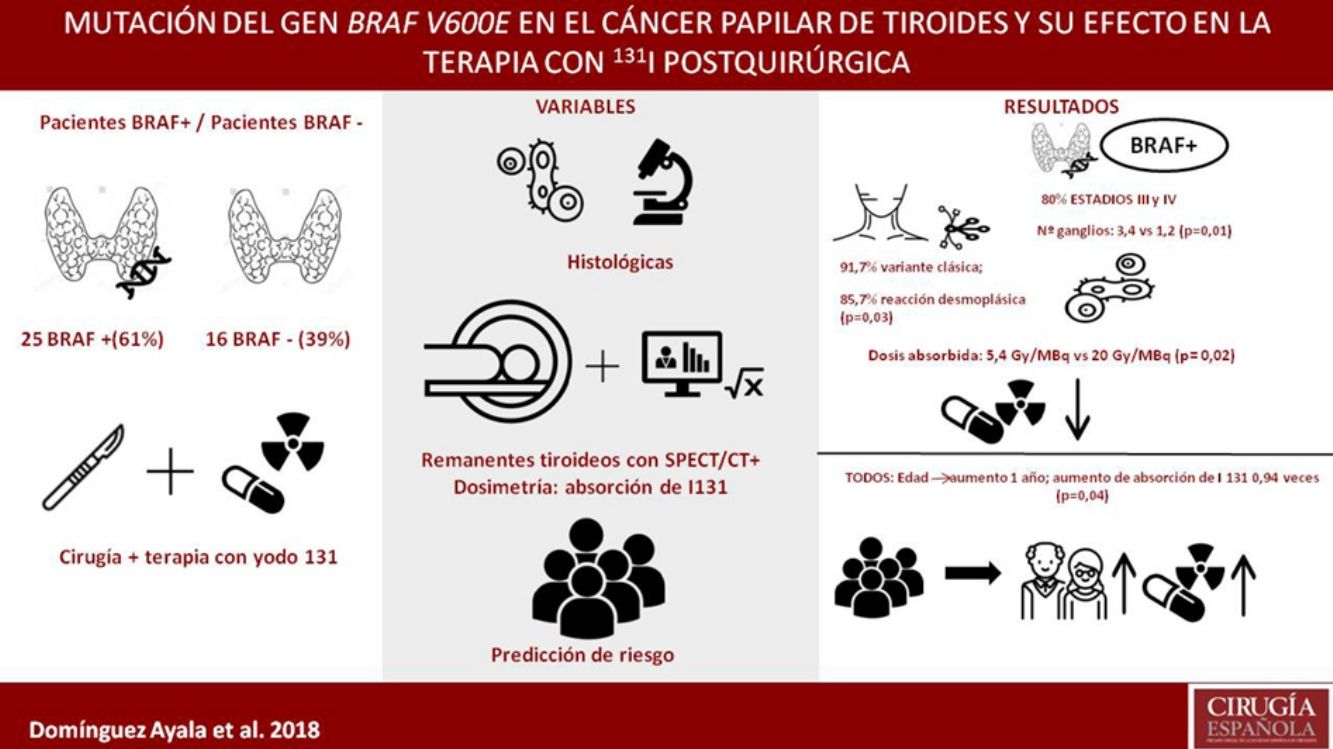
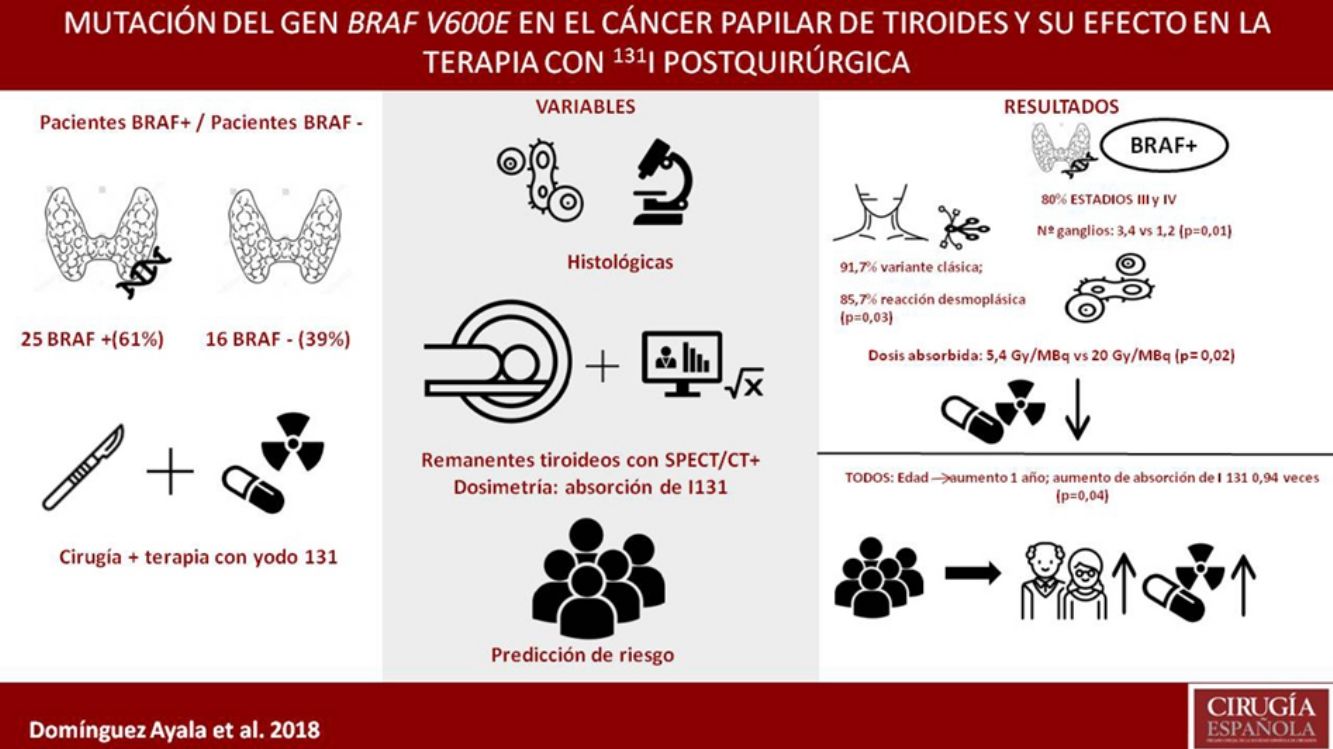
La mutación BRAF V600E en el cáncer papilar de tiroides (CPT) parece asociarse a una resistencia al 131I. Nuestro principal objetivo fue cuantificar la respuesta al 131I tras la cirugía tanto en pacientes que presentaban la mutación (BRAF+) como en los que no presentaban el gen mutado (BRAF−).
MétodoEstudio prospectivo de los CPT intervenidos y tratados con 131I desde septiembre de 2015 hasta enero de 2017. Variables: edad, género, estadio tumoral, histológicas, tiroglobulina antes de 131I, a las 48h y a los 6meses; dosis absorbida y % de actividad a los 2 y a los 7días y tiempo de eliminación.
ResultadosCuarenta y un pacientes y 67 restos tiroideos. El 61% eran BRAF+. En los estadiosiii y iv, el 80% eran BRAF+. En el vaciamiento ganglionar terapéutico, el 100% eran BRAF+. El número de ganglios fue superior en BRAF+: 3,4 vs 1,2 (p=0,01). La variante clásica fue predominante en BRAF+ (91,7% vs 8,3%; p=0,03). El 85,7% vs 14,3% de los BRAF+ tuvieron reacción desmoplásica (p=0,02). Los BRAF+ presentaban menor dosis absorbida respecto a la actividad administrada (5,4 vs 20Gy/MBq; p=0,02); menor % de actividad respecto a la unidad de masa a los 2 (0,046 vs 0,103%/g; p=0,02) y a los 7días (0,006 vs 0,034%/g, p=0,04).
ConclusionesLa mutación del gen BRAF V600E se relaciona con una mayor resistencia al tratamiento posquirúrgico con 131I desde el inicio de la enfermedad.
The BRAF V600E mutation in papillary thyroid cancer (PTC) has been associated with resistance to 131I. Our aim was to quantify the response to 131I after surgery in patients who had the mutation (BRAF+) and those who did not have the mutated gene (BRAF−).
MethodA prospective cohort study was designed, from September 2015 to February 2016, which included patients with PTC receiving therapy after surgical treatment. Variables were described for age, gender, histology, tumor stage, thyroglobulin values before, 48h after and 6months after 131I; absorbed dose and % activity on days 2 and 7 and elimination time.
Results41 patients giving in total 67 thyroid remnants were included. 61% were BRAF+. In stagesiii and iv, 80% were BRAF+. In lateral resection, 100% were BRAF+. The number of nodes was higher in BRAF+: 3.4 vs 1.2 (P=.01). The classic variant was predominant in BRAF+ (91.7% vs 8.3%, P=.03). 85.7% vs 14.3% of BRAF+ had desmoplastic reaction (P=.02). The BRAF+ had a lower absorbed dose than the administered activity (5.4Gy/MBq vs 20Gy/MBq, P=.02); lower% activity with respect to the unit of mass at 2 (0.046%/g vs 0.103%/g, P=.02) and at 7days (0.006%/gr vs 0.034%/gr, P=.04)
ConclusionsThe mutation of the BRAF V600E gene is related with greater resistance to postoperative treatment with 131I since the onset of the disease.
La mutación del gen BRAF V600E es la alteración genética más frecuente en el cáncer papilar de tiroides (CPT) (del 23 al 83%)1,2. El papel de esta mutación como marcador pronóstico en la estratificación de riesgo molecular del cáncer de tiroides es prometedor3. Además, se ha asociado a características clinicopatológicas más agresivas4, aumento de recidiva5, refractariedad al 131I en enfermedad metastásica6 e incluso mortalidad7. Sin embargo, la Asociación Americana de Tiroides en su última actualización (ATA)8, aunque reconoce su papel como marcador de riesgo de recidiva, aún no recomienda el estudio rutinario del estado mutacional del tumor.
La mutación consiste en la sustitución de valina por glutamato en la posición 600 de la proteína b-raf. Se ha asociado a la disminución de la captación de 131I, debido en parte a la activación de la vía de señalización proteincinasa activada por mitógenos (MAPK)9. Esta vía de señalización de la que forma parte el oncogén BRAF junto con otros, como RET/PTC y RAS, es esencial para la homeostasis de las células tiroideas. La activación constitutiva de la vía MAPK mediante estas oncoproteínas induce un crecimiento anormal y una resistencia a señales proapoptóticas10. Las bases moleculares que explican las relaciones entre los diversos componentes, aun siendo complejas y controvertidas, son de gran relevancia clínica por su relación directa tanto con la desdiferenciación de los tumores tiroideos como con la resistencia a la terapia con 131I. Esta resistencia es mediada fundamentalmente por BRAF al estimular la inducción de la secreción de factor de crecimiento tumoral (TGF-B) que reprime la expresión del simportador sodio/yodo o NIS, necesario para la captación de yodo en la célula, además de promover cambios necesarios para la migración y la invasión celular11,12. Esta pérdida de expresión es la base de la refractariedad al tratamiento con 131I. Como consecuencia, los CPT mutados presentan una disminución de la avidez por el 131I13, por lo que sería razonable pensar que, para este grupo de pacientes, una cirugía más agresiva sería la mejor opción terapéutica14. En este sentido, la mayor parte de los estudios miden esta resistencia al tratamiento con 131I en fase de recidiva tumoral o en cánceres metastásicos, no al inicio de la terapia posquirúrgica. La valoración de esta respuesta se obtiene exclusivamente con mediciones indirectas de los valores séricos de tiroglobulina, no existiendo en la literatura estudios que cuantifiquen el efecto de la mutación en las imágenes obtenidas mediante TAC o SPECT-TAC. Sin embargo, existen otros métodos para estimar la cuantificación de la respuesta al tratamiento, como es la dosimetría. Mediante esta metodología se pueden obtener variables tan importantes como la dosis absorbida, parámetro estrechamente relacionado con la destrucción celular y, por tanto, con el efecto del tratamiento15. Una medición más detallada de la absorción del 131I y del comportamiento de la mutación BRAF V600E tras el tratamiento posquirúrgico con el radiofármaco puede establecer definitivamente el valor pronóstico de la mutación y, por tanto, una modificación de la estrategia terapéutica.
Los objetivos de este estudio son: 1)describir las características de los pacientes con CPT según su estado mutacional; 2)cuantificar la respuesta del 131I administrado tras la cirugía, y 3)obtener un modelo predictivo de estratificación de riesgo que defina a los pacientes con mayor riesgo de resistencia al 131I.
MétodoSe diseñó un estudio observacional analítico de cohortes prospectivo. La población a estudio la constituyeron los pacientes diagnosticados histológicamente de carcinoma papilar de tiroides tratados con cirugía y 131I posquirúrgico desde septiembre del 2015 hasta enero de 2017.
Los criterios de inclusión fueron: 1)diagnóstico histológico de CPT; 2)tratamiento quirúrgico con tiroidectomía total realizada por el Sección de Cirugía Endocrina del Hospital Universitario Basurto, y 3)tratamiento con 131I posquirúrgico.
Los criterios de exclusión fueron: 1)cánceres incidentales; 2)recidiva de CPT; 3)haber recibido terapia anterior con I131, y 4)cirugía en otro centro diferente o por otro equipo quirúrgico.
Previo a la realización de la cirugía, se analizó el estado de la mutación BRAF V600E mediante análisis inmunohistoquímico de la muestra obtenida por biopsia con aguja gruesa, según el protocolo de la unidad16.
La técnica quirúrgica consistió en resección completa de la glándula tiroides (sin preservación macroscópica de restos tiroides) y/o vaciamiento ganglionar central profiláctico bilateral o terapéutico de los compartimentos afectados. Además, en los pacientes con estadificación preoperatoria por ecografía de N0 se llevó a cabo la técnica del ganglio centinela según el protocolo de otro estudio que se estaba llevando a cabo en la unidad.
Se estudiaron las siguientes variables: 1)demográficas (género, edad); 2)técnica quirúrgica; 3)estadio tumoral tras el estudio de la pieza quirúrgica, y 4)características anatomopatológicas: a)número de ganglios afectados; b)variante histológica (clásica, folicular o mixta); c)reacción desmoplásica; d)bilateralidad; c)extensión extratiroidea, y d)multifocalidad.
En base a estas variables obtenidas se clasificaron, en función del riesgo de recidiva, en riesgo bajo, intermedio y alto, siguiendo las recomendaciones de la guía ATA 2009 vigente el año del inicio del estudio17, de forma que se les administró una dosis oral de 30, 100 o 150mCi de 131I previa estimulación de TSH recombinante.
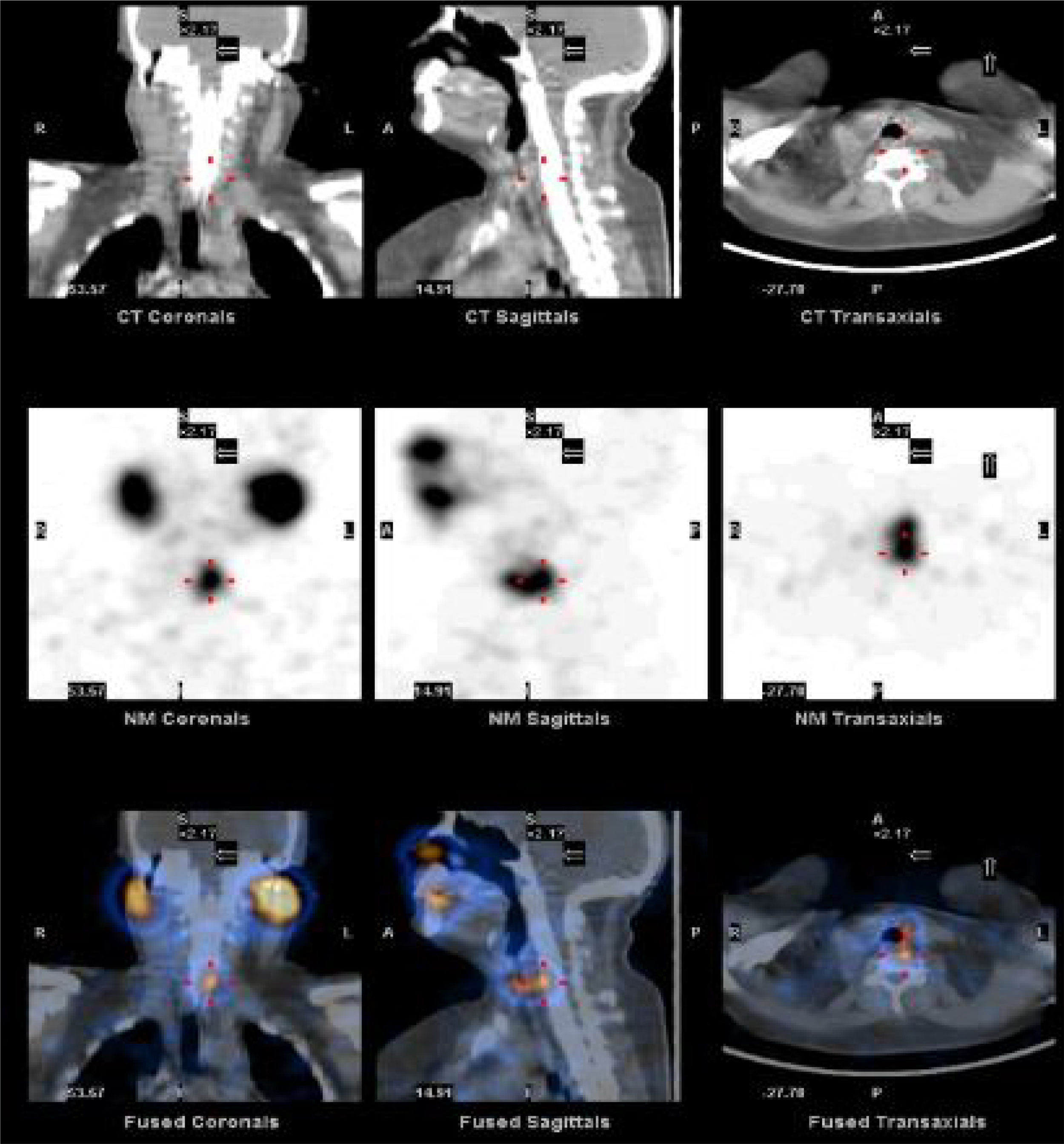
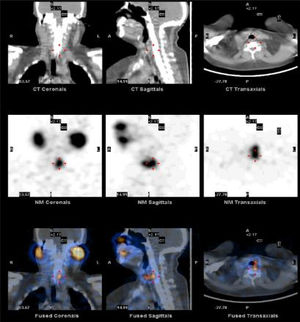
Para cuantificar la respuesta del 131I administrado tras la cirugía se estudiaron las imágenes de los restos tiroideos posquirúrgicas de cada paciente tras el tratamiento con 131I mediante SPECT-CT a las 48h y a los 7días. A los 2días, la captación de los remanentes en el lecho quirúrgico se encuentra en valores aproximados a su valor máximo, y a los 7días la actividad del 131I es considerablemente menor e insignificante en lugares diferentes al lecho tiroideo. El análisis de las imágenes de SPECT-CT en la estación de trabajo implicó la identificación de los restos tiroideos y la diferenciación del acúmulo fisiológico del radiofármaco en otras áreas anatómicas, como se muestra en la figura 1. Para la cuantificación de la actividad de los restos tiroideos previamente se aplicó un factor de calibración, de acuerdo a las recomendaciones publicadas recientemente18. Mediante dosimetría, se analizaron las siguientes variables: 1)dosis absorbida respecto a la dosis administrada; 2)porcentaje de actividad a los 2 y a los 7días respecto a la unidad de masa; 3)tiempo de eliminación de 131I. El cálculo de los valores en función de la dosis administrada en la primera medición se realizó en base a la masa calculada en las mediciones de actividad a los 2 y a los 7días; de esta forma se eliminó la posible influencia de las diferentes dosis administradas o volúmenes de restos tiroideos obtenidos. Para ello se utilizaron los formalismos obtenidos de dosis médica de radiación interna19.
Los valores séricos de tiroglobulina y anticuerpos antitiroglobulina se midieron: 1)en el momento previo a la administración del 131I; 2)a las 48h del tratamiento, y 3)a los 6meses.
Análisis estadísticoSe utilizaron frecuencias y porcentajes para el análisis descriptivo de las variables cualitativas, y medias y desviaciones estándar (DE) para las variables cuantitativas.
Se compararon las diferentes características de los pacientes entre los pacientes BRAF+ y BRAF−. Para la comparación de las variables cualitativas se utilizó la prueba chi-cuadrado o el test exacto de Fisher, y para la comparación de las cuantitativas se utilizó la prueba t-test o el test no paramétrico de Wilcoxon.
Por otro lado, se estudió la biocinética del yodo en los restos tiroideos mediante la prueba no paramétrica de Wilcoxon. Además, dentro de cada grupo (BRAF+ y BRAF−) se analizó el cambio en la tiroglobulina del antes de la administración del 131I a las 48h mediante la prueba no paramétrica de la suma de rangos con signo de Wilcoxon para datos pareados.
Finalmente, se analizó la posible asociación de las diferentes características con la dosis absorbida respecto a la actividad administrada mediante el modelo lineal general. En primer lugar, se realizaron los análisis bivariante para identificar las variables que individualmente resultaron estar significativamente asociadas a la dosis absorbida. A continuación se realizó el análisis multivariante para ver la influencia conjunta de estas variables, considerando como variables independientes aquellas que habían resultado con p<0,15 en los análisis bivariantes. En los modelos finales únicamente se considerarán las variables con p<0,05. Debido a la no normalidad de la variable dosis absorbida, se realizó una transformación logarítmica de la misma. Por lo tanto, para la interpretación de los resultados se consideró la exponencial de los parámetros beta.
Para todos los análisis se consideró un resultado estadísticamente significativo para p<0,05. Los análisis se realizaron mediante el programa SAS for Windows Statistical Software, version 9.2 (SAS Institute, Inc., Carey, NC).
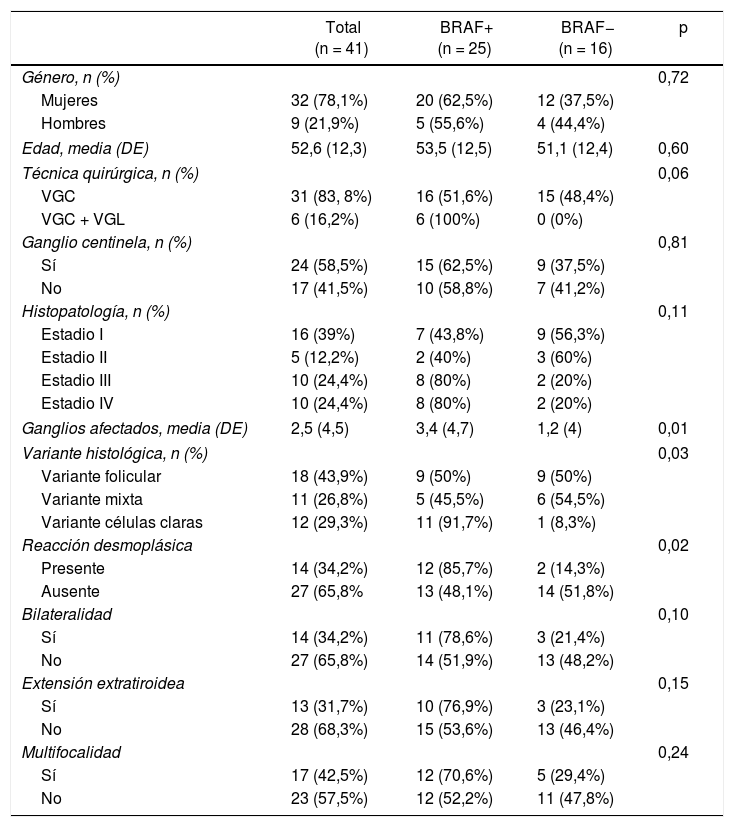
ResultadosCaracterísticas de los pacientes con cáncer papilar de tiroides según su estado mutacionalLos resultados epidemiológicos y anatomopatológicos, así como la técnica quirúrgica, se presentan en la tabla 1.
Características de los pacientes (n = 41)
| Total (n = 41) | BRAF+ (n = 25) | BRAF− (n = 16) | p | |
|---|---|---|---|---|
| Género, n (%) | 0,72 | |||
| Mujeres | 32 (78,1%) | 20 (62,5%) | 12 (37,5%) | |
| Hombres | 9 (21,9%) | 5 (55,6%) | 4 (44,4%) | |
| Edad, media (DE) | 52,6 (12,3) | 53,5 (12,5) | 51,1 (12,4) | 0,60 |
| Técnica quirúrgica, n (%) | 0,06 | |||
| VGC | 31 (83, 8%) | 16 (51,6%) | 15 (48,4%) | |
| VGC + VGL | 6 (16,2%) | 6 (100%) | 0 (0%) | |
| Ganglio centinela, n (%) | 0,81 | |||
| Sí | 24 (58,5%) | 15 (62,5%) | 9 (37,5%) | |
| No | 17 (41,5%) | 10 (58,8%) | 7 (41,2%) | |
| Histopatología, n (%) | 0,11 | |||
| Estadio I | 16 (39%) | 7 (43,8%) | 9 (56,3%) | |
| Estadio II | 5 (12,2%) | 2 (40%) | 3 (60%) | |
| Estadio III | 10 (24,4%) | 8 (80%) | 2 (20%) | |
| Estadio IV | 10 (24,4%) | 8 (80%) | 2 (20%) | |
| Ganglios afectados, media (DE) | 2,5 (4,5) | 3,4 (4,7) | 1,2 (4) | 0,01 |
| Variante histológica, n (%) | 0,03 | |||
| Variante folicular | 18 (43,9%) | 9 (50%) | 9 (50%) | |
| Variante mixta | 11 (26,8%) | 5 (45,5%) | 6 (54,5%) | |
| Variante células claras | 12 (29,3%) | 11 (91,7%) | 1 (8,3%) | |
| Reacción desmoplásica | 0,02 | |||
| Presente | 14 (34,2%) | 12 (85,7%) | 2 (14,3%) | |
| Ausente | 27 (65,8% | 13 (48,1%) | 14 (51,8%) | |
| Bilateralidad | 0,10 | |||
| Sí | 14 (34,2%) | 11 (78,6%) | 3 (21,4%) | |
| No | 27 (65,8%) | 14 (51,9%) | 13 (48,2%) | |
| Extensión extratiroidea | 0,15 | |||
| Sí | 13 (31,7%) | 10 (76,9%) | 3 (23,1%) | |
| No | 28 (68,3%) | 15 (53,6%) | 13 (46,4%) | |
| Multifocalidad | 0,24 | |||
| Sí | 17 (42,5%) | 12 (70,6%) | 5 (29,4%) | |
| No | 23 (57,5%) | 12 (52,2%) | 11 (47,8%) | |
De los 41 pacientes intervenidos de CPT a los que se les administró terapia ablativa con 131I entre septiembre de 2015 y enero de 2017, 25 (61%) resultaron positivos para la mutación.
La frecuencia de la mutación en las mujeres fue algo mayor que en los hombres: 62,5% vs 55,5%, p=0,72, sin resultar significativa. La media de edad de los pacientes fue de 52,6 (DE 12,3).
Hubo un total de 31 (75,6%) pacientes con vaciamiento central profiláctico bilateral. De estos, 16 (51,6%) eran BRAF+. En 6 casos (16,2%) se realizó vaciamiento ganglionar terapéutico por metástasis ganglionares, siendo el 100% BRAF+.
A un total de 15 pacientes (62,5%) que presentaban la mutación se les realizó la técnica del ganglio centinela. En cambio, a los otros 10 pacientes con la mutación (58,8%) no se les realizó la técnica. Esta diferencias no resultaron significativas estadísticamente (p=1,0)
El número de ganglios afectados fue significativamente superior en los BRAF+, con 3,4 (DE 4,7) vs 1,2 (DE 3,9) (p=0,01). La mutación era superior entre los de variante clásica, con un total de 11 casos (91,7%), en comparación con los de folicular, con 9 pacientes (50%), o mixta, con 5 (45,4%) (p=0,03). De los BRAF+, 12 pacientes (85,7%) presentaba reacción desmoplásica, mientras que 13 (48,1%) no presentaban esa característica (p=0,02). No hubo diferencias entre ambos grupos en cuanto a la extensión extratiroidea, la bilateralidad o la presencia de más de un foco de carcinoma.
En cuanto al estadio tumoral tras el análisis anatomopatológico de la pieza quirúrgica, el 80% de los pacientes que se encontraba en un estadio más avanzado (iii y iv) tenían el gen mutado. De los pacientes que se encontraban en estadios más precoces es decir, i y ii, más de la mitad (57,1%) no presentaban la mutación.
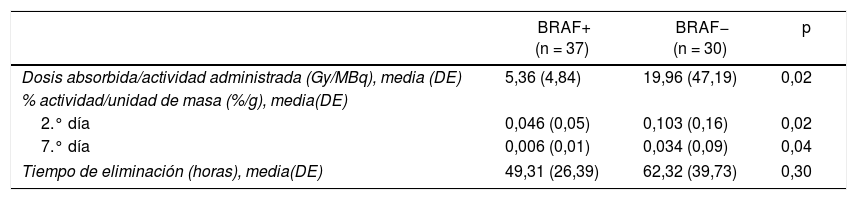
Cuantificación de la respuesta al 131i posquirúrgicaEn cuando al efecto de la mutación en el tratamiento del 131I, se estudió la biocinética del yodo en un total de 67 restos tiroideos, puesto que aun cuando la mayoría de los pacientes presentaban un único resto tiroideo, hubo casos de 2 y hasta 3 restos en un mismo paciente. Los pacientes BRAF+ presentaban menor dosis absorbida respecto a la actividad administrada (5,4 vs 20Gy/MBq; p=0,02); menor % de actividad respecto a la unidad de masa a los 2días (0,046 vs 0,103%/g; p=0,02) y a los 7días (0,006 vs 0,034%/g; p=0,04). Aunque no hubo diferencias significativas, sí se observa un tiempo de eliminación más rápido en los pacientes que presentan la mutación (49,3 vs 62,3h; p=0,30) (tabla 2.)
Cuantificación de la respuesta al 131I posquirúrgica (n = 67)
| BRAF+ (n = 37) | BRAF− (n = 30) | p | |
|---|---|---|---|
| Dosis absorbida/actividad administrada (Gy/MBq), media (DE) | 5,36 (4,84) | 19,96 (47,19) | 0,02 |
| % actividad/unidad de masa (%/g), media(DE) | |||
| 2.° día | 0,046 (0,05) | 0,103 (0,16) | 0,02 |
| 7.° día | 0,006 (0,01) | 0,034 (0,09) | 0,04 |
| Tiempo de eliminación (horas), media(DE) | 49,31 (26,39) | 62,32 (39,73) | 0,30 |
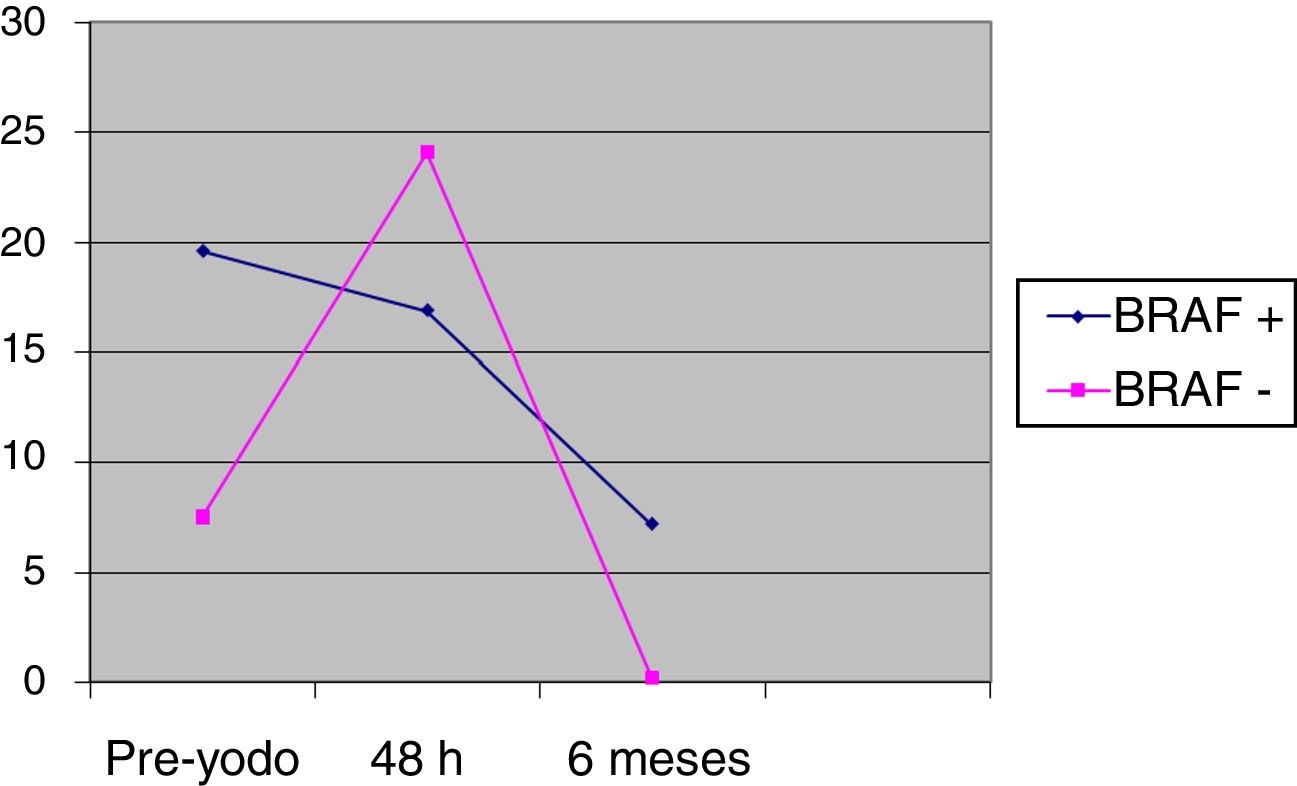
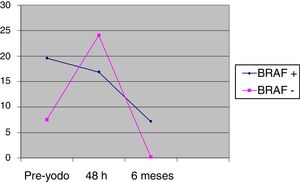
Las diferencias entre BRAF+ y BRAF− en los valores de tiroglobulina previos al yodo (pre-yodo) fueron 20,2 (DE 85,7) vs 7,6 (DE 17,9), y a las 48h, de 17,6 (DE 69,4) vs 24,1 (DE 65,6), sin ser significativos. El cambio del pre-yodo a las 48h con respecto al valor basal es significativo en el grupo BRAF− (p=0,0023), mientras que el cambio del pre-yodo a 48h no resulta estadísticamente significativo en el grupo BRAF+ (p=0,0560), según se muestra en la figura 2. A los 6meses de seguimiento no hubo diferencias significativas entre los dos grupos 7,2 (DE 28,2) vs 0,2 (DE 0,3); (p=0,74).
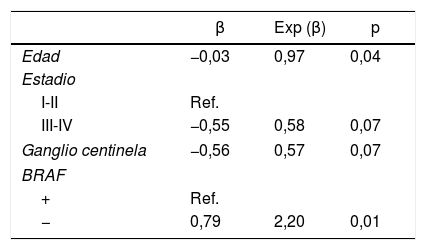
Modelo predictivo para pacientes con mayor riesgo de resistencia al 131IEn la tabla 3 se muestran los resultados de los análisis bivariantes de la asociación de las diferentes características sobre la dosis absorbida, mostrando únicamente aquellas características con p<0,15. Las variables que resultaron estar significativamente asociadas a la dosis absorbida fueron la edad y la mutación BRAF. En el caso de la edad, por cada aumento de un año la dosis absorbida fue 0,97 veces mayor (p=0,04). En cuanto a la mutación, la dosis absorbida en los BRAF− fue 2,20 veces la de los BRAF+ (p=0,01). En el análisis multivariante solo resultó significativa la variable mutación.
DiscusiónLa mutación BRAF V600E del CPT es la alteración genética más frecuente (entre el 23 y el 83%)1,2,20, lo que coincide con nuestros resultados. Si tenemos en cuenta los pacientes sometidos a vaciamiento ganglionar terapéutico, el 100% de los pacientes eran BRAF+, por lo que queda de manifiesto el carácter agresivo de la mutación, como se ha demostrado en numerosos estudios7,21,22. Así mismo, tanto el estadio más avanzado como el mayor número de ganglios afectados en los pacientes con la mutación presente refuerzan aún más el concepto de peor pronóstico cuando está presente la mutación, como se ha publicado recientemente5. Sin embargo, no se han encontrado diferencias entre otros factores de riesgo de recidiva, como la extensión extratiroidea o la multifocalidad y bilateralidad, probablemente debido al tamaño de la muestra, características histopatológicas que, por otro lado, sí se han relacionado con la mutación en otros estudios14. Entre los pacientes que presentaban la mutación, la variante histopatológica más frecuentemente asociada fue la clásica, datos similares a los publicados tras la identificación de la secuenciación genómica del CPT23. También fue más frecuente la presencia de reacción desmoplásica, tal y como se publica en algunos estudios22.
En cuanto a la cuantificación del 131I posquirúrgica, es el primer estudio que evalúa de forma cuantitativa la respuesta de la mutación al tratamiento con el radiofármaco mediante el cálculo de parámetros relacionados con la biocinética del yodo, con el método de dosimetría ya descrito en estudios anteriores24. Los valores de dosis absorbida del 131I han sido significativamente inferiores en los pacientes que presentan la mutación, lo cual está en relación con los estudios experimentales sobre la disminución de la captación del yodo en la célula por el bloqueo del simportador secundario al efecto del gen mutado9,13. Así mismo, el porcentaje de actividad del radioyodo a los 2 y a los 7días ha resultado inferior en pacientes BRAF+. Se ha observado un tiempo de semivida del 131I más corto en los pacientes con el gen mutado, aunque sin llegar a la significación estadística, por lo que no solo se ha demostrado una menor captación del 131I en los pacientes con la mutación sino que, además, el 131I que se ha captado se eliminó de un forma más rápida en estos pacientes. Ante la ausencia de un método que cuantifique y evalúe el efecto del tratamiento con 131I posquirúrgico que sea compatible con las recomendaciones establecidas en las guías de tratamiento inicial de los CPT8, consideramos que la dosimetría puede ser una alternativa a tener en cuenta.
Con respecto a los valores de Tg sérica, se objetiva un aumento a las 48h tras la administración de 131I en los pacientes que no presentan la mutación; sin embargo, este pico de concentración no se observa en los pacientes con el gen mutado. Este aumento después de la ablación con 131I se ha identificado en la literatura25, en relación con un aumento de la destrucción del remanente tiroideo y la consecuente liberación de dicha proteína. En este sentido, la identificación de una menor concentración de Tg sérica en pacientes con el gen mutado tras el tratamiento con el radiofármaco se interpreta como una menor destrucción celular y, por lo tanto, apoya la teoría del aumento de la resistencia al 131I. Sin embargo, en los resultados a los 6meses de seguimiento no se objetiva esta diferencia, por lo que es necesario evaluar resultados a más largo plazo y con un número mayor de pacientes para definir las consecuencias clínicas.
Se ha observado que la única variable que resultó significativa en el análisis multivariante es la mutación del gen BRAF, siendo, por tanto, un buen marcador pronóstico a considerar para decidir el tratamiento más adecuado. Sin embargo, no se pudo establecer un modelo predictivo que determinase el perfil de los pacientes que van a presentar más resistencia a la terapia con 131I, probablemente por el tamaño de la muestra. En cambio, sí se han identificado las características de los pacientes que definen un grupo de mayor riesgo de resistencia al 131I: la edad y la mutación BRAF. En el caso de la edad, a medida que los pacientes son más mayores aumenta la absorción al 131I. Este hecho, además de ser novedoso, puede resultar de interés para futuros estudios que midan el beneficio real del radiofármaco en el grupo de más edad, puesto que recientemente se ha descrito un aumento de la mortalidad en pacientes mayores y BRAF+26.
Somos conscientes de las limitaciones que tiene este trabajo. Una de ellas, comentada anteriormente, es el tamaño muestral. Por otro lado, el estudio realizado se fundamenta en los restos tiroideos, pudiendo ser remanentes tanto de tejido tumoral como tejido tiroideo normal, y por consiguiente no se encuentra representado el carácter directo del proceso tumoral. Los resultados obtenidos hacen pensar que la totalidad de la glándula, por diferentes vías de señalización que aún desconocemos, puede estar influenciada por el proceso de carcinogénesis del tumor. No obstante, hacen falta más estudios y a más largo plazo y con un mayor tamaño muestral que confirmen estos resultados.
En conclusión, 1)la mutación del gen BRAF V600E se relaciona con factores de mal pronóstico, como un estadio más avanzado o mayor afectación ganglionar; 2)los pacientes BRAF+ presentan menor eficacia en el tratamiento con 131I desde el inicio de la enfermedad, y 3)la absorción de 131I es mayor en los pacientes de edad más avanzada.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Parte de los resultados de este estudio fueron presentados en el 29th Annual Congress of the European Association of Nuclear Medicine (EANM) 2016, Barcelona, 15-19 de octubre de 2016; en la VI Reunión Ibérica de la Sección de Cirugía Endocrina celebrada en Sevilla, 27-28 de abril de 2017, y en la XXI Reunión Nacional del Cirugía celebrada en Málaga, 18-20 de octubre de 2017.