La iatrogenia por extravasación de agentes quimioterápicos a través de reservorios subcutáneos es poco frecuente1. No obstante, representa una entidad con gran morbilidad y potencial mortalidad, que puede provocar un retraso en el tratamiento oncológico en aquellos que la padecen. La extravasación se considera un accidente oncológico cuya incidencia se ha descrito entre un 0,1 y un 6%2,3. Actualmente, una vez se produce el evento adverso, no existe un tratamiento eficaz capaz de interrumpir la progresión del fármaco y la consecuente necrosis que produce sobre los tejidos.
Presentamos una mujer de 56 años, con antecedentes personales de cistoadenocarcinoma de ovario izquierdo y adenocarcinoma de endometrio, que tras varias líneas de tratamiento quimioterápico experimentó progresión tumoral. Se instauró una nueva línea de tratamiento con doxorrubicina y trabedectina. Finalizada su administración a través de un reservorio subcutáneo en la región torácica derecha, se objetivaron reflujo de líquido claro a través de este y un aumento brusco del volumen de la mama ipsolateral.
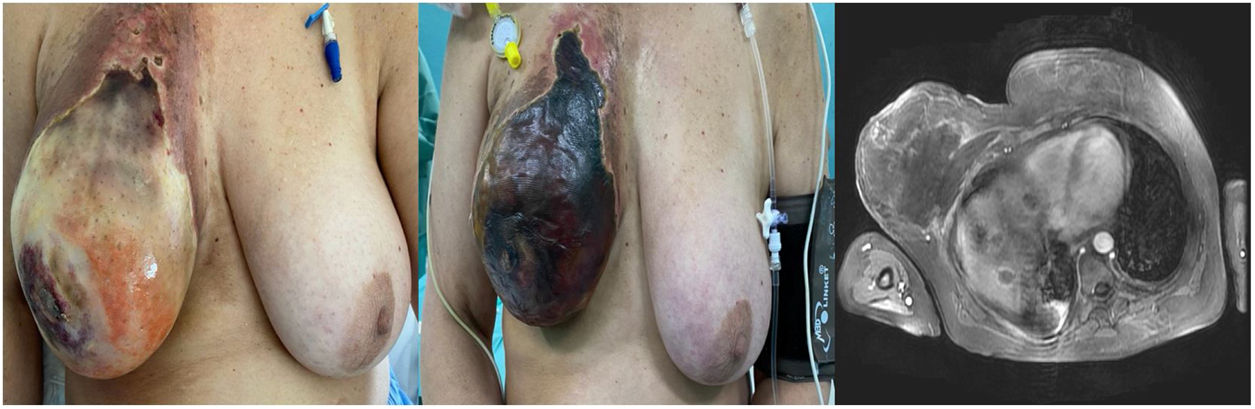
Transcurridas unas horas, presentaba la mama derecha moderadamente eritematosa, con aumento del tamaño de la misma.
Ante la sospecha de extravasación subcutánea, se llevaron a cabo medidas locales, tales como la aplicación de fomentos y frío seco. El eritema evolucionó en intensidad, progresando a abundantes flictenas, que afectaban a toda la superficie de la mama. Ante este evento, se interrumpió de forma indefinida el tratamiento quimioterápico.
En la resonancia magnética se objetivaron algunas zonas que impresionaban de pequeñas colecciones, que afectaban a la glándula mamaria derecha, musculatura pectoral e intercostal ipsolateral, con unos diámetros de 12,5×7,2×18,5cm. Los hallazgos eran compatibles con una extensa área necrótica. (fig. 1).
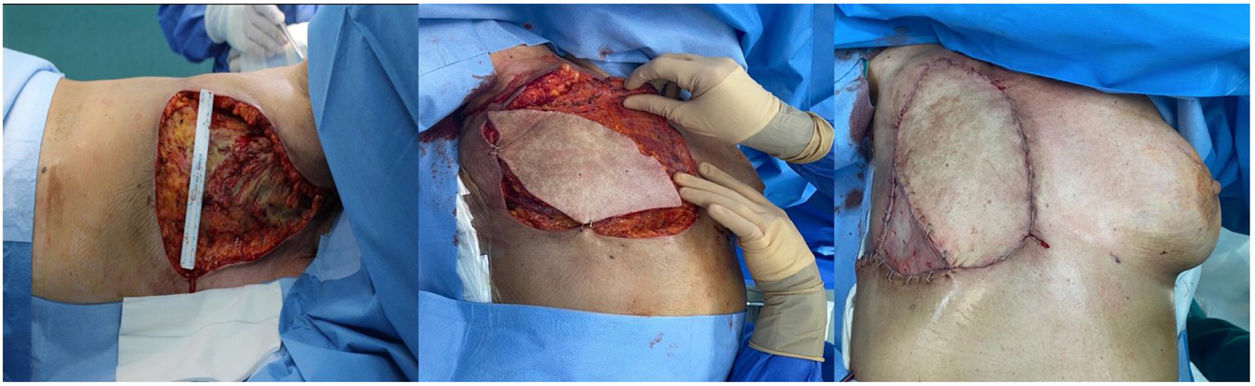
Tras delimitarse la necrosis y confirmarse la imposibilidad de regeneración espontánea del lecho pasado un mes del evento adverso, se decidió realizar el desbridamiento del tejido desvitalizado mediante una mastectomía radical ampliada, incluyendo toda la musculatura pectoral mayor y parcialmente pectoral menor e intercostales, resultando un defecto de 22×16cm. Se reconstruyó de manera inmediata con un colgajo miocutáneo pediculado de latissimus dorsi, basado en la arteria toracodorsal y tunelizado a través de la región axilar hasta alcanzar la pared torácica anterior. Además, se utilizó un injerto libre de piel parcial en el cuadrante infero-externo de la pérdida de sustancia, utilizando el muslo como zona donante (fig. 2).
En el postoperatorio inmediato, se objetivó la dehiscencia de uno de los extremos del colgajo, además de la zona donante, en probable relación con la mala calidad de los tejidos adyacentes y la acentuada fragilidad de la paciente. Esta complicación fue resuelta durante el ingreso hospitalario con curas dirigidas, mediante lavados con clorhexidina al 0,5%, gasas vaselinadas y pomadas antisépticas (nitrofural), sin necesidad de revisión quirúrgica. A los 3meses de la extravasación, y tras la resolución de este cuadro, la paciente falleció por progresión oncológica, motivada por la obligada suspensión del tratamiento quimioterápico.
En la actualidad, no existe un consenso ni en cuanto al manejo inicial, ni a nivel reconstructivo, de las extravasaciones iatrogénicas, suponiendo todo un reto médico quirúrgico4,5.
Una vez se produce el evento adverso, de inicio, se aconseja tratamiento conservador con medidas locales como la aplicación de fomentos, o dimetilsulfóxido tópico4, capaz de evitar hasta en un 91,8% de las ocasiones la aparición de necrosis tisular6. En casos de extravasación de grandes volúmenes, el dexrazoxano IV se postula como el tratamiento más específico7. También se ha descrito la utilización de factor estimulante de colonias de granulocitos-macrófagos intralesional8, así como de hialuronidasa9.
Sin embargo, el pilar fundamental del tratamiento, una vez establecida la necrosis de los tejidos, se fundamentará en un desbridamiento radical del tejido desvitalizado con posterior reconstrucción del defecto resultante, en coordinación de un equipo multidisciplinar. Existe un amplio arsenal terapéutico de menor a mayor complejidad, incluyendo los injertos cutáneos, colgajos locales, regionales o libres, utilizando técnicas microquirúrgicas. El colgajo miocutáneo de dorsal ancho es considerado el gold standard para cobertura de la región torácica anterior. En este caso, consideramos esta técnica superior a un colgajo libre, ya que los potenciales vasos receptores cercanos a la pérdida de sustancia podrían estar afectados y no ser válidos para la reconstrucción.
En nuestra experiencia, el colgajo pediculado de músculo dorsal ancho, descrito por Tansini en 190610, se considera una opción reconstructiva de extrema utilidad para los defectos de la pared torácica anterior. Aporta gran cantidad de tejido, debido a su versatilidad tanto en su composición (variante muscular, miocutánea u osteomiocutánea) como en su orientación. Este colgajo es considerado el caballo de batalla en la cirugía reparadora, ya que puede utilizarse en la reconstrucción de cualquier área del cuerpo, mediante técnicas microquirúrgicas10. Su vascularización depende de un pedículo dominante (arteria y vena toracodorsal) y una irrigación sanguínea secundaria procedente de perforantes intercostales posteriores10. Las ventajas de esta técnica reparadora frente a otras, son su pedículo fiable y que aporta gran cantidad de tejido bien vascularizado. En este caso, permite aportar una cobertura estable, de buena calidad, reduciendo los riesgos de infección local y sistémica en una paciente inmunocomprometida.
FinanciaciónEste artículo no ha sido financiado por ninguna entidad.