Los estadios precoces (T1) del cáncer de la unión esofagogástrica continúan representando únicamente el 2-3% de todos ellos. El más frecuente es el adenocarcinoma y el principal factor de riesgo para su desarrollo son el reflujo esofagogástrico y el esófago de Barrett con displasia.
Los pacientes con afectación de mucosa (T1a) o de submucosa (T1b) precisan inicialmente de una endoscopia digestiva minuciosa, pudiendo mejorar la visualización con la cromoendoscopia. El tratamiento endoscópico de estas lesiones incluye la mucosectomía, la ablación con radiofrecuencia y la disección endoscópica de la submucosa.
El tratamiento óptimo precisa una correcta estadificación y la técnica más adecuada para ello es la ultrasonografía endoscópica.
Por otra parte, la sospecha de invasión profunda de la submucosa, la presencia de características anatomopatológicas poco favorables o la imposibilidad de resección endoscópica, obligan a optar por la resección quirúrgica para alcanzar un tratamiento curativo.
Early-stage (T1) esophagogastric junction cancer continues to represent 2-3% of all cases. Adenocarcinoma is the most frequent and important type, the main risk factors for which are gastroesophageal reflux and Barrett's esophagus with dysplasia.
Patients with mucosal (T1a) or submucosal (T1b) involvement initially require a thorough digestive endoscopy, and narrow-band imaging can improve visualization. Endoscopic treatment of these lesions includes endoscopic mucosal resection, radiofrequency ablation and endoscopic submucosal dissection.
Accurate staging is necessary in order to provide optimal treatment. The most precise staging technique in these cases is endoscopic ultrasound.
The suspicion of deep invasion of the submucosa, presence of unfavorable anatomopathological characteristics or impossibility to perform endoscopic resection make it necessary to consider surgical resection.
El cáncer de la unión esofagogástrica (UEG) se define como aquella neoplasia maligna localizada entre 2cm por encima y 2cm por debajo de la UEG y constituyen un grupo de tumores cuya incidencia, en particular el asociado al esófago de Barrett (EB), ha aumentado de forma notable en nuestro medio1,2. La mejora en los programas de cribado y la mayor información de la población, son los responsables de un aumento en la incidencia de estadios precoces, aunque estos casos únicamente representan, en nuestro medio, el 2-3% de estos tumores3,4.
En este artículo realizamos una actualización del diagnóstico y tratamiento del cáncer precoz de la UEG, con el objetivo de clarificar los criterios de actuación en estos pacientes.
Aspectos histológicosDesde un punto de vista anatomopatológico, podemos diferenciar varios tipos histológicos: el adenocarcinoma sobre EB, el adenocarcinoma no asociado a EB y otros tipos de neoplasias como el carcinoma escamoso o los tumores neuroendocrinos. En este artículo, nos referiremos básicamente al adenocarcinoma.
El EB se define como una metaplasia intestinal que reemplaza el epitelio escamoso del esófago distal1,2. Según la clasificación japonesa de cáncer de esófago, el adenocarcinoma que se desarrolla sobre el EB presenta las siguientes características diferenciales: presencia de glándulas esofágicas, existencia de islotes de epitelio escamoso dentro de las lesiones y duplicación de la muscularis mucosae debajo de las lesiones5,6. Sin embargo, el hecho de que estos criterios no estén siempre presentes puede hacer difícil la diferenciación entre el adenocarcinoma sobre EB y el no asociado al EB. En consecuencia, ambos tipos se incluyen conjuntamente en la mayoría de los estudios sobre el adenocarcinoma de la UEG7.
EpidemiologíaEl principal factor de riesgo para el desarrollo de adenocarcinoma de la UEG lo constituyen el reflujo gastroesofágico y la presencia de EB asociado a displasia8. Otros factores relacionados son: índice de masa corporal aumentado, dietas ricas en grasas, el sexo masculino y el consumo de tabaco9..La progresión de adenocarcinoma en pacientes con bajo grado de displasia es del 0,12% anual, que se incrementa a un 6% anual en aquellos con displasia de alto grado10. Por dicho motivo, esta progresión entre metaplasia intestinal-displasia-adenocarcinoma obliga al diseño y aplicación de rigurosos programas de cribado, con seguimiento endoscópico periódico para conseguir un diagnóstico precoz y por ende, la aplicación de técnicas endoscópicas que permiten mejorar así la supervivencia.
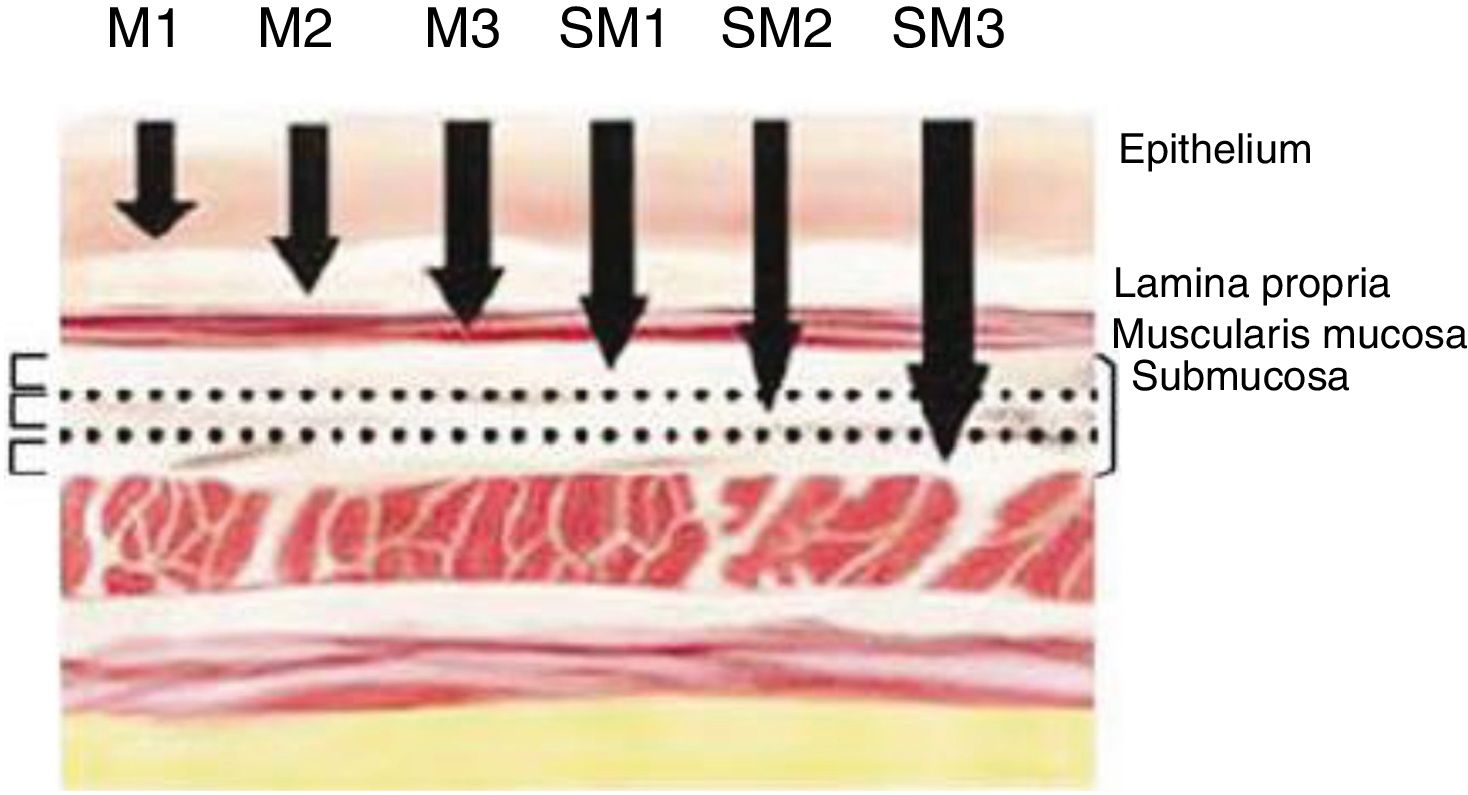
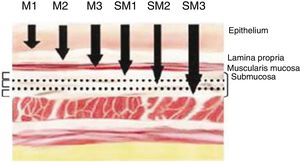
Definición de cáncer precoz. Clasificación TNMSe definen como «cáncer precoz» (early cancer) aquellos tumores que infiltran la mucosa o la submucosa con independencia de la afectación ganglionar. Estas lesiones se engloban en la categoría T1 de la clasificación TNM Edición 8.ª11. La infiltración de la capa mucosa corresponde al tipo T1a y la submucosa al T1b. Asimismo, los tumores que afectan la mucosa se pueden subdividir en m1, m2 y m3. Los m1 son tumores intraepiteliales (carcinomas in situ), los m2 infiltran la lámina propia de la mucosa y los m3 infiltran la capa muscular de la mucosa. Por otro lado, los tumores que afectan a la submucosa (T1b) se clasifican en sm1 (invasión del tercio superior de la submucosa, <500μ de invasión), sm2 (invasión del tercio medio de la submucosa) y sm3 (invasión del tercio inferior de la submucosa) (fig. 1).
DiagnósticoLos pacientes con neoplasia precoz de la UEG no presentan una clínica específica. Por ello, el impacto del diagnóstico precoz en los pacientes afectos de EB es fundamental para poder diagnosticarlos en fase temprana, mejorar así la supervivencia y optimizar los recursos económicos sanitarios.
Los cánceres esofágicos precoces se presentan como placas superficiales eritematosas, nódulos o ulceraciones y una endoscopia digestiva minuciosa con luz blanca será la prueba inicial para su diagnóstico.
Por su parte, el EB presenta un aspecto característico como mucosa asalmonada que puede afectar de forma circunferencial o con proyecciones digitales, y que contrasta con el aspecto más blanquecino de la mucosa esofágica normal.
Exploración endoscópica detalladaSe debe realizar una inspección endoscópica sistemática que incluya una búsqueda activa de elevaciones, ulceraciones y nódulos o pequeñas irregularidades de la mucosa tanto durante la insuflación como durante las maniobras de aspiración.
En los pacientes con EB, este se debe medir siguiendo la clasificación de Praga, que evalúa la extensión circunferencial y longitudinal del segmento visualizado12. Se debe prestar especial atención al área situada entre las 12 y las 6 (en sentido horario), donde se encuentran la mayoría de las lesiones neoplásicas.
En pacientes con EB con displasia de alto grado (DAG) se recomienda seguir el protocolo de biopsia de Seattle13, obteniéndose biopsias dirigidas de todas las anomalías visibles, y de forma aleatoria en los cuatro cuadrantes cada 1cm desde la parte superior de los pliegues gástricos hasta la extensión más proximal del EB (unión escamocolumnar). Así, el 80-90% de los diagnósticos se realizarán mediante las biopsias dirigidas14 y se requerirán las biopsias aleatorias para el diagnóstico de hasta un 20% de las lesiones no visibles.
Cromoendoscopia (NBI)La cromoendoscopia con imagen de banda estrecha o narrow band imaging (NBI) es una técnica endoscópica de alta resolución que mejora la visualización de la superficie de la mucosa sin el uso de colorantes. Se basa en la profundidad de la penetración de la luz según su longitud de onda, permitiendo una mejor visualización de los patrones de la mucosa y de la vascularización superficial.
Así, la cromoendoscopia electrónica con NBI nos permite detectar lesiones compatibles con displasia o neoplasia precoces mediante el análisis del patrón glandular y vascular15.
Buskens et al.16 en un metaanálisis que incluyó 446 pacientes y 2194 lesiones mostraron que la sensibilidad y especificidad combinadas de NBI para detectar la mucosa de EB fueron del 95% y 65% respectivamente. Asimismo, la sensibilidad y especificidad para la detección de displasia de alto grado fueron 96% y 94%. Estos hallazgos sugieren que el NBI es útil para la detección de mucosa con EB y DAG15 y se ha convertido en una herramienta para dirigir las biopsias a áreas con morfología superficial sospechosa. Además el NBI presenta la ventaja de poderse alternar con la visualización estándar con luz blanca, sin precisar la utilización de los colorantes de la cromoendoscopia convencional.
Más recientemente se ha reportado otra técnica de cromoendoscopia electrónica: Blue Light Imaging que nos permite mejorar la detección de adenocarcinoma precoz sobre EB17. Asimismo, la cromoendoscopia mediante la utilización de colorantes como índigo carmín o ácido acético también puede ser útil en ocasiones para detectar dichas lesiones.
Estadificación y selección de los pacientesLa posibilidad de afectación ganglionar es uno de los factores determinantes para seleccionar el tratamiento óptimo en este tipo de tumores, por lo que es preciso llevar a cabo una adecuada estadificación de las lesiones.
El riesgo de afectación linfática se incrementa con la invasión en profundidad16 y varía según el tipo histológico, siendo en los tumores bien diferenciados sm1 inferior al 3% y aumentado hasta más de un 20% cuando la lesión se clasifica como sm218 (fig. 2). Esta invasión en profundidad y su posible afectación ganglionar determinará la necesidad de un abordaje endoscópico o quirúrgico para conseguir un tratamiento oncológico radical.
La USE es la técnica más precisa para la estadificación locorregional del cáncer de esófago y nos permite diferenciar con gran precisión los T1 (afectación mucosa/submucosa) vs T2 (invasión de la capa muscular).
La USE tiene un valor predictivo negativo superior al 95% para la ausencia de infiltración del tumor en las capas de la pared más profunda y los ganglios linfáticos locales.
La resección endoscópica de la mucosa (REM) juega un papel primordial no solo como tratamiento de las lesiones precoces sino como procedimiento de estadificación12,19–21 puesto que la evaluación histopatológica de la muestra resecada permite evaluar la profundidad de infiltración.
Este enfoque es coherente con las directrices de la Sociedad Americana de Endoscopia Digestiva (ASGE 2013) que recomiendan la REM para el tratamiento y la estadificación del EB nodular y la sospecha de adenocarcinoma precoz de la UEG22. Si el aspecto endoscópico de la lesión no genera sospechas de infiltración submucosa profunda, la lesión puede extirparse por REM.
Aunque la TAC y la PET-TC son pruebas diagnósticas necesarias para completar la estadificación del cáncer de la UEG, en pacientes con DAG o cáncer precoz sin signos de infiltración submucosa profunda ni ganglios linfáticos sospechosos en la USE23 son de menor trascendencia dado el bajo riesgo de metástasis a distancia.
Tratamiento endoscópicoEl tratamiento endoscópico de las lesiones premalignas y tumores precoces de UEG está cada vez más extendido e incluye la mucosectomía (o REM), la ablación con radiofrecuencia (ARF) y la disección endoscópica de la submucosa (DES) (preferentemente en países asiáticos y no tan extendida en nuestro medio).
Serán candidatos a estas técnicas aquellos pacientes que cumplan los siguientes criterios:
- -
Afectación limitada a la mucosa o a la submucosa superficial (sm1).
- -
Sin afectación vascular o linfática.
- -
Sin afectación ganglionar.
- -
Si existe EB subyacente, es preciso su erradicación completa.
Estos criterios24 permiten seleccionar los pacientes con menor riesgo de diseminación ganglionar, con una incidencia de afectación ganglionar del 1,3%. Los pacientes con afectación de capas más profundas son candidatos a tratamiento quirúrgico.
Por el contrario, y a diferencia de otras localizaciones del tubo digestivo, el grado de diferenciación tumoral no se ha identificado como un factor de riesgo independiente para la metástasis en los ganglios linfáticos o la recidiva tumoral16. Este hallazgo puede estar relacionado con el hecho de que la mayoría de los tumores no diferenciados ya han invadido la submucosa en el momento del diagnóstico. Sin embargo, los datos que evalúan la relevancia de la diferenciación histopatológica son escasos, especialmente dado el pequeño número de lesiones tempranas no diferenciadas en los estudios disponibles.
Resección endoscópica de la mucosa o mucosectomíaEs la técnica más empleada en nuestro medio en el tratamiento del cáncer precoz de la UEG que cumpla los criterios antes mencionados.
Consiste en la creación de un seudopólipo que engloba la lesión con su posterior resección. Hay 2 tipos:
- REM inyección-cortar (REMc): consiste en la elevación de la lesión mediante inyección de un colorante (generalmente índigo carmín) en la submucosa, y posterior tracción y resección con asa de diatermia que está incorporada sobre un capuchón25.
- REM con bandas (REMb): consiste en la aspiración de la lesión en el interior de un capuchón endoscópico y la colocación de una banda elástica posteriormente resecada con asa de diatermia. Esta técnica, a diferencia de la anterior, no requiere la inyección de sustancias, siendo más rápida y económica.
Ambas técnicas son eficaces y seguras con una baja tasa de complicaciones. Aunque la REMc permite obtener especímenes de mayor tamaño, no existen diferencias en la profundidad de las piezas obtenidas con ambas técnicas19. Uno de los estudios más relevantes que evaluó la eficacia de la REM en pacientes con adenocarcinoma de esófago precoz incluyó 1000 pacientes a los que se realizó un seguimiento medio de 56,6 meses26. La remisión completa se logró en el 96% de los pacientes. Las lesiones recurrentes o metacrónicas se desarrollaron en 140 pacientes (15%) de las cuales se trataron con éxito endoscópicamente en 115 (82%). Globalmente la tasa de remisión completa a largo plazo se sitúa alrededor del 94%26.
Disección endoscópica de la submucosaPermite abordar lesiones de tamaño superior a 2cm, y lesiones ulceradas, con mayores tasas de resección en bloque que la REM. Sin embargo, la DES es más compleja y precisa de mayor experiencia27. Su curva de aprendizaje es más larga así como el tiempo de realización de la técnica, con mayor incidencia de perforaciones (4,5 vs. 1%)28.
Se desarrolló inicialmente para el tratamiento del cáncer gástrico precoz, extendiéndose posteriormente a otras localizaciones del tracto digestivo27,29–31.
Consiste en el marcaje por electrocoagulación de los límites de la lesión y la inyección submucosa de una solución salina que contiene epinefrina y azul de metileno o índigo carmín. Se realiza una incisión circunferencial a nivel de la mucosa y se diseca la capa submucosa hasta la exéresis completa de la lesión.
La localización a nivel de UEG constituye un mayor desafío técnico, aun en grupos expertos. Tiene una mayor tasa de complicaciones, así como una mayor duración del procedimiento y menor proporción de resecciones exitosas en comparación con otras localizaciones del tracto gastrointestinal.
La DES es una técnica segura en el tratamiento del cáncer precoz de UEG. La mayoría de los resultados proceden de la literatura japonesa, donde se han documentado tasas de resección completa del 87%, resección curativa del 75%32 y una supervivencia a los 5 años comparable a la obtenida con la cirugía (93,9 vs. 97,3%), con reducción de las complicaciones33.
Las principales complicaciones descritas tras la realización de DES consisten en hemorragia (3,4%), perforación (2,5%) y estenosis (6,9%)32 pudiéndose controlar endoscópicamente la mayoría de ellas.
Sin embargo, las directrices de la Sociedad Europea de Endoscopia Gastrointestinal recomiendan la REM en comparación con la DES en la mayoría de los casos de cáncer precoz de UEG sobre EB24. Ello es debido a que la REM ha mostrado una incidencia de remisión completa de la neoplasia comparable a la DES con menor riesgo de complicaciones27.
La evaluación histopatológica del tejido resecado permitirá definir el tamaño del tumor, el estado de los márgenes laterales y profundo, la presencia de ulceración, el grado de diferenciación y la invasión vascular y linfática. En aquellos especímenes con márgenes en profundidad positivos, afectación profunda de la submucosa o invasión linfovascular, será aconsejable la realización de cirugía para conseguir un tratamiento curativo.
Por otra parte, debemos tener en consideración aquellas lesiones catalogadas en el grupo III de la clasificación de Siewert, y cuyo origen se encuentra entre 2 y 5cm por debajo de cardias. Estos tumores se tratan como gástricos y, según las guías de la NCCN34 se recomienda la realización del tratamiento endoscópico (REM o DES) en el cáncer gástrico temprano para aquellas lesiones inferiores o iguales a 2cm de diámetro, cuando histológicamente sean tumores bien o moderadamente diferenciados, sin penetrar más allá de la submucosa (SM2), sin invasión linfovascular, y con obtención de márgenes de resección tanto laterales como profundos negativos. Si bien en estos casos el tratamiento endoscópico es de elección, las guías no especifican en qué circunstancias deben ser indicada las diferentes técnicas.
Técnicas endoscópicas ablativas: ablación con radiofrecuenciaLas técnicas endoscópicas ablativas destruyen el tejido mediante daño térmico bien sea en forma de calor (ARF) o frío (crioterapia). Nos referiremos a la ARF por ser la más eficaz y utilizada en nuestro medio.
Es una modalidad de tratamiento endoscópico que destruye la mucosa esofágica mediante el daño térmico generado con la radiofrecuencia. Permite la erradicación de EB, la displasia de bajo grado y el cáncer precoz de UEG sobre EB35. En caso de displasia o cáncer precoz sobre EB es preciso la erradicación del EB para evitar el desarrollo de neoplasia metacrónica que puede aparecer en el 15% de los casos con erradicación incompleta del EB. La ARF permite el tratamiento de todo el segmento de EB en una sesión, consiguiendo el tratamiento de áreas más extensas, por lo que el tratamiento combinado REM+ARF ofrece una menor tasa de recurrencia que la REM aislada y menos tasas de complicaciones36.
Existen 2 métodos de ARF esofágica:
- La ARF circunferencial35: utiliza un balón con electrodos bipolares en su superficie cuya activación provoca la liberación de energía (12J/cm2) y la quemadura del Barrett diana. Su indicación principal es el tratamiento de EB circunferencial de diámetro mayor o igual a 3cm. Posteriormente, tras retirar el esfacelo mucoso, se repite una segunda sesión sobre el EB tratado.
A los 2 meses se revisa la regeneración del epitelio esofágico que debe ser escamoso y si hay persistencia de EB se realiza una nueva sesión de ARF, habitualmente focal. El número medio de sesiones requeridas para conseguir la ablación completa suele ser de 2 o 337.
- La ARF focal: utiliza un electrodo bipolar montado en el extremo distal del endoscopio en una plataforma articulada (fig. 2). Se apoya el dispositivo sobre el tejido diana y se libera la energía38. Se utiliza en el tratamiento circular de la línea Z y en los casos de EB con pequeños islotes o lengüetas, con una extensión circunferencial de menos de 2cm o en el EB residual tras una ablación circunferencial.
La ARF debe realizarse tras la realización de REM cuando el EB se asocia a lesiones nodulares que contienen DAG y/o carcinoma intramucoso39. En EB con DAG plana, se realiza directamente la ARF ya que la erradicación del EB displásico previene el desarrollo de cáncer. Es importante realizar la ARF sobre una mucosa plana sin nódulos pues esto asegura que la ARF llegue a la muscularis mucosae.
Los estudios sugieren que esta técnica de ablación es altamente efectiva para eliminar la mucosa de Barrett y la displasia asociada al tiempo que minimiza los inconvenientes de la terapia fotodinámica y la coagulación con plasma de argón (estenosis esofágica, focos subescamosos de EB). Phoa et al.40, en un metaanálisis que incluyó 3802 pacientes, constataron una tasa de erradicación completa de la displasia del 91% al año. La tasa de erradicación del EB se sitúa en el 85-90% a los 4-5 años. La tasa de recurrencia oscila entre el 13% y el 33% y es más frecuente en la línea Z y en el esófago distal41 por lo que se requieren controles periódicos.
En cuanto a los posibles efectos adversos, las estenosis se desarrollan en el 5% de los pacientes, seguidas del dolor torácico en el 3% y la hemorragia en el 1%42.
Se debe tener en cuenta que tras el tratamiento endoscópico (REM, DES o ARF) los pacientes deben recibir tratamiento con inhibidores de bomba de protones a dosis plenas para promover la curación mucosa. El tratamiento debe prolongarse entre 4 y 6 semanas dependiendo del tamaño de la lesión mucosa dado que es el período de regeneración de la mucosa43.
Asimismo, dado el riesgo de recurrencia, los pacientes tratados endoscópicamente requieren un seguimiento endoscópico regular. En la mayoría de los estudios, los pacientes son evaluados endoscópicamente cada tres meses durante el primer año y posteriormente se siguen controles anuales44.
Tratamiento quirúrgico. ¿Cuándo y cómo?Como hemos comentado anteriormente, la invasión tumoral en profundidad de la pared esofágica incrementa el riesgo de la afectación ganglionar. El riesgo de afectación linfática es bajo cuando existe afectación tumoral limitada a la mucosa, pero este riesgo se incrementa cuando existe infiltración de la submucosa, alcanzando el 20% en aquellos tumores sm245 Por este motivo, ante la sospecha de invasión neoplásica submucosa o la presencia de factores anatomopatológicos de mal pronóstico, las guías terapéuticas34 indican la cirugía radical oncológica como tratamiento curativo. En este punto será crucial la correcta localización de la lesión ya que ello puede determinar el procedimiento quirúrgico a seguir. Es decir, aquellos tumores incluidos en la categoría Siewert III, puesto que se consideran neoplasias subcardiales que infiltran la unión esofagogástrica, queda establecida la realización de una gastrectomía, a diferencia de los tumores Siewert I y II, en los que plantearemos una esofaguectomía.
De manera que, tras una resección endoscópica inicial, debe ser considerada la cirugía ante la presencia de los siguientes hallazgos:
- •
Infiltración vascular o linfática.
- •
Tumor pobremente diferenciado (Grado ≥ 3).
- •
Infiltración de la submucosa ≥ 500μm.
- •
Presencia de tumor residual en el margen de resección (R1).
- •
Imposibilidad técnica de resección endoscópica (tabla 1, algoritmo de tratamiento).
Otra indicación de tratamiento quirúrgico posterior a la REM /DES es el manejo de las complicaciones tras esta técnica. Como hemos referido en el apartado anterior, las tasas de complicaciones tras una resección local endoscópica son bajas, situándose entre el 3,5% y el 5,2% en las series con mayor número de casos46. De manera que el manejo quirúrgico se reserva para aquellos casos que no han podido ser tratados mediante técnicas endoscópicas o en caso de perforación de gran tamaño, con peritonitis difusa o inestabilidad hemodinámica.
ConclusiónLa endoscopia digestiva representa uno de los pilares en el manejo diagnóstico y terapéutico del cáncer precoz de UEG, permitiendo las nuevas técnicas de imagen un mejor diagnóstico, que puede ser difícil con la endoscopia convencional. La combinación de técnicas de resección y ablación endoscópicas han conseguido una alta tasa de curación, con un buen perfil de seguridad.
Por otra parte, la sospecha de invasión profunda de la submucosa, la presencia de características anatomopatológicas poco favorables o la imposibilidad de resección endoscópica, obligan a optar por la resección quirúrgica para alcanzar un tratamiento curativo.
Finalmente, un abordaje multidisciplinar, con participación de oncólogos, endoscopistas, cirujanos, radiólogos y anatomopatólogos es decisivo para llevar a cabo la mejor estrategia terapéutica en cada paciente y debe incluir aspectos como la comorbilidad y la implicación del paciente en la toma de decisiones, especialmente en aquellos casos borderline.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.