La gastrectomía vertical (GV) es la cirugía bariátrica más común realizada en el mundo, y asimismo ha demostrado en el transcurso de estos años tener como consecuencia la aparición o el empeoramiento de síntomas de reflujo gastroesofágico (RGE). Es imprescindible que en los centros de alto volumen de cirugía de foregut o intestino anterior se realicen estudios de motilidad y de fisiología esofágicos. En el paciente post-GV, los factores condicionantes para desarrollar RGE son la desaparición del ángulo de His, del pliegue gástrico antirreflujo y del fondo gástrico, el aumento de la presión intragástrica, la resección forzada del antro, la sección de las fibras sling y el espasmo pilórico. A continuación se describen nuestras recomendaciones, la técnica quirúrgica y el flujograma de selección del paciente ideal para GV y evitar la aparición o el empeoramiento del RGE.
Sleeve gastrectomy (SG) is the most common bariatric surgery worldwide and has shown to cause de novo or worsen symptoms of gastroesophageal reflux disease (GERD). Esophageal motility and physiology studies are mandatory in bariatric and foregut centers. The predisposing factors in post-SG patients are disruption of His angle, resection of gastric fold and gastric fundus, increased gastric pressure, resection of the gastric antrum, cutting of the sling fibers and pyloric spasm. There are symptomatic complications due to sleeve morphology as torsion, incisura angularis stenosis, kinking and dilated fundus. In this article, we present recommendations, surgical technique and patient selection flow diagram for SG and avoid de novo or worsening GERD.
La gastrectomía vertical es la cirugía bariátrica más común realizada en el mundo, y asimismo se ha demostrado ampliamente queproduce síntomas de reflujo gastroesofágico (RGE) o empeora el reflujo existente1,2.
Existen múltiples técnicas de cirugía bariátrica. La selección de pacientes para cada técnica dependerá de sus características metabólicas, del grado de obesidad, del síndrome metabólico o de la reganancia de peso. Muchas veces la preferencia del paciente determina la elección de la técnica (por lo general «manga gástrica»)3,4.
Por este motivo, en nuestro centro especializado en cirugía de tracto digestivo anterior (Foregut) los pacientes son evaluados sobre síntomas de reflujo, regurgitación, acidez o disfagia, con un estudio completo endoscópico, radiológico y de motilidad esofágica que se realiza de rutina para una selección más precisa de los pacientes antes del tratamiento quirúrgico y para que la técnica elegida tenga la mejor tasa de éxito y la menor probabilidad de complicaciones a largo plazo. En tal sentido, el paciente con reflujo o con alta probabilidad de desarrollarlo es direccionado hacia el bypass gástrico en Y de Roux.
En este artículo se expondrán la anatomía de la unión gastroesofágica (UGE), los cambios que explicarían la aparición de la sintomatología de reflujo, los estudios comparativos pre y postoperatorios, así como la visualización de los cambios que ocurren respecto al volumen y a la morfología de la manga a través de la volumetría.
Anatomía y fisiología de la unión gastroesofágica normal y en el paciente gastrectomizadoLa UGE es la parte del tubo digestivo que está en un espacio transicional entre el tórax y el abdomen sometido a diferentes presiones y que tiene un rango importante de motilidad producida por la deglución. El mecanismo antirreflujo es multifactorial, lo cual hace compleja la investigación de su patología y el planteamiento de su tratamiento5.
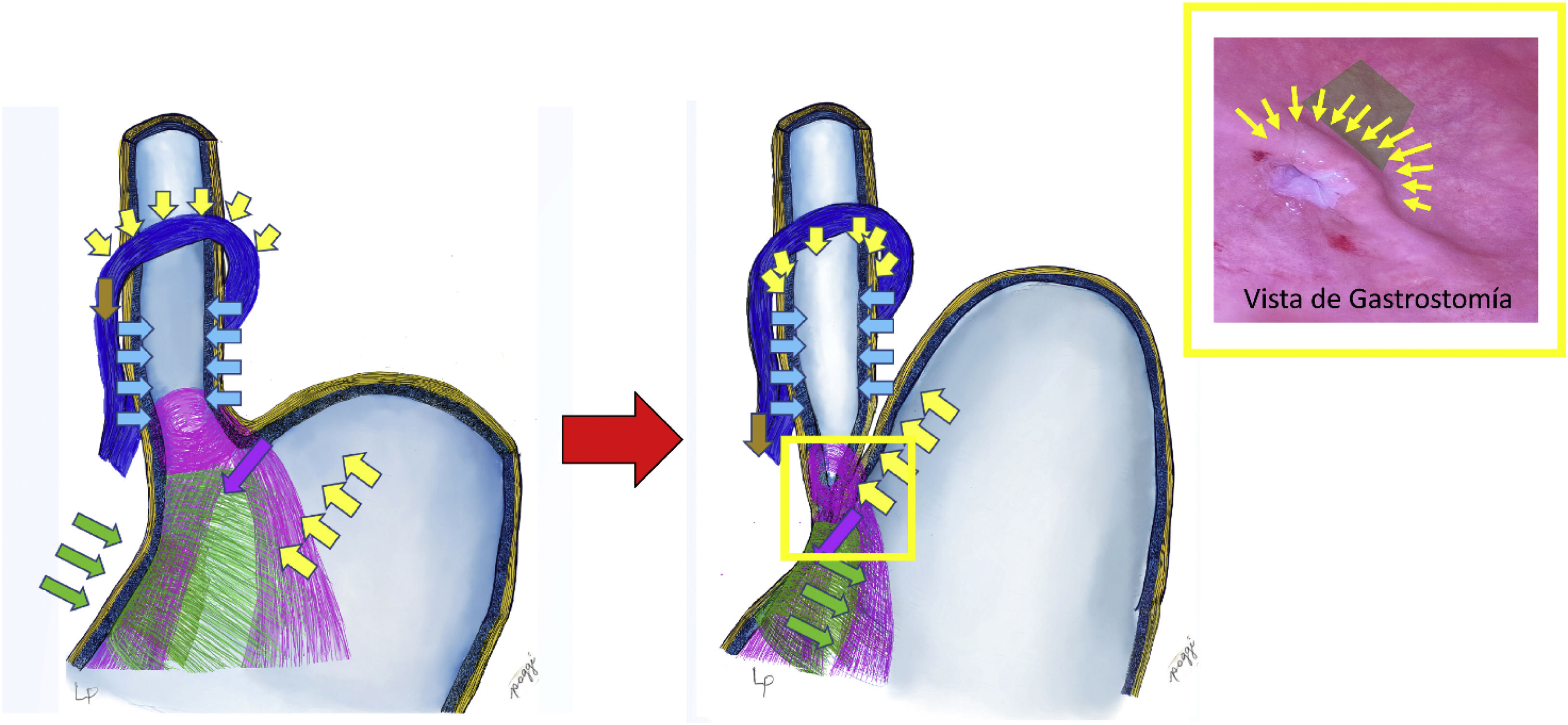
La UGE está compuesta anatómicamente por el esófago abdominal, el ángulo de His, el fondo gástrico, las fibras Sling y las fibras Clasp6. Todas estas estructuras deben estar en su posición anatómica normal para constituir un perfecto mecanismo antirreflujo gastroesofágico. Los elementos de soporte de esta zona móvil estarían dados por el ligamento frenoesofágico, la crura diafragmática, la pars condensa, el epiplón menor, el ligamento fundofrénico y los vasos cortos. Cuando hay falla una de estas estructuras, la crura se puede llegar a dilatar produciendo hernia hiatal por deslizamiento que producirá reflujo gastroesofágico. La porción abdominal del esófago (4cm) está sometida a una serie de presiones abdominales, presiones gástricas y de la UGE que crean un área de alta presión que constituiría el llamado esfínter esofágico inferior (EEI), que vendría a ser una sumatoria de fuerzas y no un esfínter muscular específico7.
Lo anatómico, regular y fisiológico de estas estructuras configura un mecanismo de compuerta antirreflujo, permitiendo el paso del alimento del esófago hacia el estómago e impidiendo su retorno8 (fig. 1). En este mecanismo las fibras Sling (color púrpura en la ilustración) tienen una disposición muy sui géneris en el estómago, van por la pared anterior, giran alrededor del esófago a manera de un lazo y bajan por la vertiente posterior fijándose en la incisura angularis. Ellas generan el ángulo de His y actúan moviendo la pared del esófago hacia abajo y hacia la derecha (flechas púrpura); esto se complementa con las fibras tipo Clasp (color verde), que se contraen llevando el borde derecho del esófago en sentido contrario, de la derecha hacia la izquierda, cerrando el cardias (flechas verdes). Este cierre se ve complementado por la acción de la presión del fondo gástrico sobre el esófago (cumpliendo la ley de Pascal [flechas amarillas]), que comprime el esófago a nivel de la transición esofagogástrica, completando así el mecanismo antirreflujo9. Repetimos que la crura diafragmática también participa, se contrae de arriba hacia abajo y de adelante hacia atrás, actuando como parte importante del mecanismo antirreflujo (según Zifan, 85%); igualmente queremos reiterar que toda dilatación de la crura produce deslizamiento del estómago y hernia hiatal, generando necesaria y obligatoriamente reflujo gastroesofágico.
En el momento de la deglución, la secuencia sería que el esófago propulsa el bolo alimenticio hacia el estómago, produciendo la relajación de las fibras Sling y Clasp, abriendo el cardias y permitiendo el ingreso del alimento. El mecanismo antirreflujo se pone en acción en el momento en que lo ingerido incrementa la presión intragástrica (esto sucede cuando los volúmenes llegan al tope, más de 750ml) produciendo el retroceso del alimento del estómago hacia el esófago. Es en esta situación en donde se contraen las fibras Clasp y Sling cerrando el cardias con la ayuda del incremento de la presión intragástrica y la elevación del fondo gástrico, comprimiendo la pared esofágica y generando un mecanismo valvular de compuerta (fig. 1)6.
La representación del mecanismo de compuerta visto desde el interior del estómago se denomina flap valve (recuadro amarillo en la figura 1), que es lo que tratamos de reproducir en la cirugía cuando este se ha perdido generando reflujo y de esta manera restablecer la funcionalidad y la competencia del EEI10. Este nivel equivale a la zona de transición del ingreso del esófago al estómago, donde actuaría la presión intragástrica además de las otras fuerzas mencionadas generando el efecto compuerta o válvula check sobre la porción de esófago que está dentro de la pared del estómago6. A esto es a lo que se refieren Jobe et al.8, y que es mencionado por Tom DeMeester como high pressure zone.
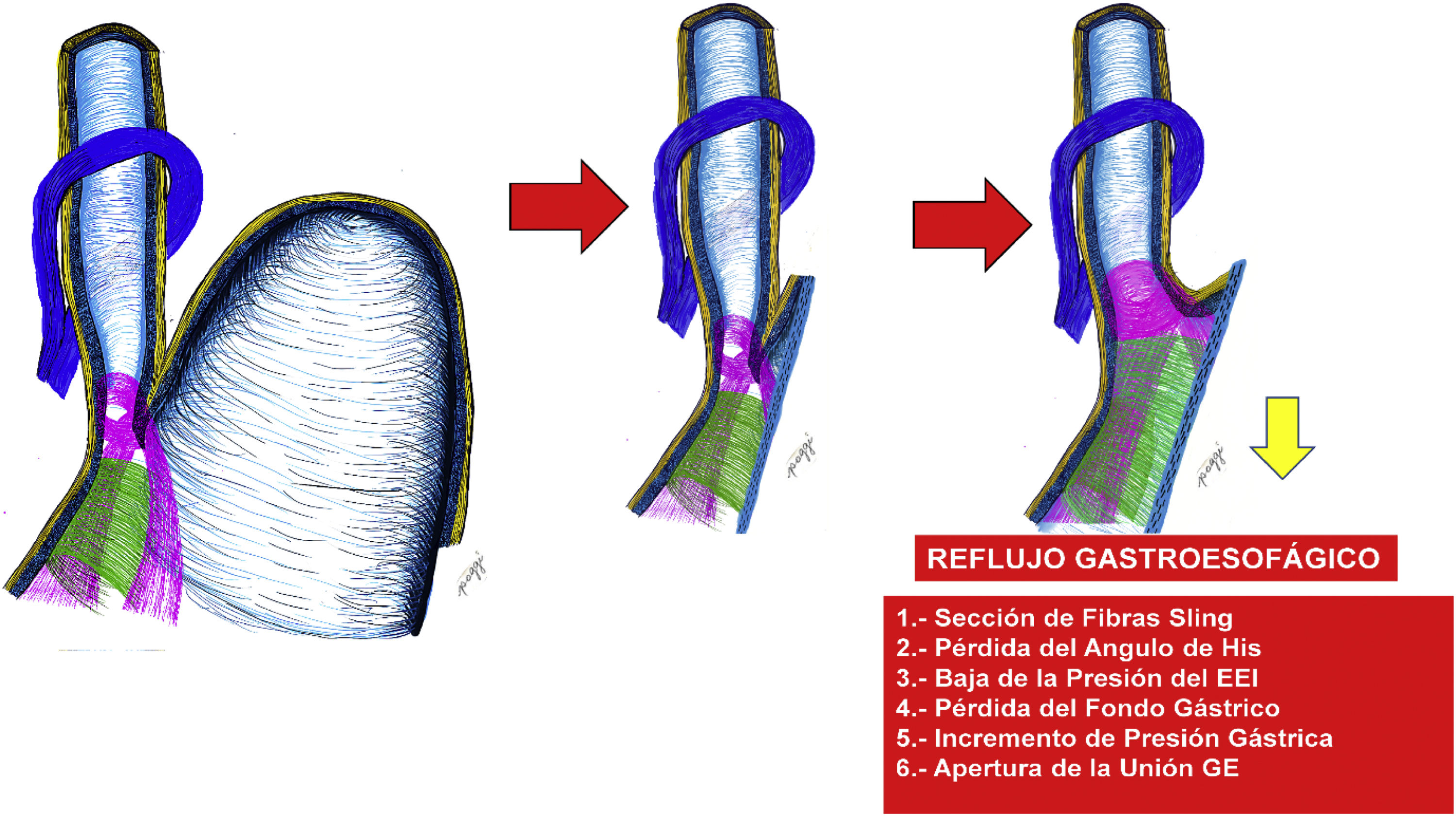
La técnica de gastrectomía produciría la sección de las estructuras que configuran el mecanismo antirreflujo. Estos cambios producidos por la resección del estómago y el fondo gástrico conllevarían, en primer lugar, a una disminución de las presiones existentes sobre el EEI11, tornándose en un cardias incompetente dado que las fibras Sling, por estar seccionadas, no pueden contraerse eficientemente, disminuyendo la presión del EEI. Igualmente, la ausencia del fondo gástrico hace que se pierda el ángulo de His, perdiéndose asimismo el mecanismo de compuerta, y la reducción del volumen del estómago haría que se incremente la presión intragástrica produciendo una apertura del cardias mayor, quedando abierto o bostezado permanentemente, causando incompetencia del mecanismo antirreflujo y propiciando el retorno del contenido gástrico hacia el esófago, incluso el reflujo biliar (fig. 2).
Factores anatómico-funcionales que propician el reflujo gastroesofágicoSon conocidas las alteraciones anatómicas que propiciarían el reflujo gastroesofágico:
- •
Hernia hiatal.
- •
Desaparición del esófago abdominal.
- •
Desaparición del fondo gástrico.
- •
Hipotensión de la zona de alta presión o EEI.
- •
Pérdida o apertura permanente del ángulo de His.
- •
Incremento de la presión intraabdominal.
- •
Incremento de la presión intragástrica.
- •
Inversión de gradiente de presiones esofagogástrico.
- •
Hiperacidez.
- •
Incremento anormal de la frecuencia de las relajaciones transitorias.
- •
Falta de resistencia de la mucosa esofágica al ácido.
- •
Retardo del vaciamiento gástrico.
- •
Alteraciones producidas como consecuencia de la cirugía gástrica:
- ∘
Resección del fondo gástrico.
- ∘
Estenosis de incisura o cuerpo gástrico.
- ∘
Obstrucciones de flujo de salida del estómago.
- ∘
Gastroparesia.
- ∘
Dismotilidad esofágica progresiva.
- ∘
Espasmo esofágico.
Para el análisis de todos los factores considerados en el párrafo anterior es necesario un estudio integral para poder entender el estado funcional de la UGE e interpretar las alteraciones fisiológicas producidas por la resección o la modificación de la anatomía generada en las diversas técnicas quirúrgicas12,13. La evaluación debe ser de una manera integral, es decir, completa, analizando el esófago por fluoroscopia, endoscopia y motilidad (manometría-pHmetría-impedancia) esofágica.
Los resultados de estas pruebas nos permitirían conocer objetivamente patologías que podrían producir reflujo como dismotilidad, acalasia, esófago Jackhammer o la patología descrita últimamente como obstrucción al flujo de salida esofágico (esophago gastric junction outflow obstruction [EGJOO]) en los pacientes de cirugía bariátrica tanto pre como postoperatorios14.
Al decir estudio completo nos referimos a lo ideal, que incluye: manometría esofágica de alta resolución, pHmetría e impedancia esofágica de 24horas, fluoroscopia esofágica, vaciamiento gástrico mediante gammagrafía y endoscopia alta15. Otras técnicas a usar en el preoperatorio de cirugía revisional no obligatorias pueden ser: endoFLIP y volumetría mediante reconstrucción 3D con tomografía para conocer el volumen, la morfología y el tipo de cirugía a la cual fue sometido el paciente con reflujo16,17.
Resultados comparativos pre y postoperatoriosMostramos los resultados pre y postoperatorios de los pacientes sometidos a gastrectomía vertical que aceptaron realizarse un estudio completo. Se trata de 245 pacientes que tuvieron una pérdida de peso aceptable, con descenso del IMC de 39,15 a 26,34. A continuación presentamos los resultados de cada estudio realizado haciendo una interpretación de los mismos.
Manometría esofágica de alta resoluciónLa manometría de alta resolución es el estudio más importante de la motilidad esofágica y que mayor información nos da sobre el estado funcional del proceso de deglución y peristalsis esofágica. Nos permite detectar y diagnosticar patologías que pueden ser una contraindicación para realizar una determinada cirugía, como la acalasia o el reflujo severo. El valor comparativo de la manometría pre y postoperatoria nos permitirá evaluar la verdadera acción, el efecto o el deterioro que la cirugía produce en la fisiología del esófago y de la UGE.
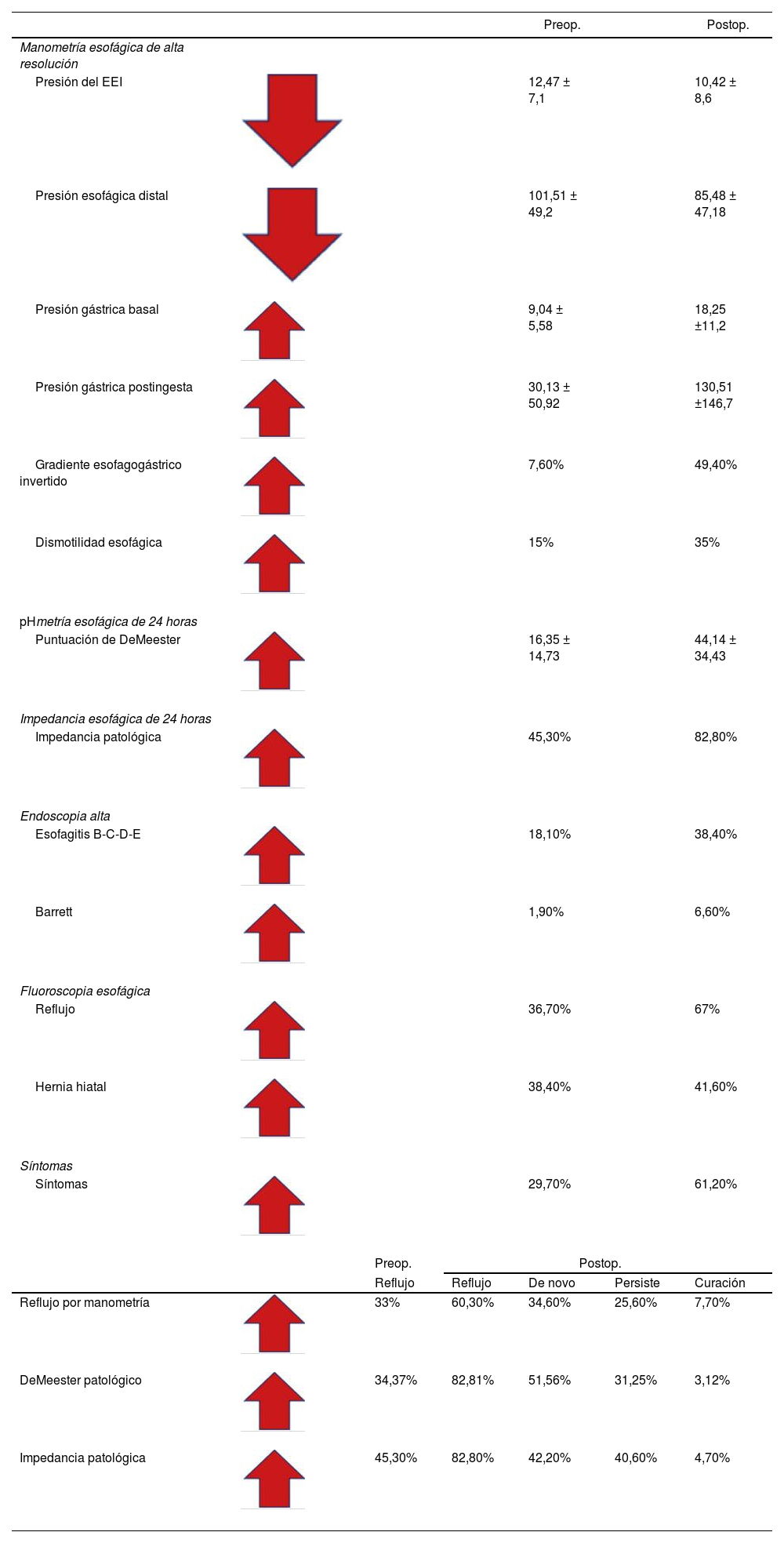
Resultados de manometría pre y postoperatoriosLos hallazgos más importantes son los cambios que se producen luego de una cirugía de gastrectomía vertical en la manometría esofágica18 (tabla 1).
Valores pre y postoperatorios pareados del estudio completo de fluoroscopia, endoscopia y motilidad esofágica en pacientes de gastrectomía vertical
| Preop. | Postop. | |||||
|---|---|---|---|---|---|---|
| Manometría esofágica de alta resolución | ||||||
| Presión del EEI | 12,47 ± 7,1 | 10,42 ± 8,6 | ||||
| Presión esofágica distal | 101,51 ± 49,2 | 85,48 ± 47,18 | ||||
| Presión gástrica basal | 9,04 ± 5,58 | 18,25 ±11,2 | ||||
| Presión gástrica postingesta | 30,13 ± 50,92 | 130,51 ±146,7 | ||||
| Gradiente esofagogástrico invertido | 7,60% | 49,40% | ||||
| Dismotilidad esofágica | 15% | 35% | ||||
| pHmetría esofágica de 24 horas | ||||||
| Puntuación de DeMeester | 16,35 ± 14,73 | 44,14 ± 34,43 | ||||
| Impedancia esofágica de 24 horas | ||||||
| Impedancia patológica | 45,30% | 82,80% | ||||
| Endoscopia alta | ||||||
| Esofagitis B-C-D-E | 18,10% | 38,40% | ||||
| Barrett | 1,90% | 6,60% | ||||
| Fluoroscopia esofágica | ||||||
| Reflujo | 36,70% | 67% | ||||
| Hernia hiatal | 38,40% | 41,60% | ||||
| Síntomas | ||||||
| Síntomas | 29,70% | 61,20% | ||||
| Preop. | Postop. | |||||
| Reflujo | Reflujo | De novo | Persiste | Curación | ||
| Reflujo por manometría | 33% | 60,30% | 34,60% | 25,60% | 7,70% | |
| DeMeester patológico | 34,37% | 82,81% | 51,56% | 31,25% | 3,12% | |
| Impedancia patológica | 45,30% | 82,80% | 42,20% | 40,60% | 4,70% | |
La presión del EEI preoperatoria es normal, con un resultado promedio de 12,47 ±7,1mmHg, en comparación con la del postoperatorio, con un resultado promedio de 10,42 ±8,6mmHg (baja de la presión del EEI evidente), pudiendo llegar a valores por debajo de 6mmHg, tendiendo a ser hipotenso y mostrando incompetencia, en especial en presencia de hernia hiatal18 (tabla 1).
La presión esofágica distal presentó un valor preoperatorio de 101,51 ±49,2mmHg y un valor postoperatorio de 85,48 ±47,1mmHg, mostrando también un deterioro de la presión del cuerpo esofágico18.
La presión intragástrica fue evaluada de dos formas: la primera fue midiendo la presión basal con el estómago vacío en el pre y el postoperatorio, encontrándose valores promedio de 9,04 ±5,58mmHg en el preoperatorio y de 18,28 ±11,2mmHg en el postoperatorio (probablemente en relación con la disminución del volumen gástrico). La segunda forma en la que evaluamos este parámetro fue medir la presión intragástrica luego de la ingesta de un vaso de agua, encontrándose que esta presión post-ingesta de líquido fue de 30,13 ±50,9mmHg en el preoperatorio y de 130,51 ±146,7mmHg en el postoperatorio, lo cual traduce un incremento de 18 a 130, aproximadamente 7 veces su valor basal, como consecuencia de la reducción del volumen gástrico18.
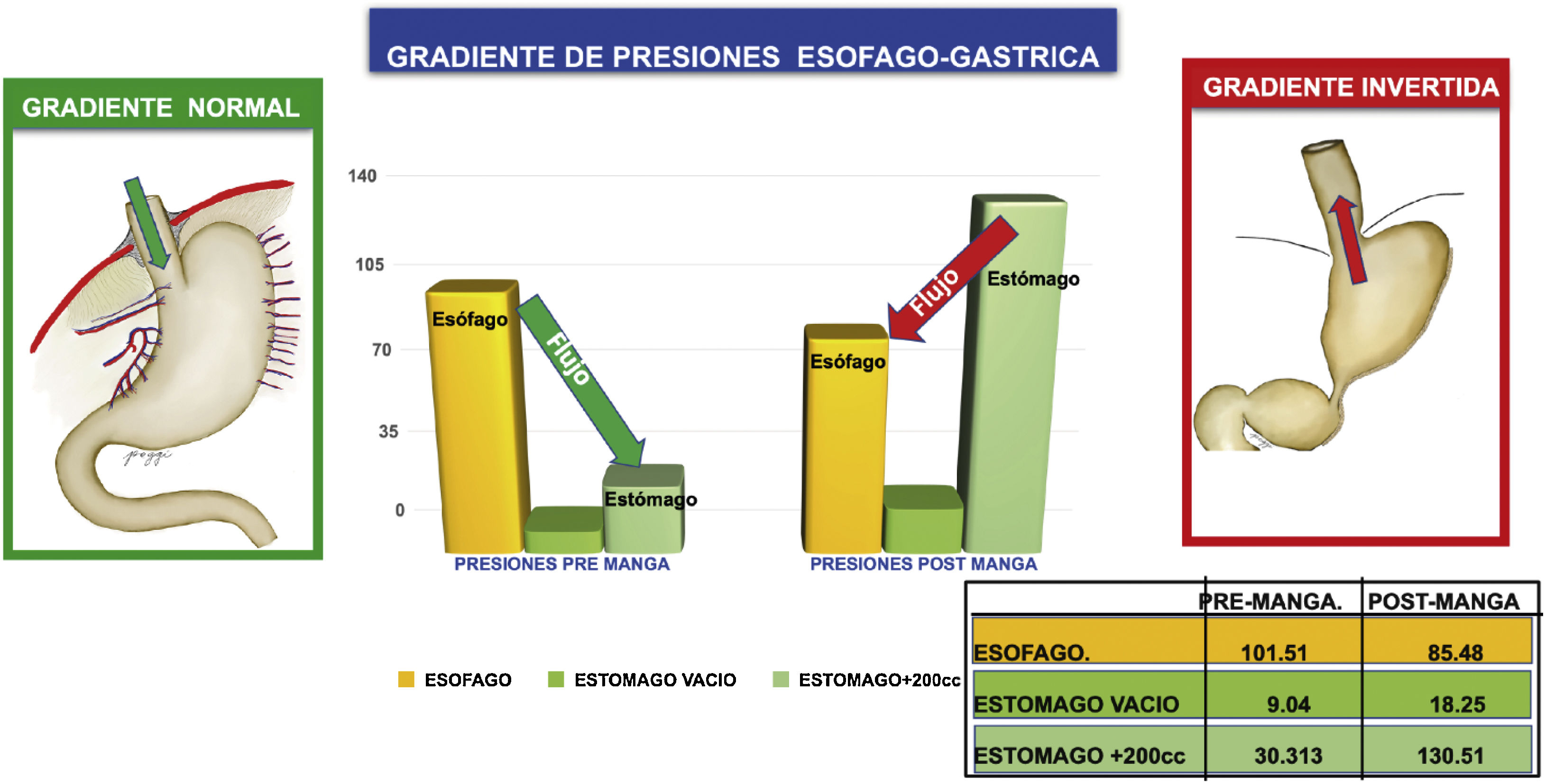
El gradiente esofagogástrico normal se da cuando la presión del esófago es mayor que la del estómago, traduciéndose en un flujo en dirección del esófago al estómago. El gradiente esofagogástrico invertido se da cuando la presión del esófago es menor que la del estómago, traduciéndose en un flujo invertido del estómago hacia el esófago (reflujo gastroesofágico). Esto sucede con nuestros resultados, que el gradiente invertido se da en el 7,6% de los pacientes en el preoperatorio y se incrementa al 49,4% de los pacientes en el postoperatorio. Este fenómeno de la inversión de gradiente constituye otro gran factor para la producción de reflujo18 (fig 3).
Por la naturaleza del tipo de cirugía, es frecuente el aumento de la presión intraluminal gástrica basal y post-ingesta (debido a la disminución del volumen del estómago)18. Este aumento de la presión es uno de los mecanismos responsables de la fisiopatología del reflujo post-manga, porque altera el gradiente de presiones entre el estómago, el EEI y el cuerpo esofágico, generando un retorno o regurgitación del contenido gástrico hacia el esófago. La inversión del gradiente, según Poggi et al.19, va en el pre y en el postoperatorio del 6% al 48%, respectivamente.
La dismotilidad está presente en el 15% preoperatorio, y en el postoperatorio aumenta al 35%, demostrando que hay un deterioro de la motilidad que condicionará el reflujo, porque después de evaluar a todos nuestros pacientes creemos que la dismotilidad nunca mejora, siempre empeora con la gastrectomía vertical18.
Tras analizar todos los factores condicionantes de reflujo evaluados por manometría, nuestros resultados de reflujo por manometría serían del 60,3%, siendo el reflujo de novo del 34,6%18 (tabla 1).
De acuerdo con nuestros resultados, los posibles predictores de empeoramiento de reflujo y de reflujo de novo serían la hipotensión del EEI, la presión gástrica elevada basal preoperatoria, el gradiente esofagogástrico invertido y la dismotilidad. Actualmente, los grupos de estudio de neuromotilidad digestiva califican la peristalsis del esófago con el análisis de la contractilidad distal integral (DCI) y la presión integral de relajación (integrated relaxation pressure [IRP]) elevada, lo que está relacionado con la competencia del EEI en patologías como la acalasia y la EGJOO18.
Hallazgos preoperatorios y posibles diagnósticosExisten estados funcionales del esófago que debemos tener en cuenta entre los candidatos a cirugía bariátrica. Estos pacientes podrían estar en un estado transicional potencial de generar reflujo en el postoperatorio, y justamente estos son los casos detectados usando la clasificación de ChicagoIV20,21.
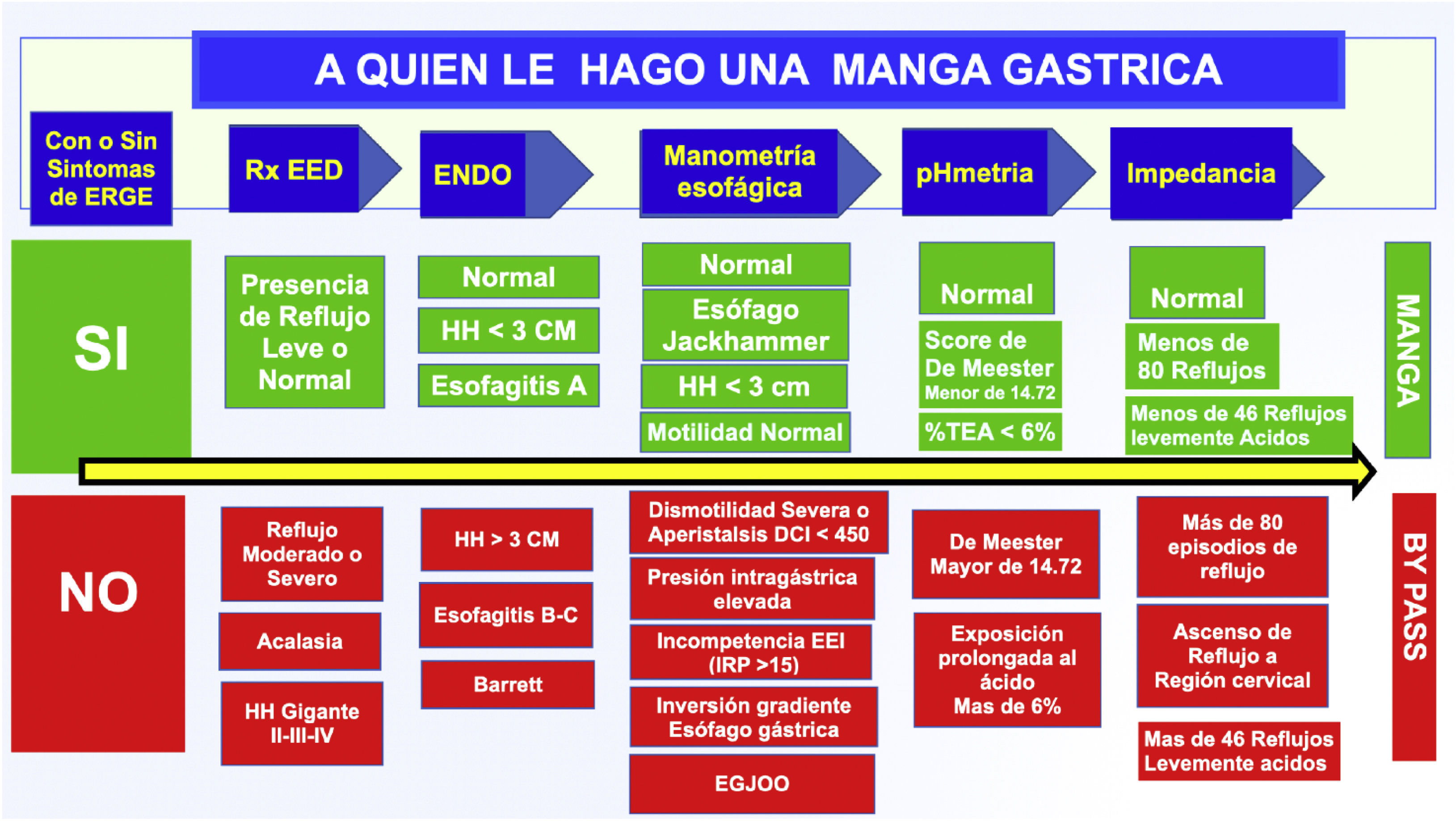
Casos que tenemos la obligación de detectar para no realizar una manga gástrica:
- •
Motilidad esofágica ineficaz (dismotilidad esofágica). Contraindicación de manga gástrica.
- •
Obstrucción al flujo de salida de la unión gastroesofágica (EGJOO).
- •
Asintomáticos en algunos casos, lo que puede ser relacionado con hernia hiatal, con acalasia temprana en desarrollo o con un problema funcional. No se recomienda manga gástrica.
- •
Esófago hipercontráctil Jackhammer (contraindicación relativa para manga gástrica). Relacionado con dolor retroesternal. Tiene riesgo de fístula.
- •
Espasmo esofágico distal. Relacionado con reflujo gastroesofágico. Contraindicación relativa de manga gástrica.
- •
Acalasia. Contraindicación absoluta de manga gástrica.
- •
Hernia hiatal que debe ser corregida y que, a la vez, es una las complicaciones más frecuentes de la manga gástrica productoras de enfermedad por RGE debido al deslizamiento de la manga al tórax.
El estudio de pHmetría se realiza junto al de impedancia esofágica con el mismo catéter que nos permite medir la exposición del ácido del esófago distal a un pH<4 mediante sensores de pH que están a la mitad y en la punta del catéter. El sensor distal queda en el estómago y el sensor proximal queda a 5cm por encima del borde superior del EEI determinado previamente por la manometría. La pHmetría se mide a través de la puntuación de DeMeester (valor normal: 14,72) y el porcentaje de tiempo de exposición al ácido (valor normal: <4%) del esófago distal22.
La impedancia esofágica de 24horas se mide junto con el catéter de pHmetría a través de 6 pares de sensores instalados desde los 3cm hasta los 17cm en forma proximal del borde superior del EEI. Este estudio permite registrar el número de episodios de reflujo (valor normal: <80), el tipo de reflujo, si es alcalino o ácido, y el nivel de ascenso del reflujo hasta la región cervical.
Resultados de pHmetría-impedancia de 24 horas pre y postoperatorios de gastrectomía vertical (tabla 1)La puntuación de DeMeester en los pacientes en el pre y el postoperatorio fue de 16,35 ±14,73 y de 44,14 ±34,43, respectivamente, o sea, que en el postoperatorio se triplican estos valores, expresando una condición patológica por reflujo ácido. Con este método se logra diagnosticar reflujo patológico en el 82,81% en el postoperatorio, siendo el reflujo de novo del 51,56%.
El tiempo de exposición al ácido en el preoperatorio fue normal, con un valor del 3%, y en el postoperatorio fue patológico en el 16% de los pacientes, mostrando, otra vez más, un evidente reflujo gastroesofágico.
La impedancia esofágica mostró que el 82,8% de los pacientes presentan reflujo postoperatorio y el 42,2%, reflujo de novo.
Estos resultados demuestran que, a través del estudio completo con pruebas de manometría, pHmetría e impedancia esofágica, con la manometría tenemos suficiente evidencia para considerar que es la única forma de hacer un diagnóstico certero e irrefutable.
Importancia de la endoscopia y fluoroscopia esofágica en el paciente bariátricoFluoroscopia esofágicaLa literatura no le da a la fluoroscopia esofágica el valor ni la importancia debidos. En nuestro servicio, basándonos en nuestros resultados, no compartimos esta opinión. Tenemos por costumbre que sea el mismo cirujano quien realice la fluoroscopia esofágica, porque de esa manera obtenemos el máximo de información sobre la motilidad y el funcionamiento esofágico. En los estudios preoperatorios nos lleva a sospechar problemas de motilidad el visualizar la hernia hiatal y el reflujo. Igualmente, en el postoperatorio nos permitirá evaluar los resultados de la cirugía y descartar problemas de estrecheces, fugas y reflujo.
Endoscopia altaConsideramos mandatorio realizar endoscopia preoperatoria para detectar patología esofágica, Barrett, esofagitis, acalasia, divertículos de esófago y patología gástrica como tumoraciones benignas tipo GIST o tumoraciones malignas incipientes que nos obliguen a replantear la cirugía. El seguimiento postoperatorio de la endoscopia es para detectar signos de reflujo relacionados con esofagitis erosivas moderadas o severas, Barrett y displasias23. Existe el planteamiento de que la endoscopia preoperatoria pueda no ser necesaria en el caso de cirugía bariátrica24,25; sin embargo, es recomendable también el seguimiento endoscópico para detectar deslizamiento, Barrett o reflujo. Hay estudios de Barrett post-manga, como reportan Genco et al.26 e Iannelli et al.27, con resultados del 17,4% y del 18,8% de Barrett post-manga, respectivamente. Nuestros resultados han sido del 6,6% al año de pacientes con esófago de Barrett, y para nuestro servicio el esófago de Barrett es una formal contraindicación. Estos casos pueden progresar a displasia severa y cáncer, y en nuestro servicio hemos tenido 2 pacientes con cáncer de la UGE.
Volumetría 3D-TCEn el protocolo de seguimiento hemos visto que una herramienta útil es la volumetría por tomografía con reconstrucción 3D. A través de este procedimiento podemos obtener resultados sobre el volumen de la manga, su morfología, sus defectos técnicos y su deslizamiento al tórax16,28. A continuación describimos los problemas que propiciarían reflujo, detectables por volumetría 3D-TC:
- a)
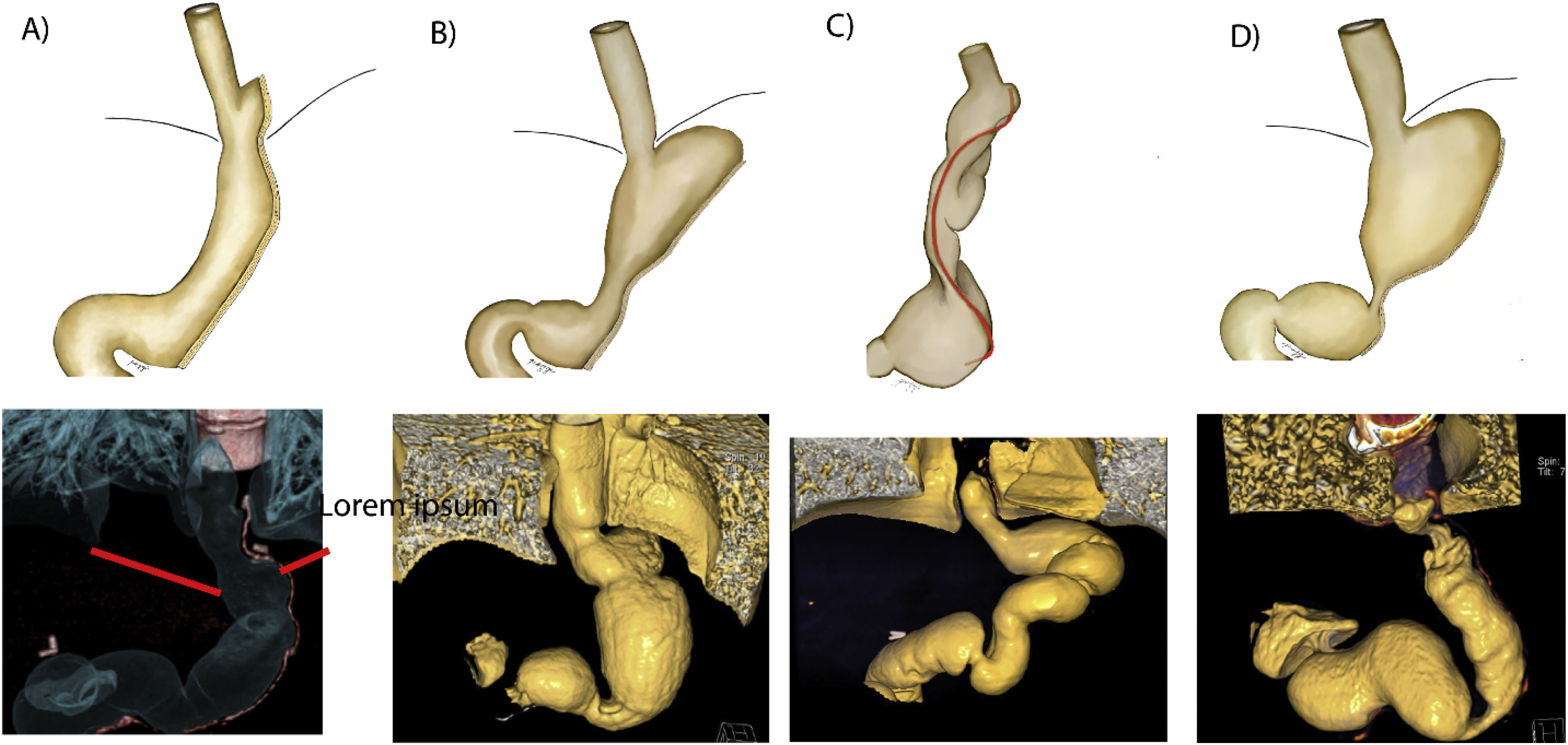
El deslizamiento se presenta en el 72,4% de nuestros casos operados, independientemente de si se realizó o no corrección de la hernia hiatal (fig. 4A, en donde se puede observar en color rojo la línea de grapas que va por encima del diafragma)16.
Figura 4.Ilustración y reconstrucción 3D de complicaciones relacionadas con la aparición de enfermedad por reflujo gastroesofágico en la gastrectomía vertical. A)Deslizamiento intratorácico. B)Dilatación del fondo gástrico y del esófago. C)Torsión. D)Estenosis/estrechamiento de la incisura angularis. En todos los casos se ve deslizamiento de la manga.
(0.42MB). - b)
La dilatación del fondo gástrico se presenta en el 22,4% de nuestros pacientes, por lo general por dilatación debido a una estenosis del cuerpo o por un fondo gástrico no resecado. La dilatación global de la manga se presenta en el 64,7% de los casos operados, que indica un crecimiento o un aumento del volumen de la manga con el tiempo a largo plazo y que guarda relación con la reganancia de peso (fig. 4B-D)16.
- c)
La dilatación esofágica acompaña al 27,6% de los operados de nuestro grupo, lo que se explica por la alimentación forzada y el incremento de la presión gástrica, que tratando de vencer la presión gástrica elevada terminan dilatando el esófago durante intento de pasar el alimento hacia el estómago. Esto conlleva reflujo gastroesofágico con dismotilidad esofágica severa y deterioro progresivo de la peristalsis esofágica. La dismotilidad severa esofágica nunca mejora, siempre empeora (en la figura 4B-D el esófago se observa dilatado en el 3D)11,16.
- d)
La torsión en espiral o sacacorchos se da en el 8,6% de nuestros casos, debido a que el tubo gástrico gira sobre su propio eje y adopta una forma en espiral a manera de sacacorchos. Esto se debe a un grapado irregular y asimétrico. Clínicamente se expresa como intolerancia digestiva con vómitos frecuentes y generalmente una pérdida masiva de peso (fig. 4C). Todos los pacientes con esta complicación desarrollarán reflujo severo intratable, y por lo general van a cirugía de revisión de manga a bypass16.
- e)
La estenosis de la incisura angularis se da en el 44% y la estenosis del cuerpo se da en el 7,8% de nuestro grupo de investigación. Esta alteración se presenta cuando el grapado se pega demasiado a nivel de la incisura angularis o cuando hubo una resección asimétrica del estómago (fig. 4B-D)16.
- f)
La presentación de Kinking se da en el 75,9%. Se forma un ángulo agudo severo entre el antro y el cuerpo gástrico a nivel de la incisura, creando obstrucción parcial cuando se quiebra sobre sí mismo e impide el pasaje de contenido de proximal a estómago distal, generando vómitos y reflujo16.
La gastrectomía vertical produce alteraciones anatómicas en la UGE que generan alteraciones de todo el mecanismo valvular antirreflujo. Esta técnica propicia la aparición de reflujo y el deterioro de todas las funciones antirreflujo de la UGE.
Con todo lo desarrollado e investigado en este capítulo hemos querido crear un flujograma con el fin de ayudarnos a la elección de la técnica quirúrgica bariátrica a utilizar en el paciente obeso, principalmente decidir entre manga gástrica y bypass. Todo este análisis está basado en nuestros resultados de manometría, pHmetría, impedancia, fluoroscopia esofágica y endoscopia alta, con el principal interés de identificar a los pacientes que tienen baja probabilidad de desarrollar reflujo frente a los que tienen muy alta probabilidad de presentar reflujo postoperatoriamente; creemos que es una buena manera de evitarle al paciente una cirugía revisional por reflujo intratable a futuro (fig. 5).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.