La pandemia por SARS-CoV-2 (COVID-19) obliga a una reflexión en el ámbito de la cirugía oncológica, tanto sobre el riesgo de infección, de consecuencias clínicas muy relevantes, como sobre la necesidad de generar planes para minimizar el impacto sobre las posibles restricciones de los recursos sanitarios.
La AEC hace una propuesta de manejo de pacientes con neoplasias hepatobiliopancreáticas (HBP) en los distintos escenarios de pandemia, con el objetivo de ofrecer el máximo beneficio a los pacientes y minimizar el riesgo de infección por COVID-19, optimizando a su vez los recursos disponibles en cada momento. Para ello es preciso la coordinación de los diferentes tratamientos entre los servicios implicados: oncología médica, oncología radioterápica, cirugía, anestesia, radiología, endoscopia y cuidados intensivos.
El objetivo es ofrecer tratamientos eficaces, adaptándonos a los recursos disponibles, sin comprometer la seguridad de los pacientes y los profesionales.
The SARS-CoV-2 (COVID-19) pandemic requires an analysis in the field of oncological surgery, both on the risk of infection, with very relevant clinical consequences, and on the need to generate plans to minimize the impact on possible restrictions on health resources.
The AEC is making a proposal for the management of patients with hepatopancreatobiliary (HPB) malignancies in the different pandemic scenarios in order to offer the maximum benefit to patients, minimising the risks of COVID-19 infection, and optimising the healthcare resources available at any time. This requires the coordination of the different treatment options between the departments involved in the management of these patients: medical oncology, radiotherapy oncology, surgery, anaesthesia, radiology, endoscopy department and intensive care.
The goal is offer effective treatments, adapted to the available resources, without compromising patients and healthcare professionals safety.
Los pacientes oncológicos presentan un estado de inmunosupresión sistémica, derivado del proceso neoplásico subyacente y de los tratamientos administrados, mostrando por ello una mayor susceptibilidad a las infecciones. El manejo de este grupo de pacientes presenta dos problemas mayores a tener en cuenta en la situación actual de pandemia por SARS-CoV-2 (COVID-19). Primero, el mayor riesgo de contraer la infección, con tasas mayores de morbimortalidad en el caso de ser intervenidos1,2. Segundo, la limitación de recursos en determinados momentos, que obligarán a la priorización del uso de los mismos para pacientes más críticos.
Generalmente el manejo de los pacientes con neoplasias del área hepatobiliopancreática (HBP) es complejo, siendo necesario diseñar la estrategia terapéutica más adecuada en Comité Multidisciplinar (CM). En el contexto actual es determinante minimizar el riesgo de infección por SARS-CoV-2 en este grupo de pacientes, así como optimizar los tratamientos y recursos disponibles, ofreciendo las alternativas mejores y más seguras. Todas las decisiones que se tomen deben ser consensuadas en CM, sabiendo que en determinados momentos puede ser necesario modificar los protocolos habituales. Es importante establecer planes de actuación en donde se contemplen la priorización, la demora e incluso la cancelación de los diferentes tratamientos oncológicos.
Despistaje perioperatorio de infección por SARS-CoV-2 en el paciente oncológico hepato-bilio-pancreáticoLos datos emanados de la literatura existente1,2 indican que los pacientes oncológicos presentan un mayor riesgo de infección por SARS-CoV-2, desarrollando complicaciones mayores o falleciendo a causa de la misma. Yu et al. describen la incidencia y los resultados en una cohorte de pacientes oncológicos en un centro terciario en Wuhan, reportando una mortalidad en este grupo del 25%3.
Es importante extremar la protección frente a la infección en este tipo de pacientes para evitar la alta morbimortalidad que conlleva. Además, se deberán tomar las medidas necesarias para la protección del personal sanitario. Las instituciones sanitarias deben comprometerse a facilitar los medios para que se apliquen las medidas de prevención establecidas según la normativa vigente4.
La recomendación actual es el despistaje de infección por virus SARS-CoV-2 a los pacientes oncológicos 24-48h antes de recibir tratamientos quimioterápicos, radioterápicos o intervenciones quirúrgicas, y aconsejarles la limitación de contactos o el autoaislamiento.
El cribado de infección se fundamentará en criterios clínicos, epidemiológicos, analíticos, serológicos y microbiológicos mediante test para COVID-19 (test de reacción en cadena de la polimerasa o PCR / test serológicos de detección de anticuerpos). Si no hay disponibilidad de test y se tiene una alta sospecha de infección, se podrá plantear la realización de tomografía computarizada (TC) de tórax en las 24-48h previas a la cirugía5.
Si el paciente presentara infección por COVID-19 y la cirugía no se pudiera posponer, todo el equipo quirúrgico deberá actuar con los equipos de protección individual (EPI), que deberán ser proporcionados por el centro de trabajo. Estos EPI constarán de bata impermeable, mascarillas tipo N95, o FFP2/FFP3, gafas, pantalla de cobertura facial, guantes de nitrilo largos (un par), gorro y calzado exclusivo para la zona y sin perforaciones4.
En el caso de que se programe la cirugía y el paciente no presente infección evidente por SARS-CoV-2 o sospecha de contacto, se establecerá un «circuito limpio» en el centro para preservar la seguridad del paciente y minimizar al máximo el riesgo de infección5.
Evaluación del paciente oncológico hepato-bilio-pancreático en el contexto de la infección COVIDEn el contexto excepcional actual, dependiendo del impacto de la pandemia y del nivel de alerta en cada centro, puede ser necesario modificar los protocolos. Además de los factores habituales a tener en cuenta, se suman los recursos disponibles, la ocupación hospitalaria y el hecho de que el paciente pueda presentar infección por SARS-CoV-2. Por lo tanto, se tendrá que hacer una evaluación detallada del paciente, la enfermedad, el equipo quirúrgico, los recursos del hospital y el área sanitaria.
En esta situación, la planificación de tratamientos adyuvantes, neoadyuvantes, quirúrgicos y otros se basará en criterios de máximo beneficio de los mismos, frente a la minimización de los riesgos de infección por SARS-CoV-2, optimizando los recursos disponibles en cada momento6,7. Se coordinarán los diferentes servicios implicados: oncología médica, oncología radioterápica, cirugía, anestesia, cuidados intensivos, radiodiagnóstico y endoscopia.
El objetivo siempre será preservar la seguridad del paciente, sin comprometer la eficacia de los tratamientos empleados contra el proceso neoplásico.
Los factores que se deben examinar son los siguientes:
Relativos al paciente: evaluar riesgo/beneficio relativo a la exposición al coronavirus y sus potenciales consecuencias, frente a las diferentes alternativas terapéuticas6,7.
- •
Edad.
- •
Criterios de fragilidad (Cuestionario G8<14)8.
- •
Dependencia moderada, grave o total (índice de Barthel<55)9.
- •
Deterioro cognitivo moderado o severo (Cuestionario Pfeiffer>5)10.
- •
Comorbilidades asociadas (Escala Charlson>3)11.
- •
Situación funcional del paciente (ECOG)12.
Relativos a la enfermedad neoplásica: estadificación clínica del tumor (cTNM), teniendo en cuenta la biología (tiempo de duplicación, ritmo de crecimiento estimado, riesgo de evolución a enfermedad diseminada) y los síntomas provocados por el mismo6.
Grado de inmunodepresión inducido por el tipo de tratamiento elegido (neoadyuvancia o adyuvancia) u otras causas (inmunodeficiencias, tratamientos inmunosupresores, desnutrición, enfermedad tumoral per se), prefiriendo esquemas que reduzcan el número de visitas, la vía oral en vez de la intravenosa; dejando esquemas cortos para casos consensuados por el CM.
Infección presente o no por SARS-CoV-2: a los pacientes con sospecha o con infección por COVID-19 se recomienda no administrar tratamientos quimioterápicos; tampoco a aquellos que hayan tenido contactos recientes hasta garantizar la ausencia de infección6. En el caso de la radioterapia, se deberá evaluar de manera individualizada13. Los pacientes que tengan que ser intervenidos electivamente de manera inaplazable, con alta sospecha de infección, se les realizará pruebas de detección de COVID-19 (PCR o test serológico…) según los protocolos establecidos en cada centro4. En caso de paciente confirmado positivo, se utilizará EPI junto a la indumentaria quirúrgica, que asegure una adecuada protección de los profesionales. Sobre el EPI se colocará el equipo estéril necesario para la intervención. Se realizará una lista de comprobación (check list) de todo el procedimiento incluyendo explícitamente la situación COVID-19 del paciente4.
Recursos sanitarios disponibles: optimizar los tratamientos teniendo en cuenta los registros sobre la infección y los recursos disponibles, que pudieran ser diferentes entre áreas sanitarias e incluso áreas geográficas:
- •
Porcentaje de pacientes ingresados con COVID-19.
- •
Urgencias definidas para pacientes respiratorios vs. el resto.
- •
Disponibilidad de quirófanos.
- •
Disponibilidad de respiradores.
- •
Disponibilidad de camas de críticos/reanimación.
Consumo de recursos estimado: será importante hacer una estimación de los recursos hospitalarios que serán necesarios como, por ejemplo, la necesidad de estancia en la Unidad de Cuidados Intensivos (UCI) durante el postoperatorio, el cálculo de la estancia media hospitalaria, la morbilidad asociada a la cirugía más frecuente, etc.
Cirugía, radioterapia y quimioterapia en el escenario COVIDLas decisiones terapéuticas se tomarán en CM con dos objetivos: ofrecer la mejor alternativa terapéutica al proceso neoplásico del paciente y limitar la exposición del paciente a la infección por SARS-CoV-2.
Respecto al abordaje laparoscópico, aunque en investigaciones previas se demostró que determinados virus de transmisión sanguínea podían diseminarse a través de procedimientos productores de aerosoles14, en el caso del virus SARS-CoV-2 esta forma de diseminación es aún controvertida, no existiendo evidencia científica suficiente al respecto. En este sentido, la AEC (Asociación Española de Cirujanos)15 y la SAGES (Society of American Gastrointestinal and Endoscopic Surgeons)16 no desaconsejan su uso, cuando esté indicado, debiéndose tomar las medidas de precaución pertinentes (baja presión de neumoperitoneo, evacuación continua de humos en circuito cerrado, succión completa del neumoperitoneo al final del procedimiento) y los equipos de protección pertinentes, para evitar de manera eficaz el contagio de profesionales.
El ACS (American College of Surgeons) mencionó que los procedimientos de generación de aerosol podrían aumentar el riesgo para el personal de quirófano, pero en la actualidad la falta de evidencia impide hacer una clara recomendación o desaconsejar la cirugía mínimamente invasiva17, poniendo en valor los beneficios de esta vía de abordaje para reducir la morbilidad postoperatoria y la estancia hospitalaria.
Cuando la radioterapia esté indicada, se recomiendan esquemas de hipofraccionamiento siempre que sean posibles. Estos esquemas permitirán tratamientos más cortos, con una toxicidad similar a los tratamientos convencionales y una eficacia de tratamiento igual o mayor. De esta manera se limitará el tiempo de permanencia de los pacientes en el centro hospitalario, minimizando el posible riesgo de contagio, tanto de los pacientes como del personal sanitario. La decisión de iniciar o continuar el tratamiento con radioterapia, en pacientes que presenten infección activa por SARS-CoV-2, deberá ser tomada de manera individualizada y consensuada13.
Las recomendaciones generales sobre la administración de quimioterapia en sus distintas modalidades es, según la SEOM-TTD-GEMCAD6, la de no administrar tratamientos en pacientes con sospecha de infección o historia de contacto de riesgo de virus SARS-CoV-2, debiéndoles hacer cribado de infección antes de comenzar ningún tratamiento, y en general se establecen como recomendaciones la priorización de tratamientos (neo) adyuvantes en pacientes con cáncer de alto riesgo en los que se espera un beneficio significativo de la supervivencia. Se recomiendan regímenes o esquemas que reduzcan el número de visitas al hospital (esquemas quincenales o cada 3 semanas en vez de semanales y la administración oral en vez de intravenosa). Se han de consensuar con los oncólogos radioterápicos esquemas cortos para el tratamiento quimioterápico6. También se recomienda el uso de profilaxis primaria con G-CSF en regímenes con riesgo de neutropenia febril ≥10-15%.
Reestructuración de la actividadConsideraciones generales para pacientes oncológicos HBPRecientemente se han publicado diferentes trabajos en los que se pone de manifiesto cómo la pandemia por SARS-CoV-2 ha tenido un impacto negativo en el manejo terapéutico de los pacientes con neoplasias del área HBP18,19. Habitualmente, la complejidad de estas intervenciones expone a los pacientes a complicaciones postoperatorias, que pueden ser más o menos frecuentes, en función del volumen de los centros. Las relaciones volumen-resultado en la cirugía HBP están bien establecidas, con una estancia hospitalaria más corta y una menor mortalidad en los centros de alto volumen20,21.
Se reportan tasas de morbilidad en la cirugía hepática del 10-15%22–24, siendo mayor en la cirugía pancreática, con tasas de morbilidad>50% y tasas de reintervenciones próximas al 10%25–29. Algunas de las complicaciones (fístulas biliares, fístulas pancreáticas, abscesos) conllevan largas estancias hospitalarias, que en ocasiones requieren medidas invasivas o reintervenciones quirúrgicas. Esto, sumado al elevado riesgo de complicaciones postoperatorias graves reportadas3,30 en pacientes COVID-19 positivos, puede hacer necesario diferir la cirugía y modificar los diferentes tratamientos oncológicos3,30. Por ello la cirugía HBP compleja, en pacientes de alto riesgo, no debe realizarse en centros de bajo volumen durante la pandemia de COVID-19, con el objetivo de reducir estancias prolongadas en el hospital y complicaciones mayores que requieran atención en la UCI31.
Además, es importante establecer un sistema de priorización de pacientes en lista de espera. El documento de la AEC de gestión para la vuelta a la normalidad recomienda la escala de puntuación adaptada de Pranchard et al. Así pacientes con una puntuación acumulada de 60 o menor, se considerarán idóneos para asumir el beneficio de la cirugía5.
En caso de limitación de recursos se planteará la posibilidad de derivación a otro centro.
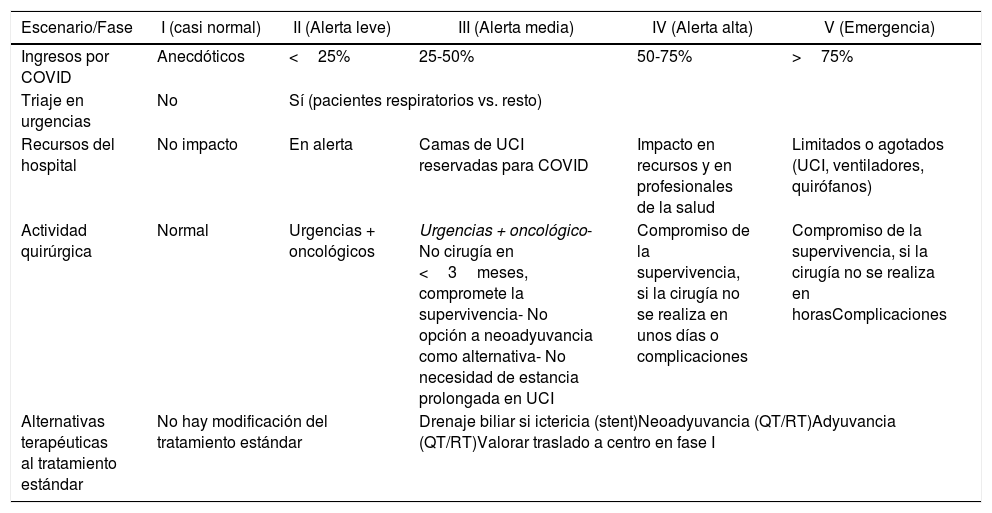
Escenarios/fases de pandemiaLa organización de la actividad quirúrgica oncológica32 vendrá determinada por el escenario de la pandemia en el que nos encontremos. La AEC propone una escala que define de modo dinámico 5 fases en la evolución de la pandemia COVID-19 (tabla 1), atendiendo al crecimiento o decrecimiento de la misma33.
Escenarios de la pandemia SARS-CoV-2
| Escenario/Fase | I (casi normal) | II (Alerta leve) | III (Alerta media) | IV (Alerta alta) | V (Emergencia) |
|---|---|---|---|---|---|
| Ingresos por COVID | Anecdóticos | <25% | 25-50% | 50-75% | >75% |
| Triaje en urgencias | No | Sí (pacientes respiratorios vs. resto) | |||
| Recursos del hospital | No impacto | En alerta | Camas de UCI reservadas para COVID | Impacto en recursos y en profesionales de la salud | Limitados o agotados (UCI, ventiladores, quirófanos) |
| Actividad quirúrgica | Normal | Urgencias + oncológicos | Urgencias + oncológico- No cirugía en <3meses, compromete la supervivencia- No opción a neoadyuvancia como alternativa- No necesidad de estancia prolongada en UCI | Compromiso de la supervivencia, si la cirugía no se realiza en unos días o complicaciones | Compromiso de la supervivencia, si la cirugía no se realiza en horasComplicaciones |
| Alternativas terapéuticas al tratamiento estándar | No hay modificación del tratamiento estándar | Drenaje biliar si ictericia (stent)Neoadyuvancia (QT/RT)Adyuvancia (QT/RT)Valorar traslado a centro en fase I | |||
En función de estas fases establecemos una serie de recomendaciones en el campo de la cirugía oncológica HBP, teniendo en cuenta el órgano afecto y el tipo de neoplasia.
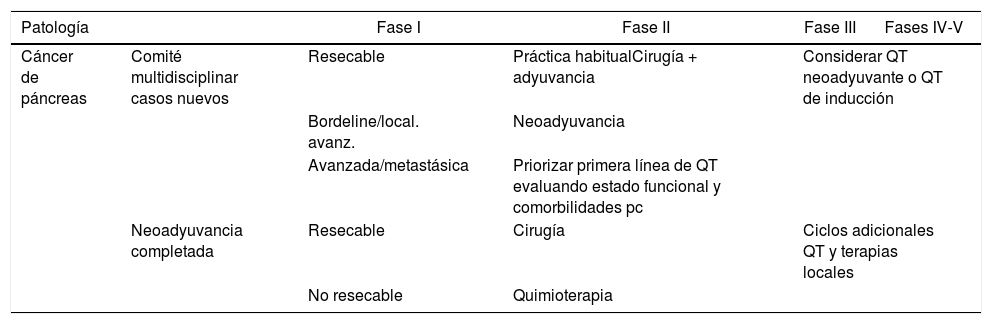
Recomendaciones terapéuticas para cirugía oncológica del páncreas y área periampularSe establecen las siguientes recomendaciones (tabla 2):
Recomendaciones de manejo del cáncer de páncreas según fases de la pandemia
| Patología | Fase I | Fase II | Fase III | Fases IV-V | |
|---|---|---|---|---|---|
| Cáncer de páncreas | Comité multidisciplinar casos nuevos | Resecable | Práctica habitualCirugía + adyuvancia | Considerar QT neoadyuvante o QT de inducción | |
| Bordeline/local. avanz. | Neoadyuvancia | ||||
| Avanzada/metastásica | Priorizar primera línea de QT evaluando estado funcional y comorbilidades pc | ||||
| Neoadyuvancia completada | Resecable | Cirugía | Ciclos adicionales QT y terapias locales | ||
| No resecable | Quimioterapia | ||||
Si el paciente presenta ictericia, plantear drenaje biliar.
Los pacientes que presenten ictericia obstructiva y se prevea una demora de la cirugía, se realizará drenaje biliar (endoscópico o percutáneo).
Cáncer de páncreas localizado/resecable34- •
Fases I-II: cirugía e inicio de quimioterapia adyuvante según protocolo habitual del centro35.
- •
Fases III-V: drenaje en presencia de ictericia o si se prevé la misma, aplazamiento de la cirugía siempre que sea posible hasta que el centro se encuentre en fase I-II. Tratamiento neoadyuvante y reevaluación para la cirugía tan pronto como sea posible o derivación a otro centro.
- •
Fases I-V: se planteará, en función del estado funcional y comorbilidad, un esquema neoadyuvante35. Se podrá plantear dependiendo del centro, tratamiento neoadyuvante con quimioterapia de inducción seguido de quimio-radioterapia (CRT), en función de la tolerancia/respuesta obtenida y lista de espera quirúrgica.
- •
Fases I-V: en función del estado funcional y comorbilidades, se priorizará el inicio de una primera línea de quimioterapia. El inicio de una segunda línea queda relegado a la situación funcional y respuesta/tolerancia de la primera línea.
Se recomienda posponer la cirugía de enfermedades pancreáticas premalignas, incluyendo las neoplasias mucinosas papilares intraductales (intraductal papillary mucinous neoplasm [IPMN]) y de pNET.
Las excepciones comprenden pNET sintomáticos sin opciones de tratamiento alternativas efectivas, o pNET o IPMN con sospecha de malignidad, en cuyo caso se debería actuar como un adenocarcinoma de páncreas resecable21.
Adenocarcinoma ampular y duodenalDebido a que la evidencia disponible hasta el momento sobre la eficacia de la quimioterapia neoadyuvante es limitada para este tipo de neoplasias y no se puede considerar como una enfermedad estable, se recomienda la resección quirúrgica, si la fase de la pandemia y los recursos sanitarios están disponibles.
En presencia de complicaciones, como hemorragia u obstrucción, se podría intentar el tratamiento endoscópico para el control de la hemorragia o la colocación de un stent duodenal para la obstrucción, hasta que se pueda realizar la intervención quirúrgica.
Recomendaciones terapéuticas para cirugía oncológica del colangiocarcinoma hiliarEste tipo de neoplasia, por su agresividad, va a requerir intervención quirúrgica en pocas semanas, debido al riesgo de progresión. En estos pacientes, el riesgo de progresión equivale al riesgo de muerte en el futuro cercano y se espera que el beneficio neto de la cirugía sea elevado36.
Si el paciente presenta ictericia se debe priorizar el drenaje biliar y/o embolización portal si lo precisa, para la preparación para la hepatectomía.
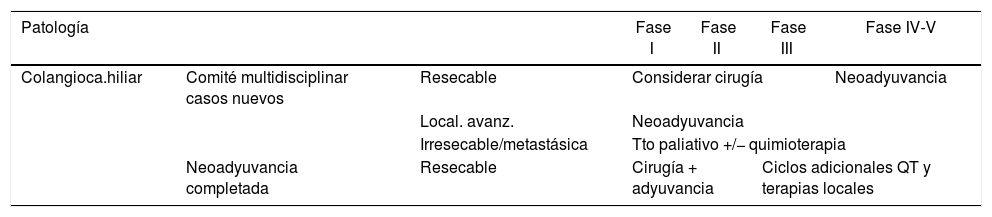
Colangiocarcinoma hiliar resecable (tabla 3)37- •
Fases I-III: es recomendable la cirugía, siempre que sea posible, con escaso beneficio de los tratamientos neoadyuvantes.
- •
Fases IV-V: tratamiento neoadyuvante en función del estado funcional y comorbilidades del paciente38.
Tabla 3.Recomendaciones de manejo del colangiocarcinoma hiliar según fases de la pandemia
Patología Fase I Fase II Fase III Fase IV-V Colangioca.hiliar Comité multidisciplinar casos nuevos Resecable Considerar cirugía Neoadyuvancia Local. avanz. Neoadyuvancia Irresecable/metastásica Tto paliativo +/− quimioterapia Neoadyuvancia completada Resecable Cirugía + adyuvancia Ciclos adicionales QT y terapias locales
Se recomienda terapia neoadyuvante independientemente de la fase si el estado funcional del paciente lo permite (tabla 3).
Colangiocarcinoma hiliar irresecable y/o metastásicoTratamiento paliativo (drenaje biliar) +/− tratamiento quimioterápico (tabla 3).
El trasplante hepático podría indicarse en casos muy seleccionados.
Recomendaciones terapéuticas para la cirugía del cáncer de vesícula biliarDebido a que la evidencia disponible hasta el momento sobre la eficacia de la quimioterapia neoadyuvante es limitada para este tipo de neoplasias, se recomienda la resección quirúrgica, si la fase de la pandemia y los recursos sanitarios están disponibles.
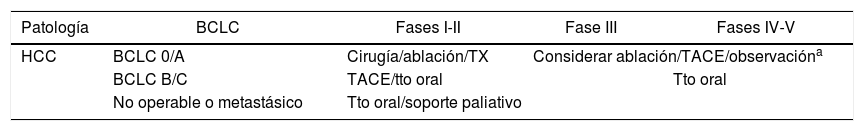
Recomendaciones terapéuticas para cirugía oncológica de hígadoHepatocarcinoma (HCC) (tabla 4)Siguiendo la clasificación de BCLC39 y dependiendo de la fase de alerta en la que se encuentre el centro se decidirá el tratamiento más adecuado, siempre consensuado en CM.
Recomendaciones de manejo del hepatocarcinoma según las fases de la pandemia
| Patología | BCLC | Fases I-II | Fase III | Fases IV-V |
|---|---|---|---|---|
| HCC | BCLC 0/A | Cirugía/ablación/TX | Considerar ablación/TACE/observacióna | |
| BCLC B/C | TACE/tto oral | Tto oral | ||
| No operable o metastásico | Tto oral/soporte paliativo | |||
- •
Fases I-II: cirugía/ablación/trasplante según el caso.
- •
Fases III-V: retrasar los tratamientos definitivos como la cirugía o el trasplante. Considerar ablación/ quimioembolización transarterial (TACE).
- •
Fases I-III: TACE/ tratamiento oral (sorafenib/regorafenib/cabozatinib).
- •
Fases IV-V: tratamientos orales.
Para garantizar la protección de los receptores de trasplante, se recomienda cribado microbiológico universal de receptores y donantes en el momento del trasplante. Se descartarán aquellos receptores con alta sospecha tras el screening clínico o PCR positiva40. Teniendo en cuenta que el escenario de la pandemia es cambiante con el tiempo, las directrices a seguir, respecto a los trasplantes hepáticos, vienen marcadas por la información aportada por la Organización Nacional de Trasplantes (ONT), que se va actualizando de manera periódica.
Colangiocarcinoma intrahepático resecable- •
Fases I-II: cirugía /ablación.
- •
Fases III-V: ablación y retraso de tratamientos definitivos.
En cualquiera de las fases: soporte paliativo/ tratamiento oral, individualizando los casos.
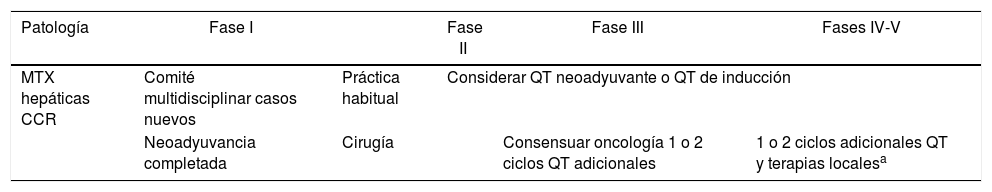
Metástasis hepáticas de cáncer colorrectal (MHCCR) (tabla 5)En la práctica habitual, el tratamiento de los pacientes con metástasis hepáticas se debe planear en CM, debido a la complejidad de esta patología y la cantidad de servicios implicados en el manejo de los mismos. En esta situación excepcional de pandemia, con mayor motivo han de evaluarse minuciosamente y de manera individualizada los casos.
Recomendaciones de manejo de las metástasis hepáticas de cáncer colorrectal según las fases de la pandemia
| Patología | Fase I | Fase II | Fase III | Fases IV-V | |
|---|---|---|---|---|---|
| MTX hepáticas CCR | Comité multidisciplinar casos nuevos | Práctica habitual | Considerar QT neoadyuvante o QT de inducción | ||
| Neoadyuvancia completada | Cirugía | Consensuar oncología 1 o 2 ciclos QT adicionales | 1 o 2 ciclos adicionales QT y terapias localesa | ||
La combinación de terapia sistémica y resección quirúrgica cuenta con la mayor supervivencia en este tipo de patología. Además, se pueden aplicar diferentes métodos de ablación local (radiofrecuencia, microondas, radioterapia, etc.) en casos seleccionados.
Existen diferentes esquemas de quimioterapia en relación con la cirugía, como son: quimioterapia neoadyuvante, de inducción o conversión, perioperatoria o adyuvante, que siempre deben ser consensuados41–44.
En esta situación de pandemia el esquema «cirugía+adyuvancia» como primera opción, especialmente en los escenarios de alerta de II a V, se deberá evitar o reconsiderar, ya que los recursos sanitarios van a estar mermados (quirófanos, respiradores, etc.), así como por el riesgo elevado de contagio para el paciente en el periodo perioperatorio. Por lo tanto, se optará por esquemas de quimioterapia y cirugía.
En el escenario o fase de alerta I, no habrá modificaciones a la hora de la toma de decisiones en los esquemas de quimioterapia y cirugía.
Neoadyuvancia completada en MHCCREn los casos en que el paciente haya completado la neoadyuvancia y se encuentre a la espera de la cirugía, tendrá un periodo ventana de 6-8 semanas en los que la cirugía podrá planificarse7,45,46, sin que el paciente pierda la oportunidad potencial de cura. Así pues, dependiendo del nivel de alerta en el que se encuentre el centro, planificaremos la cirugía (tabla 5) consensuándolo en CM.
- •
Fases I-II: cirugía.
- •
Fase III: valorar con oncología la posibilidad de añadir uno o 2 ciclos adicionales, tiempo para que lo peor de la crisis haya pasado y se minimice al máximo el riesgo de contagio para el paciente.
- •
Fases IV-V: como en nivel III y/o terapias locales en pacientes potencialmente curables.
En este momento de pandemia por SARS-CoV-2 es necesario generar una planificación de la cirugía oncológica HBP atendiendo a los diferentes escenarios evolutivos en que se encuentre el centro, con el objetivo de proteger a pacientes y profesionales de la infección COVID-19, sin que ello vaya en detrimento del tratamiento neoplásico que requiera el paciente.
En general, se entiende que la cirugía oncológica HBP por su complejidad podría precisar modificar su planificación, especialmente en fases III-V de pandemia. En estos casos se plantean alternativas terapéuticas puente mientras dure la situación.
Los resultados derivados de la aplicación de estas recomendaciones podrán ser valorados en futuros análisis puestos en marcha desde la sección HBP de la AEC, que pretenden evaluar el impacto de la pandemia en las unidades HBP y la aplicación de los protocolos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Jose M. Balibrea (Hospital Clínic de Barcelona, Universitat de Barcelona), Inés Rubio Pérez (Hospital Universitario La Paz, Madrid), Josep M. Badia (Hospital General de Granollers, Universitat Internacional de Catalunya, Barcelona), Esteban Martín-Antona (Hospital Clínico San Carlos, Madrid), Estíbaliz Alvarez Peña (Hospital General de Granollers, Universitat Internacional de Catalunya, Barcelona), Alejandra García-Botella (Hospital Clínico San Carlos, Madrid), Mario Alvarez Gallego (Hospital General de Granollers, Universitat Internacional de Catalunya, Barcelona), Elena Martín Pérez (Hospital Universitario de la Princesa, Madrid), Sagrario Martínez Cortijo (Hospital Fundación de Alcorcón, Madrid), Isabel Pascual Miguelañez (Hospital General de Granollers, Universitat Internacional de Catalunya, Barcelona), Lola Pérez Díaz (Hospital Gregorio Marañón, Madrid), Jose Luis Ramos Rodriguez (Hospital Universitario de Getafe, Madrid), Eloy Espin Basany (Hospital Vall d’Hebron, Barcelona), Raquel Sánchez Santos (Complejo Hospitalario de Vigo, Vigo),Victoriano Soria Aledo (Hospital Morales Messeguer, Murcia), Xavier Guirao Garriga (Hospital Universitario Parc Taulí, Barcelona), Jose Manuel Aranda Nárvaez (Hospital Regional Universitario Carlos Haya, Málaga) y Salvador Morales-Conde (Hospital Universitario Virgen del Rocío, Sevilla).