La gastrectomía vertical (GV) es una técnica segura y eficaz que ha demostrado excelentes resultados en relación con la pérdida ponderal y la resolución o mejoría de las comorbilidades más comunes asociadas a la obesidad a largo plazo. Sin embargo, una de las mayores preocupaciones en torno a ella es su presumible condición reflujogénica, no del todo tipificada. Cuestiones como «¿cuál es la historia natural del reflujo gastroesofágico (RGE) en el paciente intervenido de un sleeve gástrico?», «¿cuántos pacientes tras una GV desarrollarán RGE?» y «¿cuántos empeoraran su reflujo previo tras la realización de esta técnica?» pretenden ser abordadas en el presente artículo. Se ha efectuado una revisión sistemática siguiendo las recomendaciones Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA), utilizando diversas bases de datos, para intentar dar una respuesta a las anteriores preguntas.
Sleeve gastrectomy is a safe and effective bariatric surgery in terms of weight loss and long-term improvement or resolution of comorbidities. However, its achilles heel is the possible association with the development with the novo and/or worsening of pre-existing gastroesophageal reflux disease. The anatomical and mechanical changes that this technique induces in the esophagogastric junction, support or contradict this hypothesis. Questions such as «what is the natural history of gastroesophageal reflux in the patient undergoing gastric sleeve surgery?», «how many patients after vertical gastrectomy will develop gastroesophageal reflux?» and «how many patients will worsen their previous reflux after this technique?» are intended to be addressed in the present article.
La gastrectomía vertical (GV), sleeve gástrico o manga gástrica es el procedimiento de cirugía bariátrica más comúnmente realizado a nivel global1–3. Se ha consolidado como técnica primaria por su seguridad y eficacia, en lo que respecta a la pérdida de peso como a la mejoría o resolución de comorbilidades asociadas a la obesidad a largo plazo4–9. Sin embargo, su talón de Aquiles es su posible vínculo con el desarrollo de reflujo gastroesofágico (RGE) de novo o el empeoramiento del reflujo persistente. La modificación de los mecanismos fisiopatológicos y anatómicos que la técnica ocasiona, tanto sostienen como contradicen esta teoría.
Se han descrito dos clases de factores como responsables principales de la aparición de RGE tras la realización de una GV: aquellos derivados de las modificaciones anatómicas ocasionadas por la técnica quirúrgica y los que obedecen a complicaciones mecánicas. La reducción del volumen gástrico, la resección completa del fundus y la disección de las fibras de la unión esofagogástrica que comprometen la eficiencia del esfínter esofágico inferior (EEI) podrían incrementar la exposición de ácido al esófago10. A su vez, complicaciones posoperatorias mecánicas como la estenosis o la torsión (twist) del tubular11, estarían relacionadas con la aparición de síntomas vinculados con el reflujo.
Por otra parte, la obesidad es, a su vez, uno de los principales factores de riesgo independientes para el desarrollo de RGE. Se sabe que el sobrepeso incrementa de 1,2 a tres veces el reflujo patológico y en pacientes obesos la prevalencia es de 37 hasta 72%, además, estudios funcionales han demostrado que por cada aumento de 5 kg/m2 en el índice de masa corporal (IMC), se incrementa tres puntos en la escala de DeMeester. Esta relación entre el binomio RGE- obesidad puede ser explicada por algunos cambios fisiológicos inducidos por esta patología, como son el aumento de la presión intraabdominal, la alteración de la morfología de la unión gastroesofágica, la presencia de un EEI disfuncional, la elevación de la presión intragástrica, la alteración asociada de la motilidad esofágica y la mayor frecuencia de hernia hiatal. De manera que la pérdida de peso podría repercutir en la mejora de los síntomas de RGE12–14.
Se desconoce la magnitud real del impacto que genera la GV sobre el desarrollo o evolución de la enfermedad por reflujo gastroesofágico (ERGE). La escasez actual de estudios homogéneos, adecuadamente diseñados, que incluyan exploraciones endoscópicas y funcionales (manometría, pHmetría esofágica de 24 horas, impedanciometría o gammagrafía de vaciamiento) que correlacionen los hallazgos obtenidos con la clínica previa y posterior a la intervención, no permiten obtener conclusiones sólidas (dando lugar, incluso, a resultados contradictorios).
Cuestiones como «¿cuál es la historia natural del RGE en el paciente intervenido de un sleeve gástrico?», «¿cuántos pacientes tras una GV desarrollarán RGE?» y «¿cuántos empeorarán su reflujo previo tras la realización de esta técnica?» pretenden ser abordadas en el presente artículo.
MétodosEstrategia de búsquedaLa revisión sistemática de la literatura ha sido realizada según las recomendaciones Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)15. Se han efectuado búsquedas bibliográficas de estudios publicados hasta septiembre de 2022 en las bases de datos MEDLINE (PubMed), EMBASE y Cochrane Library, utilizando determinadas palabras clave y términos MeSH (medical subject headings) (tabla 1). La búsqueda, su selección y análisis posterior se llevaron a cabo de forma independiente por dos de los autores: S. Fernández-Ananín y E.M. Targarona, y las diferencias entre ellos se sometieron al criterio independiente de un tercer autor (C. Balagué Ponz).
Palabras clave y términos MeSH utilizados en la búsqueda de las bases de batos MEDLINE (PubMed), EMBASE y Cochrane Library
| Palabras clave y términos MeSH |
| «Sleeve» AND «reflux» |
| «Sleeve» AND «GERD» |
| «Sleeve» AND «gastroesophageal reflux» |
| «Sleeve» AND «esophagitis» |
| «Sleeve» AND «Barrett» |
| «Sleeve gastrectomy» AND «reflux» |
| «Sleeve gastrectomy» AND «GERD» |
| «Sleeve gastrectomy» AND «gastroesophageal reflux» |
| «Sleeve gastrectomy» AND «esophagitis» |
| «Sleeve gastrectomy» AND «Barrett» |
| «Laparoscopic sleeve gastrectomy» AND «reflux» |
| «Laparoscopic sleeve gastrectomy» AND «GERD» |
| «Laparoscopic sleeve gastrectomy» AND «gastroesophageal reflux» |
| «Laparoscopic sleeve gastrectomy» AND «esophagitis» |
| «Laparoscopic sleeve gastrectomy» AND «Barrett» |
Los datos extraídos y analizados de cada artículo fueron los siguientes: tamaño de la muestra, edad media, IMC medio, presencia de sintomatología de reflujo previa y posterior a la cirugía, pruebas endoscópicas y funcionales (manometría, pHmetría) antes y tras la cirugía baríatrica, necesidad de medicación con fármacos inhibidores de la bomba de protones (IBP), aspectos técnicos de la GV (tamaño de sonda Foucher, distancia del primer disparo de endograpadora al píloro) y tiempo de seguimiento (meses).
La aprobación del Comité de Ética de nuestra institución y el consentimiento informado de los pacientes no fue necesaria para la realización de esta revisión sistemática.
Objetivos del estudioEl objetivo primario del estudio fue determinar la incidencia de reflujo, esofagitis y desarrollo de Barrett tras la realización de una GV. Como objetivos secundarios, se analizaron aquellos artículos que documentaban el diagnóstico de RGE previo a la GV, el porcentaje de pacientes que presentaron empeoramiento de este tras la GV, la posible relación existente con las variaciones técnicas y estudios de calidad de vida.
Criterios de elegibilidadLos criterios de inclusión de los artículos fueron los siguientes: 1) artículos que analizan la relación entre GV y RGE; 2) estudios tanto unicéntricos como multicéntricos; 3) publicaciones con más de 50 pacientes y 4) trabajos que no cumplieran ninguno de los criterios de exclusión.
Como criterios de exclusión se contemplaron: 1) casos clínicos o vídeos; 2) editoriales, comentarios de artículos o cartas al editor; 3) estudios con menos de 50 pacientes; 4) revisiones sistemáticas y metaanálisis; 5) artículos redactados en otro idioma diferente al inglés; 6) aquellos trabajos que involucran a niños, adolescentes o animales; 7) aquellos que comparan la GV con otra técnica de cirugía bariátrica y 8) artículos en los que se combinan la GV con otras técnicas que involucran el hiato o la unión esófago-gástrica (cruroplastia, funduplicaturas).
En el caso de que un mismo autor o grupo hubiese publicado más de un artículo que comprendiera a una misma serie, se incluyó en el análisis el más reciente, siendo el resto rechazados.
Aquellos estudios que incluyeron en su evaluación datos relacionados con la sintomatología de RGE, exploraciones endoscópicas y pruebas funcionales pre y posoperatorios, así como su evolución se denominó «grupo completo». El resto de los trabajos fueron clasificados como «grupo incompleto».
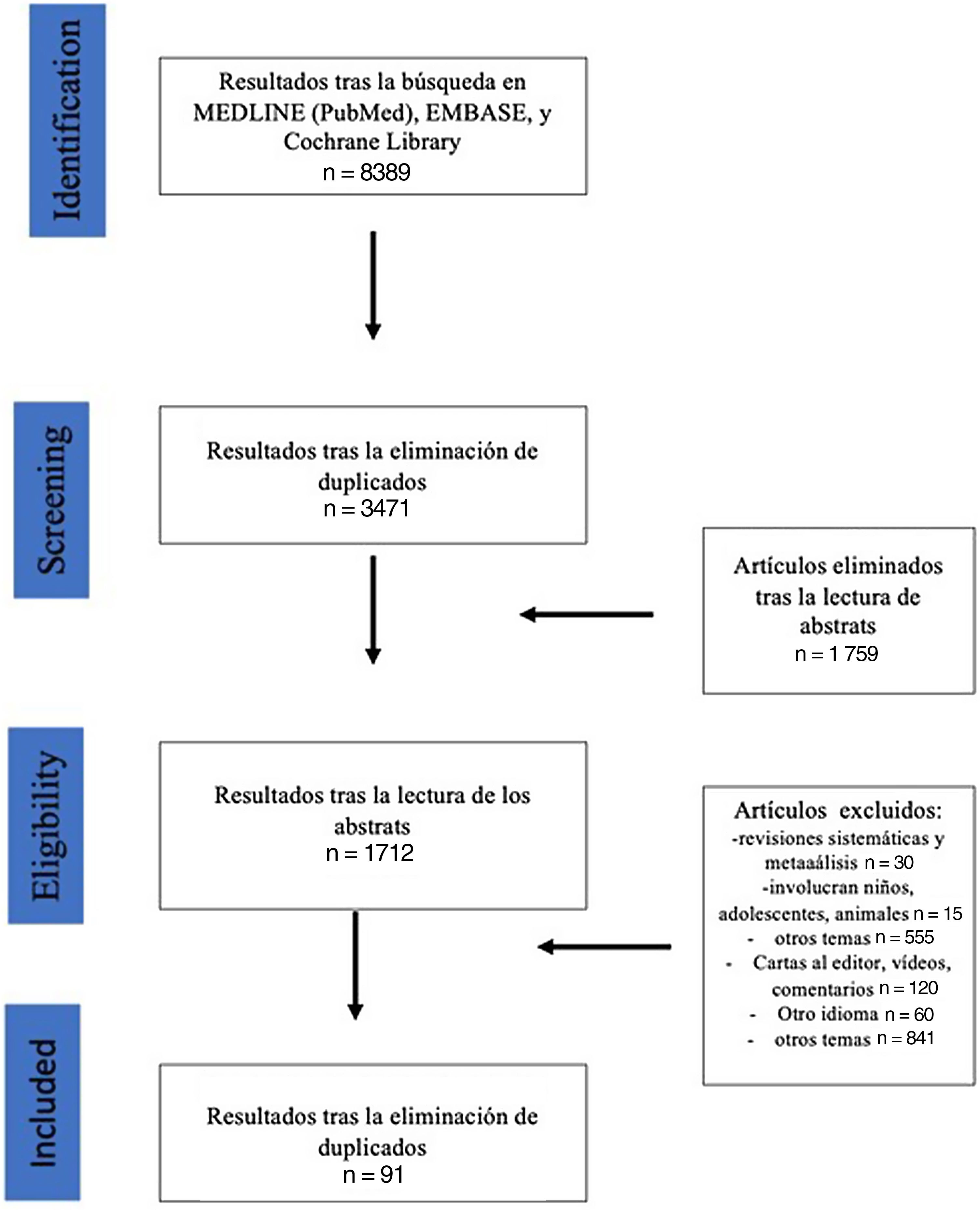
ResultadosLa búsqueda bibliográfica mostró un total de 8.389 artículos. Tras la eliminación de los duplicados y aquellos que cumplían los criterios de exclusión, se incluyeron finalmente 91 trabajos (fig. 1 y tabla 2). Siguiendo los criterios definidos en el apartado métodos, siete artículos fueron considerados completos.
Referencia de los 91 trabajos revisados
| Autor | Año de publicación | Título | n pacientes |
|---|---|---|---|
| Cottam, et al.16 | 2006 | Laparoscopic sleeve gastrectomy as an initial weight-loss procedure for high-risk patients with morbid obesity | 126 |
| Weiner et al.17 | 2007 | Laparoscopic sleeve gastrectomy--influence of sleeve size and resected gastric volume | 120 |
| Arias et al.18 | 2009 | Mid-term follow-up after sleeve gastrectomy as a final approach for morbid obesity | 130 |
| Himpens et al.19 | 2010 | Long-term results of laparoscopic sleeve gastrectomy for obesity | 53 |
| Menenakos et al.20 | 2010 | Laparoscopic sleeve gastrectomy performed with intent to treat morbid obesity: a prospective single-center study of 261 patients with a median follow-up of 1 year | 120 |
| Lakdawala et al.21 | 2010 | Comparison between the results of laparoscopic sleeve gastrectomy and laparoscopic Roux-en-Y gastric bypass in the Indian population: a retrospective 1 year study | 50 |
| Keidar et al.22 | 2010 | Dilated upper sleeve can be associated with severe postoperative gastroesophageal dysmotility and reflux | 706 |
| Carter et al.23 | 2011 | Association between gastroesophageal reflux disease and laparoscopic sleeve gastrectomy | 176 |
| Chopra et al.24 | 2012 | Laparoscopic sleeve gastrectomy for obesity: can it be considered a definitive procedure? | 185 |
| Zhang et al.25 | 2013 | Reduction in obesity-related comorbidities: is gastric bypass better than sleevegastrectomy? | 200 |
| Carabotti et al.26 | 2013 | Impact of laparoscopic sleeve gastrectomy on upper gastrointestinal symptoms | 74 |
| Catheline et al.27 | 2013 | Five-year results of sleeve gastrectomy | 65 |
| Kehagias et al.28 | 2013 | Efficacy of sleeve gastrectomy as sole procedure in patients with clinically severe obesity (BMI ≤50 kg/m(2)) | 208 |
| Tai et al.29 | 2013 | Increase in gastroesophageal reflux disease symptoms and erosive esophagitis 1 year after laparoscopic sleeve gastrectomy among obese adults | 66 |
| Rawlins et al.30 | 2013 | Sleeve gastrectomy: 5-year outcomes of a single institution | 55 |
| Abd Ellatif et al.31 | 2014 | Long term predictors of success after laparoscopic sleeve gastrectomy | 1395 |
| Boza et al.32 | 2014 | Long-term outcomes of laparoscopic sleeve gastrectomy as a primary bariatric procedure | 112 |
| Santonicola et al.33 | 2014 | The effect of laparoscopic sleeve gastrectomy with or without hiatal hernia repair on gastroesophageal reflux disease in obese patients | 102 |
| Kular et al.34 | 2014 | Analysis of the five-year outcomes of sleeve gastrectomy and mini gastric bypass: a report from the Indian sub-continent | 76 |
| Våge et al.35 | 2014 | Changes in obesity-related diseases and biochemical variables after laparoscopic sleeve gastrectomy: a two-year follow-up study | 117 |
| Daes et al.36 | 2014 | Laparoscopic sleeve gastrectomy: symptoms of gastroesophageal reflux can be reduced by changes in surgical technique | 382 |
| DuPree et al.37 | 2014 | Laparoscopic sleeve gastrectomy in patients with preexisting gastroesophageal reflux disease: a national analysis | 4836 |
| Rebecchi et al.38 | 2014 | Gastroesophageal reflux disease and laparoscopic sleeve gastrectomy: a physiopathologic evaluation | 71 |
| Toro et al.39 | 2014 | Association of radiographic morphology with early gastroesophageal reflux disease and satiety control after sleeve gastrectomy | 100 |
| Gibson et al.40 | 2015 | Laparoscopic sleeve gastrectomy: review of 500 cases in single surgeon Australian practice | 500 |
| Sheppard et al.41 | 2015 | Rates of reflux before and after laparoscopic sleeve gastrectomy for severe obesity | 205 |
| Gorodner et al.42 | 2015 | Does laparoscopic sleeve gastrectomy have any influence on gastroesophageal reflux disease? Preliminary results | 119 |
| Lyon et al.43 | 2015 | Gastroesophageal reflux in laparoscopic sleeve gastrectomy: hiatal findings and their management influence outcome | 262 |
| Sucandy et al.44 | 2015 | Reflux Symptoms After Laparoscopic Sleeve Gastrectomy for Morbid Obesity. The Importance of Preoperative Evaluation and Selection | 131 |
| Thereaux et al.45 | 2016 | pH monitoring of gastro-oesophageal reflux before and after laparoscopic sleeve gastrectomy | 89 |
| Angrisani et al.46 | 2016 | Five-year results of laparoscopic sleeve gastrectomy: effects on gastroesophageal reflux disease symptoms and co-morbidities | 61 |
| Albanopoulos et al.47 | 2016 | The impact of laparoscopic sleeve gastrectomy on weight loss and obesity-associated comorbidities: the results of 3 years of follow-up | 88 |
| Hendricks et al.48 | 2016 | Impact of sleeve gastrectomy on gastroesophageal reflux disease in a morbidly obese population undergoing bariatric surgery | C |
| Lemaître et al.49 | 2016 | Laparoscopic sleeve gastrectomy in the South Pacific. Retrospective evaluation of 510 patients in a single institution | 494 |
| Pok et al.50 | 2016 | Laparoscopic sleeve gastrectomy in Asia: Long term outcome and revisional surgery | 61 |
| Mion et al.51 | 2016 | 3 High-resolution Impedance Manometry after Sleeve Gastrectomy: Increased Intragastric Pressure and Reflux are Frequent Events | 53 |
| Arman et al.52 | 2016 | Long-term (11+years) outcomes in weight, patient satisfaction, comorbidities, and gastroesophageal reflux treatment after laparoscopic sleeve gastrectomy | 65 |
| Chuffart et al.53 | 2017 | Long-Term Results After Sleeve Gastrectomy for Gastroesophageal Reflux Disease: a Single-Center French Study | 64 |
| Nocca et al.54 | 2017 | Five-year results of laparoscopic sleeve gastrectomy for the treatment of severe obesity | 1050 |
| Yormaz et al.55 | 2017 | Midterm Clinical Outcomes of Antrum Resection Margin at Laparoscopic Sleeve Gastrectomy for Morbid Obesity | 152 |
| Valezi et al.56 | 2017 | Preoperative manometry for the selection of obese people candidate to sleeve gastrectomy | 73 |
| Attia et al.57 | 2017 | Laparoscopic Sleeve Gastrectomy and Crural Repair as a Treatment of Morbid Obesity Associated with Gastroesophageal Reflux | 53 |
| Gadiot et al.58 | 2017 | Long-Term Results of Laparoscopic Sleeve Gastrectomy for Morbid Obesity: 5 to 8-Year Results | 272 |
| Dakour Aridi et al.59 | 2017 | Gastroesophageal Reflux Disease After Laparoscopic Sleeve Gastrectomywith Concomitant Hiatal Hernia Repair: an Unresolved Question | 165 |
| Garg et al.60 | 2017 | Mid to long term outcomes of Laparoscopic Sleeve Gastrectomy in Indian population: 3-7 year results - A retrospective cohort study | 424 |
| Genco et al.61 | 2017 | Gastroesophageal reflux disease and Barrett's esophagus after laparoscopic sleeve gastrectomy: a possible, underestimated long-term complication | 110 |
| Viscido et al.62 | 2017 | Laparoscopic Sleeve Gastrectomy: Endoscopic Findings and Gastroesophageal Reflux Symptoms at 18-Month Follow-Up | 109 |
| Barr et al.63 | 2017 | GERD and acid reduction medication use following gastric bypass and sleevegastrectomy | 147 |
| Berry et al.13 | 2018 | Sleeve Gastrectomy Outcomes in Patients with BMI Between 30 and 35-3 Years of Follow-Up | 252 |
| Castagneto-Gissey et al.64 | 2018 | Sleeve gastrectomy and gastroesophageal reflux: a comprehensiveendoscopic and pH-manometric prospective study | 182 |
| Chang et al.65 | 2018 | Thirteen-Year Experience of Laparoscopic Sleeve Gastrectomy: Surgical Risk, Weight Loss, and Revision Procedures | 1759 |
| Althuwaini et al.66 | 2018 | Prevalence and Predictors of Gastroesophageal Reflux Disease After Laparoscopic Sleeve Gastrectomy | 213 |
| Felsenreich et al.67 | 2018 | Update: 10 Years of Sleeve Gastrectomy-the First 103 Patients | 53 |
| Flølo et al.68 | 2018 | Five-Year Outcomes After Vertical Sleeve Gastrectomy for Severe Obesity: A Prospective Cohort Study | 168 |
| Kowalewski et al.69 | 2018 | Long-Term Outcomes of Laparoscopic Sleeve Gastrectomy-a Single Center, Retrospective Study | 120 |
| Singla et al.70 | 2018 | Outcomes in Super Obese Patients Undergoing Laparoscopic Sleeve Gastrectomy | 123 |
| Świdnicka-Siergiejko et al.71 | 2018 | Esophageal pH and impedance reflux parameters in relation to body mass index, obesity-related hormones, and bariatric procedures | 53 |
| Peterli et al.72 | 2018 | Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss in Patients with Morbid Obesity: The SM-BOSS Randomized Clinical Trial | 107 |
| Soricelli et al.73 | 2018 | Lack of correlation between gastroesophageal reflux disease symptoms and esophageal lesions after sleeve gastrectomy | 144 |
| Alhaj Saleh et al.74 | 2018 | Does Sleeve Shape Make a Difference in Outcomes? | 199 |
| Sebastianelli et al.75 | 2019 | Systematic Endoscopy 5 Years After Sleeve Gastrectomy Results in a High Rate of Barrett's Esophagus: Results of a Multicenter Study | 90 |
| Csendes et al.76 | 2019 | Endoscopic, and Histologic Findings at the Distal Esophagus and Stomach Before and Late (10.5 Years) After Laparoscopic Sleeve Gastrectomy: Results of a Prospective Study with 93% Follow-Up | 104 |
| Signorini et al.77 | 2020 | Esophagitis evolution after sleeve gastrectomy or gastric bypass in consecutive cases | 147 |
| Pilone et al.78 | 2019 | Gastroesophageal Reflux After Sleeve Gastrectomy: New Onset and Effect on Symptoms on a Prospective Evaluation | 104 |
| Braghetto et al.79 | 2019 | Late esophagogastric anatomic and functional changes after sleevegastrectomy and its clinical consequences with regards to gastroesophageal reflux disease | 315 |
| Lim et al.80 | 2019 | Correlation Between Symptomatic Gastro-Esophageal Reflux Disease (GERD) and Erosive Esophagitis (EE) Post-vertical Sleeve Gastrectomy (VSG) | 63 |
| Van Wieren et al.81 | 2019 | The influence of gastroesophageal reflux symptoms on patient satisfaction after sleeve gastrectomy | 6608 |
| Borbély et al.82 | 2019 | De novo gastroesophageal reflux disease after sleeve gastrectomy: role of preoperative silent reflux | 222 |
| Lye et al.83 | 2020 | Small hiatal hernia and postprandial reflux after vertical sleeve gastrectomy: A multiethnic Asian cohort | 255 |
| Emile et al.84 | 2020 | Helicobacter pylori, Sleeve Gastrectomy, and Gastroesophageal Reflux Disease; Is there a Relation? | 176 |
| Lim et al.85 | 202 | Diagnostic Criteria for Gastro-esophageal Reflux Following Sleeve Gastrectomy | 124 |
| Sun et al.86 | 2020 | Effect of sleeve gastrectomy on gastroesophageal reflux in patients with metabolic syndrome | 60 |
| Varban et al.87 | 2020 | Surgeon variation in severity of reflux symptoms after sleeve gastrectomy | 2294 |
| Janik et al.88 | 2020 | Safety of concurrent sleeve gastrectomy and hiatal hernia repair: a propensity score-matched analysis of the MBSAQIP registry | 101902 |
| Gemici et al.89 | 2020 | Outcomes of laparoscopic sleeve gastrectomy by means of esophageal manometry and pH-metry, before and after surgery | 62 |
| Greilsamer et al.90 | 2020 | Hypotonic Esophageal Sphincter Is Not Predictive of Gastroesophageal Reflux Disease After Sleeve Gastrectomy | 69 |
| Johari et al.91 | 2021 | Mechanisms of Esophageal and Gastric Transit Following Sleeve Gastrectomy | 143 |
| Silveira et al.92 | 2021 | The Effect of Laparoscopic Sleeve Gastrectomy on Gastroesophageal Reflux Disease | 191 |
| Lallemand et al.93 | 2021 | Does Sleeve Gastrectomy Increase the Risk of Barrett's Esophagus? | 59 |
| ElKassem et al.94 | 2021 | Gastroesophageal Reflux Disease, Esophagitis, and Barrett's Esophagus 3 to 4 Years Post Sleeve Gastrectomy | 58 |
| Dalboh et al.95 | 2021 | Impact of Laparoscopic Sleeve Gastrectomy on Gastroesophageal Reflux Disease and Risk Factors Associated with Its Occurrence Based Upon Quality of Life | 326 |
| Quintero et al.96 | 2021 | Evaluation of gastroesophageal reflux after standardized gastric sleeve with the Gastroesophageal Reflux Disease Questionnaire (GerdQ) | 129 |
| Chhabra et al.97 | 2021 | Associations Between Video Evaluations of Surgical Technique and Outcomes of Laparoscopic Sleeve Gastrectomy | 6915 |
| Summe et al.98 | 2021 | Can lower preoperative 48-hour pH score predict reflux resolution after sleeve gastrectomy | 70 |
| Abu Sneineh et al.99 | 2021 | Sleeve Gastrectomy Is the Most Common Cause of Gastroesophageal Reflux Disease in Comparison with Other Bariatric Operations | 218 |
| Guetter et al.100 | 2021 | Predictive Factors of Gastroesophageal Reflux Disease Symptoms Following Open Sleeve Gastrectomy in Brazil Using Clinical Questionnaire | 189 |
| Soliman et al.101 | 2021 | Do Preoperative Esophageal pH Monitoring and High-Resolution Manometry Predict Symptoms of GERD After Sleeve Gastrectomy? | 160 |
| Li et al.102 | 2022 | Post Sleeve Reflux: indicators and impact on outcomes | 392 |
| Almutairi et al.103 | 2022 | Gastroesophageal Reflux Disease and Hiatal Hernia After Laparoscopic Sleeve Gastrectomy: A Retrospective Cohort Study | 142 |
| Tomasicchio et al.104 | 2022 | Gastroesophageal reflux after sleeve gastrectomy. Fact or fiction? | 52 |
| Sancho Moya et al.105 | 2022 | The Impact of Sleeve Gastrectomy on Gastroesophageal Reflux Disease in Patients with Morbid Obesity | 52 |
El número total de pacientes analizados fue de 140.387, con una media de edad de 41,64 ± 3,67 años y de IMC 44,4 ± 6,49 (R 32,3-60,7). La media de tiempo de seguimiento fue de 39,67 ± 34,58 meses (R 1-147), siendo este dato referido en 93,4% (n = 85) de los artículos.
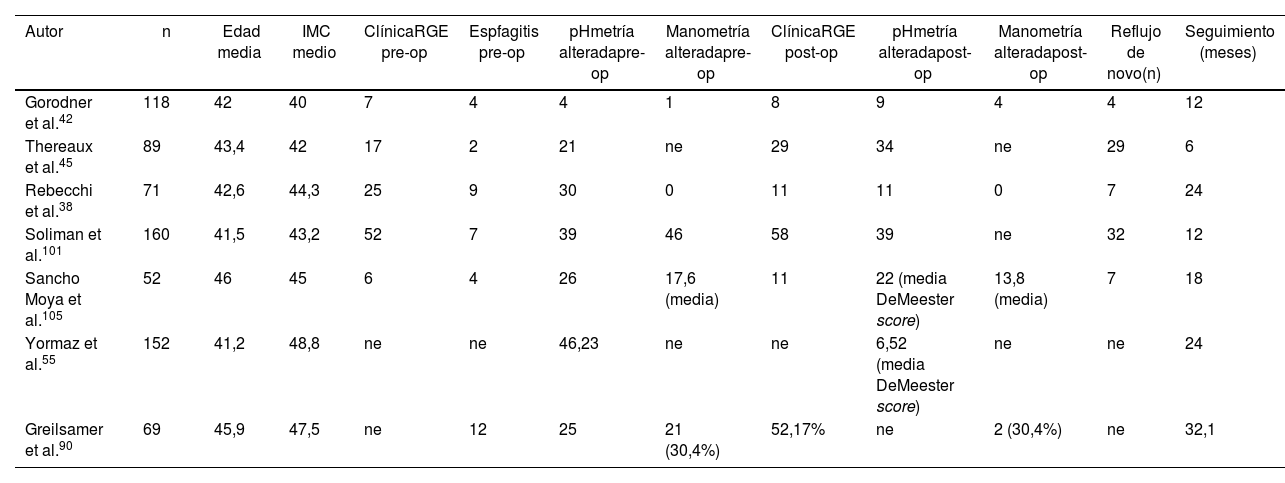
Resultados del grupocompletoEstos siete artículos definidos38,42,45,55,90,101,105 como completos incluyeron un total de 711 pacientes. La edad media fue de 43,22 años (desviación estándar [DE] 2,82), el IMC medio de 44,4 (DE 2,51) y el tiempo medio de seguimiento de 18,3 meses (R 6-32,1). De estos siete trabajos, cinco de ellos38,42,45,101,105 detallan y correlacionan datos clínicos y funcionales antes y después de la GV. De 490 pacientes, 107 presentaban clínica preoperatoria de reflujo esofagogástrico y en 26 de ellos la fibrogastroscopia (FGC) preoperatoria evidenció esofagitis (clasificada como grado A en n = 10 y grado C n = 1, en el resto de los sujetos no se especificó el tipo). La pHmetría de 24 horas previa a la cirugía mostró un índice de DeMeester alterado (> 14,3) en 83 enfermos y la manometría una presión disminuida del EEI en 47 pacientes. A los 18,3 meses (R 6-32,1) de media de seguimiento, 16,1% (n = 79) de los individuos desarrolló reflujo de novo. Las personas afectas de clínica de reflujo preoperatorio fueron 107 y 117 las que presentaron reflujo posoperatorio, suponiendo un incremento de 1% tras el sleeve gástrico en relación con el número total de pacientes (n = 711) (tabla 3).
Artículos incluidos en el «grupo completo»
| Autor | n | Edad media | IMC medio | ClínicaRGE pre-op | Espfagitis pre-op | pHmetría alteradapre-op | Manometría alteradapre-op | ClínicaRGE post-op | pHmetría alteradapost-op | Manometría alteradapost-op | Reflujo de novo(n) | Seguimiento (meses) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gorodner et al.42 | 118 | 42 | 40 | 7 | 4 | 4 | 1 | 8 | 9 | 4 | 4 | 12 |
| Thereaux et al.45 | 89 | 43,4 | 42 | 17 | 2 | 21 | ne | 29 | 34 | ne | 29 | 6 |
| Rebecchi et al.38 | 71 | 42,6 | 44,3 | 25 | 9 | 30 | 0 | 11 | 11 | 0 | 7 | 24 |
| Soliman et al.101 | 160 | 41,5 | 43,2 | 52 | 7 | 39 | 46 | 58 | 39 | ne | 32 | 12 |
| Sancho Moya et al.105 | 52 | 46 | 45 | 6 | 4 | 26 | 17,6 (media) | 11 | 22 (media DeMeester score) | 13,8 (media) | 7 | 18 |
| Yormaz et al.55 | 152 | 41,2 | 48,8 | ne | ne | 46,23 | ne | ne | 6,52 (media DeMeester score) | ne | ne | 24 |
| Greilsamer et al.90 | 69 | 45,9 | 47,5 | ne | 12 | 25 | 21 (30,4%) | 52,17% | ne | 2 (30,4%) | ne | 32,1 |
ne: dato no especificado en el artículo.
Solo 20 artículos (21,7% de los trabajos estudiados) (n = 10.360) proporcionaron la cifra de pacientes con reflujo de novo tras GV (n = 823; 7,9%). La media de tiempo de seguimiento de estos sujetos fue de 46,51 meses (R 6-126)13,22,24,29,30,32,33,37,42,48,50,59,60,64,65,69,70,76,83,105.
Un total de 55 artículos (60,43%) recogieron síntomas de RGE antes de la cirugía y después de la misma. En 30 de ellos se observó una mejoría clínica y en 25 un empeoramiento. De los pacientes incluidos en el estudio, 33,33% (n = 106) referían presentar sintomatología relacionada con RGE antes de la cirugía y 16,66% consumían IBP en su medicación habitual para su control. Tan solo 20 (21,73%) de los 91 artículos especificaron este dato. Tras la GV, el porcentaje de sintomatología de RGE fue de 25,76% (DE 23,61).
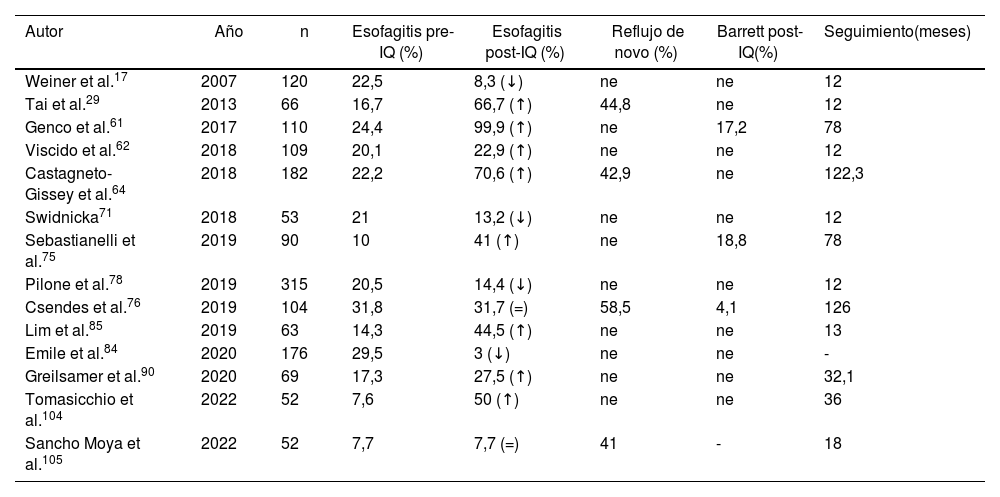
El diagnóstico de esofagitis por FGC previa a la realización de GV se observó en 361 pacientes. De los 91 artículos, 20 (n = 2.006 pacientes) incluyeron este dato. Respecto al diagnóstico de esofagitis posterior a la cirugía, reportado en 19 trabajos (n = 2.312), afectó a 427 (18,4%) pacientes. De total de estudios, únicamente 14 (n = 1.350) añadieron diagnósticos de esofagitis antes y después de cirugía con un incremento de 58% (n esofagitis pre = 186, n esofagitis post = 318) (tabla 4).
Evolución del diagnóstico de esofagitis en los artículos analizados
| Autor | Año | n | Esofagitis pre-IQ (%) | Esofagitis post-IQ (%) | Reflujo de novo (%) | Barrett post-IQ(%) | Seguimiento(meses) |
|---|---|---|---|---|---|---|---|
| Weiner et al.17 | 2007 | 120 | 22,5 | 8,3 (↓) | ne | ne | 12 |
| Tai et al.29 | 2013 | 66 | 16,7 | 66,7 (↑) | 44,8 | ne | 12 |
| Genco et al.61 | 2017 | 110 | 24,4 | 99,9 (↑) | ne | 17,2 | 78 |
| Viscido et al.62 | 2018 | 109 | 20,1 | 22,9 (↑) | ne | ne | 12 |
| Castagneto- Gissey et al.64 | 2018 | 182 | 22,2 | 70,6 (↑) | 42,9 | ne | 122,3 |
| Swidnicka71 | 2018 | 53 | 21 | 13,2 (↓) | ne | ne | 12 |
| Sebastianelli et al.75 | 2019 | 90 | 10 | 41 (↑) | ne | 18,8 | 78 |
| Pilone et al.78 | 2019 | 315 | 20,5 | 14,4 (↓) | ne | ne | 12 |
| Csendes et al.76 | 2019 | 104 | 31,8 | 31,7 (=) | 58,5 | 4,1 | 126 |
| Lim et al.85 | 2019 | 63 | 14,3 | 44,5 (↑) | ne | ne | 13 |
| Emile et al.84 | 2020 | 176 | 29,5 | 3 (↓) | ne | ne | - |
| Greilsamer et al.90 | 2020 | 69 | 17,3 | 27,5 (↑) | ne | ne | 32,1 |
| Tomasicchio et al.104 | 2022 | 52 | 7,6 | 50 (↑) | ne | ne | 36 |
| Sancho Moya et al.105 | 2022 | 52 | 7,7 | 7,7 (=) | 41 | - | 18 |
ne: dato no especificado en el artículo; ↓ disminución del porcentaje de pacientes con esofagitis tras la cirugía; ↑ incremento del porcentaje de pacientes con esofagitis tras la cirugía; = igualdad entre el porcentaje de pacientes con diagnóstico de esofagitis antes y después de la cirugía.
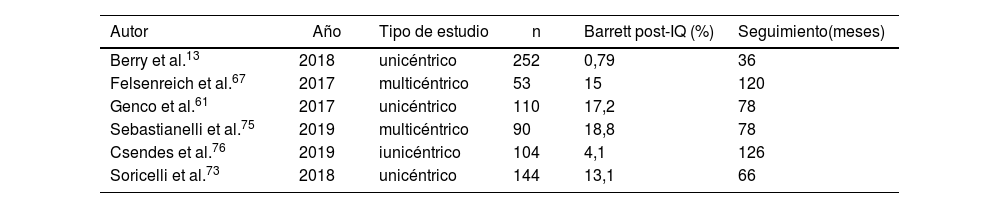
Solamente seis artículos13,61,67,73,75,76 comunicaron el desarrollo de esófago de Barrett en sus series. Del total de 590 pacientes incluidos en los mismos, 74 (12,54%) fueron diagnosticados de esófago de Barrett tras la realización de una FGC posterior a la cirugía. La media de seguimiento fue de 84 meses (R 36-126) (tabla 5).
Desarrollo de esófago de Barrett en los artículos analizados
| Autor | Año | Tipo de estudio | n | Barrett post-IQ (%) | Seguimiento(meses) |
|---|---|---|---|---|---|
| Berry et al.13 | 2018 | unicéntrico | 252 | 0,79 | 36 |
| Felsenreich et al.67 | 2017 | multicéntrico | 53 | 15 | 120 |
| Genco et al.61 | 2017 | unicéntrico | 110 | 17,2 | 78 |
| Sebastianelli et al.75 | 2019 | multicéntrico | 90 | 18,8 | 78 |
| Csendes et al.76 | 2019 | iunicéntrico | 104 | 4,1 | 126 |
| Soricelli et al.73 | 2018 | unicéntrico | 144 | 13,1 | 66 |
En relación con aspectos vínculados a la técnica quirúrgica, se recogieron datos correspondientes al calibre de la bujía utilizada y la distancia al píloro del primer disparo de la endograpadora. El tamaño más empleado de sonda Foucher fue la de 36 French (Fr) en 40,67% de los artículos, seguida de la 32 Fr (16,94%) y la de 38 Fr (8,47%). Los rangos de los calibres usados para tutorizar la manga fueron de 26,4 Fr (endoscopio)30 hasta 50 Fr. No indicaron el tipo de sonda utilizada 32 artículos (35,16%).
Respecto al primer disparo de EndoGIA, fueron 41 (44,56%) trabajos los que lo detallaron, 10 (24,39%) lo realizaron a menos de 4 cm del píloro (R 1-3) y 31 (75,60%) a 4 cm o más de este (R 4-6).
No se evidenció ninguna relación estadísticamente significativa entre ninguna de las dos características relacionadas con la técnica quirúrgica y la aparición de reflujo de novo.
Tan solo 22 de los 91 artículos revisados incluían en su seguimiento test de evaluación de la calidad de vida. Además, las escalas utilizadas diferían entre ellos (Cuestionario de salud SF-36, GERD Severity Symptom [GERD-SS], cuestionario Gastrointestinal Quality of Life (GIQLI), Visual Analog Scale [VAS], Reflux Disease Diagnostic Questionnaire [RDQ], Visick, Reflux Severity Index [RSI], GERD Symptom Assessment Scale [GSAS] y Likert) por lo que no es posible establecer comparaciones adecuadas17,19,38,43,52,55,63,66,67,68,72,78,81,84,86,87,92,95,96,97,99,100.
DiscusiónLa obesidad es uno de los principales factores de riesgo para el desarrollo de RGE y esófago de Barrett. Se sabe que el sobrepeso incrementa de 1,2 a tres veces el reflujo patológico, y en pacientes obesos su prevalencia va de 37 hasta 72%. Además, estudios de pHmetría han demostrado que por cada incremento de 5 kg/m2 en el IMC, se aumenta tres puntos en la escala de DeMeester. Esta conexión se explica por cambios fisiológicos derivados de la obesidad, que incluyen la elevación de la presión intraabdominal, la alteración de la morfología de la unión gastroesofágica, un EEI disfuncional, el aumento de la presión intragástrica, la alteración asociada de la motilidad esofágica y la mayor incidencia de hernia hiatal. La GV teóricamente modifica todos los mecanismos naturales antirreflujo, lo que favorecería la aparición de su sintomatología. Cambia el ángulo de His debido a la disección necesaria en esta área para realizar la manga gástrica y, en algunas ocasiones, varía la configuración de la membrana frenoesofágica, al menos de manera parcial; disminuye la presión del EEI, probablemente por resección de algunas de sus fibras musculares oblicuas; incrementa la presión intragástrica al reducir el volumen del estómago, sumado a la presencia de un píloro intacto y afecta el vaciamiento gástrico, cuando se reseca parte del antro. No obstante, sabemos que la pérdida de peso mitiga los síntomas de reflujo y, además de manera contradictoria, diversas publicaciones mencionan que la GV podría proteger la barrera gastroesofágica al inducir un vaciamiento gástrico rápido y disminuir la población de células parietales por la exéresis del fundus gástrico12–13.
De igual manera, parece ser que la morfología del estómago remanente tiene un efecto importante, no solo en la inducción de la saciedad, sino también en la presentación de síntomas de reflujo. Una técnica quirúrgica inapropiada, con un fundus prominente se traduce en mayor sintomatología de RGE y menor control de la saciedad14.
Los datos que la literatura actual proporcionan acerca del binomio GV-ERGE son dispares. Algunos trabajos respaldan los beneficios de la GV sobre los síntomas de reflujo y otros en cambio, los desaprueban34,35.
El impacto que la aparición de reflujo de novo (definido como la presencia de sintomatología de RGE, reflujo silente o trastorno esofágico funcional en pacientes que no padecían reflujo previo a la cirugía) o el empeoramiento del reflujo pre-existente ocasiona en el deterioro en la calidad de vida y en el requerimiento de medicación antiácida diaria es un motivo principal de preocupación y una de las causas más frecuentes de conversión de GV a bypass gástrico106.
Las tasas de desarrollo de reflujo de novo referidas en la literatura se sitúan en un rango entre 0 y 69%10,19,40 y entre 0 y 93% en el estudio actual. Lógicamente, esta extensión en los porcentajes no nos permite extraer ninguna conclusión clara.
Con la finalidad de acotar estos márgenes tan amplios e intentar definir la historia natural del reflujo en el paciente intervenido de sleeve gástrico, nace la idea del presente trabajo.
En una primera aproximación, observamos que, aunque existe una multiplicidad de estudios publicados que abordan la relación GV-RGE, solo un porcentaje muy pequeño (los que hemos llamado grupo completo) recogen el conjunto de variables que nos pueden permitir ser más precisos.
Únicamente, siete trabajos estudiaron datos clínicos y hallazgos endoscópicos y funcionales antes y después de la cirugía. De manera que, con la información más completa posible, el porcentaje de reflujo de novo tras una GV es de 16% y un empeoramiento de 1% en los pacientes con reflujo preexistente a los 14 meses de la cirugía.
Por otro lado, es importante destacar que solo 20 de los 91 artículos examinados en esta revisión mencionan la prevalencia de esta complicación tardía y un número muy limitado estudia su tiempo de aparición con una media de seguimiento poco superior al año tras la cirugía.
En esta línea, otro de los dilemas que más preocupa, sobre todo en pacientes jóvenes, es el posible incremento de esófago de Barrett con su consecuente riesgo de desarrollo de un cáncer esofágico107. Pero, de nuevo, la evidencia científica relacionada con este problema es escasa y heterogénea. La existencia de solo seis artículos que expongan este dato (tabla 5) no posibilita establecer resoluciones firmes.
Asimismo, en el momento de interpretar y analizar los datos, nos encontramos con diversos obstáculos. Uno de ellos es la falta de uniformidad en la recopilación de información en relación con la clínica. La mayoría de los trabajos diagnostican la ERGE con base en los síntomas que el paciente refiere y son limitados los que emplean cuestionarios y pruebas funcionales (pHmetría 24 horas y pHmetría con impedancia) o aplican la definición del fenotipo clínico (sintomático, silente, trastorno esofágico funcional, ausencia de RGE)105,108,109 con base en los principales consensos110–112.
Otra limitación es la falta de homogeneidad y estandarización en las exploraciones complementarias realizadas en los diversos estudios. Solo una muy escasa proporción de trabajos evalúan resultados endoscópicos y funcionales tanto preoperatorios como posoperatorios.
Es necesario señalar que el uso sistemático de la FGC antes de efectuar una GV es muy discutido. Podemos englobar las sociedades científicas en dos corrientes: aquellas que postulan que no se debe indicar en ausencia de síntomas y las que defienden su realización sistemática debido a que los síntomas son escasamente predictores de lesiones subyacentes, de manera que los hallazgos endoscópicos no se correlacionan con los síntomas referidos por los pacientes73,113,114. Así, la American Society for Metabolic and Bariatric Surgery (ASMBS), Society of American Gastrointestinal and Endoscopic Surgeons (SAGES), International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO) y la American Society for Gastrointestinal Endoscopy (ASGE) recomiendan que el uso de la FGC debe ser individualizado según los síntomas referidos y en cambio la European Association of Endoscopic Surgery (EAES) sugiere que todos los sujetos que van a someterse a cirugía bariátrica deben ser estudiados mediante FGC, abogando que la ausencia de síntomas no excluye la presencia de un RGE silente115.
A pesar de ser el procedimiento quirúrgico bariátrico más realizado a nivel mundial todavía no se dispone de una cirugía estandarizada y existen aspectos técnicos que se efectúan de forma diferente por los distintos grupos de trabajo. Consideraciones que entorpecen, una vez más, el análisis de datos. Así, el variado tamaño de las bujías utilizadas para calibrar la manga o la distancia al píloro del primer disparo de EngoGIA, pueden influir en el incremento posterior de los síntomas de RGE55,116,117.
Lo cierto es que seguimos sin poder responder de forma definitiva a algunas preguntas ya planteadas en trabajos previos118–121: ¿presentan la misma etiopatogenia los pacientes intervenidos de GV en el desarrollo de Barrett que el resto de la población?, ¿se debería implementar la realización de FGC sistemáticas antes y después de la GV aunque los pacientes no refieran sintomatología de reflujo? y en caso afirmativo, ¿hasta cuándo?, ¿podemos predecir qué sujetos desarrollarán reflujo tras la GV?, ¿debe ser contraindicación absoluta la realización de una GV en personas con sintomatología de reflujo?, ¿cuáles son los efectos de la GV sobre el RGE?
Todos estos interrogantes deberían ser objeto de futuros estudios con la finalidad de conocer mejor la fisiopatología del estómago intervenido con una GV.
FinanciaciónNo se ha obtenido ni financiación ni becas en la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.