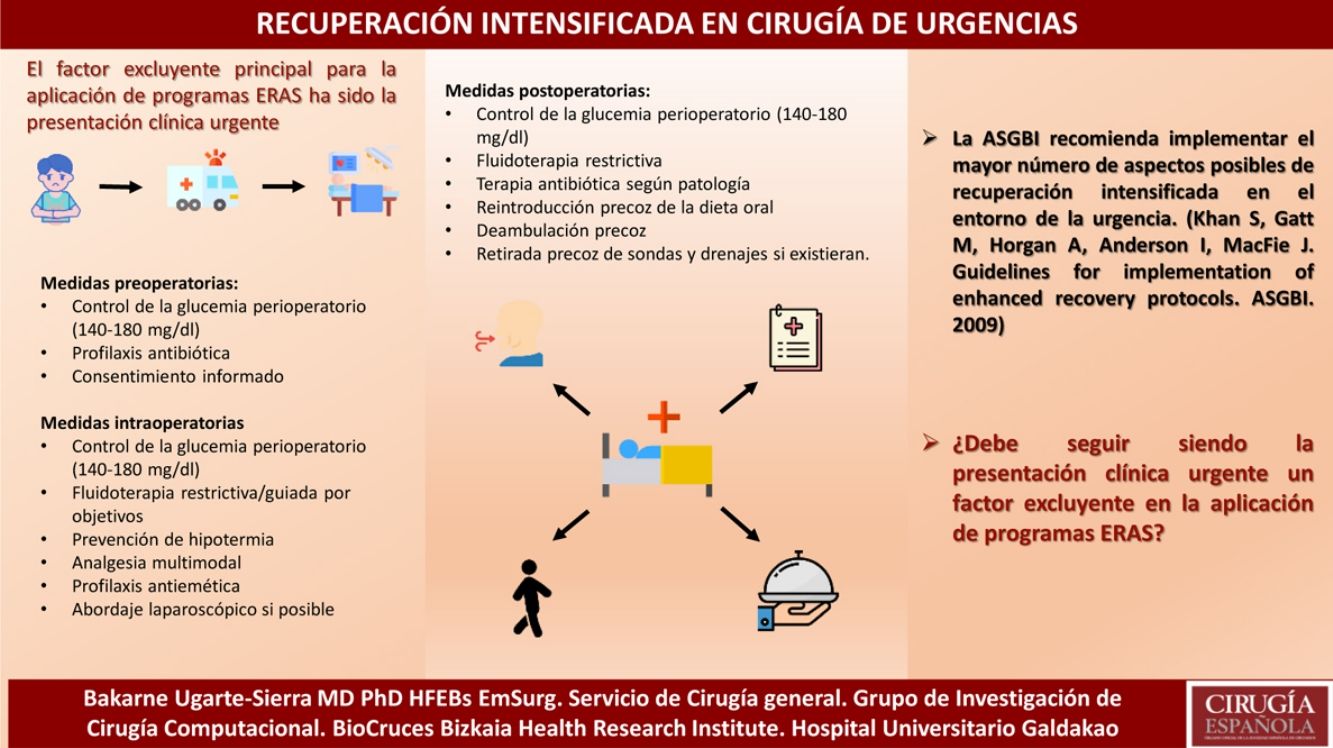
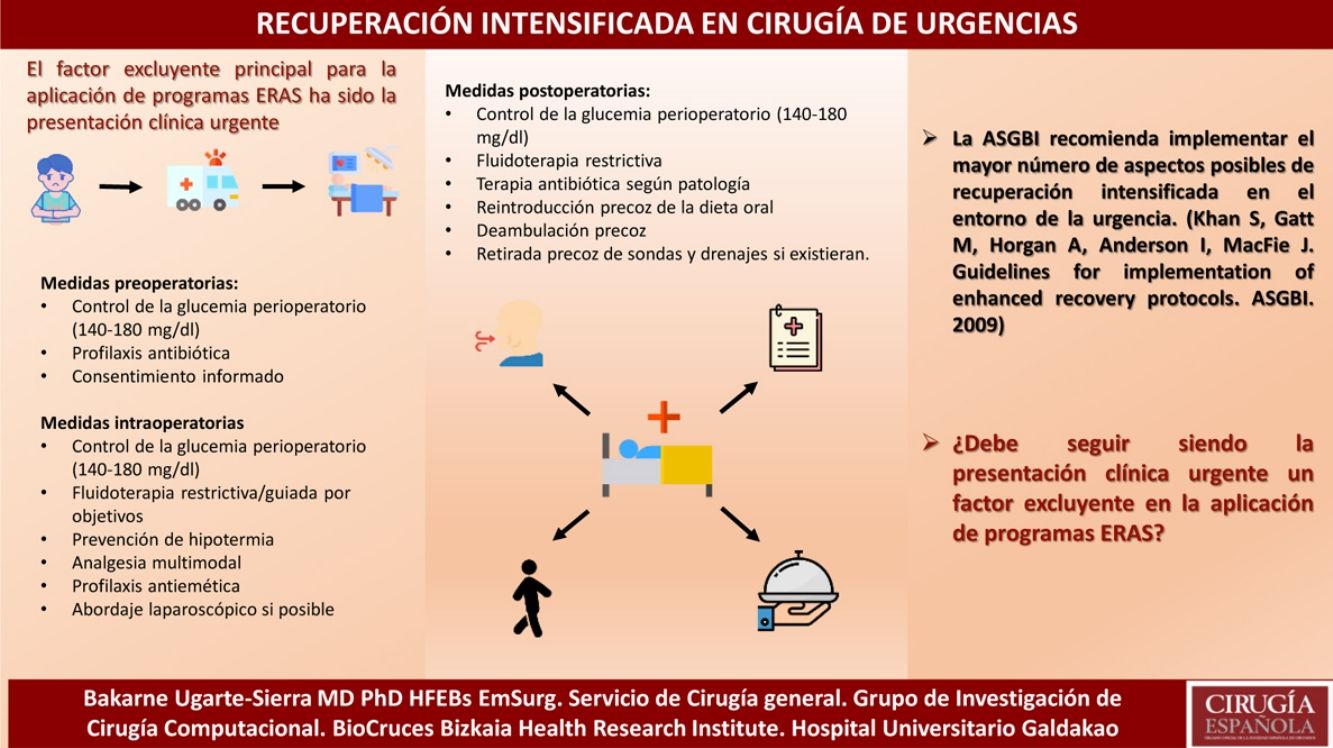
La rehabilitación multimodal quirúrgica (ERAS) constituye la aplicación de una serie de medidas perioperatorias basadas en la evidencia, con el fin de lograr una mejor recuperación del paciente y una disminución de las complicaciones y la mortalidad. Estos programas de rehabilitación multimodal inicialmente demostraron sus ventajas en el ámbito de la cirugía colorrectal siendo adoptados progresivamente por otras áreas quirúrgicas dentro de la cirugía general y por otras especialidades quirúrgicas. El factor excluyente principal para la aplicación de este tipo de programas ha sido la presentación clínica urgente, lo que ha provocado que a pesar del gran volumen de literatura existente sobre ERAS en cirugía electiva, existan pocos estudios que hayan investigado la efectividad de estos programas en pacientes quirúrgicos en urgencias. El objetivo de este artículo es mostrar las medidas de recuperación intensificada de que disponemos en la actualidad según la evidencia existente para cirugía urgente.
Enhanced Recovery After Surgery (ERAS) constitutes the application of a series of perioperative measures based on the evidence, in order to achieve a better recovery of the patient and a decrease of the complications and the mortality. These ERAS programs initially proved their advantages in the field of colorectal surgery being progressively adopted by other surgical areas within the general surgery and other surgical specialties. The main excluding factor for the application of such programs has been the urgent clinical presentation, which has caused that despite the large volume of existing literature on ERAS in elective surgery, there are few studies that have investigated the effectiveness of these programs in surgical patients in emergencies. The aim of this article is to show ERAS measures currently available according to the existing evidence for emergency surgery.
La rehabilitación multimodal quirúrgica, Programa de Recuperación Intensificada o «Enhanced Recovery After Surgery» («ERAS») constituye la aplicación de una serie de estrategias perioperatorias destinadas a pacientes que van a ser sometidos a un procedimiento quirúrgico con el objetivo de disminuir el estrés originado por la intervención quirúrgica y así lograr una mejor recuperación del paciente y una disminución de las complicaciones y la mortalidad1.
Los programas de rehabilitación multimodal comenzaron a demostrar sus ventajas en el ámbito de la cirugía colorrectal (Kehlet y Wilmore2), evidenciándose una disminución de la morbilidad y una mejora de la eficiencia. Posteriormente, estos programas han sido adoptados por otras áreas, tanto en nuestra especialidad como en otras especialidades quirúrgicas3.
En este artículo se realiza una revisión narrativa de la principal bibliografía disponible en la actualidad en lo que se refiere a rehabilitación multimodal en cirugía de urgencias, mediante una búsqueda bibliográfica en las bases de datos Biblioteca Cochrane Plus (Cochrane Library), Medline, EMBASE y Scopus desde 1995 hasta 2019.
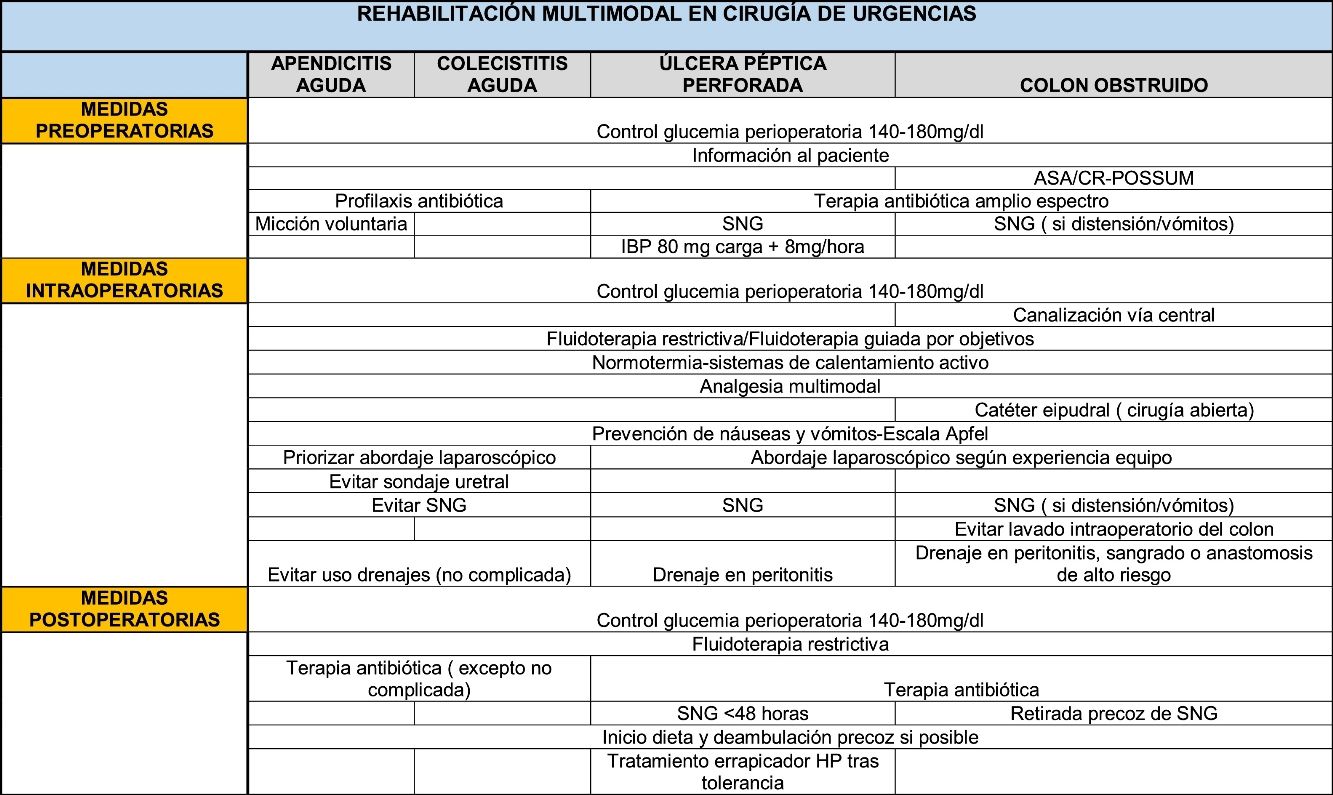
A continuación mostramos una serie de medidas ERAS comunes para el pre-, intra- y postoperatorio en cirugía de urgencias y una serie de particularidades en el manejo de las patologías seleccionadas.
Medidas comunesAunque probablemente haya ciertos aspectos extrapolables desde la cirugía electiva, la protocolización de medidas de actuación en rehabilitación multimodal para cirugía urgente tiene una serie de particularidades propias. Se constituirán, por tanto, programas ERAS modificados con una fase preoperatoria con escaso margen de optimización, siendo necesario incidir de forma más exhaustiva en las fases intra- y postoperatoria.
Medidas preoperatoriasUn alto nivel preoperatorio de HbA1c o de la hiperglucemia preoperatoria se asocia de manera evidente a mayor morbilidad. Dado que la determinación de la HbA1c en los departamentos de urgencia es bastante dificultosa, se recomienda un control de la glucemia en todo el periodo perioperatorio con un objetivo de 140-180mg/dl4.
La aceptación y satisfacción del paciente son otras de las preocupaciones a estudiar dada la naturaleza urgente de la patología. Estas cuestiones se combaten con una adecuada protocolización, un extenso asesoramiento preoperatorio e información de los beneficios de este tipo de tratamiento y del alta temprana.
Medidas intraoperatoriasHay diferentes aspectos en los que se debe mantener un control estricto, como son la fluidoterapia intraoperatoria, la prevención de hipotermia, la analgesia, los cambios hemodinámicos y profilaxis antiemética entre otros.
La instauración de fluidoterapia restrictiva/fluidoterapia guiada por objetivos en el ámbito urgente constituye un verdadero desafío, porque supone la ruptura con la enseñanza tradicional aplicada en el enfermo grave, que casi exige volúmenes grandes de fluido sin restricciones para combatir la hipotensión, la vasodilatación y la consiguiente fuga de fluido a nivel capilar. La consistencia de los resultados obtenidos en cirugía electiva en cuanto a fluidoterapia restrictiva se refiere obliga a considerar si los excesos de fluido pueden, de hecho, crear o perpetuar algo que queremos evitar5.
Se recomienda el uso de soluciones balanceadas en electrólitos (Ringer lactato, plasmalyte) frente a suero salino o coloides (grado de recomendación: GR-IIC) siendo especialmente importante en el manejo de los pacientes inestables6.
Es fundamental mantener la habitación caliente y evitar en la medida de lo posible la pérdida de calor en el paciente. La hipotermia está presente en más del 50% de los pacientes en la urgencia. Las más importantes consecuencias de la hipotermia son la mayor pérdida sanguínea/coagulopatía perioperatoria, problemas cardiacos (isquemia miocardio, arritmias) y aumento de las infecciones de pared7. El calentamiento activo está indicado preparatoriamente en pacientes de alto riesgo (mayores de 60 años) (GR-IC) y se recomienda en todo paciente en cirugía de urgencias8.
En cuanto al manejo del dolor, la mejor opción terapéutica la constituye la analgesia balanceada o multimodal. Se trata de combinar diferentes fármacos o técnicas anestésicas con distintos mecanismos de acción (bloqueo regional TAP [transversus abdominis plane] en casos de laparotomía…) y en dosis inferiores a las utilizadas en monoterapia. La finalidad es conseguir una mayor potencia analgésica con menos efectos adversos. Existen multitud de trabajos que avalan este concepto de analgesia9.
Asimismo, se debe estratificar el riesgo de náuseas y vómitos postoperatorios en todos los pacientes mediante la escala de Apfel y realizar profilaxis en función de esta1.
Medidas postoperatoriasSe aboga, como en todo protocolo ERAS, por la introducción precoz de la dieta oral y de la deambulación (así como la retirada precoz de sondas y drenajes si existieran), teniendo en cuenta que el carácter urgente de la patología provocará una cadencia distinta a la cirugía electiva.
Como corriente novedosa dentro del postoperatorio de los pacientes se está difundiendo la idea del handoff (transferencia) de los pacientes a la zona de despertar evitando el ruido o el estrés de cara a conseguir un recuperación postanestésica más plácida y evitar los problemas asociados a la no adecuada transferencia (aumento del dolor postoperatorio inicial, ansiedad...)10.
Medidas específicas por patologíasApendicitis agudaLa literatura muestra que la estancia media postoperatoria por apendicitis aguda es de 1,8-2,2 días, similar para cirugía abierta o laparoscópica.
Un protocolo ERAS permitiría retornar precozmente al domicilio, escuela o trabajo y reduciría el malestar postoperatorio, costes, e incluso, la posibilidad de plantearnos la ambulatorización del proceso, con beneficios individuales, familiares, sanitarios y sociales, reduciendo el gasto hospitalario y la pérdida de productividad.
Medidas preoperatoriasLa profilaxis antibiótica ha demostrado ser eficaz en la prevención de infecciones superficiales del sitio quirúrgico y abscesos intraabdominales en pacientes con apendicitis no complicada, sin embargo, no hay evidencia que respalde la administración rutinaria de antibióticos postoperatorios. Por lo tanto, en apendicitis aguda no complicada (en ausencia de gangrena o perforación) solo se aconseja una dosis preoperatoria11.
Asimismo, se aconseja micción voluntaria preintervención (evitando el sondaje).
Medidas intraoperatoriasEn lo referente a la vía de acceso, la apendicectomía laparoscópica debe representar la primera opción siempre y cuando se trate de un equipo entrenado, ya que ofrece claras ventajas en términos de menos dolor, menor incidencia de infección del sitio quirúrgico, disminución de estancia hospitalaria, retorno al trabajo más temprano y disminución de costes generales (GR-IA)12.
Se deben evitar sondas nasogástricas y drenajes en la apendicitis aguda no complicada. El uso rutinario de drenajes no reduce la incidencia de abscesos intraabdominales13.
Aunque mínimamente invasiva, la apendicectomía laparoscópica en la apendicitis aguda no complicada sigue produciendo dolor postoperatorio considerable, ingresos de 1-2 días y pérdida de 1-3 semanas de trabajo o escuela. Se aconseja infiltración preincisional de puertos (anestésico local y adrenalina), analgesia multimodal pre- y postoperatoria ahorradora de opioides junto con unidosis de AINE parenteral al finalizar el procedimiento. Hamill et al. en 2017 realizaron una revisión no sistemática de las medidas basadas en la evidencia, para optimizar la recuperación tras la apendicectomía laparoscópica13. Algunas de sus conclusiones destacables son: el enfoque protocolizado aún no se ha estudiado en ensayos clínicos aleatorizados; ni la minilaparoscopia ni SILS (Single-incisión Laparoscopic Surgery) mejoraron la recuperación; el bloqueo TAP no redujo el dolor postoperatorio14,15; por el contrario, la anestesia local intraperitoneal mostró beneficios en adultos16,17. No se encontraron ensayos relacionados con la apendicectomía NOTES (Natural orifice transluminal endoscopic surgery) ni con el empleo de drenajes.
Se debe realizar un control estricto de fluidoterapia intraoperatoria, prevención de hipotermia, analgesia y cambios hemodinámicos para reducir el estrés metabólico, así como profilaxis antiemética (con dexametasona y ondansetrón).
Medidas postoperatoriasEs mandatorio subrayar la importancia de insistir en el inicio precoz de dieta oral y de la deambulación.
Lefrancois et al. describieron el «Saint-Antoine Score», puntaje predictivo basado en 5 factores asociados de manera independiente con el alta hospitalaria precoz (IMC<28kg/m2, recuento de leucocitos<15.000/μl, PCR<30mg/l, ausencia de signos radiológicos de perforación y diámetro apendicular≤10mm en imágenes) al observar que el 71% de los pacientes con 4 criterios y el 92% con 5 criterios fueron pacientes ambulatorizables18.
En hospitales y casos seleccionados (sin protocolización) se ha llegado a manejar con éxito la apendicitis aguda no complicada sin ingreso19, con tasas de ambulatorización del 35%. Varios grupos han desarrollado protocolos ambulatorios para la apendicitis laparoscópica, aumentando la tasa de ambulatorización sin aumento en la morbimortalidad20,21, logrando alcanzar cifras de un 85% de tratamiento ambulatorio, sin mayor número de reingresos y estimando un ahorro de costes22.Numerosos trabajos posteriores confirman la seguridad de este enfoque en adultos, sin mayores tasas de complicaciones ni reingresos23,24. La ausencia de mortalidad y la baja morbilidad (5%) observadas en estudios recientes20,23,25, demuestran la seguridad y eficacia de esta estrategia.
Colecistitis agudaLa colecistitis aguda litiásica se diagnostica en un 3-10% de los pacientes con dolor abdominal agudo y representa 1/3 de las admisiones en urgencia26.
La mayor parte de las medidas no difieren de las recomendaciones habituales ERAS enumeradas en la primera parte. A continuación mostramos unas particularidades específicas en el caso que nos ocupa.
Medidas preoperatoriasExiste cierta controversia sobre el momento de la colecistectomía en la colecistitis aguda. Un metaanálisis27 demostró que la morbilidad y la conversión a un procedimiento abierto es la misma para la colecistectomía precoz (antes de 7 días de inicio de los síntomas) y la realizada en un segundo tiempo, asociándose la colecistectomía precoz a una estancia hospitalaria total significativamente más corta, siendo este el tratamiento de elección según las recomendaciones de las últimas guías26–28.
Según las guías de la World Society of Emergency Surgery (WSES), la colecistectomía laparoscópica precoz se debe llevar a cabo tan pronto como sea posible, pero se puede realizar hasta 10 días después de la aparición de los síntomas (GR-IA). Sin embargo, debe tenerse en cuenta que la cirugía anterior a este plazo de tiempo se asocia con una hospitalización más corta y con menos complicaciones (GR-IIB).
En lo referente a profilaxis antibiótica, la colecistitis aguda no complicada puede tratarse sin antibióticos postoperatorios de rutina siempre y cuando el foco de la infección se controle mediante la colecistectomía (GR-IB)29.
Medidas intraoperatoriasEl abordaje laparoscópico para la colecistitis aguda se considera seguro, factible, con una tasa de complicación baja y asocia menor estancia hospitalaria (GR IA). Inicialmente se debe intentar un abordaje laparoscópico en todos los pacientes, excepto en caso de contraindicación absoluta por parte de anestesia o shock séptico (GR-IIB)29.
No existe consenso (con estudios no controlados y retrospectivos) en cuanto al valor del drenaje abdominal después de la colecistectomía laparoscópica precoz para la colecistitis aguda leve o moderada (i o ii de la clasificación de Tokyo)30. El uso del mismo y sus características siguen dependiendo del cirujano. Se utiliza a menudo en poblaciones de alto riesgo aunque carezca de un beneficio real constatable en el postoperatorio, e incluso pueda comprometerla recuperación del paciente en el contexto de colecistectomía laparoscópica precoz para la colecistitis aguda grados i o ii31.
Un metaanálisis Cochrane incluyó una serie de estudios aleatorios que compararon estrategias de «no drenaje» y «drenaje» después de la colecistectomía abierta, demostrando que el uso rutinario del drenaje después de la colecistectomía abierta no supone ningún beneficio para el paciente30.
Por el contrario, el drenaje aumentó la incidencia de infecciones de la herida, infecciones torácicas y atelectasias, y, sin embargo, no afectó a la incidencia de colecciones abdominales postoperatorias32.
Medidas postoperatoriasEn la colecistitis complicada, los regímenes antimicrobianos dependerán de los presuntos patógenos implicados y de los factores de riesgo de los principales patrones de resistencia (GR-IIIB)29. En la tabla 1 se expone el protocolo de rehabilitación multimodal en colecistitis aguda del Grupo Español de Rehabilitación Multimodal, Zaragoza 2016.
Protocolo de rehabilitación multimodal en colecistitis aguda del Grupo Español de Rehabilitación Multimodal
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| Pacientes sometidos a intervención quirúrgica urgente de colecistitis aguda que cumplan los criterios:- Todos los pacientes con colecistitis aguda (según clasificación de Tokyo) ASA I y II con comienzo de los síntomas<5 días- ASA I y II, y valoración de los pacientes con ASA III | - Paciente con colecistitis aguda Tokyo III- Pacientes ASA III restantes y ASA IV- Paciente en tratamiento con anticoagulantes orales- Pacientes con colecistitis grave- Pacientes con peritonitis biliar, absceso perivesicular/hepático, colecistitis gangrenosa/enfisematosa- Comienzo de los síntomas>5 días- Enfermad crónica hepática Child B y C |
| Tiempo | Protocolo | Responsabilidad |
|---|---|---|
| Preoperatorio | Valoración preoperatoriay analítica urgencias incluyendo PCRProfilaxis antibiótica según protocolo del hospital (mantener hasta la intervención y retirar en el postoperatorio)Todos los pacientes que cumplan los criterios para entrar en el protocolo serán ampliamente informados, con la entrega de consentimiento informado | Cirujano+Anestesiólogo+Enfermería |
| Peroperatorio | Intraoperatorio | CirujanoEnfermería+Anestesiólogo |
| Inducción anestésica | ||
| Oxigenación FiO2 0,6-0,8 | ||
| Optimización hemodinámica mediante fluidoterapia guiada por objetivos | ||
| Fluidoterapia en perfusión continua solución balanceada (3,5ml/kg/h para laparoscopia; 7ml/kg/h para laparotomía) | ||
| Sondaje vesical si precisaCirugía mínimamente invasiva | ||
| Calentamiento activo con manta térmica y calentador de fluidos | ||
| Profilaxis de náuseas y vómitos postoperatorios según escala Apfel | ||
| No drenajes, cuando sea posible | ||
| Infiltración de los puertos de laparoscopia o bloqueo TAP según intervención | ||
| Postoperatorio | Postoperatorio inmediatoMantenimiento activo de temperaturaMantenimiento de FiO2 0,5 2h tras fin intervenciónAnalgesia pautada según intervención. Mínima administración de mórficosFluidoterapia restrictivaInicio de tolerancia oral 6h tras cirugía (o la mañana siguiente si intervención tarde-noche)Inicio de movilización a las 8horas tras cirugíaProfilaxis del tromboembolismo a partir de 12h tras intervención | Enfermería+Anestesiólogo |
| 1.er día postoperatorio | Dieta progresiva. Si tolerancia oral correcta retirada de líquidos intravenososValorar retirada de drenajes, si existenMovilización activa (cama/sillón/inicio deambulación)Analgesia oralValorar retirada de sondaje vesical, si lo tuvieraRetirada de catéter epiduralAnalítica control con PCRProfilaxis del tromboembolismoValorar alta a domicilio | Enfermería+Cirujano |
| 2.o día postoperatorio | Dieta normalAnalgesia oralMovilización activa (deambulación)Profilaxis del tromboembolismoValorar alta a domicilio | Enfermería+Cirujano |
| Al alta | Control telefónico tras alta | Enfermería+Cirujano+MAP |
| Criterios generales de alta: No complicaciones quirúrgicas, no fiebre, dolor controlado con analgesia oral, deambulación completa, aceptación por parte del paciente | ||
| Seguimiento al alta/continuidad asistencial | ||
| Apoyo domiciliario-Coordinación con atención primaria |
La presencia de una úlcera péptica perforada es una urgencia quirúrgica donde un retraso de más de 12h incrementa de forma notable la mortalidad. La comorbilidad asociada incrementa en 9 veces las complicaciones postoperatorias33. Los pacientes diabéticos tienen un mayor riesgo de mortalidad a 30 días34. La edad avanzada constituye un factor de riesgo independiente de mayor mortalidad en las perforaciones por úlcera35 y el inicio del paciente con hipotensión, acidosis metabólica, daño renal o hipoalbuminemia se asocia a peor pronóstico36,37. Todo esto supone que haya muy pocas medidas preparatorias que puedan realizarse antes de la cirugía de urgencia, habiéndose estimado la mortalidad a 30 días en alrededor de un 24%.
Medidas preoperatoriasEl uso de sonda nasogástrica está indicado para evitar el vertido de irritantes.
La infusión de altas dosis de inhibidores se recomienda en los sangrados digestivos, donde se ha visto el cese de la hemorragia y la cicatrización de las úlceras. Sin embargo, no se ha documentado su impacto en las perforaciones secundarias a úlcera aunque se recomienda iniciar altas dosis de inhibidores de la bomba de protones tan pronto sea posible con una dosis de carga de 80mg y 8mg por hora del inhibidor ya que se cree que puede favorecer la formación de fibrina y promover el sellado rápido de las perforaciones38.
La terapia antibiótica debe cubrir un espectro que incluya colonias de gramnegativos entéricos, anaerobios y flora de mucosa oral. Dada la reciente resistencia de las enterobacterias, principalmente Escherichia coli, la antibioticoterapia empírica deberá basarse en la sensibilidad local/regional, y tendrá que detectar a pacientes de riesgo de poseer betalactamasas de espectro ampliado donde la antibioticoterapia deberá de fundamentarse en fármacos tipo ertapenem39.
La importancia de un tratamiento empírico adecuado se deja vislumbrar en un estudio de 425 pacientes con peritonitis secundaria (incluidos pacientes con úlcera perforada). En este estudio, en un 13% el tratamiento fue inapropiado, en ellos, la resolución del cuadro ocurrió únicamente en un 53% frente a un 70% de los tratados adecuadamente. Este fracaso en la resolución del cuadro se asoció a un incremento de 6 días en la hospitalización de los pacientes40. No se ha establecido la eficacia del tratamiento intravenoso para el Helicobacter pylori en el propio postoperatorio del paciente, recomendándose iniciar el tratamiento tras el alta una vez establecida correctamente la tolerancia oral, para evitar resistencias si se interrumpiera por falta de tolerancia41.
Tanto las medidas intra- como postoperatorias no difieren en gran medida de las recomendaciones habituales ERAS.
Medidas intraoperatoriasNo existe en la actualidad evidencia que indique que la laparoscopia sea superior a la cirugía abierta, pero tampoco hay evidencia de que la laparoscopia sea perjudicial en pacientes con sepsis o peritonitis generalizada. Como no se ha demostrado ninguna diferencia en la mortalidad por la técnica abierta frente a la laparoscópica, la elección de una u otra la determinarán la experiencia del cirujano y las características del paciente42.
Se recomienda la colocación de drenaje en las peritonitis, demostrando menores complicaciones postoperatorias43.
Medidas postoperatoriasSe aboga por no mantener la sonda nasogástrica más de 2 días, con inicio precoz de tolerancia aunque hay pocos estudios44.
Obstrucción mecánica por cáncer de colonLos programas ERAS en cirugía de colon programada han sido implementados con resultados favorables45–49,siendo también relevante la implementación en España del programa IMPRICA para la adherencia a la guía RICA (Recuperación Intensificada en Cirugía Abdominal)1.
La aplicación de los mismos en cirugía urgente colónica es más bien escasa y se centran en la obstrucción. Shida et al.50 evaluaron 122 colectomías urgentes por neoplasia obstructiva colorrectal, 48 tratadas de forma tradicional y 80 con programa ERAS modificado, concluyendo que estos programas reducen la estancia hospitalaria sin aumentar la morbilidad.
Dentro del manejo de la obstrucción mecánica completa por cáncer de colon, uno de los conceptos más discutidos es el papel del stent. Se acepta que en los pacientes con cáncer de colon potencialmente curable en el lado izquierdo del colon, con alto riesgo quirúrgico, ASA III o edad mayor de 70 años, el stent se podría considerar una buen alternativa como puente para realizar posteriormente una cirugía ERAS programada51.
En la cirugía urgente del cáncer de colon con obstrucción mecánica completa, se han estudiado diversas medidas basadas en las recomendaciones del grupo ERAS y su repercusión en la morbimortalidad4.
Medidas preoperatoriasSe recomienda estimar el riesgo quirúrgico (ASA, CR-POSSUM). Un riesgo mayor de un 10%, implica una necesidad de ingreso en la unidad de cuidados intensivos, postoperatoriamente e incluso preoperatoriamente para una optimización previa a la cirugía52.
Es necesaria la canalización de una vía central para una fluidoterapia guiada por objetivos (presión venosa central entre 8-12cm H2O, presión arterial medida de 65 o menos y volumen urinario de al menos 0,5ml/kg/h). La reposición del volumen se indica con soluciones salinas isotópicas o con ringer lactato53.
En pacientes con gran distensión de colon y vómitos, se recomienda sonda nasogástrica54.
Se recomienda, asimismo, el inicio precoz de antibióticos de amplio espectro, determinada la elección empírica del mismo según las sensibilidades de la zona.
Medidas intraoperatoriasEn los pacientes que van a ser sometidos a cirugía abierta habría que considerar el catéter epidural junto a la anestesia general, para un mejor control del dolor postoperatorio. No se debe indicar su uso en los pacientes con coagulopatía, tendencia al sangrado o inestabilidad hemodinámica55.
Se recomienda la fluidoterapia guiada por objetivos, aunque no existen muchos estudios en la cirugía de urgencia, y los resultados no parezcan influir en la morbilidad, mortalidad ni en la función renal53.
La hipotermia perioperatoria se asocia a mayor infección del sitio quirúrgico, más complicaciones cardiacas y mayores pérdidas sanguíneas. Se recomienda el inicio de la prevención de la hipotermia desde el periodo preoperatorio mediante sistemas de calor activo.
La cirugía laparoscópica en la colectomía urgente es de difícil cumplimiento. Rea et al. analizaron 67.645 pacientes (datos multicéntricos). Solo el 3,9% se abordó por laparoscopia con un nivel de conversión del 55%56. La vía laparoscópica se asocia a menor estancia hospitalaria y menor índice de complicaciones postoperatorias, aunque hay que tener en cuenta la dificultad técnica extrema que supone la cirugía laparoscópica en los pacientes con obstrucción mecánica completa por cáncer de colon, que hace necesario una superespecialización no siempre disponible en el momento de la cirugía y que obliga a la no recomendación de la vía laparoscópica salvo en unidades especializadas57.
La última guía de la WSES 2017 no recomienda el lavado intraoperatorio del colon (GR-IB) ya que no influye en la dehiscencia de anastomosis ni en la morbilidad.
El drenaje no está recomendado de manera generalizada, salvo en los casos asociados a un sangrado importante, peritonitis purulenta o fecal y anastomosis de alto riesgo58.
Medidas postoperatoriasSe recomienda la analgesia multimodal adaptada a la urgencia, donde no es posible una estandarización previa54.
Diversos estudios recomiendan una retirada precoz de la sonda nasogástrica, incluso tras la cirugía, ya que su retirada precoz no se relaciona con una peor evolución54.
No se ha demostrado una evidente mejoría en la recuperación la función pulmonar ni en el descenso de las complicaciones respiratorias59 con el uso de incentivador respiratorio.
En cuanto al inicio precoz de la tolerancia oral, hay que tener en cuenta que es diferente del de la cirugía programada ya que la presencia de íleo debe hacernos pensar en un inicio más pausado58.
Y por último, aunque no exista evidencia sobre los beneficios, se aconseja la movilización precoz porque el encamamiento crónico se relaciona con mayor riesgo de tromboembolismo, debilidad muscular, neumonía y resistencia a insulina60. En la tabla 2 se resumen las recomendaciones actuales para las distintas patologías expuestas en el texto.
DiscusiónAunque algunos grupos han sugerido una inclusión global de pacientes y patologías en programas ERAS, a menudo, estos definen excepciones excluyendo de los mismos a pacientes con múltiples comorbilidades, enfermedades crónicas importantes (incluida la enfermedad mental), riesgos anestésicos elevados (ASA>III), abuso de alcohol, enfermedades que imposibiliten analgesia epidural y dificultades lingüísticas; siendo el factor excluyente por antonomasia la presentación clínica urgente.
A pesar del gran volumen de literatura existente sobre ERAS en cirugía electiva, existen pocos estudios que hayan investigado la efectividad de los programas ERAS en pacientes en cirugía de urgencias, aunque algunas guías indiquen que su uso pueda ser apropiado5.
Gonenc et al.44 demostraron seguridad y viabilidad en casos de urgencia de tracto gastrointestinal superior seleccionados y Lohsiriwat61 en urgencias de origen colorrectal. Wiseley y Barclay5 estudiaron retrospectivamente todo tipo de cirugía urgente en 370 pacientes. La etiología más frecuente fue la obstrucción pero no se registró la etiología por subgrupo de patología intervenida, 169 pacientes del estudio eran pre-ERAS comparándose con 201 ERAS, evidenciándose la disminución significativa de la morbilidad para este grupo y concluyendo que la aplicación de los programas ERAS en los pacientes urgentes no es perjudicial para los mismos. Asimismo, Le Guen et al.62 apoyan muchos aspectos ERAS aunque reconocen un nivel de evidencia limitado.
En 2009, dentro de las guías inglesas para la implementación de protocolos de recuperación intensificada63 se recomendaba que «se debe hacer todo lo posible para implementar el mayor número de aspectos posibles» en el contexto de los protocolos de recuperación intensificada en el entorno de la urgencia.
La situación actual de nuestro sistema de salud nos obliga a identificar áreas de mejora donde podamos ser más eficientes sin afectar a la calidad de la atención. Publicaciones recientes en el ámbito urgente buscan métodos para reducir costes hospitalarios y estancias, manteniendo una alta calidad de atención y satisfacción del paciente64.
ConclusiónEs mandatorio constituir grupos de trabajo multidisciplinares con interés en el desarrollo de protocolos ERAS para pacientes con patología urgente y la implementación de proyectos multicéntricos que avalen su viabilidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Carlo Brugiotti, Xavier Viñas, María José Fas, Alberto Felipe Bravo, Antonio Pérez, José Antonio López, Irene Ortega, Gianchandani Moorjani, Rajesh Haresh, Luis Tallón, Carlos David Albendea, Maria Infantes, Ruben Gonzalez, Ricardo Ortega, Ana Palomares, Antonio Dámaso, Luis Vega, Marina Molinete, Aitor Landaluce, Enric Macarulla y Bakarne Ugarte, que participaron en la Reunión de Zaragoza de 2016 para la elaboración de los protocolos iniciales de rehabilitación multimodal en cirugía de urgencias del Grupo Español de Rehabilitación Multimodal (actualmente en proceso de revisión por el grupo de trabajo *) y del que mostramos un ejemplo en este artículo.
*Grupo de Trabajo en Cirugía de Urgencias del Grupo Español de Rehabilitación multimodal: Bakarne Ugarte, Aitor Landaluce, Isaac Cabrera, José Antonio López, Susana Postigo, Manuel Artiles, Jaume Tur, María Dolores Pérez, Fernando Turégano, Alexander Forero, Andrea Craus, Francisca García-Moreno, Luis Tallón, Ricardo González, Pablo Muriel, Providencia García, Nicolás Macías, Jennifer García, Isidro Martínez, Luis Alberto Martínez, Diéter Morales, Andrea Campos, David Costa, Ignacio Rey, Francisco Blanco, Francisco Jiménez, Marta González, Rula Nasimi, Marta Gutiérrez.