El manejo quirúrgico agresivo de ciertos tipos de tumores es cuestionado en el paciente anciano debido a la posibilidad de tener un aumento en la morbimortalidad. Este es el caso del paciente anciano con carcinoma hepatocelular. Comparamos los resultados obtenidos con la resección hepática entre pacientes mayores y menores de 70 años de edad con hepatocarcinoma.
Material y métodosSe realizaron 36 resecciones hepáticas curativas para tratar cáncer hepatocelular. Dividimos nuestra población en 2 grupos (14 pacientes < 70 años y 22 pacientes ≥ 70 años de edad) y comparamos su morbimortalidad, periodo libre de enfermedad y sobrevida global utilizando curvas de Kaplan-Meir y prueba de log rank. Además buscamos factores de mal pronóstico en la población.
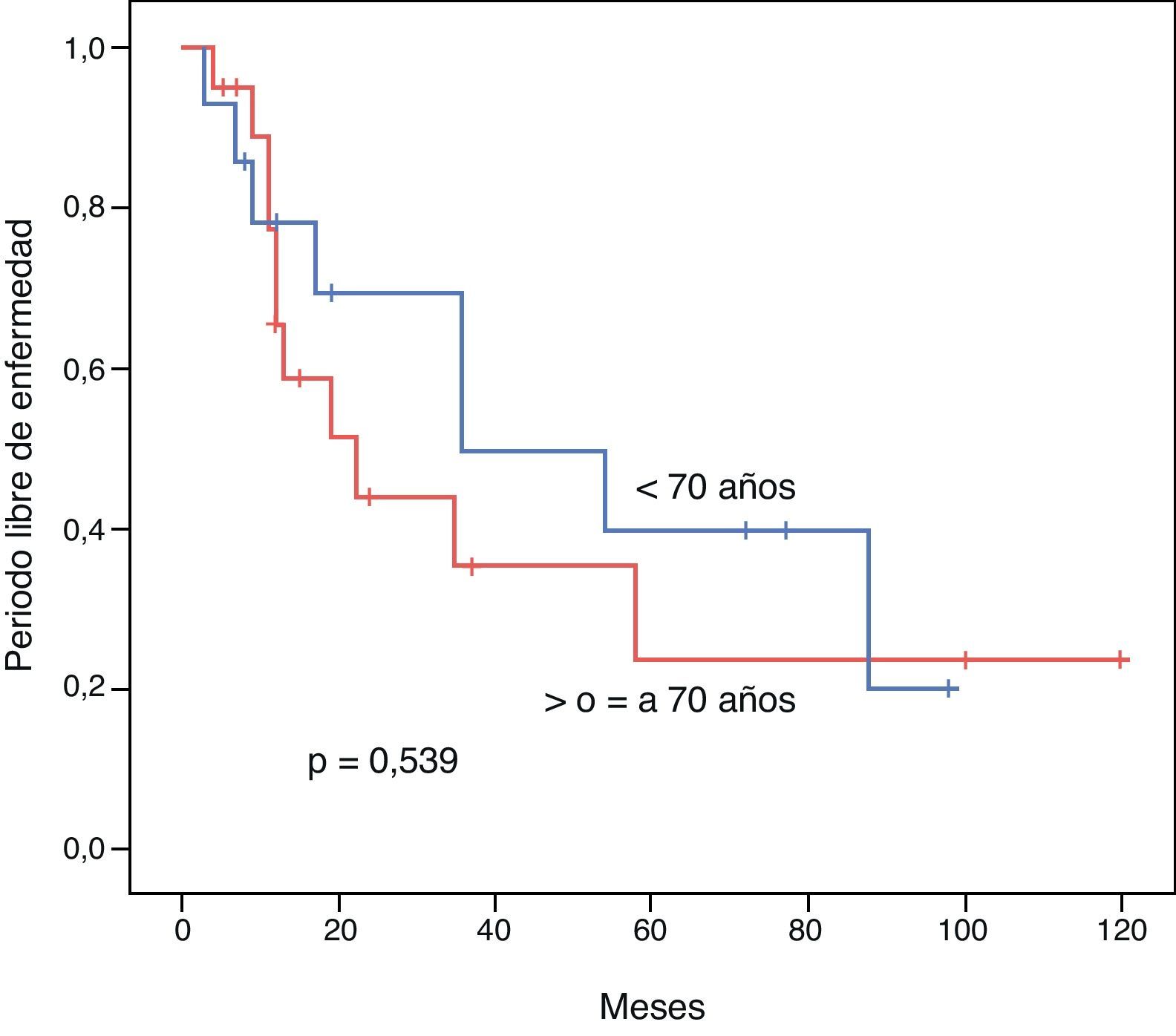
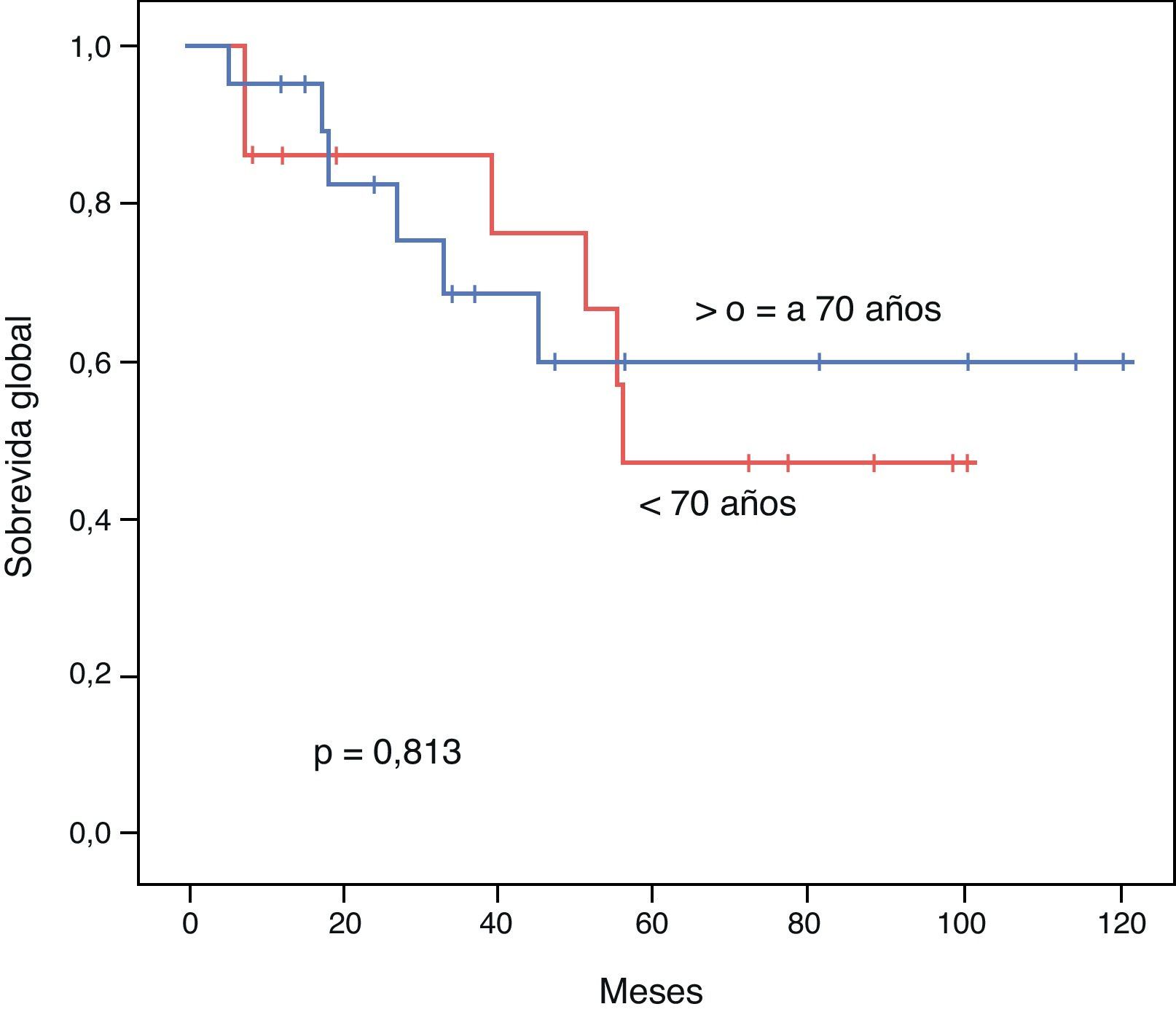
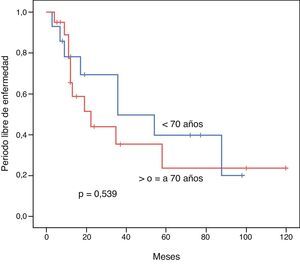
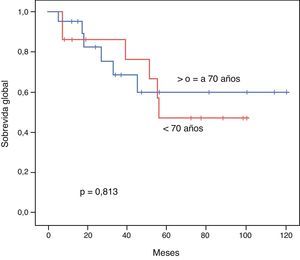
ResultadosAmbos grupos son similares en cuanto al estado pre-operatorio. El tiempo quirúrgico, tipo de procedimiento, estancia hospitalaria y morbimortalidad fueron similares. La sobrevida global para los pacientes jóvenes y seniles a 3 y 5 años fue de 85,7 vs. 68,7% y 47,6 vs. 60% respectivamente (p=0,813). El periodo libre de enfermedad a 3 y 5 años fue de 69,3 vs. 35,2% y 39,6 vs. 23,4% respectivamente (p=0,539). El análisis multivariado reveló la enfermedad multicéntrica y la alfa-feto-proteína elevada como factores pronósticos independientes de una sobrevida libre de enfermedad y global más cortas.
ConclusiónLos pacientes mayores de 70 años con carcinoma hepatocelular deben ser manejados en una manera similar a pacientes más jóvenes. Hay que tomar en cuenta factores de mal pronóstico como la multicentricidad y la alfa-feto-proteína elevadas.
The ageing population raises concerns about the adequacy of aggressive surgical procedures and their outcomes. The treatment of the elderly with hepatocellular carcinoma is one of the diseases that involve complicated management decisions. We set out to compare the results between an older and younger patient cohort with this disease are compared.
Material and methodsA total of 36 hepatic resections were performed on patients with hepatocellular carcinoma between 2000 and 2011. The cohort was divided into 2 groups (14 patients < 70 and 22 patients ≥ 70 years of age), and their results, disease free and overall survival were compared using Kaplan-Meir curves and log rank test. An attempt was also made at determining the predictive factors of a poor outcome among this patient cohort.
ResultsBoth groups were similar with regards to their pre-operative status. Operation time, procedure, hospital stay, and morbidity and mortality were similar. Overall survival at 3 and 5 years comparing the younger vs. the elderly group was 85.7% vs. 68.7% and 47.6% vs. 60%, respectively (P=.813). Disease free survival at 3 and 5 years comparing the younger vs. the elderly group was 69.3% vs. 35.2% and 39.6% vs. 23.4%, respectively (P=.539). Multivariate analysis of the whole cohort revealed multicentric diseases and elevated alpha-fetoprotein as independent factors of poor disease free survival and overall survival, respectively.
ConclusionsElderly patients with hepatocellular carcinoma should be managed in a similar fashion to younger patients. Surgeons should expect similar post-operative complications, disease free and overall survival.
La población mundial se está envejeciendo1, y como consecuencia hay un aumento paralelo en las enfermedades que afectan con mayor prevalencia a los pacientes ancianos. Aproximadamente el 60% de todas los tumores se diagnostican en la población mayor de 65 años de edad2,3. La incidencia de cáncer ajustada a la edad varía según el grupo de edad: en la población menor de 65 años es de 208/100.000 y en la población mayor de 65 es de 2.151/100.0002,3.
El carcinoma hepatocelular (HCC) se posiciona como una de los tumores más frecuentes a nivel mundial4. Se presenta generalmente en pacientes con hígados cirróticos y su manejo es multidisciplinar, enfocándose tanto en el tratamiento del tumor como en el manejo de la enfermedad hepática.
El tratamiento del HCC es primordialmente quirúrgico, obteniendo los mejores resultados mediante el trasplante hepático seguido por la resección5,6. Los pacientes que se consideran para resección son aquellos con tumor sin extensión extrahepática, Child-Pugh A, sin implicación de las estructuras vasculares o biliares principales, con una función hepática residual adecuada.
La selección cuidadosa de los pacientes para resección por hepatocarcinoma es de suma importancia y permite obtener buenos resultados y una baja mortalidad aun en pacientes con hígados cirróticos7. Existe cierta controversia en cuanto a la resección de tumores multicéntricos debido a que su presencia se piensa que significa una diseminación intrahepática de la lesión con posibles focos micrometastásicos. Aun así la resección de estas lesiones es permitida siempre y cuando exista un adecuado remanente hepático funcional8–10.
Los pacientes con clasificación Child-Pugh B o C que cumplen con los criterios de Milán son canalizados hacia trasplante, con la limitación de disponibilidad de órganos sanos1. La sobrevida global (SG) de los pacientes en los que se realiza trasplante es del 75% a 4 años, y cuentan con una periodo libre de enfermedad (PLE) del 83% a 4 años11. En los pacientes a los que se les realiza resección hepática la SG es del 33-44% a 5 años12, y la recurrencia de la enfermedad en estos pacientes es casi la norma y ronda entre el 40 y el 100% a los 5 años13,14.
Aunque la cirugía es el tratamiento de elección en el HCC, esta se hace con menos frecuencia en los pacientes ancianos que en los pacientes jóvenes. Esto, a diferencia del tratamiento de ciertos tumores como el cáncer de colon y mama donde se realiza el procedimiento quirúrgico con similar frecuencia entre pacientes jóvenes y seniles15.
Debido a este último dato, creemos que es importante establecer la seguridad de la resección hepática en el paciente anciano. Gran parte de la experiencia en relación con resección hepática por HCC en el anciano deriva de poblaciones asiáticas; sin embargo, aún se desconoce si estos resultados son específicos del contexto asiático y, por lo tanto, si son reproducibles en poblaciones occidentales. Una búsqueda, en la literatura médica sobre la resección hepática por hepatocarcinoma en pacientes > 70 años, tan solo identificó 3 estudios no asiáticos que evaluaran dichos resultados. De ellos tan solo uno analizó la SLP y la SG de los pacientes.
Tres estudios analizan únicamente los resultados postoperatorios sin análisis de sobrevida: uno realizado por Fortner et al. publicado en 1990 en el que se reporta una mortalidad operatoria elevada en pacientes ancianos (11,1%)16. En contraste, Riffat et al. y Aldrighetti et al., más recientemente, establecieron la seguridad de la cirugía hepática en el contexto de HCC en pacientes mayores de 70 años de edad17,18.
El estudio realizado en Italia por Ferrero et al. evalúa los resultados de la resección hepática en pacientes con HCC en este segmento de población y además hace un análisis de la SG y el PLE. Incluye a 64 pacientes mayores de 70 años de edad y en los que observaron un PLE y una SG similares a la cohorte de pacientes menores de 70 años de edad19.
Quisimos revisar nuestra experiencia durante los últimos 10 años y reportarla con el fin de contribuir a la escasa cantidad de literatura occidental que existe acerca de la resección hepática exclusivamente en el tratamiento de HCC en pacientes mayores de 70 años de edad.
Material y métodosRealizamos un estudio de cohorte retrospectivo comparando los resultados que obtuvimos en la resección hepática por HCC en pacientes menores vs. mayores de 70 años de edad en el Hospital de la Santa Cruz y San Pablo, un hospital de tercer nivel. Elegimos como punto de corte esta edad dado que se ha utilizado consistentemente en estudios similares para definir la población más anciana.
Se incluyó a 36 pacientes que se operaron entre enero del 2000 y enero del 2011, a quienes se les realizó resección hepática con intención curativa como tratamiento primario de un HCC. Estos pacientes se estudiaron de manera preoperatoria con tomografía computarizada (TC) y/o resonancia magnética nuclear (RMN), además de pruebas de laboratorio pertinentes incluyendo pruebas de función hepática y valores séricos de alfa-feto-proteína (AFP).
Todos los pacientes fueron evaluados previamente a su cirugía por un comité multidisciplinar formado por cirujanos hepatobiliares, gastroenterólogos, oncólogos médicos, radioterapeutas y radiólogos intervencionistas.
Solo se consideraron para cirugía pacientes Child-Pugh A, sin hipertensión portal significativa (<10mmHg), sin invasión de estructuras biliares o vasculares principales y con un remanente funcional hepático aceptable.
Se consideró la resección de tumores multicéntricos en pacientes cuyas lesiones fueran unilobulares siempre y cuando se respetaran los criterios oncológicos para la resección y no hubiese contraindicación por un volumen funcional hepático residual inaceptable.
Para el análisis se clasificó el tipo de resección de acuerdo a la clasificación de Brisbane del 200020 y posteriormente para su comparación se agruparon en resecciones mayores (≥3 segmentos) y menores (<3 segmentos).
El seguimiento en nuestro centro se realizó de forma regular en intervalos de 6 meses. Se documenta la AFP en cada visita subsecuente y se realiza una TC cada 6 meses-1 año a menos que existiera alguna sospecha de recurrencia en cuyo caso se tomaría de inmediato la TC.
Al momento de documentar una recurrencia, el caso se reevalúa en el comité multidisciplinario y se discuten las opciones de tratamiento.
En el caso de pérdida de seguimiento intentamos contactar a los pacientes con el número telefónico de su registro médico.
Dividimos a los pacientes en 2 grupos basados en su edad al momento de la intervención: el grupo control (<70 años de edad) y el grupo experimental (>70 años de edad). Recogimos variables preoperatorias pertinentes del estado del paciente, variables del procedimiento quirúrgico y relevantes del postoperatorio.
Las complicaciones posquirúrgicas se clasificaron según la clasificación de Clavien propuesta por Dindo et al.21. En esta clasificación aquellos eventos que desvían del postoperatorio normal y que no requieren ningún tipo de intervención son clasificados como grado i. Los grado ii son aquellos que se pueden resolver con intervención farmacológica únicamente. Las complicaciones clasificadas como grado iii requieren intervención quirúrgica, endoscópica o radiológica. Las complicaciones grado iv ponen en riesgo la vida del paciente y las complicaciones grado v conllevan su muerte.
Además realizamos un análisis sobre la población como un todo tratando de identificar variables preoperatorias asociadas a un peor resultado (en relación con PLE y SG).
Utilizamos la prueba T de Student para comparar medias de variables continuas y la prueba de Fisher para variables categóricas. Para el análisis de supervivencia se utilizaron las curvas de Kaplan-Meir y la prueba de log rank. Para el análisis multivariado utilizamos la regresión de Cox. Tomamos como un valor estadísticamente significativo p < 0,05. El análisis de los resultados se realizó mediante un programa estadístico IBM SPSS.
ResultadosIncluimos 36 pacientes en nuestro estudio con una edad promedio de 67,5 años, 30 (83,3%) masculinos. Todos clasificados como Child-Pugh A: 14 < 70 años de edad y 22 pacientes ≥ 70 años.
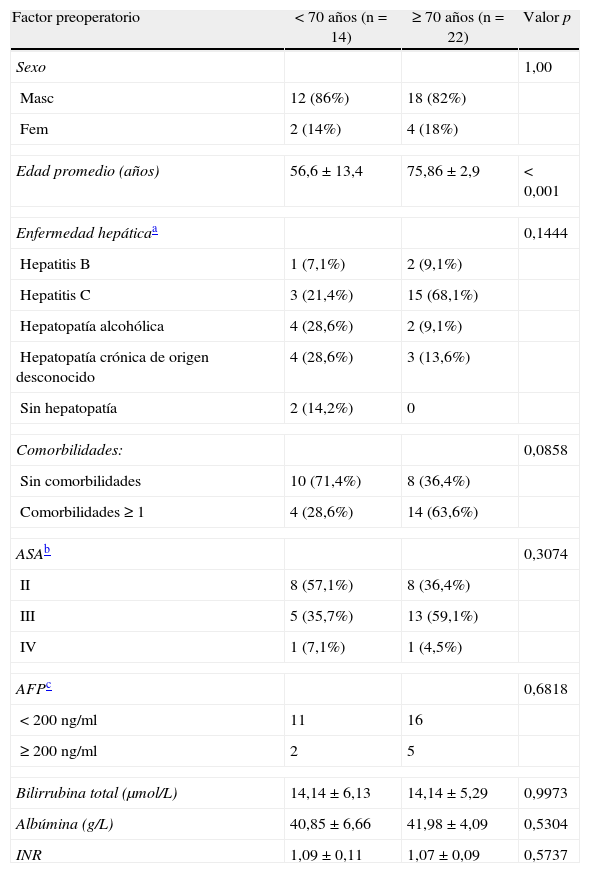
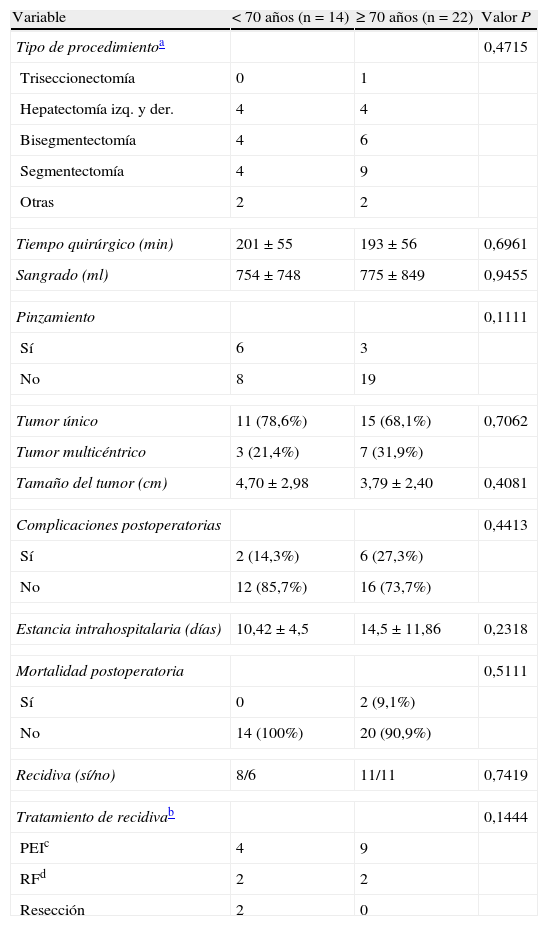
En nuestra cohorte, 18 (50%) tenían infección por VHC crónica, 3 (8,3%) VHB crónica, 6 (16,7%) hepatopatía alcohólica, 7 (19,4%) cirrosis sin etiología clara y 2 (5,5%) hígado sano. La comparación de las variables preoperatorias entre ambos grupos se resume en la tabla 1. Solo un paciente de toda la cohorte (<70 años) recibió tratamiento adyuvante con quimioembolización transarterial. Ninguno de los otros recibieron terapia neoadyuvante o adyuvante. Las variables perioperatorias se comparan en la tabla 2.
Variables preoperatorias por grupo
| Factor preoperatorio | <70 años (n=14) | ≥ 70 años (n=22) | Valor p |
| Sexo | 1,00 | ||
| Masc | 12 (86%) | 18 (82%) | |
| Fem | 2 (14%) | 4 (18%) | |
| Edad promedio (años) | 56,6±13,4 | 75,86±2,9 | <0,001 |
| Enfermedad hepáticaa | 0,1444 | ||
| Hepatitis B | 1 (7,1%) | 2 (9,1%) | |
| Hepatitis C | 3 (21,4%) | 15 (68,1%) | |
| Hepatopatía alcohólica | 4 (28,6%) | 2 (9,1%) | |
| Hepatopatía crónica de origen desconocido | 4 (28,6%) | 3 (13,6%) | |
| Sin hepatopatía | 2 (14,2%) | 0 | |
| Comorbilidades: | 0,0858 | ||
| Sin comorbilidades | 10 (71,4%) | 8 (36,4%) | |
| Comorbilidades ≥ 1 | 4 (28,6%) | 14 (63,6%) | |
| ASAb | 0,3074 | ||
| II | 8 (57,1%) | 8 (36,4%) | |
| III | 5 (35,7%) | 13 (59,1%) | |
| IV | 1 (7,1%) | 1 (4,5%) | |
| AFPc | 0,6818 | ||
| < 200 ng/ml | 11 | 16 | |
| ≥ 200 ng/ml | 2 | 5 | |
| Bilirrubina total (μmol/L) | 14,14±6,13 | 14,14±5,29 | 0,9973 |
| Albúmina (g/L) | 40,85±6,66 | 41,98±4,09 | 0,5304 |
| INR | 1,09±0,11 | 1,07±0,09 | 0,5737 |
Procedimiento quirúrgico y variables postoperatorias
| Variable | <70 años (n=14) | ≥ 70 años (n=22) | Valor P |
| Tipo de procedimientoa | 0,4715 | ||
| Triseccionectomía | 0 | 1 | |
| Hepatectomía izq. y der. | 4 | 4 | |
| Bisegmentectomía | 4 | 6 | |
| Segmentectomía | 4 | 9 | |
| Otras | 2 | 2 | |
| Tiempo quirúrgico (min) | 201±55 | 193±56 | 0,6961 |
| Sangrado (ml) | 754±748 | 775±849 | 0,9455 |
| Pinzamiento | 0,1111 | ||
| Sí | 6 | 3 | |
| No | 8 | 19 | |
| Tumor único | 11 (78,6%) | 15 (68,1%) | 0,7062 |
| Tumor multicéntrico | 3 (21,4%) | 7 (31,9%) | |
| Tamaño del tumor (cm) | 4,70±2,98 | 3,79±2,40 | 0,4081 |
| Complicaciones postoperatorias | 0,4413 | ||
| Sí | 2 (14,3%) | 6 (27,3%) | |
| No | 12 (85,7%) | 16 (73,7%) | |
| Estancia intrahospitalaria (días) | 10,42±4,5 | 14,5±11,86 | 0,2318 |
| Mortalidad postoperatoria | 0,5111 | ||
| Sí | 0 | 2 (9,1%) | |
| No | 14 (100%) | 20 (90,9%) | |
| Recidiva (sí/no) | 8/6 | 11/11 | 0,7419 |
| Tratamiento de recidivab | 0,1444 | ||
| PEIc | 4 | 9 | |
| RFd | 2 | 2 | |
| Resección | 2 | 0 | |
PEI: inyección percutánea de etanol; RF: radiofrecuencia.
El seguimiento promedio (mediana) para el grupo de pacientes < 70 años fue de 49,2 meses y el seguimiento para el grupo ≥ 70 años fue de 45,9 meses.
En el grupo de pacientes < 70 años hubo 5 complicaciones. Una colección intraabdominal clasificada como Clavien grado i; 4 abscesos clasificados como Clavien grado ii. En el grupo de pacientes más seniles hubo 2 colecciones de bilis clasificadas como Clavien grado i. Asimismo hubo 6 complicaciones (3 abscesos, una infección de herida, una descompensación ascítica y un paciente con fiebre y hemocultivo positivo para bacilos gramnegativos) clasificadas como Clavien grado ii.
En cuanto a las complicaciones mayores, en la cohorte < 70 años tuvimos una complicacion Clavien grado iiib que consistió en una fístula biliar que requirió colangiografía pancreática endoscópica retrógrada con colocación de endoprótesis. Tuvimos una complicación Clavien grado iva en un paciente con neumotórax derecho que requirió colocación de tubo pleural y traslado a UCI. En el grupo más senil hubo una complicación Clavien iiib en un paciente con dificultad respiratoria relacionado con hemoperitoneo y sangrado que requirió reintervención. Dos pacientes presentaron complicación Clavien grado v: un paciente presentó necrosis postoperatoria de 2 segmentos hepáticos que requirió reintervención; otro paciente presentó dehiscencia de una reparación ileal por la que tuvo que ser reintervenido. Los 2 pacientes que fallecieron en este grupo fueron el de la fuga de reparación ileal que cursó en el postoperatorio con sepsis y el paciente con necrosis de segmentos hepáticos, ambos se excluyeron del análisis de sobrevida ya que este análisis está enfocado a la valoración de aquellos pacientes cuya resección cursó sin mortalidad postoperatoria.
El PLE para los pacientes < 70 años vs. ≥ 70 años fue de 52,1 vs. 45,3 meses respectivamente (p=0,539). La SG a 3 y 5 años tras una resección exitosa fue de 85,7 vs. 68,7% y 47,6 vs. 60% respectivamente (p=0,813). Mostramos las curvas de Kaplan-Meir de PLE y SG en figuras 1 y 2.
Realizamos un análisis univariado y multivariado de la cohorte como un todo tratando de detectar variables que funcionaran como predictivas de un mal pronóstico en relación con PLE y SG. En el análisis univariado ninguna de las pruebas de función hepática preoperatorias (AST, ALT, albúmina, GGT, bilirrubina total, fosfatasa alcalina y plaquetas) se asociaron a un peor pronóstico. En el análisis univariado los pacientes con AFP < 200 ng/ml vs. > 200 ng/ml vs. tuvieron un PLE medio de 10,5 vs. 60,8 meses (p=0,001) y una SG de 91,0 vs. 20,6 meses (p < 0,001) respectivamente.
En relación con enfermedad única vs. tumor multicéntrico, el PLE medio fue de 11,7 vs. 64,4 meses (p < 0,001) y la SG media fue de 31,2 vs. 100,3 meses respectivamente (p < 0,001). Pacientes con tamaño tumoral ≤ 3 vs. >3cm tuvieron un PLE de 64,8 vs. 60,4 meses (p=0,806) y un PLE de 112 vs. 76,2 meses (p=0,200).
Nuestro análisis multivariado mostró que la presencia de un tumor único vs. multicéntrico afecta de manera independiente el PLE (p=0,001, riesgo relativo 8,1). Así mismo, una AFP > 200 ng/ml afecta, de forma independiente, la SG (p < 0,001, riesgo relativo 15,0).
DiscusiónLos pacientes mayores de 70 años se deberían considerar para resección hepática esperando resultados similares tanto en morbimortalidad como en PLE y SG en comparación con pacientes menores de 70 años de edad. Cuando comparamos las variables preoperatorias de nuestra población fueron similares en todos los apartados con la excepción de una tendencia de los pacientes más seniles a presentar más condiciones comórbidas (28,6 vs. 63,6%) y una proporción más elevada en el grupo senil de VHC (68,1%). La proporción elevada de comorbilidades es esperada como un resultado natural del proceso de envejecimiento que ha sido reportado por otros autores22. En relación con el VHC no es claro si los pacientes con infección de VHC tienen un peor pronóstico, ya que existen reportes con resultados variables23–25.
La pérdida sanguínea, procedimiento y tiempo fueron similares entre ambos grupos. Esto es importante ya que el tipo de resección no se debe minimizar en el grupo anciano, y el cirujano debe tratar de realizar una resección curativa de acuerdo a los principios que guían las resecciones oncológicas en pacientes con HCC (resecciones segmentarias). El uso de procedimientos menos agresivos en los pacientes ancianos es común debido a su alta tasa de comorbilidades22,26. Otras opciones de tratamiento (ablación con radiofrecuencia o inyección de etanol) pueden resultar atractivas al cirujano responsable, sin embargo, los resultados con estas técnicas son inferiores comparados con la resección, aun en lesiones pequeñas27, y su uso en los pacientes ancianos puede afectar de manera adversa el PLE y la SG.
La AFP preoperatoria, el tamaño tumoral y la presencia/ausencia de enfermedad multicéntrica fueron similares en ambos grupos. Esto es importante porque muestra que los pacientes operados en ambos grupos tenían unas características similares y, por lo tanto, la posibilidad de un sesgo en la selección de los pacientes es poca. Habiendo tomado esto en cuenta, encontramos que el PLE y la SG fueron similares entre ambas poblaciones. De la misma manera las complicaciones postoperatorias y la mortalidad también fueron similares en ambos grupos. Estos resultados se asemejan a los que se han reportado en estudios asiáticos de mayor escala28–30.
La recurrencia tumoral se trató principalmente con técnicas ablativas, y 2 pacientes dentro del grupo < 70 años de edad fueron tratados con re-resección. Aunque esta diferencia no fue estadísticamente significativa, es posible que haya cierta reserva al considerar un paciente > 70 años para re-resección. Sin embargo, otros estudios han mostrado que la re-resección es el tratamiento más efectivo para el HCC recurrente31, y que este procedimiento es una alternativa aceptable en la población mayor29.
Por el número pequeño de pacientes en nuestra serie, realizamos un análisis univariado y multivariado en la cohorte como un todo para tratar de identificar factores pronósticos relacionados con la SG y PLE. Nuestro análisis univariado reveló que la enfermedad multicéntrica y los niveles de AFP > 200 ng/ml están asociados a un PLE y SG más cortos. No encontramos en nuestro análisis univariado que el tamaño tumoral o las variables de PFH preoperatorias tuvieran un impacto en el PLE o la SG.
En el análisis multivariado el único factor pronóstico independiente de un PLE más corto fue la presencia de enfermedad multicéntrica. El único factor independiente asociado a una SG más corta fue la AFP > 200 ng/ml. La AFP elevada se ha propuesto que está relacionada con invasión vascular y progresión del HCC32, y que además provoca efectos inmunosupresores en el paciente33,34.
Nuestro estudio no mostró diferencia estadísticamente significativa en PLE y SG en pacientes con tumores > 3 vs. < 3 cm, aunque hubo una tendencia a una SG disminuida en pacientes con tumores > 3cm. En relación con este aspecto existe evidencia conflictiva en cuanto al tamaño tumoral y su relación al pronóstico. Shah reporta que el PLE fue significativamente más corto en pacientes con tumores muy grandes, mientras que la SG no tuvo diferencia significativa en pacientes con tumores < 10 vs. > 10 cm35. Ng realizó un análisis multiinstitucional y comparó pacientes con tumores < 5 vs. tumores multicéntricos o > 5cm y encontró que el grupo con tumores grandes o multicéntricos tenía peor pronóstico después de la resección36, además los tumores de mayor tamaño tenían una biología tumoral más agresiva36. Creemos que el prónostico de los pacientes con adenocarcinomas de gran tamaño están relacionados con una biología tumoral más agresiva, así como con una mayor posibilidad de que se asocien a una mayor invasión vascular37, lo que hace empeorar el prónostico y la SG.
Una limitación de nuestro estudio es el número pequeño de pacientes. Sin embargo, nosotros creemos que es un estudio valioso en el que se establece la seguridad de la resección hepática en una población no asiática.
En conclusión, creemos que los pacientes seniles se deberían tratar siguiendo los mismos criterios que su contraparte más joven ya que sus resultados y pronóstico son similares. La selección apropiada de pacientes y valoración de los mismos por un comité multidisciplinar es indispensable y debería realizarse por un equipo que se especializara en cirugía hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.