El cáncer de colon es una enfermedad de elevada prevalencia cuya incidencia ha aumentado en los últimos años1. El tratamiento actual del cáncer de colon localmente avanzado, entendiendo como tal los estadios ii (T3-4/N0/M0) y iii (T1-4/N+/M0), se fundamenta en la realización de cirugía oncológica. En los estadios iii y en los ii que, en ausencia de inestabilidad de microsatélites, asocian factores de mal pronóstico-tumores T4, indiferenciados, con invasión perineural o linfovascular, con obstrucción o perforación intestinal, con una linfadenectomía menor a 12 ganglios, con márgenes afectos tras la intervención o con un valor del CEA al diagnóstico mayor a 5-10ng/dl, se recomienda la administración de quimioterapia adyuvante2–5.
Con esta combinación terapéutica, la supervivencia a 5 años oscila ampliamente entre el 66% en el estadio IIA y el 28% en el estadio IIIC6. Estos resultados, que de alguna manera distan de ser óptimos, representan un fracaso parcial en el control local y a distancia de la enfermedad.
En este escenario parece razonable buscar alternativas de tratamiento para mejorar el pronóstico de los pacientes. Una de ellas es la quimioterapia neoadyuvante, con la que existe amplia experiencia en otros tumores digestivos7. Esta modificación de la secuencia terapéutica tiene una serie de ventajas teóricas: disminución del volumen tumoral preoperatorio, menor riesgo de diseminación celular del tumor durante la cirugía, estudio «in vivo» de la eficacia de la quimioterapia y administración precoz de la misma, aumentando la tasa de cumplimentación, ya que es independiente de las eventuales complicaciones quirúrgicas. En contraposición, existe el riego de sobretratamiento –secundario a una sobreestadificación radiológica–, el temor a la progresión tumoral durante el tiempo de administración de la quimioterapia neoadyuvante y el riesgo teórico de una mayor morbilidad postoperatoria.
En la actualidad, este planteamiento terapéutico preoperatorio está en fase de estudio, habiéndose publicado varios trabajos con resultados preliminares, en los que se muestra que es una práctica segura –en términos de complicaciones quirúrgicas y toxicidad oncológica–, que permite obtener una adecuada respuesta tumoral clínica y patológica, con escaso riesgo de progresión y con una supervivencia alentadora8–10. Existen varios ensayos clínicos en fase de reclutamiento activo de pacientes en diferentes países.
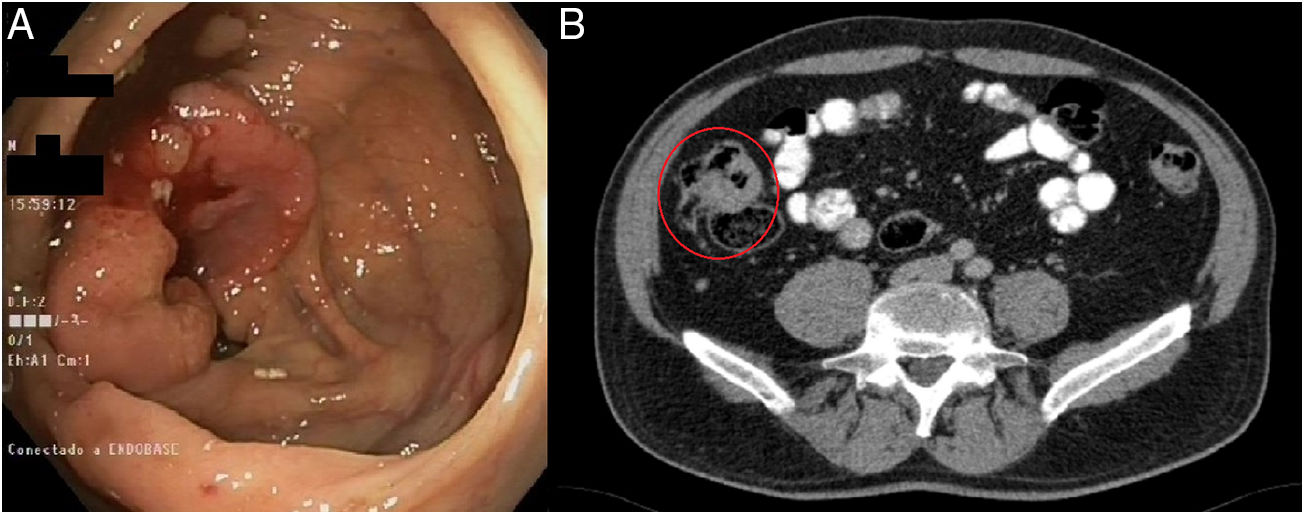
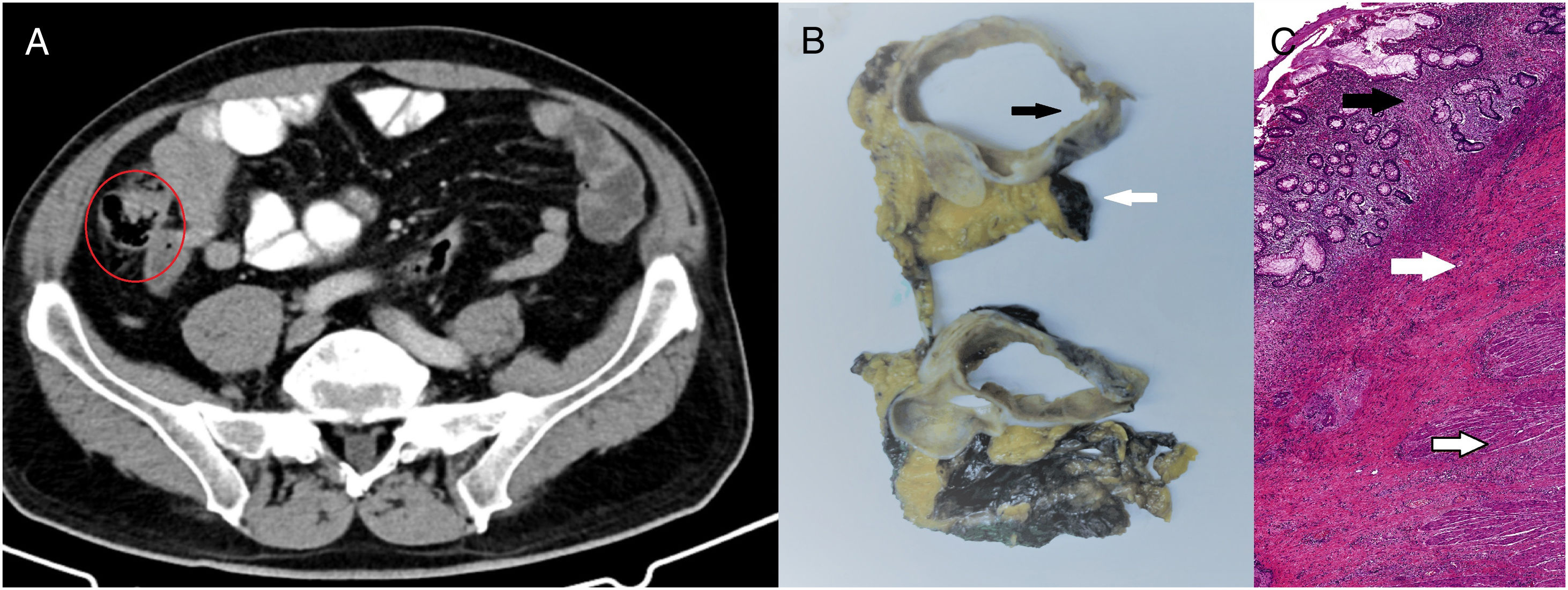
Se presenta un caso perteneciente al ensayo clínico ELECLA (Registro Español de Estudios Clínicos: 2016-002970-10), en el que se analiza el papel de la quimioterapia neoadyuvante en el cáncer de colon localmente avanzado, considerándose como tal aquellos tumores T4 o T3 con más de 5mm de invasión extramural, con o sin afectación ganglionar y sin evidencia de metástasis a distancia, mediante tac. Se trata de un paciente de 62 años al que se le realizó una colonoscopia por estudio de anemia, en la que se observó un adenocarcinoma infiltrante de ciego (fig. 1A). En el tac de estadificación se objetivó la tumoración cecal con afectación de la válvula ileocecal: T3N1M0 (fig. 1B). Tras ser informado de la posibilidad de participar en el ensayo y firmar los correspondientes consentimientos informados, el paciente fue incluido en el estudio, asignándosele aleatoriamente a recibir 3 ciclos preoperatorios de quimioterapia basada en el esquema XELOX. Se obtuvo una reducción del 71% del volumen tumoral, pasando a ser un tumor T2N0M0, evaluado en el tac realizado preoperatoriamente (fig. 2A). Cuatro semanas después de la finalización de la quimioterapia se le realizó una hemicolectomía derecha por vía laparoscópica, siendo dado de alta al tercer día postoperatorio sin ninguna complicación quirúrgica. En el análisis anatomopatológico se observó ausencia de tumor residual, con respuesta patológica completa (grado de regresión tumoral 0 en la escala de Ryan modificada) (fig. 2B y 2C). Tras un seguimiento de 12 meses, el paciente se encuentra asintomático y permanece libre de enfermedad.
Pruebas de diagnóstico: 1A: Colonoscopia: Neoplasia de colon derecho adyacente a ciego y válvula ileocecal, con confirmación histológica de adenocarcinoma infiltrante. 1B: Tac: Masa en ciego con afectación de la válvula ileocecal de 7×3,6×3cm, con infiltración de la grasa adyacente y adenopatías satélites. T3N1M0.
Pruebas de valoración de respuesta: 2A: Tac tras quimioterapia neoadyuvante: Disminución de la masa tumoral, ahora de 4×2,2×2,5cm, con desaparición de la especulación de los bordes y disminución de las adenopatías. T2N0M0. 2B: Imagen macroscópica: Pared de colon sin objetivar tumor (flecha negra). Mesocolon marcado con tinta china (flecha blanca). 0/39 ganglios afectos. 2C: Imagen microscópica: tinción de hematoxilina-eosina. 40x. Respuesta patológica completa. Mucosa con cambios regenerativos, sin evidencia de displasia ni de malignidad (flecha negra). Submucosa con marcados signos de fibrosis (flecha blanca). Muscular propia normal (flecha hueca).
En este caso clínico se muestra un ejemplo de eficacia de la quimioterapia neoadyuvante en el cáncer de colon localmente avanzado. En los diferentes ensayos clínicos que se están realizando en la actualidad, se han descrito unas tasas de respuesta patológica completa que oscilan entre el 2% y el 4,6%, con diferentes esquemas basados en capecitabina –o ácido folínico y fluorouracilo– y oxaliplatino, con o sin panitumumab8–10. Se ha de determinar si el tiempo entre la finalización de la quimioterapia neoadyuvante y la cirugía –descrito entre 24 y 61 días8,10– y la adición de anticuerpos monoclonales pueden influir en las tasas de respuesta patológica. Se precisa completar los ensayos clínicos que están en marcha y tener un seguimiento a largo plazo para determinar el impacto real que este tipo de hallazgos puede tener en la supervivencia.
El ensayo clínico ELECLA ha recibido la Beca de la Fundación Española de Coloproctología para proyectos de investigación 2018, y la Beca de la Gerencia Regional de Salud de Castilla y León (GRS 1890/A/18).
Conflicto de interesesNinguno.