La aparición de una nueva lesión pulmonar, bien un tumor metacrónico o una recidiva, en pacientes neumonectomizados plantea un reto terapéutico, en el que la cirugía en muchas ocasiones se considera contraindicada. El objetivo de nuestro estudio es valorar la morbimortalidad de la cirugía de resección pulmonar sobre pulmón único.
MétodosRevisamos a todos los pacientes a los que se les realizó una neumonectomía y presentaron una nueva lesión en el pulmón remanente entre 1994 y 2012.
ResultadosLa serie consta de 12 pacientes (10 varones y 2 mujeres) con una edad media de 71 años (54-81 años). El FEV1 medio fue de 1.470ml (54,2%) y la CVF de 2.153ml (61,5%). Tras una mediana de 34,5 meses se les intervino de una segunda lesión en el pulmón contralateral, realizándose en todos los casos resecciones pulmonares atípicas. La anatomía patológica mostró metástasis de tumor primario pulmonar en 2 pacientes; tumor metacrónico, en 6 pacientes; metástasis de carcinoma de origen extratorácico, en 3 pacientes y nódulo benigno en un paciente. Se registraron complicaciones en 4 pacientes (33,4%): arritmia cardíaca en 2 pacientes e insuficiencia respiratoria en otros 2 pacientes. No hubo ningún fallecimiento postoperatorio.
ConclusiónLa resección pulmonar sobre pulmón único es un procedimiento seguro con una aceptable morbimortalidad, en la que es de gran importancia una meticulosa selección de los pacientes.
After pneumonectomy, the development of a new lung cancer or a recurrence in the residual lung is a challenge. Surgery often is considered contraindicated. The goal of our study is to assess the morbidity and mortality of lung resection on a single lung.
MethodsAll patients who underwent lung resection after pneumonectomy from January 1996 through December 2012 were reviewed.
ResultsThere were 12 patients (10 men and 2 women). Mean age was 71 years (range, 54-81 years). Mean preoperative FEV1 was 1470ml (52%) and preoperative FVC 2153ml (61,5%). Subsequent pulmonary resection was performed after a median follow-up of 34,5 months. Wedge resection was performed in all patients. Diagnosis was pulmonary mestastatic lung cancer in 2 patients, metachronous lung cancer in 6, metastatic extrathoracic cancer in 3 and benign nodule in one. Complications occurred in 4 patients (33,4%) while operative mortality was nil.
ConclusionsLung resection on a single lung is a safe procedure associated with acceptable morbidity and mortality. Careful patient selection is very important.
Los pacientes intervenidos de carcinoma de pulmón (CP) presentan al año de la cirugía un riesgo de entre un 2 y un 5% de desarrollar una recidiva1,2 y entre el 1 y el 5% de desarrollar un segundo carcinoma primario de pulmón en función del estadio inicial del tumor previo3,4. El reto en estos casos se plantea cuando la cirugía previa es una neumonectomía. La cirugía sobre un pulmón único es poco común ya que, en la mayoría de los casos, el estatus funcional del paciente o la presencia de metástasis a distancia contraindican un segundo procedimiento5. Así mismo, en muchas ocasiones, es el desconocimiento por parte de los clínicos lo que priva a los pacientes de ser intervenidos mediante una cirugía sobre pulmón único con el concepto erróneo de que la realización de una neumonectomía contraindica una resección pulmonar ulterior, eliminando la que, probablemente, sea la única opción curativa de estos pacientes. El propósito de esta revisión fue analizar nuestra experiencia en pacientes intervenidos de lesiones pulmonares con el antecedente de neumonectomía en cuanto a la morbimortalidad postoperatoria.
MétodosEntre enero de 1994 y diciembre de 2012 se realizaron 394 neumonectomías. Se intervino a 12 pacientes (3%) de lesiones pulmonares por enfermedad maligna, bien por CP o por metástasis pulmonares. Los criterios de inclusión fueron: pacientes con lesiones resecables, sin lesiones a distancia y con un estatus funcional adecuado para tolerar una resección pulmonar.
Todos los pacientes con antecedente de CP fueron seguidos postoperatoriamente con TAC cada 6 meses los 2 primeros años y, luego, anualmente. El seguimiento del paciente con diagnóstico de lesiones metastásicas fue realizado por el Servicio de Oncología. El estudio preoperatorio de todos los pacientes incluyó una TAC toracoabdominal, pruebas funcionales respiratorias, fibrobroncoscopia y, en los últimos años del estudio, una PET-TAC. Así mismo, todos los pacientes fueron informados del procedimiento y firmaron el consentimiento informado para ser tratados con él.
Los datos analizados en estos pacientes fueron: demográficos (edad, sexo), aquellos relacionados con el episodio de la neumonectomía (histología, TNM), los relacionados con el episodio de la resección posterior (intervalo libre de enfermedad, estudio preoperatorio, aspectos quirúrgicos, morbimortalidad postoperatoria) y la supervivencia de la serie. Utilizamos los criterios de Martini y Melamed para diferenciar a los pacientes con segundos tumores primarios de los pacientes con metástasis. La mortalidad postoperatoria incluyó a aquellos pacientes que fallecieron en los 30 días siguientes a la cirugía o que fallecieron posteriormente a dicho periodo pero en el mismo ingreso. Para unificar el estadio TNM reclasificamos a todos los pacientes al nuevo sistema TNM del 2007.
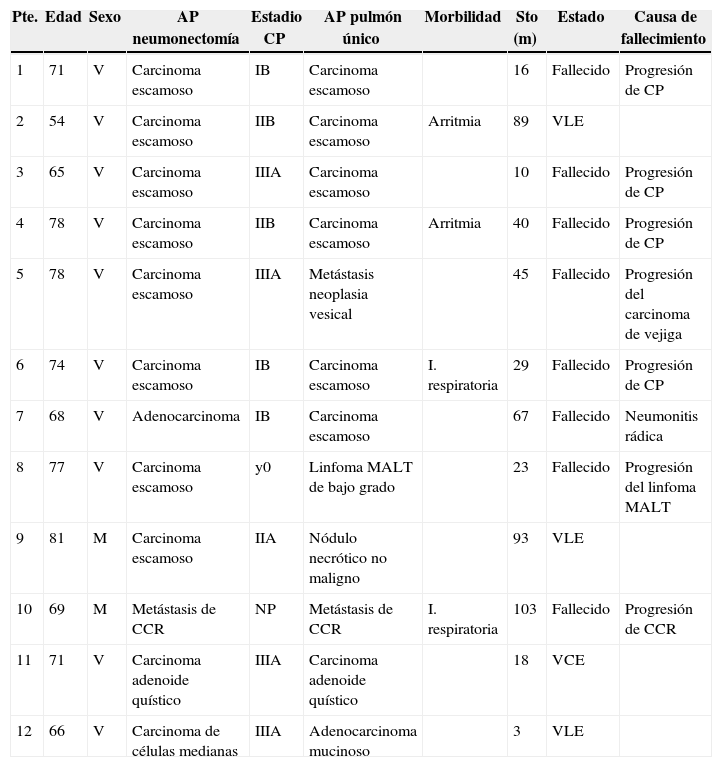
ResultadosLa serie está compuesta por 12 pacientes, 10 varones (83,3%) y 2 mujeres (16,7%) con una edad media de 71 años (54-81 años). La tabla 1 resume las características de la serie. La histología postoperatoria tras la neumonectomía fue de carcinoma escamoso de pulmón en 8 pacientes (66,6%), adenocarcinoma de pulmón en un paciente (8,3%), carcinoma adenoide quístico en un paciente (8,3%), carcinoma de células medianas en un paciente (8,3%) y metástasis pulmonar de carcinoma colorrectal (CCR) en un paciente (8,3%). A esta paciente se le realizó una lobectomía superior izquierda en un primer episodio, completándose la neumonectomía por una nueva recidiva del CCR. El estadio patológico de los pacientes con tumor primario de pulmón en el episodio de la neumonectomía fue: estadio yp0 (1 paciente, 9%), pIB (3 pacientes, 27,3%), pIIA (1 paciente, 9%), pIIB (2 pacientes, 18,2%) y pIIIA (4 pacientes, 36,5%).
Características de la serie
| Pte. | Edad | Sexo | AP neumonectomía | Estadio CP | AP pulmón único | Morbilidad | Sto (m) | Estado | Causa de fallecimiento |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 71 | V | Carcinoma escamoso | IB | Carcinoma escamoso | 16 | Fallecido | Progresión de CP | |
| 2 | 54 | V | Carcinoma escamoso | IIB | Carcinoma escamoso | Arritmia | 89 | VLE | |
| 3 | 65 | V | Carcinoma escamoso | IIIA | Carcinoma escamoso | 10 | Fallecido | Progresión de CP | |
| 4 | 78 | V | Carcinoma escamoso | IIB | Carcinoma escamoso | Arritmia | 40 | Fallecido | Progresión de CP |
| 5 | 78 | V | Carcinoma escamoso | IIIA | Metástasis neoplasia vesical | 45 | Fallecido | Progresión del carcinoma de vejiga | |
| 6 | 74 | V | Carcinoma escamoso | IB | Carcinoma escamoso | I. respiratoria | 29 | Fallecido | Progresión de CP |
| 7 | 68 | V | Adenocarcinoma | IB | Carcinoma escamoso | 67 | Fallecido | Neumonitis rádica | |
| 8 | 77 | V | Carcinoma escamoso | y0 | Linfoma MALT de bajo grado | 23 | Fallecido | Progresión del linfoma MALT | |
| 9 | 81 | M | Carcinoma escamoso | IIA | Nódulo necrótico no maligno | 93 | VLE | ||
| 10 | 69 | M | Metástasis de CCR | NP | Metástasis de CCR | I. respiratoria | 103 | Fallecido | Progresión de CCR |
| 11 | 71 | V | Carcinoma adenoide quístico | IIIA | Carcinoma adenoide quístico | 18 | VCE | ||
| 12 | 66 | V | Carcinoma de células medianas | IIIA | Adenocarcinoma mucinoso | 3 | VLE |
AP: anatomía patológica; CCR: carcinoma colorrectal; CP: cáncer de pulmón; I. respiratoria: insuficiencia respiratoria; M: mujer; Pte: paciente; Sto: seguimiento; V: varón; VCE: vivo con enfermedad; VLE: vivo libre de enfermedad.
La mediana del tiempo entre la neumonectomía y la posterior cirugía fue de 34,5 meses. El número de lesiones observadas en la TAC fue una en 10 pacientes (83,3%) y 2 en 2 pacientes (16,7%), siendo el tamaño medio de las lesiones de 16,3mm (7-29mm). Con relación a las pruebas funcionales respiratorias preoperatorias, el FEV1 medio fue de 1.470mL (54,2%) y la CVF de 2.153mL (61,5%). Solo 2 pacientes tenían DLCO y KCO como parte del estudio funcional preoperatorio, que correspondió a los pacientes más recientes, periodo en el que se estandarizó en nuestro centro la determinación de dichos valores en la valoración preoperatoria. Las medias de los valores fueron 75% y 148%, respectivamente. En el estudio de extensión, ningún paciente presentaba afectación extratorácica. Solo a 3 pacientes (25%) se les realizó una PET-TC como parte del estudio de extensión preoperatorio. Fue positivo para la lesión en 2 de ellos (66,6%) y negativo en un paciente (33,4%).
Con relación a la cirugía, el abordaje fue la toracotomía en 11 pacientes (91,6%) y la VATS en un paciente (8,4%). En todos los pacientes la resección realizada fue la resección atípica (RA), realizándose una RA en 10 pacientes (83,3%), 2 RA en un paciente (8,35%) y 3 RA en otro paciente (8,35%). La duración media de las intervenciones fue de 151 min. Solo 5 pacientes (41,6%) fueron extubados en quirófano.
La anatomía patológica definitiva fue de carcinoma escamoso en 5 pacientes (41,6%), metástasis pulmonar de tumor de origen extratorácico en 3 pacientes (25%) (CCR, carcinoma vesical y linfoma gástrico MALT), tumoración necrótica benigna en un paciente (8,3%), carcinoma adenoide quístico en un paciente (8,3%) y adenocarcinoma mucinoso en un paciente (8,3%). El paciente con diagnóstico de metástasis de carcinoma vesical había sido intervenido 13 meses antes de dicha neoplasia. El paciente con una metástasis de linfoma gástrico MALT fue intervenido de una gastrectomía por ulcus y con diagnóstico 20 meses antes de dicho linfoma en la anastomosis. El estadio TNM de los pacientes con lesión de origen pulmonar fue IA en 5 pacientes (71,4%) y estadio IB en 2 pacientes (28,6%). En todos los pacientes los márgenes de resección estuvieron libres de tumor.
Con relación a la morbimortalidad postoperatoria, no se registró complicación alguna en 8 pacientes (66,6%). Se registraron únicamente complicaciones clasificadas como menores (definidas como aquellas manejadas en planta de hospitalización) en 4 pacientes (33,4%). Estas complicaciones fueron arritmia cardíaca en 2 pacientes (50%) e insuficiencia respiratoria en 2 pacientes (50%). No hubo ningún fallecimiento postoperatorio. La mediana de la estancia postoperatoria fue de 6,5 días (3-14 días).
Tras un seguimiento medio de 44,6 meses, 8 pacientes fallecieron (66,6%), un paciente se encuentra vivo con enfermedad (8,7%) y 3 pacientes vivos libres de enfermedad (25%).
DiscusiónLos pacientes intervenidos de un CP con resección completa presentan un riesgo de un 5-10% de desarrollar un nuevo CP1 y de un 30-80% de recidiva, porcentaje que irá en aumento conforme aumente la supervivencia del paciente2,4. El reto se plantea cuando la recidiva o el nuevo carcinoma aparecen en un paciente previamente neumonectomizado. Es por ello por lo que las series que ofrecen la mejor relevancia con relación a la cirugía en pacientes con pulmón único son escasas y recogen, entre todas, poco más de 100 casos5–13. Los principales motivos por los que estos pacientes no son derivados a la cirugía vienen determinados por el tamaño tumoral, la localización de la lesión, el estadio del nuevo tumor, la mala reserva funcional de los pacientes neumonectomizados o la falsa creencia por parte de algunos clínicos de que el antecedente de una neumonectomía es una contraindicación para una posterior resección pulmonar por poder conllevar una elevada morbimortalidad. Nuestros resultados demuestran que la cirugía pulmonar sobre pulmón único puede llevarse a cabo con buenos resultados de morbimortalidad.
La mayoría de los pacientes (70-80%) que presentan nuevas lesiones pulmonares tras una neumonectomía suelen estar asintomáticos al diagnóstico: la mayoría se descubre durante el seguimiento clínico y radiológico5,14–16. Por ello, los pacientes tratados quirúrgicamente de cáncer de pulmón precisan de un seguimiento a largo plazo17. No obstante, un metaanálisis y una revisión sistemática llevados a cabo por Calman et al. recientemente no mostraron ningún beneficio claro en la supervivencia de 1.669 pacientes con relación al seguimiento intensivo18.
El estudio preoperatorio de pacientes con lesiones pulmonares en pulmón único es el mismo que el que se lleva a cabo en el cáncer inicial. La valoración radiológica busca no solo valorar las lesiones pulmonares sino también descartar la presencia de lesiones a distancia. Habitualmente el diagnóstico por imagen de elección es la TAC toracoabdominal. En casos seleccionados, puede ser recomendable realizar una TAC cerebral en busca de metástasis a dicho nivel. Así mismo, la realización de una PET-TC nos ayudará a descartar afectación mediastínicas y a distancia5,6. En nuestra serie, solo a 3 pacientes, los más recientes de la serie, se les realizó una PET-TC, debido a la incorporación en los últimos años de esta técnica en la evaluación preoperatoria de los pacientes con sospecha de cáncer de pulmón. Ninguno de los pacientes presentaba en la PET-TC afectación ganglionar hiliar, mediastínica ni a distancia.
Como hemos comentado anteriormente, uno de los principales motivos de contraindicación de dicha cirugía es el estatus funcional del paciente tras una neumonectomía. En la serie de Donington et al. de 772 pacientes tratados mediante neumonectomía5, solo un 3% de estos pudieron ser intervenidos mediante una segunda resección pulmonar. En dicha serie, el FEV1 preoperatorio medio fue de 1.470mL (rango, 660-2.550). En nuestra serie, el FEV1 preoperatorio medio fue de 1.470mL, con un rango que variaba desde 1.030 a 1.680mL, lo que supone un 54,2%. Otro factor que puede hacernos cuestionar la posibilidad de una resección pulmonar en pacientes con pulmón único es la necesidad de realizar una resección pulmonar mayor. Así, las resecciones pulmonares amplias, como la lobectomía, la segmentectomía o múltiples resecciones atípicas, se han asociado a peores resultados en pacientes neumonectomizados5,6,8,11. Cuanto mayor sea la resección realizada, peor función respiratoria presentará el paciente y mayor riesgo de mortalidad postoperatoria7. En nuestra serie solo a 2 pacientes se les realizó más de una resección atípica, sin realizar ninguna segmentectomía ni lobectomía. Otro aspecto importante que influye en la función pulmonar respiratoria postoperatoria es la realización de una toracotomía, que causa un efecto restrictivo sobre el paciente. Es por este motivo por lo que se prefiere realizar dichas resecciones mediante cirugía endoscópica. Como se ha publicado anteriormente, la cirugía endoscópica se asocia a una mejor recuperación postoperatoria, con menor disfunción respiratoria y sin comprometer los resultados oncológicos a largo plazo19–23. En nuestra serie, solo un paciente fue intervenido mediante cirugía endoscópica coincidiendo con el periodo en el que empezamos a desarrollar esta técnica y con el desarrollo en nuestro centro de la anestesia cardiotorácica. Así, se realizó un abordaje videotoracoscópico mediante 2 puertos, con una resección atípica y manejo ventilatorio mediante apneas.
El éxito de la cirugía sobre pulmón único reside en la experiencia del equipo que va a manejar a este tipo de pacientes. Uno de los aspectos clave es el manejo anestésico. El manejo ventilatorio de estos pacientes mediante el bloqueo lobar selectivo o la ventilación alternada con apneas son algunas de las técnicas de ventilación llevadas a cabo en nuestro centro, por parte de una sección de anestesia cardiotorácica específica. Otro aspecto crítico es la extubación de estos pacientes en quirófano. En nuestra serie solo 5 pacientes fueron extubados en quirófano. Estos fueron los más recientes y coincidieron con el mejor manejo desarrollado en los últimos años en la anestesia en cirugía torácica. Así mismo, la anestesia locorregional, bien mediante catéter epidural o paravertebral, ha contribuido a disminuir el dolor postoperatorio, lo que ayuda al paciente a expulsar las secreciones, toser y a comenzar la deambulación más precozmente, y disminuyen las complicaciones derivadas de ello.
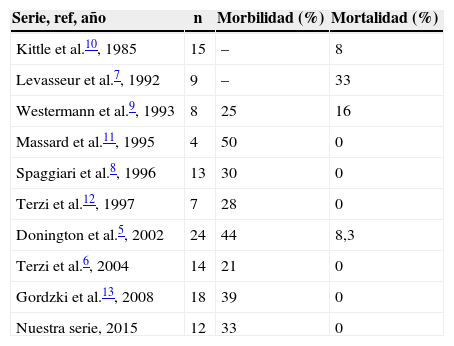
La morbilidad postoperatoria en nuestra serie fue del 33%, similar a la registrada en el resto de las series5–13. Cuatro pacientes presentaron complicaciones, en 2 de ellos fue fibrilación auricular y en otros 2 insuficiencia respiratoria. No se registraron otras complicaciones respiratorias como atelectasia, retención de secreciones o neumonías. Ninguno de los pacientes precisó su ingreso en la Unidad de Cuidados Intensivos. En la serie de Donintong5, 11 pacientes (44%) presentaron alguna complicación. Como en nuestra serie, fueron las complicaciones respiratorias y la fibrilación auricular de las más frecuentes. En la serie de Terzi6, ocurrieron complicaciones en 3 pacientes (21%): retención de secreciones, atelectasia y fibrilación auricular. Con relación a la mortalidad postoperatoria, las tasas publicadas en la bibliografía se encuentran entre 0 y 33%5–13. En nuestra serie no falleció ningún paciente, al igual que en las series de Terzi6, Spaggiari8 y Massard11. En la serie de Donington5 fallecieron 2 pacientes (8,3%), ocurriendo en los pacientes a los que se les realizó una resección mayor. Sin embargo, en los pacientes en los que se realizó una resección pulmonar menor, la mortalidad fue, como en nuestra serie, del 0%. En la tabla 2 se recoge la morbimortalidad de las distintas series publicadas hasta la fecha.
Morbimortalidad de las distintas series publicadas en la bibliografía
| Serie, ref, año | n | Morbilidad (%) | Mortalidad (%) |
|---|---|---|---|
| Kittle et al.10, 1985 | 15 | – | 8 |
| Levasseur et al.7, 1992 | 9 | – | 33 |
| Westermann et al.9, 1993 | 8 | 25 | 16 |
| Massard et al.11, 1995 | 4 | 50 | 0 |
| Spaggiari et al.8, 1996 | 13 | 30 | 0 |
| Terzi et al.12, 1997 | 7 | 28 | 0 |
| Donington et al.5, 2002 | 24 | 44 | 8,3 |
| Terzi et al.6, 2004 | 14 | 21 | 0 |
| Gordzki et al.13, 2008 | 18 | 39 | 0 |
| Nuestra serie, 2015 | 12 | 33 | 0 |
Durante el seguimiento, fallecieron 8 pacientes. De los 4 pacientes restantes, 3 se encuentran vivos libres de enfermedad y uno vivo con enfermedad. De los 3 pacientes que permanecen vivos sin enfermedad, uno fue intervenido de una recidiva de su carcinoma de pulmón, el segundo de un tumor metacrónico y el último de un nódulo necrótico. El paciente que se encuentra con enfermedad fue el intervenido de carcinoma adenoide quístico. Este se intervino sobre pulmón único en 2 ocasiones por 2 recidivas. Actualmente se encuentra en tratamiento con radioterapia.
La principal limitación de nuestro estudio viene dada por el carácter retrospectivo de la serie. Así mismo, la heterogeneidad de la serie y el escaso número de casos no permite realizar un estudio de supervivencia.
En conclusión, la cirugía de pulmón sobre pacientes con el antecedente de una neumonectomía se asocia a una aceptable morbimortalidad postoperatoria, con la resección atípica como el tratamiento de elección. Es importante seleccionar bien a los pacientes que van a ser tratados mediante dicho procedimiento, con un cuidadoso estudio y manejo perioperatorio.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.