La experiencia con la esofaguectomía robótica en el cáncer de esófago y de la unión esofagogástrica es limitada. El objetivo de este estudio es presentar nuestra experiencia actual.
Pacientes y métodosEstudio prospectivo, de vigilancia observacional, de las primeras 32 esofaguectomías mínimamente invasivas por cáncer con toracoscopia robótica entre septiembre de 2011 y junio de 2014. La plastia gástrica se realizó por vía laparoscópica. La toracoscopia robótica se llevó a cabo con el paciente en decúbito prono y la anastomosis intratorácica, siempre de forma manual. Se evaluaron las siguientes variables: características clínicas y patológicas, técnica quirúrgica, resultados a corto plazo (morbimortalidad) y resultados oncológicos (radicalidad y ganglios extirpados).
ResultadosA 32 pacientes con una edad media de 58 años (rango 34-74) se les realizó una esofaguectomía mínimamente invasiva en su totalidad: laparoscopia y toracoscopia robótica (11 McKeown y 21 Ivor Lewis). En 29 casos se administró quimiorradioterapia neoadyuvante. No hubo conversiones a cirugía abierta. El tiempo medio de consola fue 218 min (rango 190-285) y la pérdida de sangre fue de 170ml (rango 40-255). Un paciente falleció por causa cardiológica y 9 presentaron complicaciones mayores (grado II o más de Dindo-Clavien). No hubo complicaciones respiratorias ni parálisis recurrencial. Hubo 5 fístulas intratorácicas, 4 radiológicas y una clínica, 3 quilotórax, 2 fístulas cervicales y una necrosis de la plastia. La mediana de la estancia hospitalaria fue 12 días (rango 8-50). Todas las resecciones fueron R0 y se extirparon una mediana de 16 (rango 2-23) ganglios linfáticos.
ConclusionesNuestros resultados indican inicialmente que la esofaguectomía mínimamente invasiva con toracoscopia robótica es segura y respeta los principios oncológicos.
There is scant experience with robot-assisted esophagectomy in cases of esophageal and gastro-esophageal junction cancer. Our aim is to report our current experience.
Patients and methodsObservational cohort study of the first 32 patients who underwent minimally invasive esophagectomy for esophageal cancer from September 2011 to June 2014. The gastric tube was created laparoscopically. In the thoracic field, a robot-assisted thoracoscopic approach was performed in the prone position with intrathoracic robotic hand-sewn anastomosis. Patient and tumour characteristics, surgical technique, short-term outcomes (morbidity and mortality) and oncological results (radicality and number of removed nodes) were evaluated.
ResultsThirty-two patients, with a mean age of 58 years (34-74) were treated by a totally minimally invasive esophagectomy: robotic laparoscopy and thoracoscopy (11 McKeown and 21 Ivor-Lewis). Twenty-nine received neoadjuvant chemoradiotherapy. There were no conversions to open surgery. Console time was 218minutes (190-285). Blood loss was 170ml (40-255). One patient died from cardiac disease. Nine patients had a major complication (Dindo-Clavien grade II or higher). There was no case of respiratory complication or recurrent laryngeal nerve palsy. Five patients had intrathoracic fistula, 4 radiological and one clinical. Three had chylothorax, 2 cervical fistula and one gastric tube necrosis. The median hospital stay was 12 days (8-50). All the resections were R0 and the median of removed lymph nodes was 16 (2-23).
ConclusionsOur results suggest that minimally invasive esophagectomy with robot-assisted thoracoscopy is safe and achieves oncological standards.
El tratamiento estándar del cáncer de esófago es la cirugía, asociada o no, a quimioterapia o quimiorradioterapia neoadyuvante. La esofaguectomía sigue teniendo una elevada mortalidad dentro de la cirugía gastrointestinal electiva, con tasas que varían entre el 5 y 18%, dependiendo del volumen del centro1.
La utilización del abordaje mínimamente invasivo (CMI) con el objetivo de reducir el trauma quirúrgico, y con ello la morbimortalidad asociada, debería ser especialmente beneficiosa en una técnica quirúrgica tan compleja y agresiva como la esofaguectomía2,3, especialmente cuando se realiza la anastomosis esofagogástrica intratorácica.
El sistema robótico «Da Vinci», con una visión tridimensional y amplificada y más libertad de movimientos, solventa algunas de las limitaciones de la CMI convencional tanto para una disección quirúrgica más precisa como para la realización de una anastomosis manual. En campos quirúrgicos no muy amplios, como es el tórax, y sin necesidad de cambios frecuentes de instrumental4,5, estas ventajas son más claras.
Hasta la fecha, pocos grupos han adoptado este tipo de abordaje6–14, entre ellos el nuestro15 con la descripción de una primera serie de Ivor-Lewis robóticos en posición de prono y con anastomosis manual. Los resultados iniciales de esta serie, sin complicaciones respiratorias ni mortalidad, una fuga de anastomosis (7,1%) y 3 fístulas radiológicas (21,4%) y resultados oncológicos comparables a los de otros abordajes, indican que la técnica es factible y segura a pesar del escaso número de casos evaluados.
Nos parece por ello de interés presentar nuestra experiencia actual con una nueva serie que amplía en más del doble el número de casos de la publicación previa15.
La incorporación de nuevos casos permitirá comprobar, en una técnica aún poco utilizada, si los resultados de morbimortalidad y oncológicos se mantienen, lo cual debe ser el primer objetivo a la hora de incorporar nuevos procedimientos. Por otro lado, y ante la falta de nuevas publicaciones en el último año, nos parece pertinente toda nueva aportación en ese sentido.
El objetivo de este estudio es describir los aspectos técnicos de la esofaguectomía robótica en el cáncer de esófago y los resultados a corto plazo de nuestra serie ampliada.
Pacientes y métodoEntre abril de 2008 y junio de 2014, 66 pacientes fueron intervenidos por cáncer de esófago y de la unión esofagogástrica y en 51 (77%) se realizó una esofaguectomía mínimamente invasiva en su totalidad. En todos los casos se realizó el tubo gástrico por vía laparoscópica. En los primeros 19 pacientes, el tiempo torácico se realizó mediante una toracoscopia convencional y, en los últimos 32 casos (grupo de estudio) mediante una toracoscopia robótica (11 McKeown y 21 Ivor-Lewis).
Los datos clínicos fueron recogidos prospectivamente en una base de datos. Todos los pacientes fueron diagnosticados mediante endoscopia y biopsia. El estudio de extensión incluyó tránsito baritado, tomografía computarizada toracoabdominal, ecoendoscopia y tomografía por emisión de positrones. La estadificación clínica y patológica se realizó siguiendo la clasificación TNM actualizada desde 201016.
En 29 (90,5%) pacientes con tumores localmente avanzados (cT2-4, cN1, cM0) se administró quimiorradioterapia neoadyuvante. Todos los pacientes fueron reevaluados al mes de completar el tratamiento para descartar progresión de la enfermedad y fueron operados a las 8 semanas de finalizarlo. A todos los pacientes se les practicaron pruebas de función respiratoria y posteriormente realizaron fisioterapia respiratoria.
Indicamos una esofaguectomía transtorácica de Ivor-Lewis en tumores localizados a partir de 30cm de arcada dentaria y una esofaguectomía transtorácica con anastomosis cervical (técnica de McKeown) en los situados por encima, salvo contraindicación para el abordaje torácico, única circunstancia en la que se indica un abordaje transhiatal.
Las variables analizadas fueron las siguientes: estancia hospitalaria, mortalidad postoperatoria intrahospitalaria (independientemente del tiempo transcurrido desde la cirugía) y morbilidad. La morbilidad fue clasificada de acuerdo a los criterios de Dindo-Clavien17. La fuga anastomótica ha sido definida como sintomática o radiológica. La primera se asocia a mediastinitis, abscesos o contenido gastrointestinal en el drenaje.
La fuga radiológica ha sido definida como la imagen en el tránsito baritado realizado de rutina al 6.° día postoperatorio, en ausencia de síntomas18. Para las complicaciones respiratorias postoperatorias se utilizaron los criterios de Briez et al.18.
Los resultados oncológicos se evaluaron a partir del porcentaje de resecciones R0 y del número de ganglios extirpados, siguiendo el protocolo propuesto por Colina et al.19 y, desde 2013, el último protocolo del College of American Pathologists20.
Técnica quirúrgicaTodas las intervenciones fueron realizadas por 2 cirujanas (S.T. y M.F.) con asistencia de un residente en el tiempo abdominal. El paciente fue intubado con tubo de doble luz para colapso pulmonar selectivo durante todo el tiempo torácico y previamente se colocaba un catéter epidural o paravertebral.
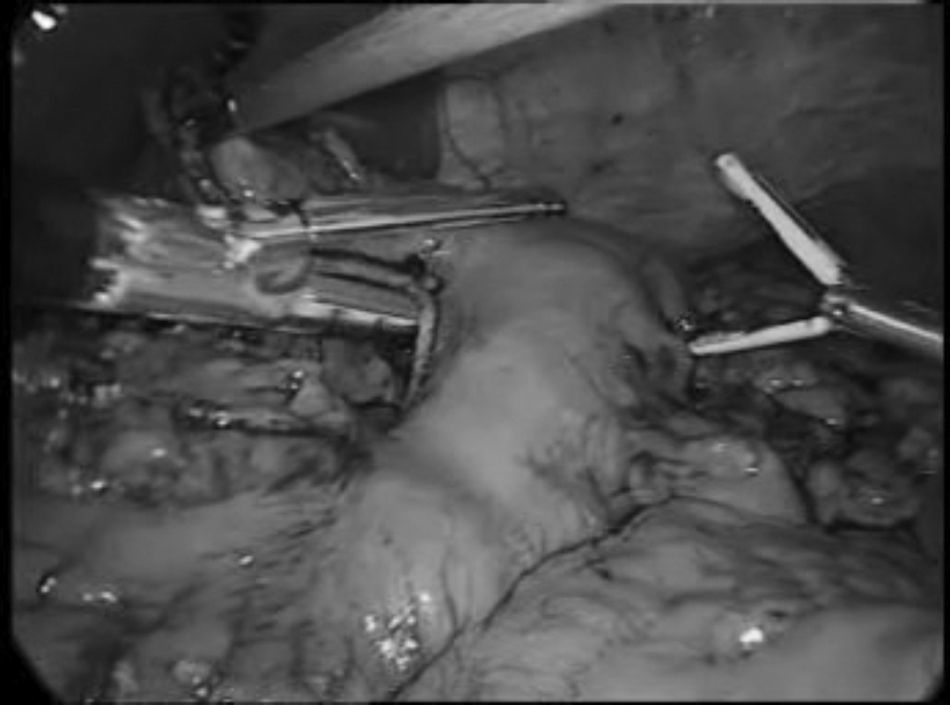
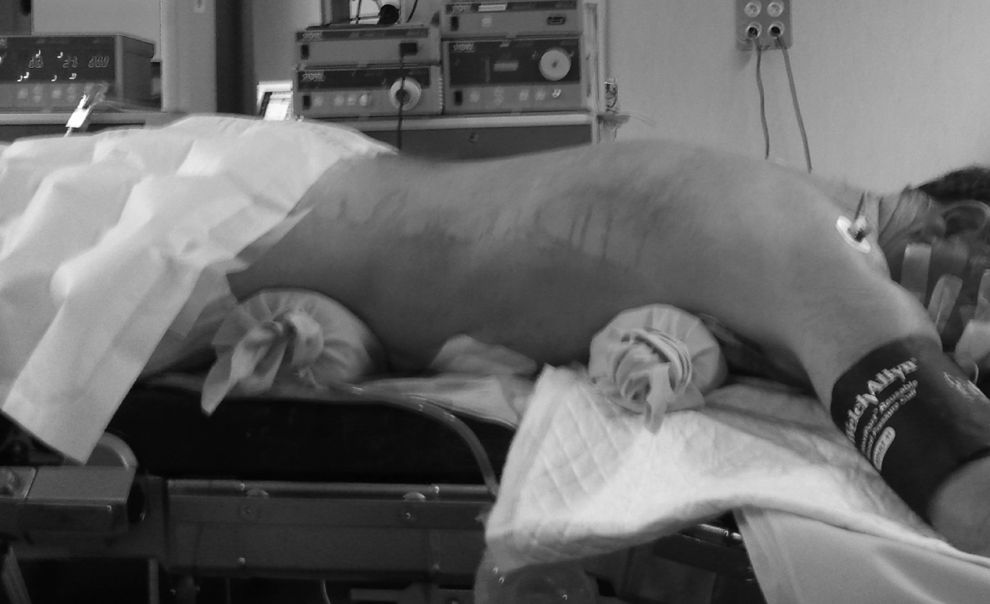
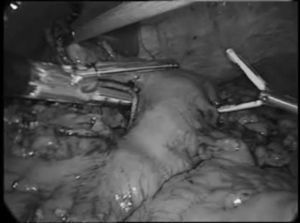
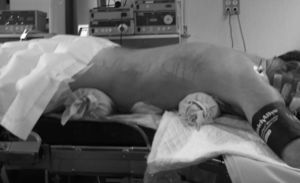
En la técnica de Ivor-Lewis, la esofaguectomía comenzaba por el tiempo abdominal para la creación de la plastia gástrica según la técnica ya descrita15 (fig. 1). Las toracoscopias robóticas fueron realizadas con el sistema de robot Da Vinci (Intuitive, Sunnyvale, California, EE. UU.) modelo SI. Los pacientes fueron colocados en decúbito prono, con los brazos extendidos hacia delante y una angulación de 15-30° a nivel del vértice de la escápula (fig. 2). Se colocó un trocar convencional de 12mm para la óptica de 30° en el 6.° espacio intercostal, subescapular, y se insufló gas a 4-6 mmHg para ampliar el espacio de trabajo. Bajo visión toracoscópica se colocaron los 2 trocares de 8mm del robot, separados 5cm del anterior. Finalmente se colocó otro trocar convencional de 12mm para el ayudante y el robot a la izquierda del paciente, utilizando solo 3 de sus 4 brazos (fig. 3).
Con la pinza bipolar en el brazo izquierdo y el gancho monopolar en el derecho se realizaba la disección esofágica desde hiato hacia vértice torácico y una linfadenectomía en 2 campos infracarinal que se ampliaba a ganglios traqueobronquiales y paratraqueales derechos en las esofaguectomías tipo McKeown.
Se identificaba y se seccionaba entre ligaduras, cerca del hiato, el conducto torácico. Se seccionaba el cayado de la vena ácigos con endograpadora lineal introducida por el trocar del ayudante y, a esa altura, se seccionaba el esófago con tijera monopolar. Tras ascender al tórax la plastia gástrica, se seccionaba la pieza con otra endograpadora lineal.
La anastomosis se realizó de forma manual en todos los pacientes. En los primeros casos se usaron puntos sueltos. Posteriormente, se pasó a utilizar puntos sueltos entre la muscular del esófago y la serosa gástrica en la cara posterior y tras la apertura del estómago se completó la cara posterior con una sutura continua (V-Loc 2/0 Covidien, Mansfield, EE. UU.). Se pasó una sonda nasogástrica distal a la anastomosis antes de completar esta con otra sutura continua en la cara anterior. La incisión de uno de los trocares se amplió a una minitoracotomía de 4cm, protegida con el dispositivo Alexis® (Applied Medical, Rancho Santa Margarita, California, EE. UU.), para la extracción de la pieza. Se colocaron 2 tubos de drenaje torácicos.
Se intentó siempre la extubación inmediata, y los pacientes eran trasladados al área de reanimación anestésica donde se iniciaba la movilización precoz y la fisioterapia respiratoria incentivada en las primeras 24 h.
En los casos en los que se indicó una esofaguectomía con anastomosis cervical, la cirugía se iniciaba con el tiempo torácico y la disección mediastínica se extendía hacia el vértice torácico.
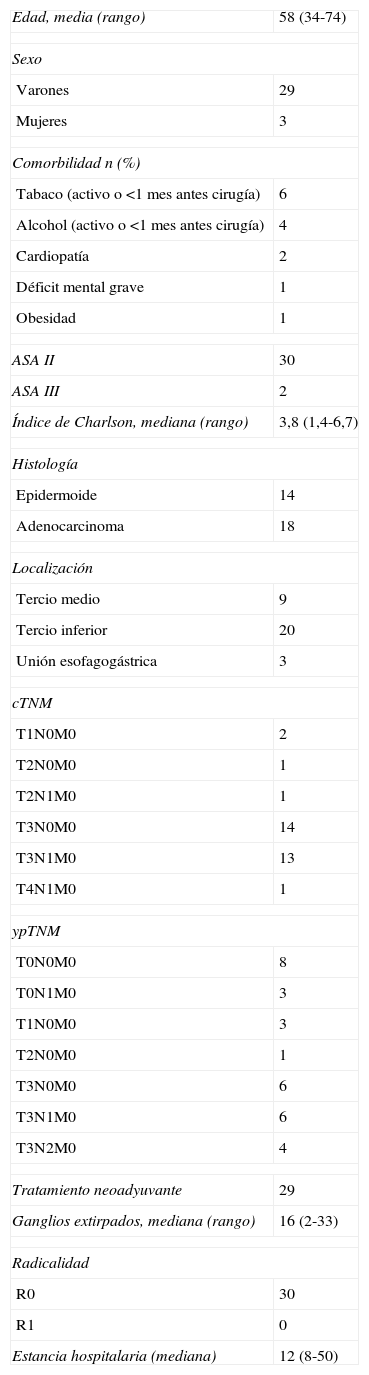
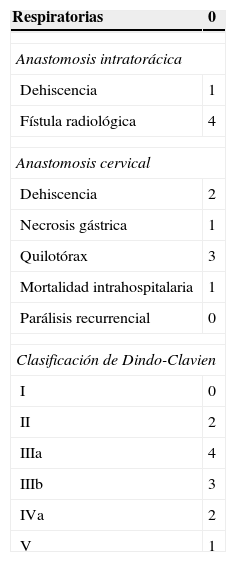
ResultadosLas características demográficas y clínico-patológicas de los pacientes se recogen en la tabla 1. Las complicaciones postoperatorias se muestran en la tabla 2.
Características clínicas de los 32 pacientes
| Edad, media (rango) | 58 (34-74) |
| Sexo | |
| Varones | 29 |
| Mujeres | 3 |
| Comorbilidad n (%) | |
| Tabaco (activo o <1 mes antes cirugía) | 6 |
| Alcohol (activo o <1 mes antes cirugía) | 4 |
| Cardiopatía | 2 |
| Déficit mental grave | 1 |
| Obesidad | 1 |
| ASA II | 30 |
| ASA III | 2 |
| Índice de Charlson, mediana (rango) | 3,8 (1,4-6,7) |
| Histología | |
| Epidermoide | 14 |
| Adenocarcinoma | 18 |
| Localización | |
| Tercio medio | 9 |
| Tercio inferior | 20 |
| Unión esofagogástrica | 3 |
| cTNM | |
| T1N0M0 | 2 |
| T2N0M0 | 1 |
| T2N1M0 | 1 |
| T3N0M0 | 14 |
| T3N1M0 | 13 |
| T4N1M0 | 1 |
| ypTNM | |
| T0N0M0 | 8 |
| T0N1M0 | 3 |
| T1N0M0 | 3 |
| T2N0M0 | 1 |
| T3N0M0 | 6 |
| T3N1M0 | 6 |
| T3N2M0 | 4 |
| Tratamiento neoadyuvante | 29 |
| Ganglios extirpados, mediana (rango) | 16 (2-33) |
| Radicalidad | |
| R0 | 30 |
| R1 | 0 |
| Estancia hospitalaria (mediana) | 12 (8-50) |
ASA: American Society of Anesthesiologists classification.
Fuente: AJCC, 201016.
Complicaciones postoperatorias n (%)
| Respiratorias | 0 |
|---|---|
| Anastomosis intratorácica | |
| Dehiscencia | 1 |
| Fístula radiológica | 4 |
| Anastomosis cervical | |
| Dehiscencia | 2 |
| Necrosis gástrica | 1 |
| Quilotórax | 3 |
| Mortalidad intrahospitalaria | 1 |
| Parálisis recurrencial | 0 |
| Clasificación de Dindo-Clavien | |
| I | 0 |
| II | 2 |
| IIIa | 4 |
| IIIb | 3 |
| IVa | 2 |
| V | 1 |
No hubo conversiones a cirugía abierta. La mediana de pérdida de sangre fue de 170 ml (rango 40-255) y el tiempo de consola de 218 min (rango 190-285). No hubo casos de parálisis recurrencial ni complicaciones respiratorias. La mortalidad fue del 3% (un paciente por causa cardiológica).
La morbilidad global fue 28% y la mediana de estancia hospitalaria de 12 días (rango 8-50). Hubo 4 fístulas radiológicas intratorácicas. A pesar de ser asintomáticas fueron tratadas con una endoprótesis, sin necesidad de drenaje y los pacientes comenzaron la ingesta oral a las 48 h. Hubo una fuga intratorácica sintomática que se sospechó al 6.° día postoperatorio por la clínica y se confirmó por tránsito y tomografía computarizada. Se colocó una endoprótesis con mala evolución. El paciente fue reintervenido a las 24 h, realizándose una esofagostomía y gastrostomía con ingreso en la Unidad de Cuidados Intensivos (UCI) (Clavien IVa) con evolución favorable.
Hubo 3 casos de quilotórax, 2 tratados quirúrgicamente, uno por toracotomía y otro por toracoscopia convencional (Clavien IIIb). El tercero se trató de forma conservadora pero precisó ingreso en UCI (Clavien IVa). Entre los pacientes con anastomosis cervical hubo 2 casos de fístula cervical resueltos con nutrición parenteral (Clavien II) y una necrosis del borde proximal de la plastia gástrica que precisó reintervención con esofagostomía y gastrostomía sin ingreso en UCI (Clavien IIIb).
La mediana de ganglios extirpados fue 16 (rango 2-23), y todas las resecciones fueron R0. Hubo 8 casos (25%) de respuesta patológica completa (ypT0, ypN0) y 3 con afectación de un ganglio (ypT0, ypN1).
DiscusiónSigue sin existir un procedimiento estándar para la esofaguectomía por cáncer.
La elección de una anastomosis cervical o intratorácica y un abordaje transtorácico o transhiatal depende de la localización del tumor, de las características del paciente y, en gran medida, de la experiencia del cirujano.
Los abordajes mínimamente invasivos son cada vez más utilizados en la cirugía oncológica en general. Dos recientes metaanálisis analizan los diferentes abordajes de la esofaguectomía mínimamente invasiva, con resultados similares a los de la cirugía abierta y confirman la viabilidad y seguridad de la técnica2,3. En cuanto a los resultados oncológicos, también la esofaguectomía mínimamente invasiva parece ser comparable a la cirugía abierta21.
Sin embargo, la complejidad de la técnica, y más si implica la realización de una anastomosis intratorácica, hace que en la mayoría de las series incluidas en estas revisiones se utilice la CMI solo para la movilización gástrica o esofágica, seguida de una anastomosis cervical. El número de grupos que realizan la técnica de Ivor-Lewis mínimamente invasiva en su totalidad es muy reducido, si bien hay estudios que describen una mejor calidad de vida con la anastomosis intratorácica alta22.
Los sistemas robóticos podrían solventar algunas de las limitaciones de la CMI al proporcionar una visión más amplificada, en 3 dimensiones y una mayor amplitud de movimientos, especialmente en el tiempo torácico de una esofaguectomía.
La primera esofaguectomía asistida por Da Vinci fue publicada por Kernstine et al. en 200423. Desde entonces se han publicado pocas series, cortas (6-47 pacientes) y siempre con anastomosis cervical6–11. Hasta el año 2013 no han sido publicadas las primeras series de esofaguectomía de Ivor-Lewis robóticas con 22, 17 y 50 casos respectivamente12–14 y, en el último año, la nuestra con 14 casos15.
La experiencia previa con la cirugía CMI oncológica en el cáncer gástrico y esofágico y la disponibilidad en nuestra unidad del sistema robótico Da Vinci nos ha permitido acumular un número de casos que, aunque pequeño, es comparable al de otras series de la bibliografía mundial, a pesar de la baja incidencia del cáncer de esófago en nuestro país.
Este trabajo incluye, por tanto, 11 McKeown robóticos y 21 Ivor-Lewis robóticos entre los que se encuentran los casos publicados por nosotros recientemente15. Diversos autores defienden la colocación del paciente en decúbito prono para la CMI, ya que favorece una mejor exposición del esófago, la acumulación de sangre fuera del campo quirúrgico y una menor manipulación del pulmón24,25.
Hasta ahora ningún grupo, salvo el nuestro, parece utilizar esta posición para la anastomosis intratorácica. Papanivelu et al.26 describen, en una serie de 130 pacientes, solo un 2,3% de complicaciones respiratorias con la movilización esofágica mínimamente invasiva en esta posición, frente al 18% publicado por Luketich et al.27 en sus 222 pacientes en posición de decúbito lateral. En el análisis retrospectivo más amplio publicado por Kuwabara et al.28, se observan beneficios significativos de la toracoscopia realizada en posición de prono en cuanto a pérdida de sangre, complicaciones respiratorias, duración de la estancia postoperatoria y número de ganglios extirpados.
En el caso de la toracoscopia robótica, la posición en prono no solo ofrece estas ventajas sino que además, a nosotros, nos ha permitido la utilización de solo 3 brazos del robot frente a los 4 que utilizan los demás grupos, al no ser necesaria la separación del pulmón, lo cual supone un ahorro económico en pinzas y disminuye el conflicto de espacio entre los brazos.
La realización de una anastomosis intratorácica por CMI no es sencilla. La posición en prono, en nuestra experiencia, ofrece ventajas en la disección pero dificulta la realización de una anastomosis mecánica, sea transtorácica o transoral. En una reciente revisión con 12 estudios y 220 pacientes, Maas et al.29 comparan las diferentes técnicas para una anastomosis intratorácica por CMI y concluyen que ninguna es superior a las demás, con un porcentaje de fugas entre el 0 y el 10%.
Los sistemas robóticos, gracias a su mayor amplitud de movimientos, pueden facilitar la realización de una anastomosis manual, permitiendo así el uso del prono y sus ventajas. En 2 de las 3 series publicadas de esofaguectomías robóticas con anastomosis intratorácica, la incidencia de dehiscencias anastomóticas fue del 4,5 y 2% respectivamente12,14. Sin embargo, en la serie de Sarkaria et al.13, con 17 Ivor-Lewis, describen un 14% de fugas clínicamente significativas, 14% de fístulas traqueoesofágicas y 4 fístulas asintomáticas. El número de fístulas intratorácicas de nuestra serie, 4 radiológicas (19%) totalmente asintomáticas aunque tratadas con una endoprótesis y una dehiscencia clínica(4,7%), no difieren de lo publicado hasta la fecha. Tres de las fístulas radiológicas y la dehiscencia tuvieron lugar entre los13 primeros casos de la serie, posiblemente por algún problema técnico con la sutura, debido a la ausencia de sensación táctil. En la actualidad, hemos sustituido la sutura con puntos sueltos por una doble sutura continua, una en la cara anterior y otra en la posterior. Esta modificación técnica, además, acorta el tiempo quirúrgico. A las dificultades técnicas hay que añadir la necesaria curva de aprendizaje, otro de los resultados importantes de esta nueva serie.
Nuestro tiempo de consola, aunque largo, es difícil de valorar ya que incluye la realización de la anastomosis manual en 21 de los 32 pacientes y no hay información en la literatura para compararlo. Solo una de las series de Ivor-Lewis robóticos publicadas incluye la anastomosis manual12 y su tiempo es similar al nuestro. En las series sin anastomosis se informa de tiempos que oscilan entre 100 y 335 min (lo más frecuente 180) por lo que nuestros 218 min no parecen excesivos.
No hemos tenido conversiones a cirugía abierta ni complicaciones respiratorias.
Hemos tenido 3 casos de quilotórax (9,3%). Diversos estudios describen un claro aumento de su incidencia con la CMI, desde el 2,4% de Smithers et al.30 al 11,6% de Luketich et al.31. Nuestros resultados coinciden con lo publicado, ya que no teníamos casos de quilotórax con cirugía abierta, y está en el rango de cifras de los grupos de cirugía robótica (3-14%)7,14,23,32–34. Este aumento en la incidencia es lo que nos llevó a realizar la ligadura profiláctica del conducto torácico, sin nuevos casos desde entonces.
Nuestro porcentaje de resecciones R0 y el número de ganglios obtenidos son comparables a los de otras series de esofaguectomía robótica así como a los de la cirugía abierta. En algunos casos el número de ganglios ha sido limitado. Sin embargo, el rango, media y mediana son similares a lo publicado. En un estudio multicéntrico que incluye a 299 pacientes de 6 centros especializados, la media de ganglios obtenidos fue 20, incluyendo casos de un único ganglio (rango 1-77)35.
Las principales limitaciones de este trabajo son el número de casos y el corto seguimiento.
En conclusión, nuestros resultados indican inicialmente que la esofaguectomía mínimamente invasiva en su totalidad (incluido el Ivor-Lewis) con toracoscopia robótica es una técnica factible, segura y oncológicamente correcta. La toracoscopia robótica puede proporcionar las ventajas de la cirugía mínimamente invasiva, y resuelve alguna de las limitaciones de la toracoscopia convencional, aunque este aspecto debería ser objeto de un futuro estudio.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Parte del contenido de este manuscrito ha sido presentado previamente: en el III Curso Internacional de Cirugía Robótica. Hospital San Carlos, Madrid, enero de 2013. en la XIX Reunión Nacional de Cirugía. Burgos, octubre de 2013. en la XXIII Reunión Nacional de la International Society for Diseases of the Esophagus (ISDE), donde recibió el premio a la mejor comunicación oral. San Sebastián, mayo de 2013.