La cavidad oral constituye la puerta de entrada al complejo sistema digestivo, por lo que el conocimiento de los mecanismos que los vinculan es de vital importancia. En los últimos años la patología dental y oral ha sido analizada como potencial factor de riesgo de enfermedades vinculadas al estilo de vida y, por tanto, se está considerando como una posible interesante vía de prevención.
Realizamos una revisión narrativa con búsqueda bibliográfica exhaustiva en las bases de datos MEDLINE y SCOPUS, incluyendo artículos internacionales que relacionan la salud oral con neoplasias del tracto digestivo, publicados entre 2015 y 2020.
El objetivo de esta revisión es analizar la evidencia existente sobre la potencial asociación entre salud bucodental y procesos carcinogénicos del tracto gastrointestinal, proporcionando una posible futura vía de prevención a nivel odontológico. Como objetivo secundario, se fomenta concienciar sobre la importancia de la salud oral como nuevo paradigma y variable de estudio en el ámbito de la investigación médico-sanitaria.
The oral cavity represents the gateway to the complex digestive system, so the knowledge of the exact mechanisms that link them is vitally important. Recently, oral and dental pathologies have been studied as potential risk factors for pathologies linked to lifestyle habits. Therefore, it could be considered as an interesting preventive way.
We conducted a narrative review with a thorough bibliographic search on MEDLINE and SCOPUS, including international studies related to oral healthcare and gastrointestinal neoplasms, published between 2015 and 2020.
The primary aim of this revision is to analyze the association between oral healthcare and carcinogenic gastrointestinal processes, providing a possible future preventive strategy for dental care. Moreover, we intend to raise awareness about the importance of oral healthcare as a new paradigm and study variable in the global health care system.
Es de notable importancia reconocer el impacto de la salud bucodental, así como de la progresiva pérdida dentaria, en la salud sistémica del paciente. Recientemente, la patología oral ha sido objeto de numerosos estudios como posible factor de riesgo en patologías vinculadas al estilo de vida y, por tanto, también se está considerando como una nueva vía de prevención1,2.
En los últimos años, numerosas enfermedades sistémicas (cardiovasculares, neurodegenerativas, digestivas y algunos tipos de cáncer, entre otras) se han asociado etiológicamente con patologías dentales y orales1,3-5.
Hasta ahora, el potencial efecto carcinogénico de la microbiota oral no estaba claramente determinado, y aunque sí era asociada etiológicamente al cáncer de cabeza-cuello (especialmente a cáncer oral)6,7, su posible relación con órganos más distantes solo constituía una mera posibilidad4. Actualmente, el método más extendido y universal para poder analizar los distintos microorganismos orales es la secuenciación genómica mediante ARNr 16S (componente de la subunidad menor de los ribosomas procariotas, utilizado para la reconstrucción de filogenias), lo que ha permitido, según los recientes estudios, empezar a explorar los diferentes patrones bacterianos repetidos de microorganismos beneficiosos y/o perjudiciales6.
Para poder hacer el análisis aplicable a más ámbitos, muchos ensayos se basan sobre todo en la microbiota intestinal, que constituye la comunidad más extensa del organismo formada por trillones de microorganismos residentes2,8. Es evidente que durante la realización de funciones fisiológicas, como la masticación o deglución, los microorganismos orales pasan directamente al complejo digestivo7. Así pues, la cavidad oral constituye la entrada al sistema digestivo. Un estado de disbiosis oral debido al deterioro de la salud bucodental afecta a la respuesta inflamatoria e inmunológica, llegando a poseer un rol fundamental en pacientes con tumores del tracto gastrointestinal4. A nivel clínico, este hecho está permitiendo abrir una puerta evolutiva hacia la identificación, la prevención y el tratamiento de neoplasias gastrointestinales2,4,6.
El objetivo principal de esta revisión es analizar la evidencia existente sobre la potencial asociación entre salud bucodental y procesos carcinogénicos del tracto gastrointestinal, estableciendo una posible vía de prevención mediante la promoción de la salud bucodental. Como objetivo secundario se fomenta concienciar sobre la importancia de la salud oral como nuevo paradigma y variable de estudio en el ámbito de la investigación médico-sanitaria.
MetodologíaEstrategia de búsquedaRealizamos una revisión narrativa con búsqueda bibliográfica exhaustiva de artículos publicados en los últimos 5años (2015-2020) que relacionaran la salud oral con neoplasias del tracto digestivo.
La búsqueda sistemática se llevó a cabo a partir de las bases de datos MEDLINE y SCOPUS, incorporando los términos MeSH (Medical Subject Headings) o palabras clave: digestive system neoplasms», juntamente con el operador boleano «AND» y sumado a los términos «mouth», «oral health», «tooth los».
Proceso de selección de artículosCon tal de filtrar y cribar los artículos que más se adaptaban a la revisión, inicialmente se incluyeron estudios centrados en la relación entre neoplasias digestivas y salud oral, publicados en inglés y entre 2015 y 2020, disponibles a texto completo o pertenecientes a revistas accesibles a través de la Universitat de Barcelona. Se excluyeron estudios realizados en muestras animales, incluyendo únicamente muestras humanas sin tener en cuenta la variable de edad. Respecto al nivel de evidencia, se evaluaron estudios prospectivos de cohortes, casos-controles, in vitro, revisiones tanto sistemáticas como narrativas y metaanálisis.
Posteriormente, en una segunda fase de selección, que consistía en la lectura de títulos y resúmenes, se descartaron los artículos que no se centraran en el tema en cuestión o que presentaban un bajo nivel de impacto para ser incluidos en nuestra revisión.
Finalmente, tras una lectura completa y exhaustiva de la bibliografía se incluyeron 43 artículos: 13 estudios de cohortes, 14 casos-controles, 8 revisiones narrativas, 2 revisiones sistemáticas, 5 metaanálisis y 1 estudio in vitro (fig. 1).
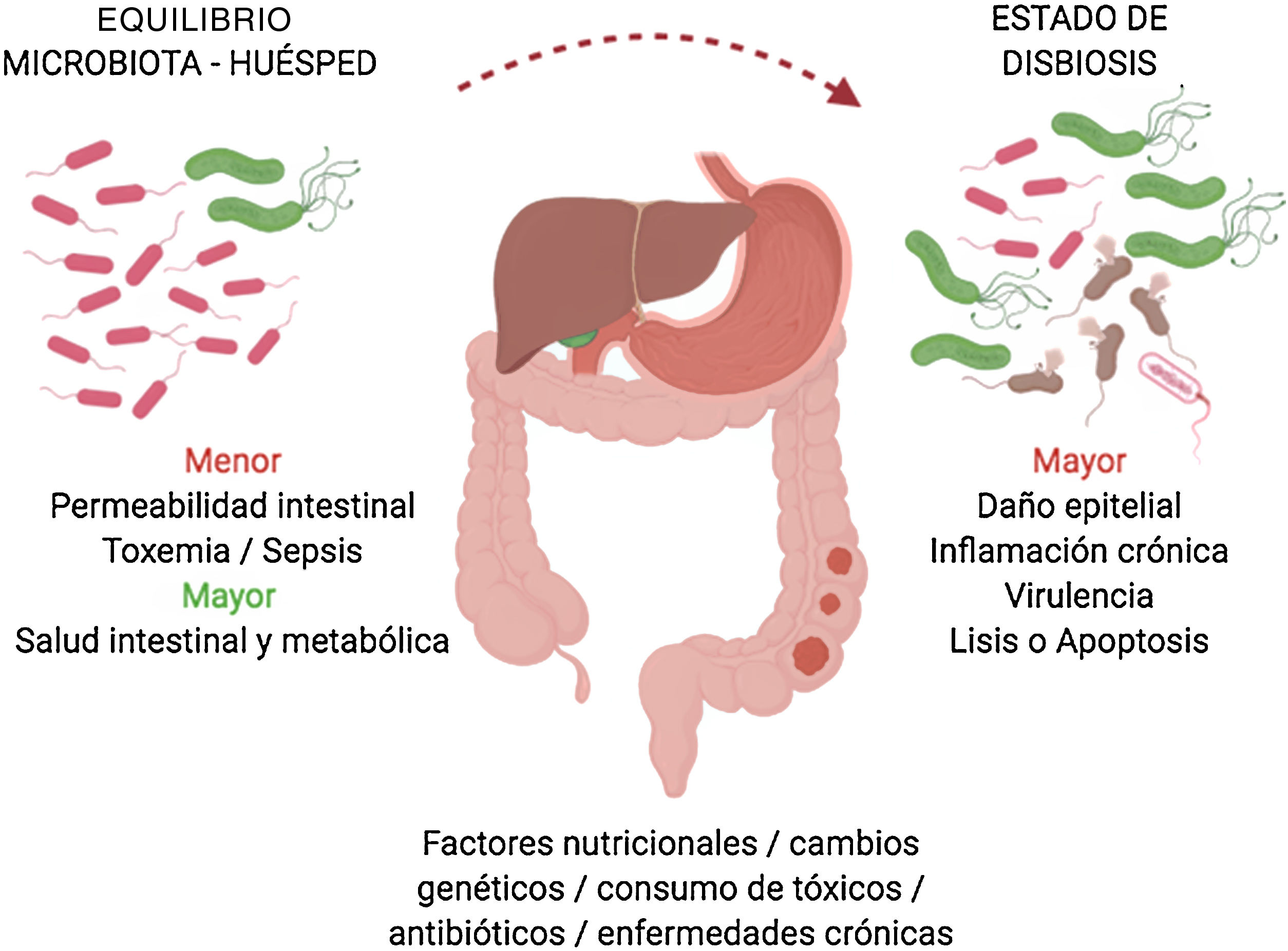
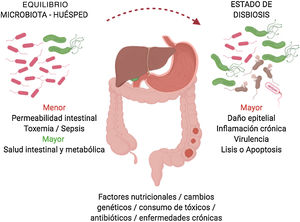
Resultados y discusiónMicrobiota oral: procesos patológicosEl conjunto de microorganismos orales (más de 700 especies diferentes) es reconocido ya como un verdadero órgano cuyos mecanismos se asocian directamente al ecosistema microbiológico digestivo6,8-11. En un estado microbiológico de homeostasis con el huésped, ciertas alteraciones en la microbiota oral pueden convertirse en inductores de susceptibilidad para ciertos cambios patológicos, tanto internos (p.ej., genéticos) como externos (p.ej., dieta, antibioticoterapia, tóxicos)2.
Ciertos cambios en la composición bacteriana pueden inducir la aparición de patógenos oportunistas que presentarían efectos nocivos en el huésped, como daño epitelial directo, respuesta inflamatoria, factores de virulencia, e influir asimismo en procesos de apoptosis celular2 (fig. 2). Dicha disbiosis microbiológica es más frecuente y acentuada en pacientes que desarrollan tumores gastrointestinales, específicamente esofágicos, gástricos, pancreáticos y colorrectales6.
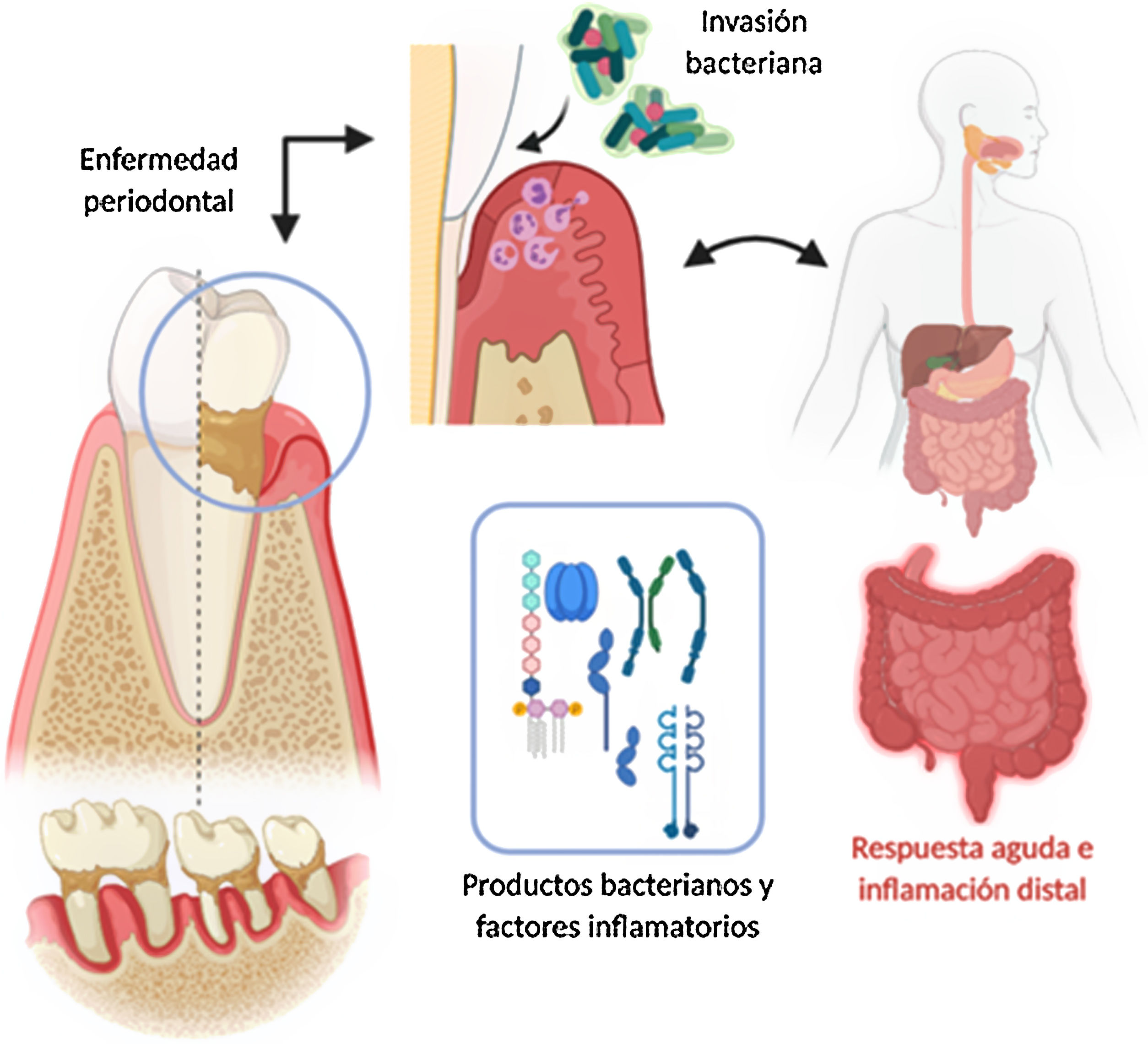
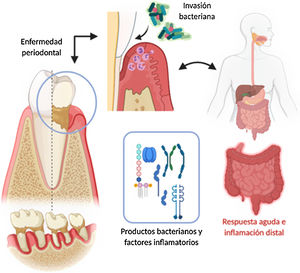
Mecanismo de invasión de bacterias periodontopatógenas y su inflamación sistémica posterior. Elaborado con BioRender, Adaptado de Konkel et al.5.
El análisis de Pierre Le Bars et al.8 sintetiza que, a nivel mucoso, la microbiota gastrointestinal y/u oral podría alterarse progresivamente por los procesos de reducción mucosa de CD4+, inflamación crónica, alteración de enterocitos epiteliales y, finalmente, por la penetración tisular de microorganismos. A partir de la placa dental, ciertas bacterias pueden activar directamente productos carcinógenos como son nitrosaminas y acetaldehído (provenientes de la dieta y/o el tabaco), estableciéndose esta como otra posible hipótesis de iniciación de procesos malignos4,12-14. No obstante, diferenciar las taxonomías bacterianas inocuas de las patógenas continúa siendo un reto, así como definir el mecanismo microbiológico asociado a sus propiedades invasivas, expresión y factores de virulencia6,8,15.
Enfermedad periodontal y patología sistémica asociadaLa periodontitis se inicia por ulceración del epitelio gingival, invasión y/o alteración bacteriana, y finalmente por colonización de células inmunitarias, conduciendo a un estado de inflamación que destruye el periodonto (hueso alveolar, cemento radicular, ligamento periodontal y encía)5. Una vez que los productos proinflamatorios derivados de la enfermedad periodontal, entre los que destacan lipopolisacáridos, interleucinas IL-17, IL-6, IL-1β y el factor TNF-α, se encuentran en la circulación sistémica, pueden afectar directamente (in situ) o indirectamente en la respuesta inflamatoria de órganos distales5,16.
Pérdida dentaria y salud bucodentalEn los últimos años se han realizado diversos estudios sobre diferentes parámetros de salud oral que podrían favorecer la aparición de lesiones malignas en el tracto digestivo3,6,7,12,13,16-19. Un ejemplo es el estudio de Sakai et al.3, donde se observó que la pérdida dentaria (<20 dientes remanentes) y/o la falta de uso de prótesis se asociaban a un mayor riesgo de cáncer digestivo, siendo más significativo en pacientes entre 60 y 70años de edad. No se encontraron diferencias en relación con la localización de la neoplasia. A destacar que los autores consideran las condiciones socioeconómicas y el nivel de educación recibida de los pacientes incluidos como limitaciones o factores de confusión, indicando que afectan mucho en el tratamiento médico individual y en el acceso a instituciones de salud en general.
A nivel global, las enfermedades dentales suelen ser las más costosas para muchos sistemas sanitarios1,3. En el estudio japonés de Saito et al.1 se refleja que el coste sanitario para enfermedades diversas aumentaba para pacientes ancianos que presentaban <28 dientes o eran edéntulos. En el caso de los tumores digestivos, pacientes con <19 dientes supusieron un mayor gasto sanitario público, además de un aumento de días de hospitalización en el seguimiento a un año. De esta manera, se describe el mantenimiento del mayor número posible de dientes como un probable factor protector.
Cofactores epidemiológicos asociados a cáncer digestivoLa relación entre enfermedades dentales y la prevalencia de neoplasias del tracto gastrointestinal no está claramente determinada, pudiendo estarlo por varios factores3,7,14,18-21. Asociar ciertos patrones nutricionales y parámetros relacionados con el estilo de vida a un mayor riesgo de padecer algunos tipos de cáncer es un aspecto ampliamente discutido22-25. Un gran número de los factores, además, son compartidos con la enfermedad periodontal, de ahí la importancia del ajuste de riesgo estimado para cada uno3,14.
A continuación se analizan los estudios actuales sobre neoplasias gastrointestinales más frecuentes por apartados en relación con alteraciones bucodentales.
Cáncer esofágicoTres20,26,27 de los 12 artículos incluidos sobre neoplasias esofágicas se centran en su etiología y factores modificables, entre los cuales figuran la pérdida dentaria y/o un estado de salud oral alterado. El tabaco o el consumo de alcohol por sí solos no explican el alto volumen de carcinoma escamoso esofágico en las regiones con más prevalencia18,28.
El estudio epidemiológico de Abnet et al., llevado a cabo para determinar posibles factores de riesgo asociados al carcinoma escamoso esofágico, argumenta que su etiología es multifactorial y característica de cada población. Se sugiere, asimismo, el potencial papel de la inflamación asociada a la enfermedad periodontal y a la producción de ciertos metabolitos por parte de las bacterias periodontopatógenas, como acetaldehídos y/o nitritos20,26.
En regiones como el norte de Irán, donde existen las mayores tasas de incidencia de este tipo de neoplasias, el estudio de Sheikh et al.20 determinó que el 76% de casos se atribuyen también a factores causales, siendo uno de ellos la progresiva pérdida dentaria asociada a la extendida tendencia cultural de no conservar dientes con patología.
Otro estudio llevado a cabo en Eldoret (Kenia) concluyó que un estado alterado de salud oral, sumado o como resultado de un consumo alto de agua fluorada (concentraciones mayores a 1,5mg/l) en zonas como Tanzania y Etiopía podía ser una de las mayores causas del alto número de casos (especialmente cáncer esofágico de células escamosas) acumulados en el Valle del Rift africano, manifestando así un ejemplo de importancia de prevención primaria y paliativa frente a una patología que supone la tercera causa de mortalidad en esas zonas específicas (Menya et al.)27.
Cuatro de los estudios analizados7,13,18,21 defienden que la pérdida dentaria y la falta de higiene oral juegan roles importantes en la progresión del cáncer esofágico, acentuándose en países asiáticos. Aun así, los grupos estudiados son heterogéneos y complejos para poder extraer conclusiones concretas21. Estos factores se deberían considerar como marcadores, más que indicadores causales per se7.
Tanto el estudio de Tanda et al.29 como el realizado por Mizuno et al.30 abogan por la importancia de la disminución de carga bacteriana y el tratamiento bucodental profesional preoperatorio utilizando cloruro de benzalconio (antiséptico), cepillos interdentales y peróxido de hidrógeno para disminuir los niveles de acetaldehído. Mizuno et al.30, comparando dos grupos de pacientes tratados por neoplasia de esófago, observaron que, en presencia de un número similar de complicaciones postoperatorias, el grupo con el nuevo régimen de higiene bucal redujo significativamente el número de bacterias orales y días con fiebre elevada respecto al grupo con higiene bucal de rutina. Sin embargo, este estudio presenta limitaciones, como el pequeño número de pacientes de un solo centro y la falta de relación entre fiebre elevada y número de bacterias orales. Por lo tanto, se necesitan ulteriores estudios a gran escala para corroborar los resultados observados.
Microbiota y cáncer esofágicoLas muestras salivales recogidas usando una secuencia genómica de ARNr 16S para el estudio de casos y controles de Chen et al.28 mostraron una menor diversidad en la composición microbiológica en los pacientes con carcinoma escamoso esofágico. No obstante, se necesitan ulteriores investigaciones y caracterización de los microorganismos patógenos.
El estudio prospectivo de Peter et al.31 sobre pacientes diagnosticados de cáncer esofágico mostró grupos de microorganismos diferentes para adenocarcinoma respecto a cáncer de células escamosas. Los autores proponen un minucioso estudio a nivel microbiológico para identificar la presencia de ciertas especies características mediante la secuencia genética 16S, haciendo hincapié en su potencial papel preventivo y de estratificación de riesgo individual para este tipo de tumores.
Cáncer gástricoEl cáncer gástrico constituye la tercera causa mundial de mortalidad asociada a neoplasias. El mal pronóstico que presenta pone de manifiesto la importancia de su prevención32.
En el estudio de Ndegwa et al.12 se relaciona la pérdida dentaria (sobre todo para pacientes jóvenes) y lesiones de mucosa asociadas a prótesis dentales con un mayor riesgo de neoplasia gástrica (los resultados no son consistentes para lesiones por Candida, placa dental o lesiones linguales). En el análisis de Zhang et al.13 se relaciona la pérdida dentaria severa con un incremento de la mortalidad. Aunque son necesarios más estudios, en la revisión de Yin et al.32 se sugiere que la pérdida dentaria es un potencial marcador de riesgo para cáncer gástrico.
Microbiota y cáncer gástricoEl estudio de Sun et al.33 realizado en 35 pacientes con lesiones precancerosas de cáncer gástrico y 70 controles concluyó que Treponema forsythia, Treponema denticola y Actinomyces actinomycetemcomitans eran microorganismos de riesgo para el cáncer gástrico. También se tuvieron en cuenta factores como la diversidad bacteriana presente en la placa dental y/o la falta de higiene en zonas dentales interproximales.
Asimismo, la mucosa lingual sirvió para determinar las características microbiológicas (bacterianas y fúngicas) de los 115 pacientes con cáncer gástrico del estudio de Xu et al.9, estableciendo así un biomarcador oncológico a través de las relaciones comensales que allí se establecen. No obstante, falta caracterizar los microorganismos específicos que se repiten.
En Japón, Kawano et al.34 describieron las diferencias bacteriológicas encontradas entre pacientes de cáncer gástrico tratados mediante cirugía abierta, comparándolos con otros que recibieron tratamiento mínimamente invasivo. Incluso con cuidado oral diario, el número de bacterias en pacientes que recibieron cirugía abierta siguió siendo elevado, sobre todo en la zona gingival anterosuperior. El estudio indica la necesidad de técnicas preoperatorias efectivas para reducir el número de bacterias, así como monitorizar la presencia de gingivitis.
Cabe destacar el rol de Helicobacter pylori en procesos tumorales gástricos, considerándolo ya un potencial carcinógeno y biomarcador, actuando en presencia de una microbiota específica y pH luminar determinado9,11,12,14,17,32,33.
Cáncer colorrectalEn el estudio de Lee et al.35 se evidencia que la enfermedad periodontal y/o la pérdida dentaria es un factor de riesgo para adenoma colorrectal, siendo más acentuado en hombres, pacientes fumadores (10-20 paquetes/año) o bebedores frecuentes de alcohol. Todo ello sugiere la potencial aplicación de medidas preventivas y estratificación de riesgo, incluyendo estrategias como revisiones y radiografías dentales periódicas.
En la misma línea, el estudio de Momen-Heravi et al.16 quiso indagar también en el papel de la enfermedad periodontal y su posible repercusión en el cáncer colorrectal. En las 77.443 mujeres estudiadas durante 18años, se mostró que la pérdida dentaria (menos de 17 dientes remanentes) y la presencia de periodontitis alteran y aumentan la inflamación sistémica, la disfunción inmunológica, cambios en la composición bacteriana, aumentando el riesgo de cáncer colorrectal. El resultado fue una probabilidad aumentada (48% mayor) en las mujeres que presentaban pérdida ósea (característica sugestiva) y enfermedad periodontal, independientemente de otros factores asociados.
No obstante, también existen contradicciones a los resultados anteriores. En el caso del metaanálisis de Ren et al.36, no se encontró asociación alguna entre pérdida dentaria, periodontitis y progresión de cáncer colorrectal. La evidencia no es suficientemente concluyente, además de posiblemente alterada por cofactores presentes.
Otro metaanálisis de Almeida et al.37 indica la relación entre la poliposis adenomatosa familiar con algunas manifestaciones de patología oral, siendo las alteraciones mandibulares las más frecuentes (65,35%). Estos pacientes presentan a menudo odontomas compuestos, dientes supernumerarios, no erupcionados y anomalías de la mucosa oral (30,48%). Los hallazgos mencionados podrían llegar a ser precursores de cáncer colorrectal en pacientes con la enfermedad y no tratados ni diagnosticados, estableciéndose así como otra medida preventiva de la patología.
Microbiota oral y cáncer colorrectalFlemer et al.11 investigaron las taxonomías bacterianas que posiblemente intervienen en el desarrollo del cáncer colorrectal. El resultado de su estudio fue una clasificación de diferentes microorganismos orales y fecales en sujetos diagnosticados y sanos, detectando una composición similar entre mucosa oral y colorrectal. El género Lachnospiraceae mostró un rol protector, posiblemente mediado por una dieta adecuada. Este hecho podría mejorar el cribado y la caracterización de nuevos programas diagnósticos.
Otros tres estudios mantienen la misma línea de investigación.
Primero, el estudio de Brennan et al.38 indaga sobre el papel de Fusobacterium nucleatum en el desarrollo de infecciones oportunistas que puedan afectar a cáncer colorrectal. Este también constituye un miembro presente habitualmente en la cavidad oral; por tanto, se establece como posible favorecedor de un buen estado de salud oral, así como también de iniciar procesos periodontales. Se necesitan más estudios sobre su mecanismo de acción y su posible rol en la carcinogénesis.
En segundo lugar, Koliarakis et al.2 sostienen la posible diseminación de bacterias orales en el colon. Esta asociación, según ellos, se hace más evidente para los microorganismos Fusobacterium nucleatum y Porphyromonas gingivalis (periodontopatógenos), pudiendo inducir procesos de disbiosis que promocionan cambios inflamatorios e inmunológicos. Sus relaciones, no obstante, necesitan el conocimiento del mecanismo de acción exacto que los rige.
Finalmente, Yang et al.39 realizaron un estudio basado en sujetos afroamericanos (75% de los participantes), utilizando una secuencia genómica de ARNr 16S, diferenciando finalmente entre los microorganismos beneficiosos (Treponema denticola, Prevotella intermedia, Prevotella denticola y Bifidobacteriaceae) y perjudiciales (Prevotella melaninogenica, Firmicutes, Carnobacteriaceae, Streptococcaceae, Erysipelotrichaceae, Streptococcus, Solobacterium, Streptococcus sp. y Solobacterium moorei) para cáncer colorrectal. La conclusión fue la necesidad de establecer el rol de la microbiota oral en relación con la etiología de las neoplasias de colon39.
Cáncer hepáticoLos estudios realizados por Thistle et al.40 y Yang et al.17 demostraron un incremento del riesgo de neoplasia hepática en pacientes que perdieron un elevado número de dientes. Los estudios fueron realizados respectivamente en una población rural china en desventaja socioeconómica (329 casos diagnosticados durante 30años), donde se obtuvieron resultados más fuertes en mujeres con obesidad y en una cohorte de pacientes varones fumadores de Finlandia (213 casos incidentes en el seguimiento a 17años).
El estudio finés17 especificó que el riesgo aumentaba en los pacientes que perdieron entre 11 y 31 dientes definitivos, o en los totalmente edéntulos. También faltaría tener en cuenta la presencia seropositiva de H.pylori como cofactor.
Contrariamente a los dos estudios anteriores, Jordão et al.19 quisieron estudiar la controvertida relación entre salud oral deteriorada (gingivitis, periodontitis, pérdida dentaria) y riesgo de desarrollo de cáncer gastrointestinal. Tras el seguimiento de una cohorte del Reino Unido formada por 475.766 pacientes durante 6años se llegó a la conclusión de que no había una asociación definida, aunque se observó una tendencia de aumento del riesgo de cáncer hepatobiliar, específicamente de carcinoma hepatocelular. El estudio argumenta que existe una significativa variación entre localizaciones geográficas de riesgo de cáncer y salud oral.
Microbiota y cáncer hepáticoEl estudio de Lu et al.43 demostró la caracterización microbiológica oral a partir de la mucosa lingual de pacientes con neoplasia hepática. Se realizó mediante secuenciación genómica de ARN ribosómico 16S. En este, 35 casos y 25 sujetos sanos fueron enrolados, con los que se pudo concluir que existía una diferencia notable en la composición microbiológica, con presencia de Oribacterium y Fusobacterium como microorganismos distintivos en los pacientes con patología hepática.
Cáncer pancreáticoEl metaanálisis de Maisonneuve et al.14, que incluye 8 artículos, evidencia una asociación de dos patologías orales (periodontitis y edentulismo) con un aumento de riesgo de cáncer pancreático (incluso al ajustarse con otros cofactores). No obstante, los mecanismos por los que se produce no están aún determinados.
Microbiota oral y cáncer pancreáticoCuatro de los estudios4,10,41,42 indagan sobre el papel microbiológico en cáncer pancreático.
El estudio de Fan et al.10 estudió nuevos métodos para desarrollar mecanismos más rápidos, no invasivos y accesibles para identificar potenciales pacientes de riesgo. El resultado fue la caracterización genómica microbiológica en muestras orales, mostrando una asociación de riesgo aumentado y disminuido en las taxonomías presentadas en la tabla 1.
Resumen de taxonomías bacterianas para cáncer pancreático
| Microorganismos beneficiosos | Microorganismos perjudiciales | Referencias |
|---|---|---|
| Leptotrichia y Fusobacterium | Porphyromonas gingivalis y Aggregatibacter actinomycetencomitans | Fan et al. (2017) |
| – | Fusobacterium nucleatum, Granulicatella adiacens y Serratia | Gaiser et al. (2019) |
| – | No diferencia de microorganismos orales patógenos suficientemente conclusiva para cáncer pancreático | Olson et al. (2017) |
Los estudios de Gaiser et al.41 y de Olson et al.42 relacionan las neoplasias mucinosas papilares intraductales presentes en precursores premalignos quísticos sugestivos de displasia celular y con bacterias orales o mala higiene bucodental.
La hipótesis de Gaiser et al.41 fue que ciertos géneros de bacterias orales podrían iniciar procesos oncogénicos a partir de modulación inmunológica y mediante la interleucina-1β, colaborando en sinergia con las papilas mucinosas y aumentando así la producción de mucina. La caracterización genómica de las bacterias intraquísticas podría abrir un nuevo manejo etiopatológico de estas alteraciones. Toda medida que contribuya a reducir la inflamación pancreática es una herramienta terapéutica para reducir los casos de neoplasias intraductales, por lo que se estudia una posible vía mediante antibioticoterapia.
Por otro lado, y contrariamente, Olson et al.42 no obtuvieron en su estudio una diferencia suficientemente fuerte para relacionar los casos de adenocarcinomas pancreáticos ductales con lesiones premalignas mucinosas y un estado de salud oral desfavorable, teniendo en cuenta el papel que desempeña la microbiota oral en ellos. No existe, en conclusión, una gran diferencia entre la composición bacteriana oral de casos y controles sanos, solo en algunas taxonomías concretas. Serían necesarios más estudios específicos.
LimitacionesEn la presente revisión, los resultados expuestos son heterogéneos y específicos para cada tipo de cáncer, población y/o muestra elegida. La falta de concordancia entre estudios puede ser debida principalmente a la diferencia del tamaño muestral, demografía de las poblaciones estudiadas, delimitación del concepto de enfermedad periodontal, periodo de seguimiento y criterios de inclusión planteados. Es necesario definir una clara etiología, con un diagnóstico eficaz, y caracterizar las diferentes neoplasias digestivas, así como la creación de un buen mecanismo de prevención primaria a nivel comunitario.
ConclusionesLa alta incidencia asociada a la falta de diagnósticos precisos y a limitadas opciones terapéuticas de algunas neoplasias gastrointestinales explica la necesidad primordial de una prevención primaria completa. La enfermedad periodontal, la pérdida dentaria y la falta de uso de prótesis dentales podrían asociarse a una mayor prevalencia de ciertos tipos de cáncer del aparato digestivo. Este hecho se basa principalmente en una alteración de procesos inflamatorios e inmunitarios debidos a un estado de disbiosis microbiológica. Consecuentemente, la caracterización genómica microbiológica a partir de muestras orales puede mostrarse como una prometedora futura vía diagnóstica no invasiva.
Sería necesario fomentar la salud bucodental a nivel comunitario, realizando los tratamientos dentales requeridos en cada caso particular e intentando conservar el mayor número de dientes posibles. También se requiere un mayor número de estudios que verifiquen y traten de homogeneizar los diferentes parámetros de estudio a nivel de salud oral y cáncer digestivo.
Conflicto de interesesNo hay conflictos de intereses.
Esta revisión está basada en un trabajo de final de grado presentado en la Facultad de Medicina y Ciencias de la Salud, Grado de Odontología, Universidad de Barcelona.