La polineuropatía amiloidótica familiar (PAF) es una enfermedad autosómica dominante, progresiva y de fatal pronóstico, que se caracteriza por el depósito de la transtiretina (TTR), una proteína sintetizada predominantemente en el hígado1,2. Las manifestaciones clínicas dependen del tipo de órgano involucrado3. La afectación cardiaca se presenta como una miocardiopatía restrictiva, que es la principal causa de morbimortalidad4,5.
El único tratamiento etiológico eficaz es el trasplante hepático (TH) y, en pacientes que presentan afectación cardiaca importante, está indicado el TH y el cardiaco4,5.
Presentamos nuestra experiencia de 2 casos de trasplante cardıaco y hepático simultáneo por PAF.
Caso 1Paciente mujer de 61 años, procedente de Canarias, con antecedentes familiares con diagnóstico de PAF. En el año 2002, comienza sintomatología con pérdida de peso y parestesias. Se realizó el estudio genético, que demostró la presencia de la mutación Glu89Lys, con diagnóstico de PAF. El ecocardiograma mostró una miocardiopatía restrictiva. La ecografía y la TAC abdominal fueron normales. La serología fue negativa.
En enero de 2005, se realizó trasplante cardiaco según técnica de Lower-Shumway-Barnard, seguido del TH mediante la técnica de preservación de vena la cava inferior sin bypass. Además, se realizó un trasplante en dominó sin incidencias. La anatomía patológica del corazón mostró amiloidosis primaria. La evolución postoperatoria fue favorable. El ecocardiograma postoperatorio objetivó un ventrículo izquierdo y derecho no dilatado con función sistólica conservada. Fue dada de alta a los 24 días postrasplante.
La paciente sigue viva en la actualidad, con adecuada función hepática y cardiaca tras 9 años del trasplante combinado y lleva una vida cama-sillón debido al estadio avanzado de su enfermedad cuando se realizó el trasplante.
Caso 2Paciente varón de 62 años, procedente de Canarias. Sin antecedentes de interés. En mayo de 2006 es diagnosticado de miocardiopatía con disfunción moderada del ventrículo izquierdo. Se realizó el estudio genético, que demostró la presencia de la mutación Val122lle. Fue diagnosticado de PAF con afectación cardiaca biventricular y polineuropatía sensitivo-motora. Al examen físico, se auscultaba un soplo sistólico iii/viy leve hepatomegalia. En el ecocardiograma se observó un ventrículo izquierdo con hipertrofia concéntrica grave y signos de hipertensión pulmonar moderada. En la ecografía abdominal se objetivó una leve hepatomegalia y ascitis, atribuido a sobrecarga hídrica.
En septiembre del 2007 se realizó un trasplante cardiaco ortotópico según técnica de Lower-Shumway-Barnard. A continuación, se realizó el TH ortotópico mediante la técnica de preservación de vena cava inferior sin bypass. Se analizó una cuña subcapsular del hígado que no mostró alteraciones, por lo que se utilizó para un trasplante dominó. Fue dado de alta a los 17 días postrasplante con buena evolución. La histología endomiocárdica demostró el depósito de amiloide con positividad a transtiretina.
Al cabo de 7 años del trasplante hepatocardiaco, el paciente presenta buena función hepática y cardiaca sin signos de progresión neurológica y VIcon función sistólica normal (FEVI 74%).
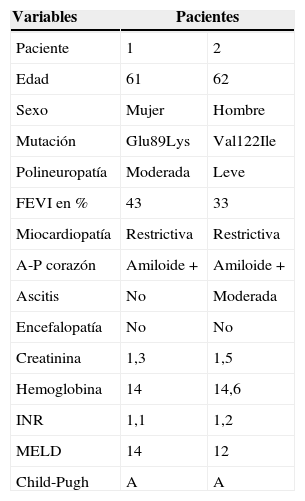
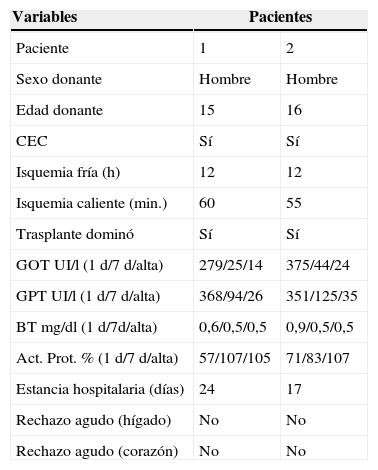
En la tablas 1 y 2, se muestran las características clínicas, demográficas y perioperatorias de los pacientes de nuestra serie en los que se realizó un trasplante hepatocardiaco simultáneo.
Características preoperatorias clínicas y demográficas de los pacientes que recibieron un trasplante simultáneo hepatocardiaco
| Variables | Pacientes | |
|---|---|---|
| Paciente | 1 | 2 |
| Edad | 61 | 62 |
| Sexo | Mujer | Hombre |
| Mutación | Glu89Lys | Val122Ile |
| Polineuropatía | Moderada | Leve |
| FEVI en % | 43 | 33 |
| Miocardiopatía | Restrictiva | Restrictiva |
| A-P corazón | Amiloide + | Amiloide + |
| Ascitis | No | Moderada |
| Encefalopatía | No | No |
| Creatinina | 1,3 | 1,5 |
| Hemoglobina | 14 | 14,6 |
| INR | 1,1 | 1,2 |
| MELD | 14 | 12 |
| Child-Pugh | A | A |
Características perioperatorias en el trasplante simultáneo hepatocardiaco
| Variables | Pacientes | |
|---|---|---|
| Paciente | 1 | 2 |
| Sexo donante | Hombre | Hombre |
| Edad donante | 15 | 16 |
| CEC | Sí | Sí |
| Isquemia fría (h) | 12 | 12 |
| Isquemia caliente (min.) | 60 | 55 |
| Trasplante dominó | Sí | Sí |
| GOT UI/l (1 d/7 d/alta) | 279/25/14 | 375/44/24 |
| GPT UI/l (1 d/7 d/alta) | 368/94/26 | 351/125/35 |
| BT mg/dl (1 d/7d/alta) | 0,6/0,5/0,5 | 0,9/0,5/0,5 |
| Act. Prot. % (1 d/7 d/alta) | 57/107/105 | 71/83/107 |
| Estancia hospitalaria (días) | 24 | 17 |
| Rechazo agudo (hígado) | No | No |
| Rechazo agudo (corazón) | No | No |
Act Prot: actividad de protrombina; BT: bilirrubina total; CEC: circulación extracorpórea; GOT: transaminasa glutámico-oxalacética; GPT: transaminasa glutámico-pirúvica.
El primer trasplante combinado de hígado y corazón fue publicado en 1984 por Starzl et al.6,7. Hasta el 2013, se habían descrito 143 trasplantes combinados cardiaco y hepático, con tasas de mortalidad operatoria que variaban entre 0 y 25%8.
Las opciones quirúrgicas que se discuten en este procedimiento son las siguientes: 1) trasplante cardiaco y posteriormente TH varios meses después; 2) trasplante cardiaco seguido por el TH dentro de la misma operación después del cierre del tórax; y 3) trasplante cardiaco seguido de TH, mientras que el corazón se reperfunde en bypass cardiopulmonar8.
El abordaje secuencial plantea como riesgo el depósito de amiloide a nivel cardıaco en el tiempo de espera para el TH, y el hecho de que el paciente recibe sus 2 injertos de donantes diferentes, que podría llevar a problemas inmunológicos7. El abordaje simultáneo presenta desventajas como son el sangrado, la coagulopatía y la prolongación del tiempo quirúrgico7. De hecho, Shaw et al. describieron que la coagulopatía inducida tardó varias horas en revertirse9. En nuestra serie, la secuencia del trasplante combinado fue, en primer lugar, el cardiaco con establecimiento de circulación extracorpórea (CEC). Al finalizar el procedimiento se realizó la desconexión de la CEC, neutralización de la heparina y posterior cierre del tórax. A continuación se procedió a la realización del TH. Este tipo de abordaje permitió un adecuado control hemodinámico posterior al trasplante cardiaco y, aunque supuso un aumento significativo en el tiempo de isquemia del hígado, este no influyó en la recuperación de la función del injerto.
La presencia de 2 órganos que procedan del mismo donante o no, en un mismo receptor, plantea problemas inmunológicos especiales. El hígado parece tener un papel inmunológico protector cuando se realiza un trasplante combinado con otros órganos, por lo que se presenta una menor incidencia de rechazo y una mayor supervivencia que en el caso del órgano extrahepático aislado7,10.
En conclusión, el trasplante combinado de hígado-corazón está indicado en los pacientes que presentan una disfunción cardiaca grave y PAF. La inducción de la tolerancia del hígado a otros órganos extrahepáticos propicia una menor incidencia de rechazo y una mayor supervivencia del corazón trasplantado.