La presión en lista de espera de trasplante hepático obliga a la exploración de nuevas fuentes de donación, siendo la utilización de injertos procedentes de donantes después de muerte cardiocirculatoria una de las que reúnen un potencial más prometedor e interesante. Inicialmente, este recurso ha sido utilizado en España a través de la llamada categoría II de Maastricht, previamente denominada asistolia no controlada tipo II. Diferentes motivos han conducido a reconsiderar la donación después de la llamada muerte cardiocirculatoria controlada en el territorio nacional. El fenómeno distintivo en este tipo de donación es el estrés isquémico al que se exponen los órganos del donante con sus importantes implicaciones sobre los resultados. Los aspectos particulares de esta modalidad de trasplante hepático son el objeto de este trabajo.
An increasing pressure on the liver transplant waiting list, forces us to explore new sources, in order to expand the donor pool. One of the most interesting and with a promising potential, is donation after cardiac death (DCD). Initially, this activity has developed in Spain by means of the Maastricht type II donation in the uncontrolled setting. For different reasons, donation after controlled cardiac death has been reconsidered in our country. The most outstanding circumstance involved in DCD donation is a potential ischemic stress, that could cause severe liver graft cell damage, resulting in an adverse effect on liver transplant results, in terms of complications and outcomes. The complex and particular issues related to DCD Donation will be discussed in this review.
El trasplante hepático no escapa a la necesidad ineludible de una expansión de las fuentes de donación de órganos, provocada por una notable desproporción entre candidatos en lista de espera, y un insuficiente número de donantes que condicionan una mortalidad en lista de espera no desdeñable.
Los llamados injertos o donantes con criterios extendidos1 suponen un importante soporte para el desarrollo de la actividad de trasplante hepático, si bien, numéricamente, su uso constituye una proporción menor en el territorio nacional actualmente.
España aglutina la experiencia más sólida en trasplante hepático a nivel mundial dentro de la donación después de muerte cardiocirculatoria no controlada2–4 tipo II (tabla 1)5,6, suponiendo esta modalidad de trasplante un 0,7% de la actividad global en el año 20117. Este fenómeno contrasta con la utilización mucho más extensiva de injertos provenientes de donación después de la muerte cardiocirculatoria controlada en países como el Reino Unido o Estados Unidos, donde la actividad de trasplante de órgano sólido realizado con este tipo de donantes ha alcanzado un 35% o un 10% respectivamente8.
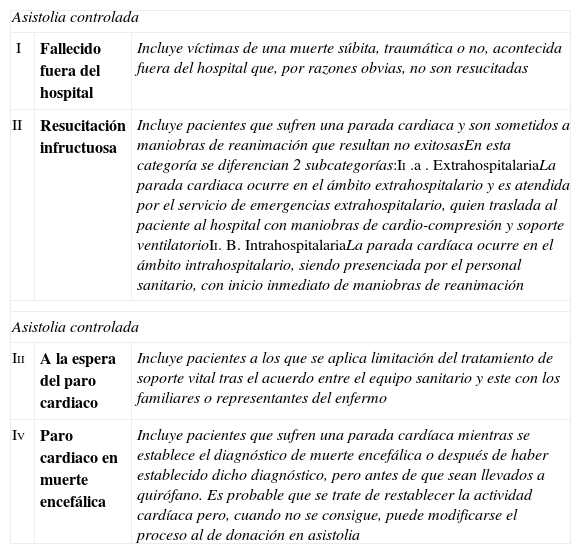
Clasificación de Maastricht modificada (ONT, Madrid 2011) para la donación después de muerte cardiocirculatoria
| Asistolia controlada | ||
| I | Fallecido fuera del hospital | Incluye víctimas de una muerte súbita, traumática o no, acontecida fuera del hospital que, por razones obvias, no son resucitadas |
| II | Resucitación infructuosa | Incluye pacientes que sufren una parada cardiaca y son sometidos a maniobras de reanimación que resultan no exitosasEn esta categoría se diferencian 2 subcategorías:Ii .a . ExtrahospitalariaLa parada cardiaca ocurre en el ámbito extrahospitalario y es atendida por el servicio de emergencias extrahospitalario, quien traslada al paciente al hospital con maniobras de cardio-compresión y soporte ventilatorioIi. B. IntrahospitalariaLa parada cardíaca ocurre en el ámbito intrahospitalario, siendo presenciada por el personal sanitario, con inicio inmediato de maniobras de reanimación |
| Asistolia controlada | ||
| Iii | A la espera del paro cardiaco | Incluye pacientes a los que se aplica limitación del tratamiento de soporte vital tras el acuerdo entre el equipo sanitario y este con los familiares o representantes del enfermo |
| Iv | Paro cardiaco en muerte encefálica | Incluye pacientes que sufren una parada cardíaca mientras se establece el diagnóstico de muerte encefálica o después de haber establecido dicho diagnóstico, pero antes de que sean llevados a quirófano. Es probable que se trate de restablecer la actividad cardíaca pero, cuando no se consigue, puede modificarse el proceso al de donación en asistolia |
El motivo principal de la renuncia inicial a la utilización de estos potenciales donantes, en los que se realiza retirada de medidas de soporte vital, radicaba en reservas de tipo ético como queda reflejado en el Documento de Consenso Español elaborado por los Grupos Españoles de Trasplante y la ONT en el año 19959. Sin embargo, varios factores han favorecido la revaluación de esta fuente de donación en España.
Como se ha comentado, la presión en la lista de espera se incrementa progresivamente, y por otro lado, las experiencias observadas en otros países europeos o en Estados Unidos han ofrecido resultados consistentes y prometedores cuando se utilizan estos injertos hepáticos.
Es de destacar que la elaboración del proyecto de ley 121/000132 Proyecto de ley reguladora de los derechos de la persona ante el proceso final de la vida10 parece suponer un cambio en el marco legal, que puede ser trascendente para el desarrollo de la donación después de muerte cardiocirculatoria controlada en el territorio nacional. Finalmente, la Organización Nacional de Trasplantes ha promovido activamente el desarrollo de un protocolo consensuado para establecer las bases de este tipo de donación6.
De este modo, se han iniciado experiencias de donación después de la muerte cardiocirculatoria controlada siendo pionero en este ámbito el Hospital Santiago Apóstol de Vitoria11, y se han multiplicado los casos de donación de manera esporádica en diferentes centros a lo largo de nuestra geografía. En la mayoría de estas donaciones de este tipo, se han obtenido injertos renales para su implante, aunque es previsible que en breve, de modo paralelo, se desarrolle la utilización de injertos hepáticos.
El primer caso publicado en el ámbito nacional de utilización de injerto hepático obtenido tras muerte cardiocirculatoria controlada tuvo lugar en el Hospital Universitario 12 de Octubre de Madrid, el 11 de mayo de 2011, y permitió el trasplante exitoso de una candidata en lista de espera12.
Todos estos hechos nos obligan a analizar atentamente los complejos e interesantes detalles de este tipo de donación, así como los resultados derivados del uso de estos injertos.
Isquemia caliente en el donanteLa denominada isquemia caliente del donante marca importantes diferencias con otros tipos de donación hepática. La muerte de origen cardiocirculatorio (tanto en la categoría II, como en la III de Maastricht)5 condiciona un escenario en el que el potencial daño por estrés isquémico desempeña un papel fundamental y de suma trascendencia en cuanto al desarrollo de complicaciones en los receptores de trasplante hepático. La transición de un metabolismo eminentemente aeróbico hacia un metabolismo anaeróbico, insuficiente para suplir la demanda energética, puede condicionar un grave daño, si no, la muerte celular. El daño isquémico se manifestará sobre hepatocitos y vía biliar de diferente modo. Un daño hepatocitario masivo provocará el fallo primario del injerto inmediato, que obligará al retrasplante hepático, mientras que grados más leves conducirán a una disfunción más o menos grave del injerto de cuya capacidad de regeneración dependerá la viabilidad futura del órgano. El daño isquémico sobre la vía biliar se manifestará como enfermedad inflamatoria estenosante, conocida como colangiopatía isquémica, de cuya intensidad también dependerá la viabilidad del injerto trasplantado. Los mecanismos fisiopatológicos íntimos que median en la aparición de estas complicaciones no se conocen con exactitud, si bien la alteración de la función de la bomba Na/K dependiente, el fenómeno de microtrombosis vascular13, los cambios en el metabolismo de las sales biliares14, la sobreproducción de radicales libres o la alteración del metabolismo del ATP con sobreproducción de hipoxantina15, han sido implicados en la aparición de este tipo de fenómenos adversos.
Estos hechos marcan diferencias muy relevantes con la donación tras la muerte encefálica en la que prevalecen otros tipos de eventos de respuesta inflamatoria sistémica, con marcado aumento de mediadores inflamatorios, con diferentes consecuencias para la viabilidad del injerto trasplantado16.
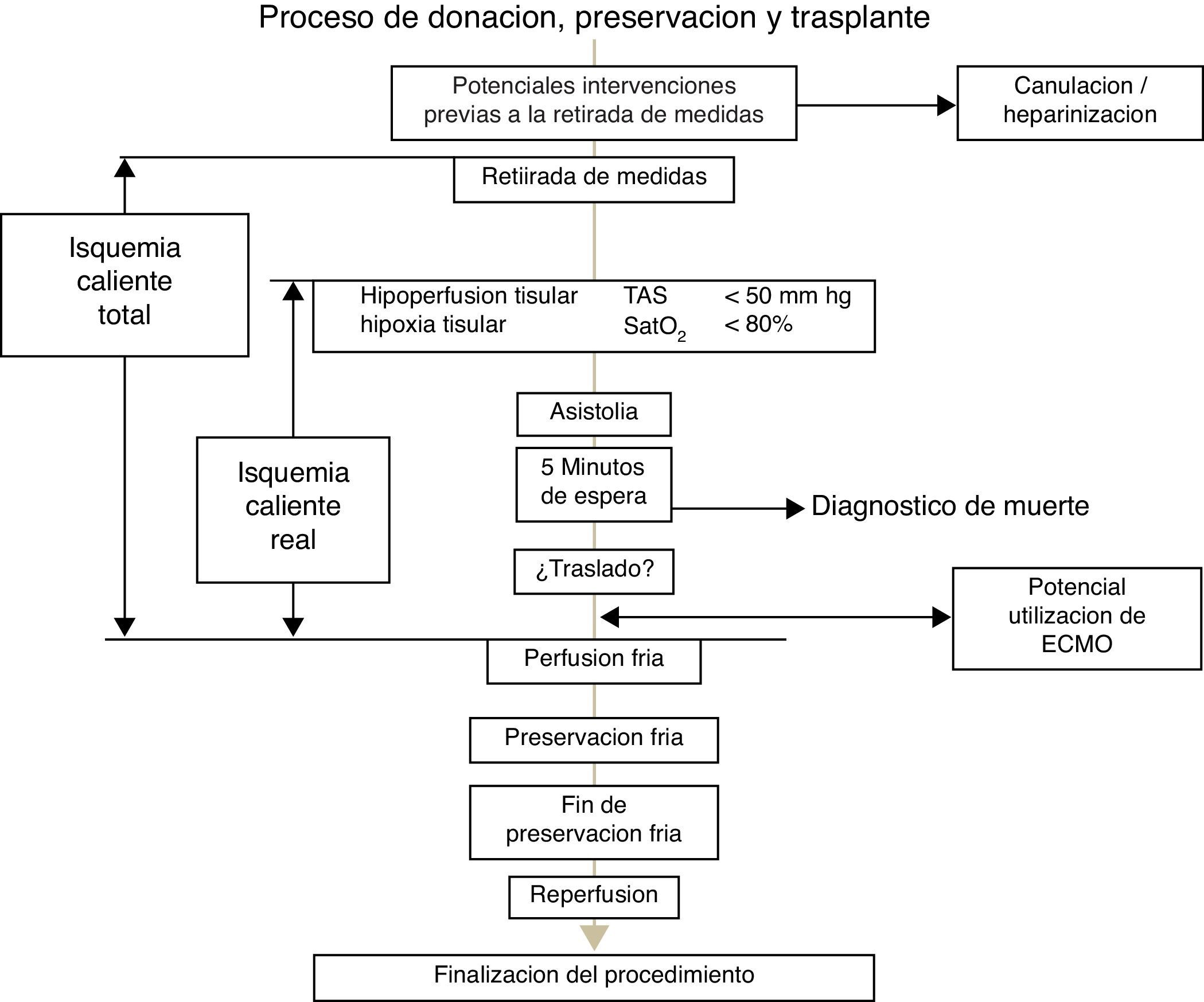
Las definiciones de los tiempos de isquemia caliente, a observar en el trasplante hepático realizado con injerto procedente de donante en muerte cardiocirculatoria controlada, esenciales en este tipo de donación, se recogen en diferentes guías y protocolos6,17,18 y merecen un comentario.
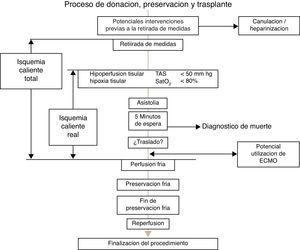
La asistolia acontece en un tiempo variable después de la retirada de medidas de soporte vital, recomendándose renunciar a la utilización hepática si esta no tiene lugar en los primeros 60minutos después de la retirada. En la figura 1 se detallan las diferentes fases del procedimiento de donación, preservación y trasplante después de la muerte cardiocirculatoria controlada. Se han de considerar 2 conceptos, el tiempo de isquemia total y el tiempo de isquemia funcional o real.
En primer lugar, se ha de considerar un tiempo de isquemia caliente total, cuyo inicio vendría delimitado por la retirada de medidas y que concluiría con el inicio de la preservación, bien mediante perfusión fría o con la entrada en recirculación normotérmica mediante dispositivo tipo Extracorporeal Membrane Oxygenation (ECMO) en el donante. Sin embargo, cobra una mayor relevancia la llamada isquemia caliente funcional (también llamada isquemia caliente real), comenzando este periodo, con el primer episodio de desaturación arterial (Sat PO2<70-80%) y/o hipotensión arterial (TAS<60-50mmHg), observadas después de la retirada de medidas, y que finalizaría en el mismo punto de perfusión fría o establecimiento de ECMO que acotan el tiempo de isquemia caliente total. El tiempo máximo aceptable para la donación hepática segura se establece en un máximo de 30 minutos de isquemia real o funcional, si bien existen experiencias de utilización con tiempos de isquemia caliente de donante discretamente más prolongados19.
Es de reseñar que, en todo caso, estos tiempos de isquemia caliente incluirían los 5 minutos de observación inmediatos a la asistolia establecidos para la certificación de la muerte y los tiempos de traslado a quirófano y/o a la mesa de intervenciones (en el caso de no realizarse la retirada de medidas en el mismo quirófano), así como los tiempos necesarios para iniciar las maniobras precisas para la preservación, mediante perfusión fría o recirculación normotérmica.
Muerte cardiocirculatoria controlada y muerte encefálicaComo cirujanos de trasplante hepático, queda lejos de nuestra competencia la decisión de la limitación del tratamiento de soporte vital. Por otro lado, esta decisión ha de ser obligadamente previa e independiente al planteamiento de la donación de órganos para trasplante. En este sentido, existen aspectos relacionados con este tipo de donación que deben ser tenidos en cuenta.
La sustitución o competencia arbitraria entre donación por muerte encefálica por la donación después de muerte cardiocirculatoria controlada es un fenómeno preocupante, reflejado por diferentes estudios20,21, que ha de ser analizado y evitado. La sustitución de la donación tras muerte encefálica, realizada de un modo indiscriminado, puede provocar un efecto negativo tanto en el aspecto cualitativo (resultados del trasplante), como en el cuantitativo (número de órganos válidos) en la actividad de trasplante hepático.
La Organización Nacional de Trasplantes en su reciente documento «Donación en Asistolia en España: Situación Actual y Recomendaciones»6 alude a una inferior rentabilidad general de este tipo de donación en los citados aspectos cuantitativos y cualitativos para el trasplante, y recomienda no considerar esta fuente de órganos como una alternativa equivalente a la donación en muerte encefálica, para considerar aquel planteamiento, en los casos en los que la evolución a la muerte encefálica del donante (en la mayoría de los casos pacientes con patología neurológica grave con pronóstico funcional catastrófico) no fuera previsible.
En cuanto los aspectos cuantitativos negativos, relacionados con esta modalidad de donación, es pertinente reseñar que en el Reino Unido existe un promedio de obtención de 3,6 órganos implantados por donante en muerte encefálica y de 2,1 órganos implantados por donante después de muerte cardiocirculatoria controlada22. Por otro lado, se ha de considerar que la utilización de un injerto procedente de una donación después de muerte cardiocirculatoria conlleva a la restricción de factores adversos añadidos como, esteatosis, necesidades de drogas, parada cardiorrespiratoria previa a la donación u otros eventos, que sumados al estrés isquémico del proceso de donación pueden hacer descartar un injerto que sí sería trasplantado en el caso de una donación de muerte encefálica. En un escenario en el que la edad de nuestros donantes hepáticos se incrementa progresivamente y considerando que la mayoría de los grupos acepta edades máximas seguras de donante hepático recomendables entre 60-65 años en el ámbito de la muerte cardiocirculatoria controlada, la sustitución indiscriminada supondría también una merma cuantitativa en los números absolutos de donación hepática.
Un problema notable, añadido en el caso de la muerte cardiocirculatoria controlada, deriva de la alta proporción de potenciales donantes en los que, una vez realizada la limitación de medidas de soporte vital, solo sufren asistolia después de tiempos de isquemia calientes tan prolongados (especialmente críticos en la donación hepática) que no permiten la utilización de los posibles injertos. Esta circunstancia de cancelación de donación por los motivos descritos se ha cuantificado en el Reino Unido, alcanzando un 40% de las potenciales donaciones después de muerte cardiocirculatoria, circunstancia que resulta en una pérdida cuantitativa de injertos hepáticos22.
Aspectos técnicosLa técnica más extendida, utilizada para la extracción de este tipo de injertos, es la comúnmente conocida como súper-rápida, descrita en Pittsburgh en 199523.
Esta técnica se basa en el acceso inmediato, una vez declarado el fallecimiento, a la arteria aorta infrarrenal para la introducción directa de la solución fría de preservación heparinizada; a esta maniobra se sucedería, a continuación el drenaje de la vena cava inferior y del cierre aórtico supracelíaco, (a nivel intratorácico o abdominal) con el fin de seleccionar el territorio de perfusión. Paralelamente se procedería al enfriamiento externo de los órganos abdominales con suero helado y a la perfusión portal, también con solución heparinizada. La implantación percutánea premortem de un catéter de doble balón para la selección del territorio a perfundir24 agiliza el proceso de comienzo de perfusión una vez diagnosticado el fallecimiento si bien comporta la solicitud de consentimiento para realizar manipulaciones en el donante (heparinización y canulación) y encarece el procedimiento.
Nuevas modificaciones en la técnica de extracción son objeto de investigación25. Una alternativa a la técnica estándar de perfusión fría rápida sería el establecimiento de un circuito de recirculación normotérmica26, similar al utilizado en los centros de mayor experiencia en donación después de la muerte cardiocirculatoria no controlada3,27. Las ventajas de la utilización de esta opción se basarían en un preacondicionamiento isquémico y la posibilidad de realizar determinaciones de marcadores de viabilidad de injerto durante el tiempo de mantenimiento. Por el momento no existe evidencia científica de estas potenciales ventajas o una aproximación al tiempo recomendable de mantenimiento del donante en recirculación normotérmica, siendo actualmente objeto de investigación.
Resultados en el trasplante hepático y muerte cardiocirculatoria controladaLa utilización de este tipo de donación obliga al análisis de potenciales complicaciones que pudieran ocurrir con mayor prevalencia en este tipo de trasplante. La hipoxia e hipotensión correspondientes a los tiempos transcurridos entre la retirada de medidas y el comienzo de las maniobras de preservación, bien sea mediante perfusión fría o recirculación normotérmica, deben desempeñar un papel decisivo en el desarrollo de estos fenómenos.
Paralelamente al análisis de los posibles eventos adversos derivados de la utilización de este tipo de injertos, es obligado conocer cuáles son las implicaciones económicas que el desarrollo de este tipo de donación conlleva, que se ha estimado en hasta un 25% de incremento de gasto en el trasplante hepático, con la utilización de injertos de donante en muerta cardiocirculatoria, que incluso alcanzaría la duplicación de los costes en el caso de precisarse un retrasplante28.
Complicaciones: trombosis arterial del injerto, fallo primario, colangiopatía isquémica y perfil de recidiva de reinfección por virus de la hepatitis CSi bien se identificó la trombosis arterial como un fenómeno especialmente frecuente en el trasplante realizado con este tipo de injerto en las series iniciales29, las experiencias más recientes no confirman estos hallazgos, apareciendo esta complicación con una frecuencia similar a la observada con el uso de injertos convencionales.
El fallo primario del injerto hepático expresa la manifestación máxima del estrés isquémico que comporta la muerte hepatocitaria masiva con insuficiencia hepática aguda grave de aparición inmediata al implante, y que obliga al retrasplante urgente para salvar la vida del receptor. Esta complicación se ha descrito con una frecuencia variable que ha disminuido desde las series iniciales, constituyendo una complicación infrecuente con tasas de aparición que no alcanzan el 4% en las últimas series publicadas30–33. Múltiples factores se encuentran implicados en la disminución de las frecuencias de aparición de este fenómeno relacionado con la curva de aprendizaje y las mejoras en las técnicas de preservación y extracción de órganos.
La denominada colangiopatía isquémica, caracterizada por la aparición de estenosis biliares de localización hiliar y/o intrahepática, en ausencia de trombosis arterial, es otra de las manifestaciones de la hipoperfusión y/o hipoxia tisular sufrida por el donante. Al contrario del fallo primario, se trata de una complicación no inmediata cuya aparición se ha descrito con frecuencia y cronología variable. El hecho de que el 50% del flujo arterial hepático se destine al sistema ductal biliar, explicaría que ante un intenso daño isquémico transitorio se desencadene una respuesta inflamatoria que finalmente resulte en la aparición de estenosis de vía biliar a nivel hiliar y/o intrahepático, a pesar de demostrarse un flujo arterial patente en el momento del diagnóstico34.
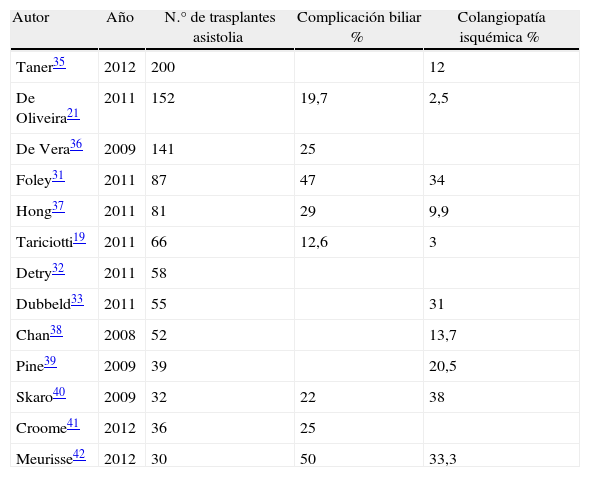
En las primeras experiencias descritas con la utilización de este tipo de donantes controlados, la prevalencia de esta complicación era muy elevada, sin embargo, las últimas series publicadas (tabla 2) demuestran unas frecuencias de aparición de este fenómeno inferiores, observándose en estudios de series recientes tasas de complicación biliar por colangiopatía isquémica no superiores a un 3%21, incluso con la utilización injertos procedentes de donantes tras muerte cardiocirculatoria categorizados como de criterios extendidos17.
Complicaciones biliares, colangiopatía isquémica y retrasplante por colangiopatía isquémica
| Autor | Año | N.° de trasplantes asistolia | Complicación biliar % | Colangiopatía isquémica % |
| Taner35 | 2012 | 200 | 12 | |
| De Oliveira21 | 2011 | 152 | 19,7 | 2,5 |
| De Vera36 | 2009 | 141 | 25 | |
| Foley31 | 2011 | 87 | 47 | 34 |
| Hong37 | 2011 | 81 | 29 | 9,9 |
| Tariciotti19 | 2011 | 66 | 12,6 | 3 |
| Detry32 | 2011 | 58 | ||
| Dubbeld33 | 2011 | 55 | 31 | |
| Chan38 | 2008 | 52 | 13,7 | |
| Pine39 | 2009 | 39 | 20,5 | |
| Skaro40 | 2009 | 32 | 22 | 38 |
| Croome41 | 2012 | 36 | 25 | |
| Meurisse42 | 2012 | 30 | 50 | 33,3 |
Complicación biliar y colangiopatía isquémica en series de trasplante hepático con utilización de injertos procedentes de donantes tras muerte cardiocirculatoria controlada.
En cualquiera de los casos, esta complicación parece asociarse particularmente a la utilización de injertos procedentes de donantes en asistolia, reconociéndose, según corrobora un reciente metaanálisis43, una frecuencia de aparición de colangiopatía isquémica de un 16%, conllevando el uso de estos injertos un riesgo más de 10 veces superior para la aparición de este fenómeno que el correspondiente a la utilización de injertos de donantes en muerte encefálica.
Los factores de riesgo asociados a la aparición de este tipo de complicación han sido investigados, y en este sentido, se han reconocido como tales una edad de donante superior31,36,38,40, peso de donante elevado38 o elevada razón peso de donante/peso de receptor40, o unos tiempos de isquemia caliente35 o fría más prolongados31,38,42.
Por otro lado, se han ensayado diferentes métodos para intentar controlar la aparición de este problema, como la perfusión arterial a presión en banco44 o la administración de activador de plasminógeno tisular13. El manejo de esta entidad es también variable dependiendo de su espectro anatómico de presentación y de las consecuencias de este fenómeno sobre la función del injerto. En el caso de no tratarse de un problema difuso y que no conlleve una disfunción relevante del injerto, la primera aproximación al problema se basa en las dilataciones por acceso percutáneo por radiología intervencionista o en el tratamiento endoscópico, obteniéndose buena respuesta en un 30% de los casos31.
Las implicaciones de la aparición de esta complicación son sumamente trascendentes, dado que constituye la causa más frecuente de retrasplante en el ámbito de la utilización de injertos hepáticos procedentes de donantes fallecidos tras muerte cardiocirculatoria28,40,45, y que además, la mayor parte de los pacientes que padecen colangiopatía isquémica precisarán retrasplante31,35,41.
El retrasplante, por lo tanto, ha de ser considerado precozmente, habida cuenta del elevado número de procedimientos que podrían ser necesarios para manejar esta complicación, los riesgos inherentes, los costes adicionales que conlleva el tratamiento endoscópico o el realizado por radiología intervencionista y la baja probabilidad de alcanzar la resolución del problema.
Selección del receptorLa adecuada selección del receptor idóneo para un injerto de estas características ha sido y es objeto de estudio y debate. Teóricamente, aquellos candidatos con reserva funcional más limitada más difícilmente pudieran afrontar las complicaciones asociadas a la utilización de este tipo de injertos, y así, los más recientes estudios de registro, evidencian una significativa tendencia a trasplantar con estos órganos a pacientes con MELD más bajos o que no se encuentren en una situación clínica especialmente comprometida45–50. Algunos de estos trabajos han sugerido un impacto negativo en los candidatos con puntuaciones MELD más elevadas o peor situación clínica46,47,49,51, si bien, este punto es todavía objeto de investigación. Por otro lado, una selección adecuada de donante y receptor ha permitido obtener resultados satisfactorios con estos injertos hepáticos, incluso en el caso de realizarse el trasplante a pacientes en situación crítica52.
En lo referente a la selección de candidatos, también se han identificado varios factores pronósticos adversos como la edad del receptor46–48,51, el hecho de que un injerto hepático procedente de un donante en asistolia se utilice para realizar un retrasplante hepático47,49,51, el hecho de que se trate de órganos compartidos48 o la presencia de hepatocarcinoma46,48 y/o de insuficiencia renal46,48,51, sin embargo, las características del receptor óptimo para este tipo de trasplante no se han definido completamente.
La alta prevalencia de la infección por virus virus de la hepatitis C (VHC), así como la recidiva universal postrasplante en el candidato virémico, obligan a considerar la reinfección del injerto por VHC como un problema mayor en el trasplante hepático. Según demuestra un reciente estudio multicéntrico47, este fenómeno ocurre de modo paralelo en los candidatos sometidos a trasplante hepático con órganos procedentes de donantes fallecidos por muerte cardiocirculatoria después de la retirada de medidas. Los escasos estudios que comparan la evolución de los candidatos infectados con VHC cuando estos son trasplantados con donantes en muerte encefálica o con donantes fallecidos después de muerte cardiocirculatoria53, tan solo observan en algún caso peor evolución de estos injertos en relación con hepatitis recurrente. En el estudio de Jay et al., basado en 1.113 pacientes48, se evidencia la máxima probabilidad de pérdida de injerto en el caso de trasplante de órgano procedente de donante después de muerte cardiocirculatoria para candidato con infección VHC cuando se establece un grupo de referencia de trasplantados con un órgano de donante de muerte encefálica en receptores no infectados con virus C, no obstante, el último trabajo basado en el registroUnited Net of Organ Sharing (UNOS), Estados Unidos, también con un amplio tamaño muestral54, concluye que la opción de trasplante con estos donantes para los candidatos VHC positivos ha de considerarse válida al no demostrarse un efecto significativamente negativo para esta población.
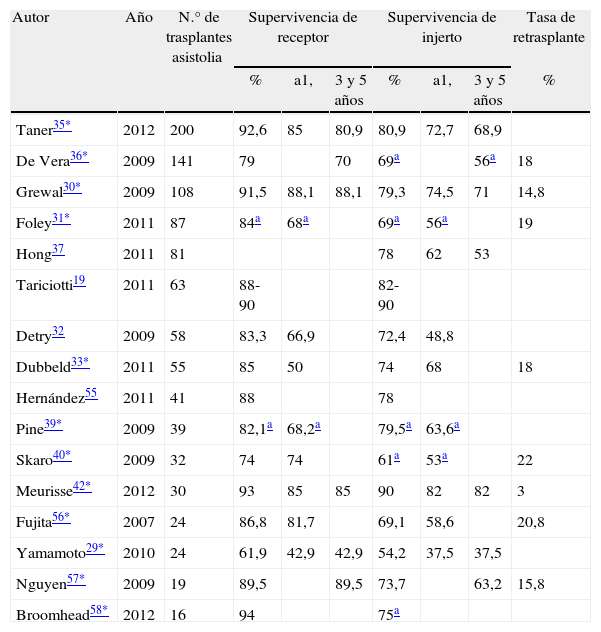
Supervivencia de receptor, supervivencia de injertoLas características de este tipo de trasplante han condicionado supervivencias de injertos y pacientes que han de ser analizadas. Los estudios de series de trasplante más recientes (tabla 3) han mostrado en general supervivencias equiparables19,29,30,32,33,35,37,42,55-58 a las obtenidas con otras fuentes de donación, si bien algunos de ellos han mostrado desventaja significativa para el trasplante hepático con órgano de asistolia31,36,39,40,58. Habría que destacar que los estudios de registro recientes (tabla 4) basados en poblaciones un tanto heterogéneas pero apoyados sobre tamaños muestrales mucho más consistentes, han demostrado supervivencias significativamente inferiores de injerto45,50,51 e incluso en algunos casos peores para injertos y receptores trasplantados con órganos procedentes de donantes en asistolia46,48,49 en la comparación con otras fuentes de donación hepática.
Supervivencia de paciente e injerto y tasa de retrasplante en series de trasplante hepático con utilización de injertos procedentes de donantes tras muerte cardiocirculatoria controlada
| Autor | Año | N.° de trasplantes asistolia | Supervivencia de receptor | Supervivencia de injerto | Tasa de retrasplante | ||||
| % | a1, | 3 y 5 años | % | a1, | 3 y 5 años | % | |||
| Taner35* | 2012 | 200 | 92,6 | 85 | 80,9 | 80,9 | 72,7 | 68,9 | |
| De Vera36* | 2009 | 141 | 79 | 70 | 69a | 56a | 18 | ||
| Grewal30* | 2009 | 108 | 91,5 | 88,1 | 88,1 | 79,3 | 74,5 | 71 | 14,8 |
| Foley31* | 2011 | 87 | 84a | 68a | 69a | 56a | 19 | ||
| Hong37 | 2011 | 81 | 78 | 62 | 53 | ||||
| Tariciotti19 | 2011 | 63 | 88-90 | 82-90 | |||||
| Detry32 | 2009 | 58 | 83,3 | 66,9 | 72,4 | 48,8 | |||
| Dubbeld33* | 2011 | 55 | 85 | 50 | 74 | 68 | 18 | ||
| Hernández55 | 2011 | 41 | 88 | 78 | |||||
| Pine39* | 2009 | 39 | 82,1a | 68,2a | 79,5a | 63,6a | |||
| Skaro40* | 2009 | 32 | 74 | 74 | 61a | 53a | 22 | ||
| Meurisse42* | 2012 | 30 | 93 | 85 | 85 | 90 | 82 | 82 | 3 |
| Fujita56* | 2007 | 24 | 86,8 | 81,7 | 69,1 | 58,6 | 20,8 | ||
| Yamamoto29* | 2010 | 24 | 61,9 | 42,9 | 42,9 | 54,2 | 37,5 | 37,5 | |
| Nguyen57* | 2009 | 19 | 89,5 | 89,5 | 73,7 | 63,2 | 15,8 | ||
| Broomhead58* | 2012 | 16 | 94 | 75a | |||||
Supervivencia de receptor y de injerto en series de trasplante hepático con utilización de injertos procedentes de donantes tras muerte cardiocirculatoria controlada.
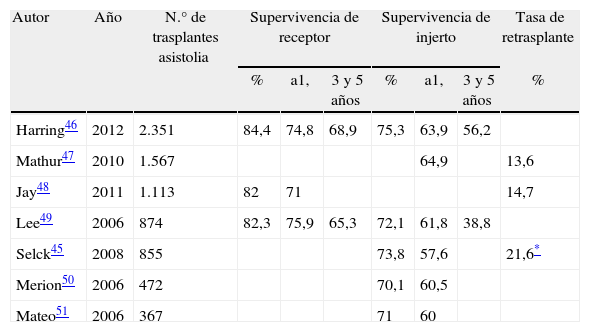
Supervivencia de paciente e injerto y tasa de retrasplante en series de trasplante hepático con utilización de injertos procedentes de donantes tras muerte cardiocirculatoria controlada
| Autor | Año | N.° de trasplantes asistolia | Supervivencia de receptor | Supervivencia de injerto | Tasa de retrasplante | ||||
| % | a1, | 3 y 5 años | % | a1, | 3 y 5 años | % | |||
| Harring46 | 2012 | 2.351 | 84,4 | 74,8 | 68,9 | 75,3 | 63,9 | 56,2 | |
| Mathur47 | 2010 | 1.567 | 64,9 | 13,6 | |||||
| Jay48 | 2011 | 1.113 | 82 | 71 | 14,7 | ||||
| Lee49 | 2006 | 874 | 82,3 | 75,9 | 65,3 | 72,1 | 61,8 | 38,8 | |
| Selck45 | 2008 | 855 | 73,8 | 57,6 | 21,6* | ||||
| Merion50 | 2006 | 472 | 70,1 | 60,5 | |||||
| Mateo51 | 2006 | 367 | 71 | 60 | |||||
Supervivencia de receptor y de injerto en estudios de registro en trasplante hepático con utilización de injertos procedentes de donantes tras muerte cardiocirculatoria controlada.
La utilización de injertos hepáticos procedentes de donantes después de muerte cardiocirculatoria ofrece resultados prometedores. Este recurso de donación, de desarrollo incipiente en el territorio nacional, ha de ser utilizado racionalmente sin resultar en competencia con la donación procedente de muerte encefálica. La investigación en el campo de las técnicas de preservación probablemente facilite en un futuro no lejano controlar las complicaciones específicas observadas en esta modalidad de trasplante hepático, permitiendo una sustancial mejora de los resultados.
FinanciaciónBeca posgrado concedida por la Fundación Mutua Madrileña: donación en asistolia tipo III de Maastricht. Centro: Queen Elisabeth Hospital (Birmingham), Reino Unido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A nuestra Organización Nacional de Trasplantes por su continuo estímulo y esfuerzo para el máximo desarrollo de la donación en España.