El único tratamiento curativo del cáncer de páncreas (CP) es la exéresis quirúrgica, pero debido a su presentación clínica tardía solo el 15-25% de los pacientes son candidatos a resección curativa. El objetivo de este trabajo, prospectivo y unicéntrico, es determinar la utilidad de la PET-TC preoperatoria en el diagnóstico precoz del CP, en su estadificación y en la detección de estadios precursores de la enfermedad en una serie de 139 pacientes sometidos a intervención quirúrgica con «intención curativa» y con el diagnóstico histológico de adenocarcinoma ductal.
MétodosHemos estudiado las características histopatológicas del CP y de las diferentes lesiones panIN en las piezas quirúrgicas de 139 pacientes sometidos a resección pancreática durante el periodo 2010-2014, comparando estos resultados con los datos preoperatorios de una tomografía computarizada multidetector con contraste trifásico (TCMD) y una PET-TC en la que la captación de glucosa fue determinada por el SUV, considerando malignidad por encima de 2,5.
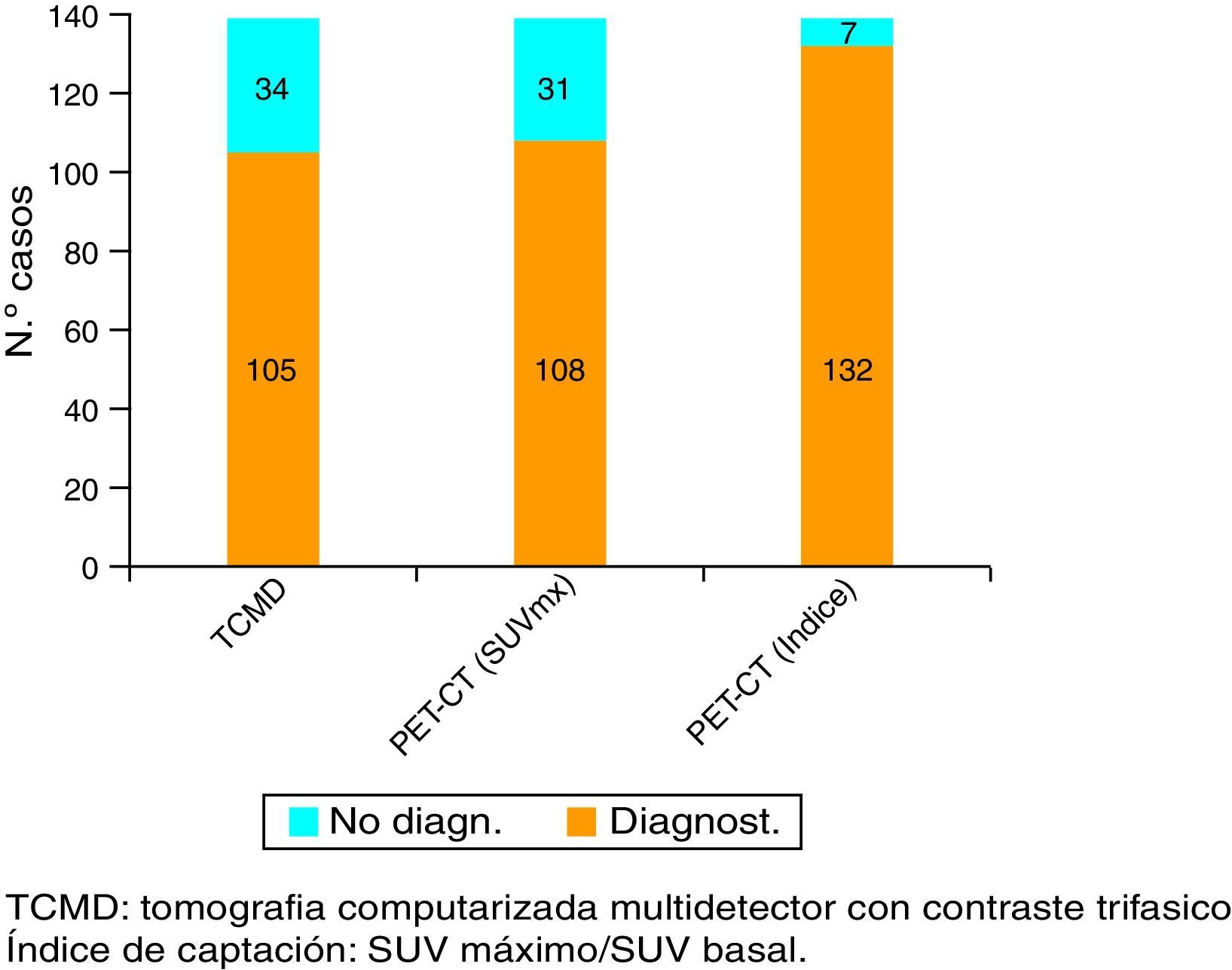
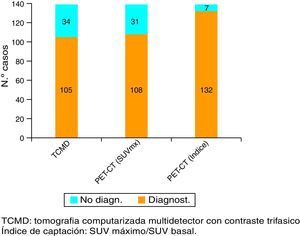
ResultadosEn nuestra serie, la sensibilidad de la PET-TC para el diagnóstico tumoral fue del 77,7% (108 de los 139 casos) versus el 75,5% (105 de los 139 casos) para la TCMD. Cuando combinamos este valor máximo del SUV tumoral con el SUV máximo de tejido pancreático normal de cada paciente, la sensibilidad diagnóstica de la PET-TC para el CP asciende al 94,9% (132 de los 139 casos).
ConclusiónUna combinación de los estudios del PET-TC en el tejido tumoral y no tumoral de cada paciente puede ser una herramienta diagnóstica muy útil no solo para el diagnóstico preoperatorio del CP, sino también para las lesiones panIN.
In pancreatic ductal adenocarcinoma (PDA), surgical resection is the only curative treatment, but due to its late clinical presentation only 15-25% patients are candidates for curative resection. The aim of this prospective, single-center study is to determine the diagnostic utility of preoperative PET-CT for early detection of PDA and early panIN lesions.
MethodsWe studied the histopathological features of PDA and different panIN lesions in 139 surgical samples from patients undergoing pancreatic resection (from 2010-2014), comparing these results with preoperative PET-CT and MDCT study. For tumor diagnosis in PET-CT maximum standard SUV 2.5 was used. Pancreatic baseline SUVmax is the maximum uptake of the radiotracer 18-2FDG on the ROI curve determined for the area of the normal pancreas after pathological reassessment with areas not affected by tumours or preneoplastic lesions. Tumour Uptake Index is the ratio between the tumour SUVmax and pancreatic baseline SUVmax.
ResultsUsing an standard maximum SUV value of 2.5, PET-CT sensitivity was 77.7% (108 of the 139 cases) against 75.5% (105 of the 139 cases) of MDCT. But when we combined this value with maximum SUV of normal pancreatic tissue from each patient, PET-CT sensitivity improved its value to 94.9%.
ConclusionA combination of studies of PET-CT in tumor and non-tumor tissue of each patient might be a very useful diagnostic tool not only for preoperative diagnosis of PDA, but also for early panIN lesions.
El único tratamiento curativo del cáncer de páncreas (CP) es la exéresis quirúrgica1-7. La supervivencia a los 5años es inferior al 5%, elevándose al 30% en los pacientes sometidos a cirugía con intención curativa asociada a radioterapia y quimioterapia adyuvante8-10.
Hoy en día quizá se pueda mejorar la supervivencia del CP si se consigue un diagnóstico precoz y una estadificación tumoral precisa, además de la detección de lesiones precursoras del CP, conocidas como neoplasias intraepiteliales pancreáticas (panIN)11-15. Algunos autores16-22 sugieren que la 18-fluorodeoxiglucosa en la tomografía por emisión de positrones-tomografía computarizada (PET-TC) podría aportar beneficios en este sentido. Además, en modelos experimentales se ha observado que la PET puede ser útil para la detección de lesiones precursoras de CP, pero nunca se ha evaluado su utilidad en humanos23.
El objetivo de nuestro trabajo es determinar la utilidad de la PET-TC preoperatoria en el diagnóstico precoz del CP, en su estadificación y en la detección de estadios precursores de la enfermedad en una serie de 139 pacientes sometidos a intervención quirúrgica con «intención curativa» y con el diagnóstico histológico de adenocarcinoma ductal.
MétodosPacientesEn nuestro hospital y de forma prospectiva, a 139 pacientes diagnosticados de CP se les realizó una resección pancreática con «intención curativa» durante el periodo 2010-2014. La edad media fue de 60,6±12,9años (rango: 37-79años). Respecto al sexo, 88 pacientes (63,3%) eran varones y los 51 restantes (36,7%) eran mujeres. Las variables estudiadas fueron: localización tumoral y tamaño tumoral, grado histológico del tumor, estadio TNM, invasión linfovascular, invasión perineural, metástasis ganglionares, presencia de lesiones panIN, SUV máximo tumoral, SUV máximo de panIN y SUV máximo basal de páncreas.
MétodosLa resecabilidad y la estadificación preoperatoria se evaluaron mediante una tomografía computarizada multidetector con contraste trifásico (TCMD) y una PET-TC en la que la captación de glucosa fue determinada por el SUV, considerando malignidad por encima de 2,5. En nuestra serie, en 103 casos (74,1%) se realizó una duodenopancreatectomía cefálica; en 26 casos (18,7%), una pancreatectomía corporocaudal, y en los 10 restantes casos, una duodenopancreatectomía total.
La precisión diagnóstica para la estadificación del CP de la PET-TC y la TCMD se calculó a partir de los hallazgos intraoperatorios e informes anatomopatológicos de cada paciente. Todas las piezas quirúrgicas fueron estudiadas por 2 únicos patólogos especialistas en patología pancreática. En todos los casos, el tipo histológico fue un adenocarcinoma ductal. La estadificación se realizó según la 7.ª edición de la clasificación TNM de la AJCC/UICC24,25.
Definición de conceptos- •
SUV: el valor estandarizado de captación (SUV) es el índice semicuantitativo más usado y mide la captación de FDG de la lesión (MBq/cc) en relación con la dosis inyectada corregida por el peso del paciente (MBq/kg).
- •
SUV máximo tumoral es la captación máxima de radiotrazador 18-2FDG (18F-2-flúor-2-desoxi-D-glucosa) en la curva ROI determinada para el área tumoral a estudio. Se considera patológico un SUV máximo ≥2,5.
- •
SUV máximo de panIN es la captación máxima de radiotrazador 18-2FDG en la curva ROI determinada para el área con lesiones histopatológicas compatibles con lesiones panIN reevaluadas tras el análisis histopatológico de la pieza quirúrgica.
- •
SUV máximo basal del páncreas es la captación máxima de radiotrazador 18-2FDG en la curva ROI determinada para el área de páncreas normal tras ser reevaluado anatomopatológicamente con áreas no afectas por tumor ni por lesiones preneoplásicas.
- •
Índice de captación tumoral (ICT) es el cociente entre el SUV máximo tumoral y el SUV máximo basal pancreático.
La sensibilidad de la TC para la detección del CP se calculó en función de los resultados histológicos de la pieza resecada. El test de McNemar fue utilizado para comparar la sensibilidad de detección de la PET-TC frente a la de la TCMD. El análisis estadístico se llevó a cabo utilizando el software SPSS (versión 20.0), SPSS Inc, Chicago, Ill), a través de las pruebas de Fisher y el coeficiente de correlación de Spearman. Un valor de p<0,05 fue considerado estadísticamente significativo.
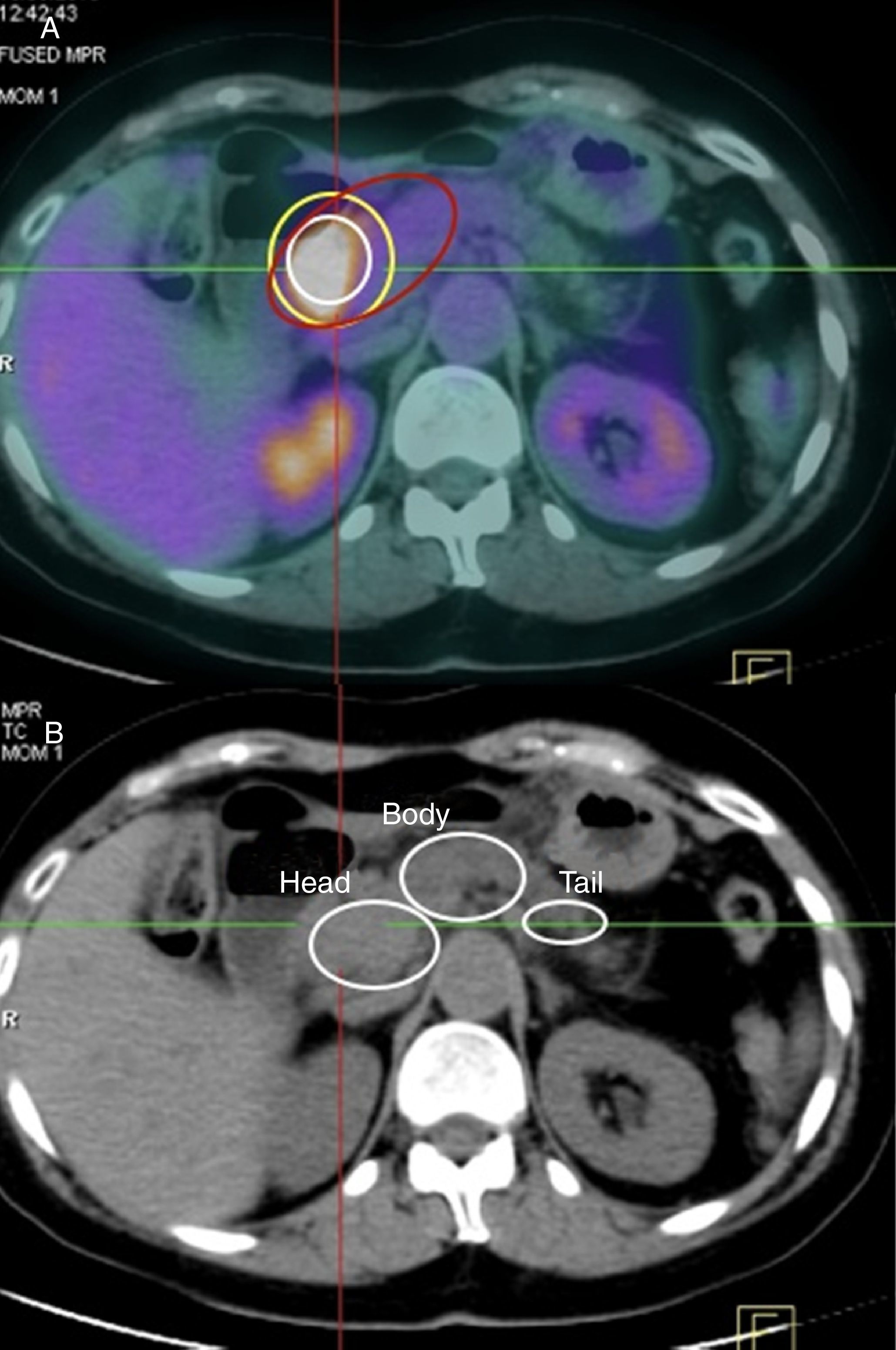
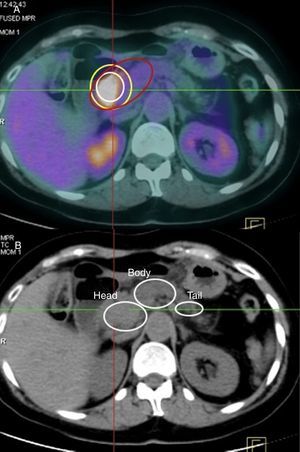
ResultadosCaracterísticas histopatológicas de nuestra serieEn el examen histológico (AP) de las piezas quirúrgicas la localización tumoral más frecuente fue la cabeza pancreática (113 de 139, lo que supone un 81,3% de los casos), mientras que los 26 casos restantes se localizaron en cuerpo y cola pancreáticos (18,7% de los casos). La cabeza pancreática también fue la localización tumoral más frecuentemente descrita con el resto de técnicas, siendo los porcentajes en la TC y en la PET-TC del 75,5% (105 de 139 pacientes) y del 77,7% (108 de 139 pacientes), respectivamente. Analizando estos resultados, existe una relación estadísticamente significativa (ES) entre la localización tumoral de la AP con la localización tumoral en la TC (p=0,01) y la PET-TC (p=0,02).
La media del tamaño tumoral en la AP fue de 2,7±0,75cm (rango: 1,5-4cm). La media del tamaño tumoral en la TC fue de 2,5±1,25cm y en la PET-TC, de 2,6±0,87cm. Analizando estos resultados, existe una relación ES entre el tamaño tumoral de la AP con el tamaño tumoral en la TC (p=0,01) y la PET-TC (p=0,02).
Respecto al grado histológico, en 29 pacientes se encontró un tumor bien diferenciado (20,9%), en 103 pacientes (74,1%) un tumor moderadamente diferenciado y en los 7 pacientes restantes (5,1%) un tumor pobremente diferenciado. En nuestra serie, en 54 de los 139 casos (38,8%) y en 76 de los 139 casos (54,6%) había una invasión linfovascular y perineural, respectivamente.
En cuanto a la estadificación TNM, el 24,4% (34 pacientes) eran T1, el 36% (50 casos) eran T2 y el 39,6% restante (55 casos) eran T3. El 21,6% de los pacientes no tuvieron invasión metastásica ganglionar (30 casos), mientras que el 78,4% restante (109 casos) fueron N1. En cuanto al estadio, el 37,4% (52 pacientes) fueron clasificados como un estadio inferior o igual a IIA y el 62,6% restante (87 pacientes) eran un estadio IIB.
Por último, en 109 de los 139 pacientes (78,4%) se objetivaron adenopatías metastásicas en la pieza quirúrgica. Sin embargo, preoperatoriamente solo en 75 pacientes (53,9%) existió sospecha de metástasis ganglionares en la TCMD, y solo en 10 pacientes (7,2%) en la PET-TC, lo que demuestra una escasa sensibilidad de la PET-TC. En nuestra serie, no existe relación ES entre la presencia o ausencia de metástasis ganglionares y su detección en la TCMD ni en la PET-TC.
Valor estandarizado de captación máximo del páncreas normal, del páncreas tumoral y de las neoplasias intraepiteliales pancreáticasLa mayoría de autores consideran patológico el SUV máximo ≥2,5. Sin embargo, dado que existe una gran variabilidad de captación en el tejido pancreático sano en la PET-TC interindividuos, en nuestra serie se ha realizado en cada uno de los pacientes una medición del SUV máximo basal del páncreas, siendo la mediana de 1,28. Además, en cada paciente los hallazgos de la PET-TC se correlacionaron anatomopatológicamente con áreas no afectas por tumor ni por lesiones preneoplásicas. En nuestra serie, la mediana del SUV máximo tumoral fue de 3,29.
Un 68,3% de pacientes (95 de los 139 casos) presentaron lesiones preneoplásicas en el estudio de AP, siendo en 30 casos (21,6%) lesiones panIN grado 3. La localización más frecuente fue la cabeza del páncreas (53 casos), lo que supone el 38,1% de los casos estudiados. Además, encontramos que en 45 casos (32,6%) se apreció multicentrismo de las lesiones panIN en la pieza quirúrgica. La mediana de SUV máximo alcanzado en las lesiones panIN grado3 fue de 2,8; en el panIN grado2, de 1,95, y en el panIN grado1, de 1,76.
En base a que existe mucha variabilidad de captación basal y tumoral interindividuos, en nuestra serie se ha calculado un índice entre el SUV máximo tumoral y el SUV máximo basal que nos permite establecer como límite inferior de sospecha de cáncer pancreático un valor de 1,33, mientras que en el estudio de las lesiones panIN el índice o coeficiente de captación SUV máximo de panIN con respecto al SUV máximo basal del páncreas fue de 1,03. Al analizar nuestra serie, el 95% de los pacientes (132 casos) presentaron un índice SUV máximo tumoral/SUV máximo basal superior a 1,33.
Validez de la TCMD y de la PET-TC para el diagnóstico y estadificación del cáncer de páncreasLa sensibilidad de la TCMD para el diagnóstico de CP fue del 75,5% (105 de los 139 casos). Por su parte, la sensibilidad de la PET-TC fue del 77,7% (108 casos) usando como criterio de sospecha de malignidad SUV máximo tumoral de 2,5. Sin embargo, si utilizamos el coeficiente SUV máximo tumoral/SUV basal (índice de captación) con punto de corte en 1,33, la sensibilidad se eleva al 94,9% (132 de 139 pacientes) (figs. 1 y 2).
En el CP, a pesar de la cirugía con intención curativa, son muchos los pacientes que desarrollan una recidiva tumoral entre los 6-15meses tras la cirugía, lo que se relaciona con la gran agresividad biológica del tumor y con la extensión tumoral extrapancreática que no se detecta en la cirugía9. Por otra parte, en la historia natural del adenocarcinoma ductal, gracias a la biología molecular, se han descrito las lesiones precursoras denominadas panIN11-14 en las que el epitelio ductal normal evolucionaría hacia un epitelio con metaplasia (panIN grados 1A y 1B), posteriormente con displasia leve o de bajo grado (panIN grado2) y, de forma progresiva, a displasia severa o de alto grado (panIN grado3) y, por último, a un carcinoma invasivo, de forma paralela a la acumulación de sucesivas mutaciones genéticas. Por todo lo anterior, cabe esperar que se puedan mejorar los resultados del tratamiento del CP si se consigue un diagnóstico precoz y una estadificación tumoral precisa, además de la detección de lesiones panIN15. Esto habitualmente es insuficientemente valorado con las técnicas convencionales de imagen y, por ello, pretendemos analizar la utilidad de la PET-TC en el diagnóstico precoz del CP.
En nuestro estudio, la distribución por sexo, la edad media, el tamaño tumoral, la localización tumoral más frecuente y la media de SUV máximo coinciden con lo descrito en la bibliografía consultada26-28.
Actualmente todavía no está clara la utilidad de la PET-TC en el diagnóstico y estadificación del CP28,29. Su sensibilidad para el diagnóstico inicial oscila entre el 73-94%, mientras que su especificidad desciende hasta alcanzar el 60-89%, en relación con la posible aparición de falsos positivos que suceden en procesos inflamatorios tales como pancreatitis, pseudoquistes infectados y materiales protésicos, entre otros.
Además, diversos estudios30-32 han comparado los resultados de la PET con los de la TC y la RMN, publicándose resultados contradictorios respecto a que la primera proporcione información adicional respecto a las otras técnicas. Otros autores33,34 consideran que la asociación de la PET con la TCMD permite conseguir una mejor resolución espacial-anatómica, aunque su uso con contraste intravenoso no está muy extendido, perdiendo así sensibilidad para el diagnóstico de pequeños tumores y metástasis35.
Fendrich et al.23 publicaron en 2011 un estudio en el que habían realizado un modelo experimental de detección de lesiones precursoras de CP en ratones K-RAS mutados, los cuales desarrollaban lesiones panIN que evolucionaban a CP invasivo. En este trabajo se demostró que había sobreexpresión de GLUT-2 en las lesiones panIN a partir del tipo1B y en estadios más avanzados, lo que se asociaba con un incremento del transporte y la acumulación intracelular de FDG, objetivable a través de PET-TC. Apoyándonos en los resultados de estos autores23, realizamos este estudio en los pacientes con sospecha de CP, y por eso se realizó de manera preoperatoria una TCMD y una PET-TC en todos los casos. En nuestro trabajo, la sensibilidad de la TCMD para el diagnóstico de CP fue del 75,5% mientras que para la PET-TC fue del 77,7%. Así mismo, no se obtuvieron diferencias ES respecto a la estadificación TNM. En nuestra serie, la mediana del SUV máximo tumoral fue de 3,29, no utilizando la media como medida de posición por presentar la serie valores muy dispersos que oscilan entre 1,18-12,73. En nuestro estudio hemos observado que si en la PET-TC consideramos el punto de corte para sospecha de malignidad en un SUV máximo de 2,5, como hacen diversos autores18-21, perdemos un 23,8% de los pacientes con CP durante el diagnóstico preoperatorio. Para solucionar este problema, basándonos en la gran variabilidad de captación de FDG del páncreas sano (basal) interindividuos y en la presencia de falsos positivos y negativos dependientes del sesgo de instrumentación, se realizó medición en cada individuo del índice de captación tumoral (ICT). Utilizando este índice, en nuestra serie podemos afirmar que el 95% de los pacientes con CP presentan un ICT superior a 1,33. La sensibilidad de la PET-TC en el diagnóstico de ICT alcanza, con este nuevo índice, el 94,9%, vs el 76,2% que se obtiene utilizando como parámetro diagnóstico el SUV máximo superior o igual a 2,5.
Así mismo, en nuestra serie, el 68,3% de pacientes presentaban lesiones panIN. Evaluamos de forma retrospectiva la traducción de las áreas anatómicas afectas por estas lesiones con respecto a la captación de FDG basal del páncreas en la PET-TC, obteniendo diferencias estadísticamente significativas en la captación de FDG con respecto al tejido pancreático sano para panIN grado1, grado2 y grado3, respectivamente. En nuestra serie, el ICT utilizado para el diagnóstico de las lesiones panIN fue de 1,03, con lo que pudimos diagnosticar el 95% de los pacientes afectos por dichas lesiones. Quizá con la utilización del ICT podamos detectar lesiones multicéntricas panIN grado2 y grado3 a nivel de cuerpo y cola del páncreas, lo que obligaría a realizar pancreatectomías totales. Asimismo, podría utilizarse en los grupos de pacientes de alto riesgo para desarrollar un CP; por ejemplo, pancreatitis crónica hereditaria, síndrome de Gardner, síndrome de Peutz-Jeghers, etc.
En resumen, según nuestra experiencia la PET-TC es una valiosa arma para el diagnóstico preoperatorio del CP y de las lesiones preneoplásicas panIN, si bien el análisis debe ser individualizado y muy meticuloso en cada uno de los pacientes a estudio. El uso del ICT podría ser útil para el diagnóstico en los pacientes sospechosos de malignidad y con pruebas de imagen (TCMD) dudosas.
AutoríaDiseño del estudio. En este apartado han participado: Francisco Sánchez Bueno, Rocío García-Pérez, María Antonia Claver Valderas y Pascual Parrilla Paricio.
Adquisición y recogida de datos. En este apartado han participado: Francisco Sánchez-Bueno, Rocío García-Pérez, Laura Frutos Esteban y Matilde Fuster Quiñonero.
Análisis e interpretación de los resultados. En este apartado han participado: Francisco Sánchez Bueno, Rocío García-Pérez, María Antonia Claver Valderas, Jesús de la Peña Moral y Matilde Fuster Quiñonero.
Redacción del artículo. En esta apartado han participado: Francisco Sánchez Bueno, Rocío García-Pérez, Eduardo Ortiz Ruiz y Laura Frutos Esteban.
Revisión crítica y aprobación de la versión final. En este apartado han participado: Francisco Sánchez-Bueno, Rocío García-Pérez y Pascual Parrilla Paricio.
Conflicto de interesesDeclaramos que no hay conflicto de intereses en ninguno de los autores.