El objetivo principal de este estudio es determinar si la Unidad de Cirugía Hepato-Bilio-Pancreática y Trasplante Hepático del Hospital Universitario de Badajoz cumple los estándares de calidad exigidos por la comunidad científica a los centros de referencia de cirugía pancreática (CP) en términos de resultados perioperatorios. Los objetivos secundarios consisten en comparar las diferentes técnicas de CP realizadas en función de la morbimortalidad postoperatoria precoz y analizar el impacto de las resecciones extendidas en dichos términos.
MétodoEstudio descriptivo, retrospectivo y unicéntrico, correspondiente al periodo 2006-2019. Se compararon los resultados obtenidos con los estándares de calidad propuestos por Bassi et al. y Sabater et al., exigidos a los centros de referencia en cirugía pancreática. La muestra se dividió según técnica quirúrgica y se compararon en términos de morbimortalidad postoperatoria precoz, estudiando el impacto de las resecciones vasculares y viscerales extendidas. Se incluyeron todos los pacientes sometidos a cirugía pancreática en nuestra unidad por patología pancreática, maligna y benigna, desde que ésta se implementó como centro de referencia. Se excluyeron las realizadas de urgencia.
ResultadosSe analizaron 631 pacientes. Los valores obtenidos en los estándares de calidad se encuentran en rango. La cirugía más frecuente fue duodenopancreatectomía cefálica, la cual asoció mayor tasa de morbimortalidad perioperatoria (p ≤ 0,05). Las resecciones vasculares añadidas impactaron en el grupo de duodenopancreatectomía cefálica asociando mayor estancia media (p = 0,01) y mayor tasa de reintervención (p = 0,02).
ConclusionesLa experiencia acumulada permite cumplir con los estándares de calidad exigidos, así como realizar resecciones extendidas a la pancreatectomía con buenos resultados en términos de morbimortalidad postoperatoria.
The main objective of this study is to determine if our unit meets the quality standards required by the scientific community from the reference centers for pancreatic surgery in terms of peri-operative results. The secondary objectives are to compare the different pancreatic surgery techniques performed in terms of early post-operative morbidity and mortality and to analyze the impact of the resections added in these terms.
MethodDescriptive, retrospective and single-center study, corresponding to the period 2006-2019. The results obtained were compared with the proposed quality standards, by Bassi et al. and Sabater et al., required from the reference centers in pancreatic surgery. The sample was divided according to surgical technique and compared in terms of early post-operative morbidity and mortality, studying the impact of extended vascular and visceral resections. All patients undergoing pancreatic surgery in our unit due to pancreatic, malignant and benign pathology were included, since it was implemented as a reference center. Emergency procedures were excluded.
Results631 patients were analyzed. The values ??obtained in the quality standards are in range. The most frequent surgery was cephalic duodenopancreatectomy, which associated higher peri-operative morbidity and mortality rates (p ≤ 0.05). The extended vascular resections impacted the cephalic duodenopancreatectomy group, associating a longer mean stay (p = 0.01) and a higher rate of re-interventions (p = 0.02).
ConclusionsThe experience accumulated allows to meet the required quality standards, as well as perform extended resections to pancreatectomy with good results in terms of post-operative morbi-mortality.
Pese a que actualmente, en centros de alto volumen de cirugía pancreática (CP), la mortalidad postoperatoria se sitúa en torno al 5%1,2, la morbilidad continua siendo elevada alcanzando tasas del 60%3,4. Independientemente de las complicaciones quirúrgicas generales asociadas a cualquier procedimiento, la CP presenta complicaciones específicas: retraso del vaciamiento gástrico (RVG), fístula pancreática (FP) y hemorragia postpancreatectomía (HP), con incidencias asociadas del 19%-57%5, 2%-20%6 y 1%-8%7, respectivamente.
Sabater et al.8 establecieron los estándares de calidad exigibles en CP oncológica. Proponen tasas de resecabilidad > 58%, de morbilidad < 73% y de mortalidad < 10%, con tasas asociadas de fístula biliar (FB) < 14%, de FP < 29%, de HP < 21% y de reintervención < 20%, con una estancia media < 21 días.
Los tres tipos de CP más frecuentes son duodeno-pancreatectomía cefálica (DPC), pancreatectomía corporo-caudal (PCC) y pancreatectomía total (PT). La tasa de morbilidad postoperatoria asociada a DPC es del 50-60%, con una mortalidad del 5%9; PT asocia una morbilidad del 59,3%, con una mortalidad del 2,1%10; constituyendo PCC el grupo con menores tasas de morbimortalidad, 18% y 0,6%11, respectivamente.
El objetivo principal de este estudio es determinar si la Unidad de Cirugía Hepato-Bilio-Pancreática y Trasplante Hepático del Hospital Universitario de Badajoz cumple los estándares de calidad exigidos por la comunidad científica a los centros de referencia de CP en términos de resultados perioperatorios. Los objetivos secundarios son comparar las diferentes técnicas de CP realizadas en términos de morbimortalidad postoperatoria precoz y analizar el impacto de las resecciones extendidas en dichos términos.
MétodoSe ha realizado un estudio descriptivo, retrospectivo y unicéntrico, correspondiente al periodo 2006-2019. Se incluyeron todos los pacientes sometidos a CP en nuestra unidad por patología pancreática, maligna y benigna, desde que ésta se implementó como centro de referencia regional de CP. Se excluyeron las CP realizadas de urgencia.
Manejo diagnóstico y prequirúrgicoEn nuestro centro el estudio de una lesión pancreática se realiza mediante prueba de imagen y estudios de laboratorio. La primera prueba es una tomografía axial computarizada (TAC). La resonancia magnética nuclear (RMN) se emplea en caso de duda diagnóstica o contraindicación de TAC; la tomografía por emisión de positrones (PET) en caso de sospecha de metástasis a distancia, y la ecoendoscopia en caso de necesidad de toma de biopsia o mejor caracterización de la afectación vascular. Los estudios de laboratorio no incluyen parámetros de función pancreática específicos, se solicita hemograma, bioquímica general y perfil hepático, coagulación y marcadores tumorales. En caso de sospecha de tumor neuroendocrino (TNE) se solicitan los test específicos para cada uno de ellos.
Tras la prueba de imagen, el adenocarcinoma ductal pancreático (ADP) se clasificó según los criterios del hospital MD Anderson12, en resecable, borderline resecable e irresecable. Todos los ADP en los que se indicó cirugía sin neoadyuvancia fueron considerados resecables, aquellos en los que se indicó neoadyuvancia fueron considerados borderline resecables.
La tasa de resecabilidad se ha calculado con base en los pacientes sometidos a laparotomía.
Nuestro grupo indica drenaje biliar prequirúrgico (DBP) en los siguientes casos:
- •
Hiperbilirrubinemia + clínica biliar.
- •
Hiperbilirrubinemia + tiempo de espera hasta la cirugía ≥ 15 días.
- •
Hiperbilirrubinemia + necesidad de tratamiento neoadyuvante.
Se estableció como hiperbilirrubinemia a aquella situación clínica en la que el paciente presenta valores analíticos de bilirrubina directa superior a 0,3 mg/dL y/o bilirrubina total superior a 1,2 mg/dL.
La neoadyuvancia se indicó en aquellos casos en los que el tumor se clasificó en el diagnóstico como borderline12,13. El esquema utilizado fue folfirinox ± radioterapia (RT), o gemcitabina + paclitaxel ± RT (terapia sistémica: capecitabina o 5-FU en infusión continua) en función del estado y evolución del paciente14. La RT fue administrada tras los ciclos de quimioterapia (2-6), generalmente a 36 Gy en fracciones de 2,4 Gy.
Técnica y variables quirúrgicas- •
DPC15. Realizamos cuatro técnicas distintas de anastomosis pancreática:
- ∘
Ductomucosa (DM)16
- ∘
Blumgart (BM)17
- ∘
Embutida (EM)18
- ∘
Pancreatogastrostomía (PG)19
En todas ellas el uso de tutor pancreático no estaba estandarizado, constituyendo su uso una decisión intraoperatoria de cada cirujano. Si se procedía a su colocación, se llevaba a cabo como tutor perdido20.
La muestra se dividió en tres grupos, según técnica quirúrgica: DPC, PCC y PT.
Se establecieron dos tipos de resecciones extendidas:
- •
Resección visceral extendida (RVE). Resección de algún órgano extra en el grupo DPC y realización de esplenectomía (EP) en los grupos PCC y PT.
- •
Resección vascular extendida (RVaE). Resección de alguna estructura vascular arterial (arteria mesentérica superior, tronco celíaco y/o arteria hepática) y/o venosa (vena porta y/o mesentérica superior) en cualquiera de los grupos.
La consistencia del páncreas se clasificó con base en el aspecto macroscópico y al tacto del páncreas en duro24 o blando25. Por su parte, el tamaño de Winsurg, el cual se midió utilizando una regla quirúrgica, se clasificó en estrecho, si el diámetro era < 3 mm, y ancho, si era ≥ 3 mm26.
En nuestro centro, el abordaje laparoscópico solo se indica en casos de PCC ± EP, sin afectación vascular ni visceral añadida. Nuestra experiencia es limitada, ya que este abordaje se incorporó a nuestro arsenal en el año 2017.
MorbimortalidadSe han estudiado las tasas generales de complicaciones médicas (CM) y de complicaciones quirúrgicas (CQ), describiendo las más frecuentes, clasificándolas según Clavien-Dindo27 y exponiendo su manejo. Tras esto se estudiaron las complicaciones específicas de la CP. Hemos utilizado las definiciones y conceptos propuestos por International Study Group on Pancreatic Fistula Definition (ISGPF) y por International Study Group of Pancreatic Surgery (SGPS)28. Las tasas de CQ, CM, HP, reintervención y mortalidad precoz, así como la estancia media, se han calculado en función de las cirugías resectivas. El cálculo de la tasa de FP solo se realizó respecto al total de DPC y PCC, y la de RVG en relación al total de DPC.
La tasa de mortalidad calculada ha sido la correspondiente a los primeros 90 días postoperatorios.
Se calculó el impacto de las resecciones extendidas en dichas variables de morbimortalidad.
Protocolo anatomopatológicoEl protocolo anatomopatologico se basó en el sistema de clasificación propuesto por la International Union Against Cancer29 y el estudio de los márgenes de resección quirúrgico de las piezas de adenocarcinomas pancreáticos, en el estudio del Royal College30.
Estudio estadísticoEl estudio estadístico se realizó con el programa IBM SPSS Statistics® V22.2. Las variables nominales se expresan como número y porcentajes (%) y las cuantitativas como mediana y rango intercuartílico, en las unidades que correspondan.
Tras confirmar la distribución normal de la muestra mediante el test Shapiro Wilk, se establecieron los grupos y se compararon las tasas de las variables de morbimortalidad utilizando el test de χ2 en las variables nominales, la t de Student en las variables continuas, cuando se estudiaron dos grupos, así como el test ANOVA cuando se estudiaron tres grupos. La significación estadística se estableció con un valor p ≤ 0,05. El estudio multivariante se realizó mediante regresión logística con aquellas variables que presentaron p ≤ 0,2 en el estudio univariante. La significación estadística se mantuvo para un valor de p ≤ 0,05 y el riesgo se estimó mediante los coeficientes de riesgo B y EXP (B).
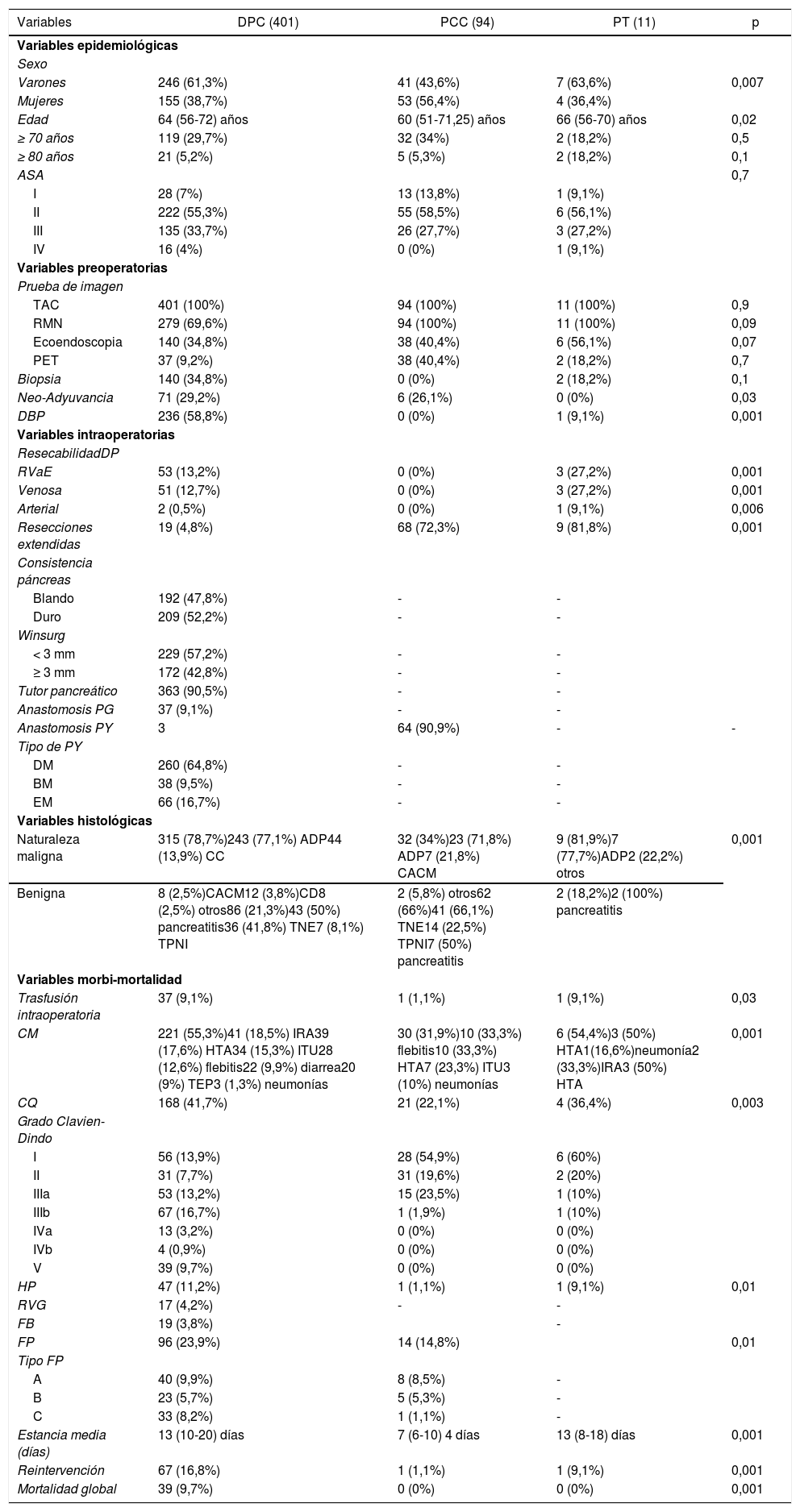
ResultadosEn el periodo de estudio se han realizado 631 CP, con una tasa de resecabilidad asociada del 80,2%.
La CP más frecuente fue DPC, seguida de PCC y PT (tabla 1).
Estudio descriptivo por grupo de cirugía
| Variables | DPC (401) | PCC (94) | PT (11) | p |
|---|---|---|---|---|
| Variables epidemiológicas | ||||
| Sexo | ||||
| Varones | 246 (61,3%) | 41 (43,6%) | 7 (63,6%) | 0,007 |
| Mujeres | 155 (38,7%) | 53 (56,4%) | 4 (36,4%) | |
| Edad | 64 (56-72) años | 60 (51-71,25) años | 66 (56-70) años | 0,02 |
| ≥ 70 años | 119 (29,7%) | 32 (34%) | 2 (18,2%) | 0,5 |
| ≥ 80 años | 21 (5,2%) | 5 (5,3%) | 2 (18,2%) | 0,1 |
| ASA | 0,7 | |||
| I | 28 (7%) | 13 (13,8%) | 1 (9,1%) | |
| II | 222 (55,3%) | 55 (58,5%) | 6 (56,1%) | |
| III | 135 (33,7%) | 26 (27,7%) | 3 (27,2%) | |
| IV | 16 (4%) | 0 (0%) | 1 (9,1%) | |
| Variables preoperatorias | ||||
| Prueba de imagen | ||||
| TAC | 401 (100%) | 94 (100%) | 11 (100%) | 0,9 |
| RMN | 279 (69,6%) | 94 (100%) | 11 (100%) | 0,09 |
| Ecoendoscopia | 140 (34,8%) | 38 (40,4%) | 6 (56,1%) | 0,07 |
| PET | 37 (9,2%) | 38 (40,4%) | 2 (18,2%) | 0,7 |
| Biopsia | 140 (34,8%) | 0 (0%) | 2 (18,2%) | 0,1 |
| Neo-Adyuvancia | 71 (29,2%) | 6 (26,1%) | 0 (0%) | 0,03 |
| DBP | 236 (58,8%) | 0 (0%) | 1 (9,1%) | 0,001 |
| Variables intraoperatorias | ||||
| ResecabilidadDP | ||||
| RVaE | 53 (13,2%) | 0 (0%) | 3 (27,2%) | 0,001 |
| Venosa | 51 (12,7%) | 0 (0%) | 3 (27,2%) | 0,001 |
| Arterial | 2 (0,5%) | 0 (0%) | 1 (9,1%) | 0,006 |
| Resecciones extendidas | 19 (4,8%) | 68 (72,3%) | 9 (81,8%) | 0,001 |
| Consistencia páncreas | ||||
| Blando | 192 (47,8%) | - | - | |
| Duro | 209 (52,2%) | - | - | |
| Winsurg | ||||
| < 3 mm | 229 (57,2%) | - | - | |
| ≥ 3 mm | 172 (42,8%) | - | - | |
| Tutor pancreático | 363 (90,5%) | - | - | |
| Anastomosis PG | 37 (9,1%) | - | - | |
| Anastomosis PY | 3 | 64 (90,9%) | - | - |
| Tipo de PY | ||||
| DM | 260 (64,8%) | - | - | |
| BM | 38 (9,5%) | - | - | |
| EM | 66 (16,7%) | - | - | |
| Variables histológicas | ||||
| Naturaleza maligna | 315 (78,7%)243 (77,1%) ADP44 (13,9%) CC | 32 (34%)23 (71,8%) ADP7 (21,8%) CACM | 9 (81,9%)7 (77,7%)ADP2 (22,2%) otros | 0,001 |
| Benigna | 8 (2,5%)CACM12 (3,8%)CD8 (2,5%) otros86 (21,3%)43 (50%) pancreatitis36 (41,8%) TNE7 (8,1%) TPNI | 2 (5,8%) otros62 (66%)41 (66,1%) TNE14 (22,5%) TPNI7 (50%) pancreatitis | 2 (18,2%)2 (100%) pancreatitis | |
| Variables morbi-mortalidad | ||||
| Trasfusión intraoperatoria | 37 (9,1%) | 1 (1,1%) | 1 (9,1%) | 0,03 |
| CM | 221 (55,3%)41 (18,5%) IRA39 (17,6%) HTA34 (15,3%) ITU28 (12,6%) flebitis22 (9,9%) diarrea20 (9%) TEP3 (1,3%) neumonías | 30 (31,9%)10 (33,3%) flebitis10 (33,3%) HTA7 (23,3%) ITU3 (10%) neumonías | 6 (54,4%)3 (50%) HTA1(16,6%)neumonía2 (33,3%)IRA3 (50%) HTA | 0,001 |
| CQ | 168 (41,7%) | 21 (22,1%) | 4 (36,4%) | 0,003 |
| Grado Clavien-Dindo | ||||
| I | 56 (13,9%) | 28 (54,9%) | 6 (60%) | |
| II | 31 (7,7%) | 31 (19,6%) | 2 (20%) | |
| IIIa | 53 (13,2%) | 15 (23,5%) | 1 (10%) | |
| IIIb | 67 (16,7%) | 1 (1,9%) | 1 (10%) | |
| IVa | 13 (3,2%) | 0 (0%) | 0 (0%) | |
| IVb | 4 (0,9%) | 0 (0%) | 0 (0%) | |
| V | 39 (9,7%) | 0 (0%) | 0 (0%) | |
| HP | 47 (11,2%) | 1 (1,1%) | 1 (9,1%) | 0,01 |
| RVG | 17 (4,2%) | - | - | |
| FB | 19 (3,8%) | - | ||
| FP | 96 (23,9%) | 14 (14,8%) | 0,01 | |
| Tipo FP | ||||
| A | 40 (9,9%) | 8 (8,5%) | - | |
| B | 23 (5,7%) | 5 (5,3%) | - | |
| C | 33 (8,2%) | 1 (1,1%) | - | |
| Estancia media (días) | 13 (10-20) días | 7 (6-10) 4 días | 13 (8-18) días | 0,001 |
| Reintervención | 67 (16,8%) | 1 (1,1%) | 1 (9,1%) | 0,001 |
| Mortalidad global | 39 (9,7%) | 0 (0%) | 0 (0%) | 0,001 |
Variables nominales expresadas como número (n) y porcentaje (%).
Variables cuantitativas expresadas como mediana y rango intercuartil.
ADP: adenocarcinoma ductal pancreático; ASA: American Society Anesthesiology; BM: Blumgart; CACM: cistoadenocarcinoma mucinoso; CC: colangiocarcinoma; CD: cáncer duodenal; CM: complicación médica; CQ: complicación quirúrgica; DBP: drenaje biliar pre-quirúrgico; DM: ductomucosa; DP: derivación paliativa; DPC: duodeno-pancreatectomía cefálica; EM: embutida; FB: fístula biliar; FP: fístula pancreática; HP: hemorragia post-pancreatectomía; HTA: hipertensión arterial; IRA: insuficiencia respiratoria aguda; ITU: infección de tracto urinario; PCC: pancreatectomía corporocaudal; PET: tomografía por emisión de positrones; PG: pancreatogastrostomía; PT: pancreatectomía total; PY: pancreatoyeyunostomía; RMN: resonancia magnética nuclear; RvaE: resección vascular extendida; RVE: resección visceral extendida; RVG: retraso del vaciamiento gástrico; TAC: tomografía axial computarizada; TEP: trombo-embolismo pulmonar; TNE: tumor neuroendocrino; TPMI: tumor papilar mucinoso intraductal.
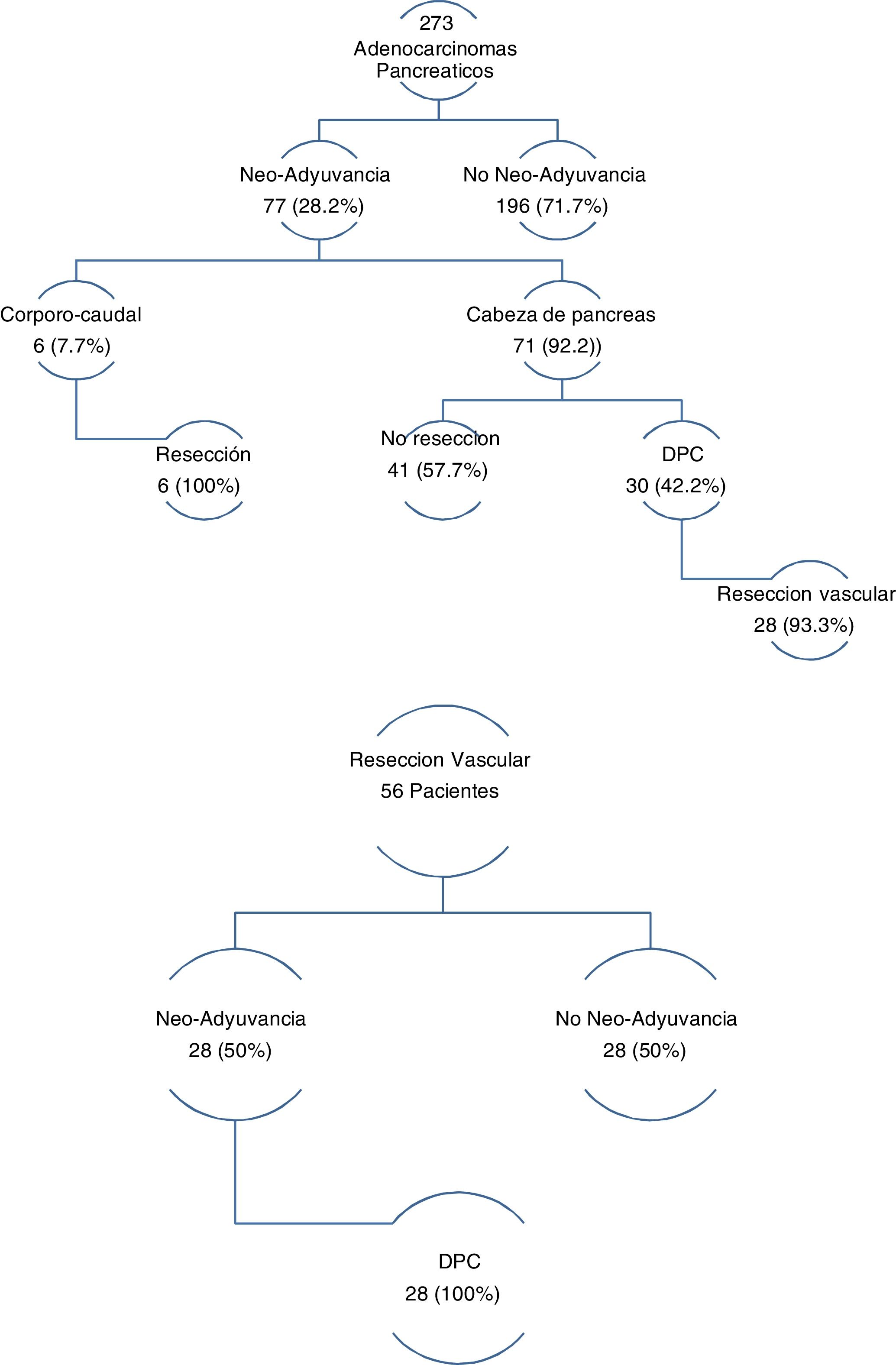
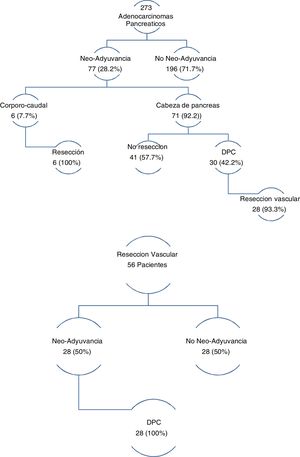
Los tres grupos son homogéneos en términos de variables epidemiológicas y preoperatorias. Salvo, en el sexo de los pacientes (p = 0,007) y las tasas de DBP (p = 0,03) y neoadyuvancia (p = 0,001), ambas superiores en el grupo DPC (tabla 1). Las tasas de rescate quirúrgico tras neoadyuvancia fueron del 100% en el grupo PCC y del 42,2% en el grupo DPC (fig. 1).
Las patologías malignas y benignas más frecuentes fueron ADP y TNE, respectivamente. La mayor parte de los pacientes intervenidos mediante DPC presentaron indicación quirúrgica en el contexto de una enfermedad maligna (p = 0,001) (tabla 1).
El grupo DPC presentó una mayor tasa de RVaE general (p = 0,001), y mayores tasas de RVaE arterial (p = 0,006) y venosa (p = 0,001). En cuanto a las RVE, el grupo PCC fue en el que se observó una mayor tasa (p = 0,001) (tabla 1). La tasa del grupo DPC es la más baja de los tres, con el colon ascendente como órgano más frecuentemente resecado.
En el grupo de pacientes con RVaE, la tasa de neoadyuvancia fue del 50%. Y de rescate quirúrgico tras neoadyuvancia del 100% (fig. 1).
La DPC presentó las tasas más elevadas en las variables de morbimortalidad con diferencias estadísticamente significativas en todas ellas (tabla 1).
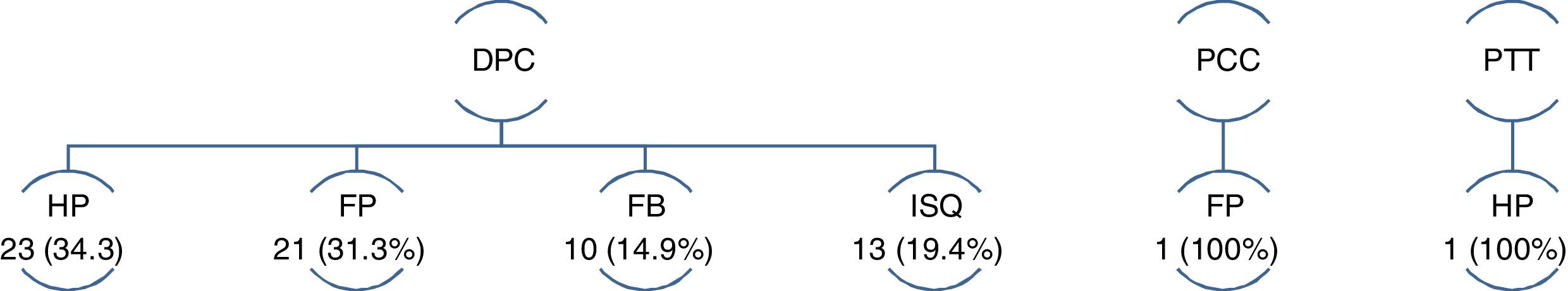
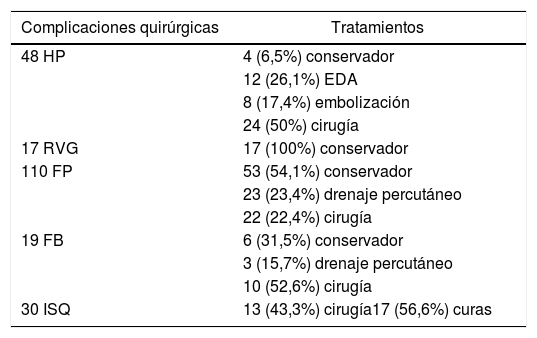
El 50% de las HP y el 22,4% de las FP tratadas, precisaron cirugía. En cuanto al RVG el tratamiento fue conservador en todos los casos (tabla 2).
Tratamientos de las complicaciones quirúrgicas
| Complicaciones quirúrgicas | Tratamientos |
|---|---|
| 48 HP | 4 (6,5%) conservador |
| 12 (26,1%) EDA | |
| 8 (17,4%) embolización | |
| 24 (50%) cirugía | |
| 17 RVG | 17 (100%) conservador |
| 110 FP | 53 (54,1%) conservador |
| 23 (23,4%) drenaje percutáneo | |
| 22 (22,4%) cirugía | |
| 19 FB | 6 (31,5%) conservador |
| 3 (15,7%) drenaje percutáneo | |
| 10 (52,6%) cirugía | |
| 30 ISQ | 13 (43,3%) cirugía17 (56,6%) curas |
EDA: endoscopia digestiva alta; FB: fístula biliar; FP: fístula pancreática; HP: hemorragia postpancreatectomía; ISQ: infección de sitio quirúrgico; RVG: retraso del vaciamiento gástrico.
De las 69 reintervenciones, el 97,1% corresponden al grupo DPC (p = 0,001). Solo un paciente del grupo PCC y otro del grupo PT requirieron reintervención, el primero en el contexto de una FP tipo C y el segundo por HP (fig. 2).
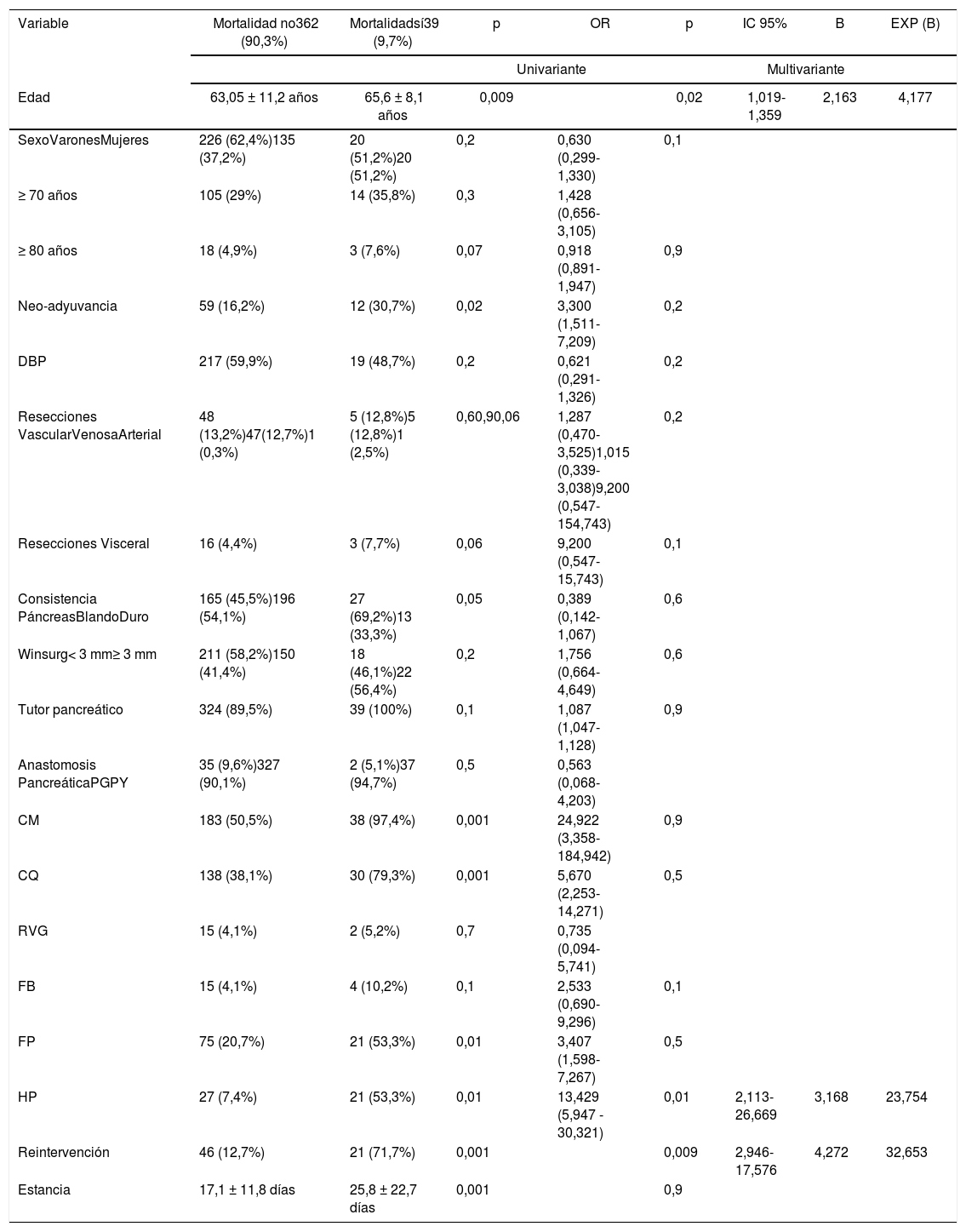
Toda la mortalidad de la muestra se presentó en pacientes sometidos a DPC (p = 0,001). El estudio multivariante demostró que la edad (p = 0,02), la reintervención (p = 0,01) y la HP (p = 0,009) son factores de riesgo de mortalidad en la serie estudiada (tabla 3).
Estudio uni y multivariante de los factores de riesgo de mortalidad asociados con duodeno-pancreatectomía cefálica
| Variable | Mortalidad no362 (90,3%) | Mortalidadsí39 (9,7%) | p | OR | p | IC 95% | B | EXP (B) |
|---|---|---|---|---|---|---|---|---|
| Univariante | Multivariante | |||||||
| Edad | 63,05 ± 11,2 años | 65,6 ± 8,1 años | 0,009 | 0,02 | 1,019-1,359 | 2,163 | 4,177 | |
| SexoVaronesMujeres | 226 (62,4%)135 (37,2%) | 20 (51,2%)20 (51,2%) | 0,2 | 0,630 (0,299-1,330) | 0,1 | |||
| ≥ 70 años | 105 (29%) | 14 (35,8%) | 0,3 | 1,428 (0,656-3,105) | ||||
| ≥ 80 años | 18 (4,9%) | 3 (7,6%) | 0,07 | 0,918 (0,891-1,947) | 0,9 | |||
| Neo-adyuvancia | 59 (16,2%) | 12 (30,7%) | 0,02 | 3,300 (1,511-7,209) | 0,2 | |||
| DBP | 217 (59,9%) | 19 (48,7%) | 0,2 | 0,621 (0,291-1,326) | 0,2 | |||
| Resecciones VascularVenosaArterial | 48 (13,2%)47(12,7%)1 (0,3%) | 5 (12,8%)5 (12,8%)1 (2,5%) | 0,60,90,06 | 1,287 (0,470-3,525)1,015 (0,339-3,038)9,200 (0,547-154,743) | 0,2 | |||
| Resecciones Visceral | 16 (4,4%) | 3 (7,7%) | 0,06 | 9,200 (0,547-15,743) | 0,1 | |||
| Consistencia PáncreasBlandoDuro | 165 (45,5%)196 (54,1%) | 27 (69,2%)13 (33,3%) | 0,05 | 0,389 (0,142-1,067) | 0,6 | |||
| Winsurg< 3 mm≥ 3 mm | 211 (58,2%)150 (41,4%) | 18 (46,1%)22 (56,4%) | 0,2 | 1,756 (0,664-4,649) | 0,6 | |||
| Tutor pancreático | 324 (89,5%) | 39 (100%) | 0,1 | 1,087 (1,047-1,128) | 0,9 | |||
| Anastomosis PancreáticaPGPY | 35 (9,6%)327 (90,1%) | 2 (5,1%)37 (94,7%) | 0,5 | 0,563 (0,068-4,203) | ||||
| CM | 183 (50,5%) | 38 (97,4%) | 0,001 | 24,922 (3,358-184,942) | 0,9 | |||
| CQ | 138 (38,1%) | 30 (79,3%) | 0,001 | 5,670 (2,253-14,271) | 0,5 | |||
| RVG | 15 (4,1%) | 2 (5,2%) | 0,7 | 0,735 (0,094-5,741) | ||||
| FB | 15 (4,1%) | 4 (10,2%) | 0,1 | 2,533 (0,690-9,296) | 0,1 | |||
| FP | 75 (20,7%) | 21 (53,3%) | 0,01 | 3,407 (1,598-7,267) | 0,5 | |||
| HP | 27 (7,4%) | 21 (53,3%) | 0,01 | 13,429 (5,947 - 30,321) | 0,01 | 2,113-26,669 | 3,168 | 23,754 |
| Reintervención | 46 (12,7%) | 21 (71,7%) | 0,001 | 0,009 | 2,946-17,576 | 4,272 | 32,653 | |
| Estancia | 17,1 ± 11,8 días | 25,8 ± 22,7 días | 0,001 | 0,9 | ||||
CM: complicación médica; CQ: complicación quirúrgica; DBP: drenaje biliar prequirúrgico; FB: fístula biliar; FP: fístula pancreática; HP: hemorragia postpancreatectomía; PG: pancreatogastrostomía; PY: pancreatoyeyunostomía; RVG: retraso del vaciamiento gástrico.
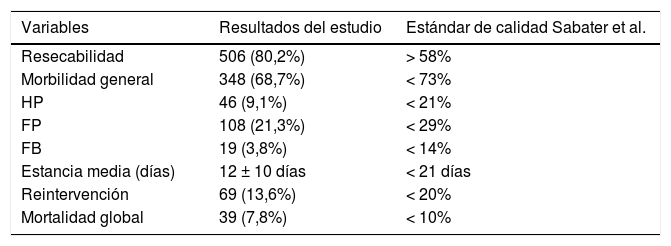
Al estudiar las tasas globales y compararlas con las exigidas por la comunidad científica en el contexto de CP oncológica, comprobamos que los valores obtenidos son inferiores al requerido en nuestro país (tabla 4).
Valores globales de la muestra vs. estándares de calidad de Sabater et al
| Variables | Resultados del estudio | Estándar de calidad Sabater et al. |
|---|---|---|
| Resecabilidad | 506 (80,2%) | > 58% |
| Morbilidad general | 348 (68,7%) | < 73% |
| HP | 46 (9,1%) | < 21% |
| FP | 108 (21,3%) | < 29% |
| FB | 19 (3,8%) | < 14% |
| Estancia media (días) | 12 ± 10 días | < 21 días |
| Reintervención | 69 (13,6%) | < 20% |
| Mortalidad global | 39 (7,8%) | < 10% |
Variables nominales expresadas como número (n) y porcentaje (%).
Variables cuantitativas expresadas como mediana y rango intercuartil.
FB: fístula biliar; FP: fístula pancreática; HP: hemorragia postpancreatectomía.
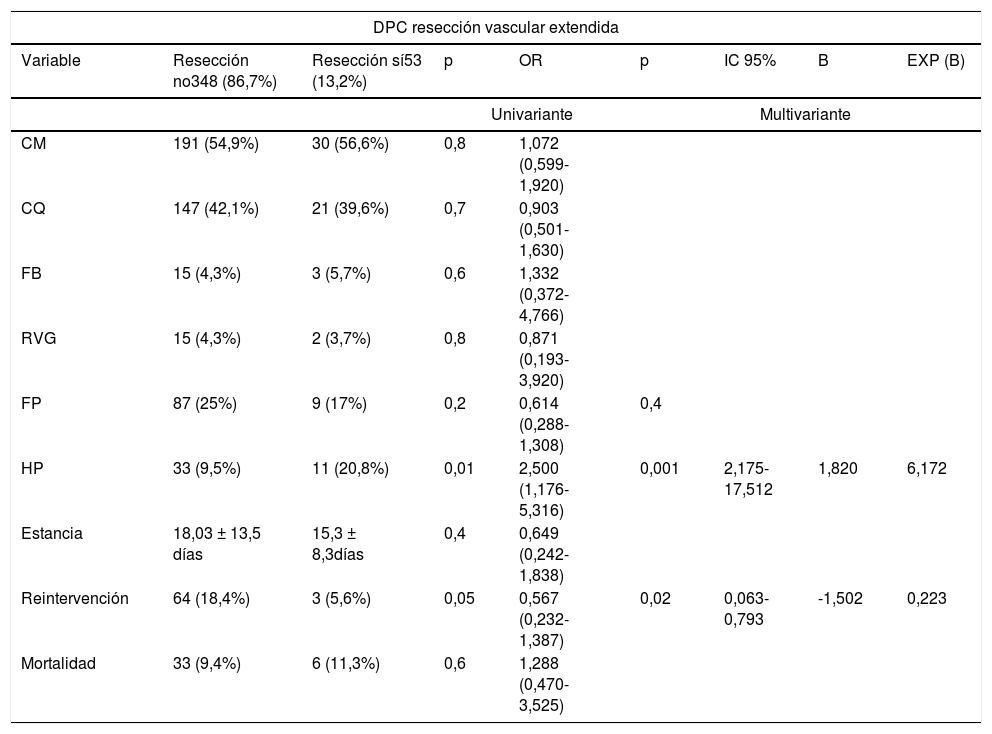
Por otro lado, al analizar el efecto en las variables de morbimortalidad de las resecciones extendidas en los diferentes grupos, observamos que las RVE no impactan en ninguna de ellas (tabla 5). Mientras que las RVaE sí lo hacen en la estancia media (p = 0,01) y la tasa de reintervención (p = 0,02) en el grupo DPC (tabla 5).
Estudio uni y multivariante del impacto de las resecciones extendidas a la duodeno-pancreatectomía cefálica sobre las variables de morbimortalidad
| DPC resección vascular extendida | ||||||||
|---|---|---|---|---|---|---|---|---|
| Variable | Resección no348 (86,7%) | Resección sí53 (13,2%) | p | OR | p | IC 95% | B | EXP (B) |
| Univariante | Multivariante | |||||||
| CM | 191 (54,9%) | 30 (56,6%) | 0,8 | 1,072 (0,599-1,920) | ||||
| CQ | 147 (42,1%) | 21 (39,6%) | 0,7 | 0,903 (0,501-1,630) | ||||
| FB | 15 (4,3%) | 3 (5,7%) | 0,6 | 1,332 (0,372-4,766) | ||||
| RVG | 15 (4,3%) | 2 (3,7%) | 0,8 | 0,871 (0,193-3,920) | ||||
| FP | 87 (25%) | 9 (17%) | 0,2 | 0,614 (0,288-1,308) | 0,4 | |||
| HP | 33 (9,5%) | 11 (20,8%) | 0,01 | 2,500 (1,176-5,316) | 0,001 | 2,175-17,512 | 1,820 | 6,172 |
| Estancia | 18,03 ± 13,5 días | 15,3 ± 8,3días | 0,4 | 0,649 (0,242-1,838) | ||||
| Reintervención | 64 (18,4%) | 3 (5,6%) | 0,05 | 0,567 (0,232-1,387) | 0,02 | 0,063-0,793 | -1,502 | 0,223 |
| Mortalidad | 33 (9,4%) | 6 (11,3%) | 0,6 | 1,288 (0,470-3,525) | ||||
| DPC resección visceral extendida | ||||||||
|---|---|---|---|---|---|---|---|---|
| Variable | Resección no382 (95,2%) | Resección sí19 (4,8%) | p | OR | p | IC 95% | B | EXP (B) |
| Univariante | Multivariante | |||||||
| CM | 210 (55%) | 11 (56,6%) | 0,8 | 1,126 (0,443-2,862) | ||||
| CQ | 159 (41,6%) | 9 (47,4%) | 0,6 | 1,270 (0,505-3,198) | ||||
| FB | 18 (4,7%) | 1 (5,3%) | 0,8 | 1,193 (0,150-9,468) | ||||
| RVG | 16 (4,2%) | 1 (5,3%) | 0,8 | 1,271 (0,160-10,121) | ||||
| FP | 91 (23,8%) | 5 (26,3%) | 0,8 | 1,142 (0,400-3,257) | ||||
| HP | 44 (11,7%) | 1 (10,5%) | 0,3 | 0,438 (0,057-3,363) | ||||
| Estancia | 17,6 ± 13,1 días | 18,6 ± 12,7días | 0,4 | 0,649 (0,242-1,838) | ||||
| Reintervención | 64 (16,7%) | 3 (15,8%) | 0,8 | 0,885 (0,250-3,126) | ||||
| Mortalidad | 36 (9,3%) | 3 (11,5%) | 0,6 | 1,429 (0,314-6,499) | ||||
| PCC resección visceral extendida | ||||||||
|---|---|---|---|---|---|---|---|---|
| Variable | Resección no26 (27,7%) | Resección sí68 (72,3%) | p | OR | p | IC 95% | B | EXP (B) |
| Univariante | Multivariante | |||||||
| CM | 7 (26,9%) | 23 (33,8%) | 0,4 | 1,494 (0,551-4,050) | ||||
| CQ | 3 (11,5%) | 18 (26,4%) | 0,07 | 3,167 (0,852-11,766) | 0,4 | |||
| FP | 1 (3,8%) | 13 (19,1%) | 0,09 | 5,107 (0,626-41,676) | 0,6 | |||
| HP | 1 (3,8%) | 0 (0%) | 0,1 | 0,280 (0,202-1,387) | 1 | |||
| Estancia | 7,6 ± 2,1días | 10,7 ± 11,4días | 0,04 | 1,572 (1,234-2,573) | 0,2 | |||
| Reintervención | 1 (3,8%) | 0 (0%) | 0,1 | 0,280 (0,202-1,387) | 0,8 | |||
| Mortalidad | 0 (0%) | 0 (0%) | ||||||
| PT resección vascular extendida | ||||||||
|---|---|---|---|---|---|---|---|---|
| Variable | Resección no8 (72,8%) | Resección sí3 (27,2%) | p | OR | p | IC 95% | B | EXP (B) |
| Univariante | Multivariante | |||||||
| CM | 4 (50%) | 2 (66,6%) | 0,6 | 2,000(0,125-31,975) | ||||
| CQ | 1 (12,5%) | 3 (100%) | 0,07 | 14,000 (0,579-338,778) | 0,2 | |||
| HP | 1 (12,5%) | 0 (0%) | 0,5 | 0,875 (0,673-1,137) | ||||
| Estancia | 12,2 ± 4,6 días | 21,5 ± 19,1 días | 0,001 | 2,357 (1,953-4,455) | 0,9 | |||
| Reintervención | 1 (12,5%) | 0 (0%) | 0,5 | 0,875 (0,673-1,137) | ||||
| Mortalidad | 0 (0%) | 0 (0%) | ||||||
| PT resección visceral extendida | ||||||||
|---|---|---|---|---|---|---|---|---|
| Variable | Resección no2 (18,2%) | Resección sí9 (81,8%) | p | OR | p | IC 95% | B | EXP (B) |
| Univariante | Multivariante | |||||||
| CM | 1 (50%) | 5 (55,6%) | 0,8 | 1,250 (0,058-26,869) | ||||
| CQ | 1 (50%) | 3 (33,3%) | 0,4 | 0,286 (0,012-6,914) | ||||
| HP | 0 (0%) | 1 (11,1%) | 0,6 | 1,125 (0,893-1,417) | ||||
| Estancia | 10,5 ± 4,9 días | 14,6 ± 8,6 días | 0,5 | 1,938 (1,695-3,848) | ||||
| Reintervención | 0 (0%) | 1 (11,1%) | 0,6 | 1,125 (0,893-1,417) | ||||
| Mortalidad | 0 (0%) | 0 (0%) | ||||||
CM: complicación médica; CQ: complicación quirúrgica; DPC: duodeno-pancreatectomía cefálica; FB: fístula biliar; FP: fístula pancreática; HP: hemorragia postpancreatectomía; PCC: pancreatectomía corporocaudal; PT: pancreatectomía total; RVG: retraso del vaciamiento gástrico.
En 1999 Birkmeyer et al. relacionan las tasas de mortalidad post-DPC con el volumen de cirugía de los centros hospitalarios, sugiriendo que la centralización de la CP podría impactar en la supervivencia de los pacientes31. Dos años más tarde, en 2001, el Instituto de Medicina (IM) define el concepto de calidad en al ámbito médico, el cual está compuesto por seis elementos: seguridad, efectividad, oportunidad, eficiencia, centralización y equidad32. Posteriormente, en 2004, el grupo Leapfrog, para la mejora de la calidad, propone un sistema de derivación a centros de referencia basado en la evidencia y a la CP como grupo de procedimientos que se beneficiarían de este sistema33. En este contexto, la relación entre resultados en CP con volumen del centro y experiencia del cirujano fue asentándose entre la comunidad científica, gracias a diversos estudios en este sentido, incluyendo metaanálisis33-42. Poco a poco, el concepto de centro de referencia se ha ido asentando en la mentalidad de todas las esferas sanitarias.
Actualmente, para conseguir la acreditación en CP se exige haber realizado 50 CP en tres años, que 30 de esas CP sean DPC y una tasa de mortalidad inferior al 5%. Se considera centro de alto volumen en CP si se realizan entre 50 y 100 CP anuales y de muy alto volumen cuando se realizan más de 10043. En este sentido, y con base en el concepto propuesto por Bassi et al., la exigencia aumenta y se publican en 2016 los principales indicadores de calidad de los centros de CP, los cuales se dividen en tres grupos: los relacionados con el centro, con el procedimiento y con los resultados44, ya que mortalidad y volumen de CP no determinan per se la calidad asistencial. Por su parte, Sabater et al. dan un paso más y proponen los estándares de calidad exigibles en España en el ámbito de la CP oncológica8.
Nuestro centro cumple con todos los indicadores de calidad propuestos por Bassi et al.44; contamos con profesionales de diferentes especialidades con dedicación exclusiva a la patología pancreática, incluyendo en nuestra cartera de servicio la endoscopia y la radiología intervencionista, comités multidisciplinares, y una base de datos específica con las variables exigidas. De todos los indicadores relacionados con los resultados, el último en desarrollarse en nuestra unidad es el protocolo ERA45. Si nos centramos en los estándares de resultados exigidos, presentamos una mortalidad superior a la propuesta en la definición de centro de referencia en CP (5% vs. 7,8%)31. En cuanto al número de CP, presentamos una media de 48,5 por año, cumpliendo estrictamente el estándar de número de cirugías superior a 50 desde 201043. Al centrarnos en los estándares propuestos por Sabater et al.8, que sí son específicos de la CP oncológica, definitivamente cumplimos con todos los exigidos (tabla 4).
El grupo DPC asoció una mayor tasa de DBP (58,8% vs. 0% vs. 9,1%; p = 0,001). En este sentido, la tasa global de la muestra es del 37,5% y de complicaciones postdrenaje del 22,3% (tabla 1). Se trata de un procedimiento controvertido46-48, hay estudios que relacionan el DBP con tasas superiores de complicaciones preoperatorias, postoperatorias precoces y tardías, RVG e infección del sitio quirúrgico (ISQ)49. En 2018 se publicó un metaanálisis que concluye que DBP no ofrece ventajas en términos de complicaciones postoperatorias, genera molestias y que no existe evidencia para determinar la mejor opción técnica50.
La DPC también presentó mayor tasa de neoadyuvancia (29,2% vs. 26,1% vs. 0%; p = 0,03) (tabla 1 y fig. 1). Por grupos, la tasa de rescate fue del 42,2% en DPC y 100% en PCC. La tasa global de la muestra fue del 28,2%, con una de rescate del 46,7%. En CP, la neoadyuvancia presenta dos principales problemas: falta de ensayos clínicos aleatorizados fase iii, y aplicabilidad de criterios RECIST en la re-estatificación del cáncer de páncreas borderline. Pese a esto, son muchos los metaanálisis y guías clínicas que proponen la neoadyuvancia en el cáncer de páncreas con recomendaciones51-54. En cuanto a la reestatificación, las tasas de respuesta radiológica no se corresponden con las tasas de rescate quirúrgico, las cuales oscilan entre el 69-93%55-57, superiores a las publicadas en el presente artículo. La laparoscopia tiene en la reestatificación del cáncer de páncreas borderline una importante indicación, con el fin de evitar morbilidad que retrase el inicio del tratamiento adyuvante y de conseguir aumentar las tasas de rescate.
Presentamos una tasa de RVaE del 13,2% en el grupo DPC y del 27,2% en el grupo PT (tabla 1). Según los resultados publicados en una revisión sistemática de 201958, la tasa de resección venosa oscila entre el 6,1-65,1% con impacto en las tasas de mortalidad, reintervención y HP. Por su parte, las resecciones arteriales aumentan las tasas de morbimortalidad, de forma global, al compararlas con las de resección estándar, con o sin resección venosa asociada59,60. En manos expertas, asocia una mortalidad del 11,8% y una morbilidad del 53,6%61. En nuestra muestra, las RVaE impactaron en la estancia media y la tasa de reintervención del grupo DPC (tabla 5).
Con relación a las RVE, presentamos tasas del 4,8% en el grupo DPC, 72,3% en PCC y un 81,8% en PT. Un metaanálisis de 2018, que estudia 713 pancreatectomías con una tasa de RVE del 20%, concluye que este tipo de resecciones no asocia diferencias estadísticamente significativas en términos de morbimortalidad postoperatoria62. Ese mismo año se publica otro estudio que compara PCC con/sin RVE, el cual tampoco encuentra asociación entre dicha resección y un incremento en las tasas de morbimortalidad postoperatoria63. En nuestra muestra, las RVE no impactaron en ninguna variable de morbimortalidad de ninguno de los grupos estudiados (tabla 5). Los órganos más frecuentemente resecados fueron colon derecho en el grupo DPC y bazo en los grupos PCC y PT.
El grupo DPC asoció las tasas más elevadas de morbimortalidad postoperaria con significación estadística en todas ellas (tabla 1). Al comparar nuestros resultados con los del grupo español de Lera-Tricas et al.64, también presentamos el grado iiib de Clavien-Dindo como el más frecuente, con una tasa superior (16,7% vs. 5,7%), una tasa de FP similar (23,9% vs. 22,9%), a expensas del tipo A (9,9%), y una mayor tasa de reintervención (16,8% vs. 12,3%).
Por su parte, el grupo PCC asoció las menores tasas de morbimortalidad postoperaria (tabla 1). En 2017 se publicó un articulo que estudiaba 2026 PCC, con tasas de reintervención y mortalidad del 5% y 0,6%, y una estancia media de cinco días65. Un año más tarde, un artículo que englobaba 157 PCC presentó tasas de morbilidad del 18%, de FP B/C del 8%, de reintervención del 3% y de mortalidad precoz del 0,6%, así como, los grados iii y iv de Clavien-Dindo como las más frecuentes66. Valores todos superiores a los obtenidos en el presente artículo.
Por último, el grupo PT asoció una tasa de morbilidad del 36,4%, de reintervención del 9,1% y nula mortalidad (tabla 1). Datos que se encuentran en rango con lo publicado67.
La centralización de CP en centros de referencia permite alcanzar la excelencia en términos de calidad de cuidados asistenciales a los pacientes afectos de patología quirúrgica pancreática. La experiencia acumulada que deriva de dicha centralización permite realizar pancreatectomías extendidas de forma segura y efectiva. El diseño y elaboración de programas de acreditación en CP permitirá mejorar aún más los resultados de esta cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.