El cierre de la pared abdominal después del trasplante de órganos abdominales, especialmente en los casos de trasplante intestinal y multivisceral, sigue siendo un reto en muchos pacientes debido al importante número de intervenciones previas al trasplante, así como al edema de asas que dichos injertos presentan. Ante la imposibilidad de cierre primario y debido a las complicaciones en el uso de mallas, surge la opción del trasplante de la pared abdominal. Existen diversas opciones para dicho procedimiento, desde el empleo únicamente de la fascia no vascularizada hasta el trasplante de espesor completo de la pared abdominal. Revisamos la literatura en cuanto al uso de los injertos referidos y presentamos 2 casos de trasplante de fascia no vascularizada realizados en nuestra unidad de trasplante.
Abdominal wall transplantation has been consolidated as an alternative to primary abdominal wall closure in intestinal and multiple organ transplant recipients. Given that it is feasible to obtain the visceral graft and the abdominal wall graft from the same donor, abdominal wall transplantation could offer satisfactory outcomes and be easily coordinated. Non-vascularized fascia is one of the alternatives for abdominal wall closure in transplantation. We report two cases of non-vascularized fascia transplantation in intestinal and multivisceral transplants, respectively. Both donors were young (23 and 18 years old). Both recipients had endured multiple previous surgeries, and no surgical alternatives for primary wall repair could be offered. In both cases, a complete abdominal wall flap was retrieved from the donor, however, due to the characteristics of the recipient's abdominal wall defect, only non-vascularized fascia was used after removing skin and subcutaneous cellular tissue from the graft. Abdominal wall transplantation is an option to consider for abdominal wall closure in patients with multiple previous surgeries and no alternatives for primary wall repair.
El cierre primario de la pared abdominal, después del trasplante de intestino delgado aislado o de trasplante multivisceral sigue siendo uno de los retos más importantes a solucionar en este ámbito. La distensión intestinal por el síndrome de isquemia-reperfusión, asociada al edema intestinal, así como a la inelasticidad de una cavidad abdominal, generalmente reducida en volumen por el antecedente de múltiples intervenciones e infecciones asociadas, colocación de estomas y una alta incidencia de fístulas previas, explica que una gran mayoría de estos pacientes presenten complicaciones asociadas al cierre de la pared1,2. Todo esto aumenta el riesgo de síndrome compartimental que puede acabar en isquemia o necrosis del injerto3. Asociado a esto hasta un 20-50% de los receptores de este tipo de injertos precisarán alguna técnica quirúrgica alternativa al cierre convencional primario de la pared abdominal4–6. En general, dada la desestructuración de la pared de estos receptores, podemos considerarlos malos candidatos a cirugía reconstructiva, tales como la separación de componentes o los colgajos musculocutáneos.
Puede solucionarse o tratarse, bien reduciendo el tamaño del injerto, o bien ampliando la capacidad del receptor. La tendencia general a escoger donantes de menor peso, con una ratio entre 1,1 y 0,757 o incluso a la reducción del tamaño de los injertos8,9 facilita un cierre sin tensión en muchos casos1. La técnica de cierre de pared empleando mallas convencionales (absorbibles o no), así como el uso de mallas biológicas10 han presentado unos resultados decepcionantes, probablemente debido a una mezcla de tensión en el cierre y a los efectos de las altas dosis de fármacos inmunosupresores. El empleo de la cirugía en etapas, preconizada por el grupo de Birmingham, con 23 casos combinando prótesis sintéticas de nailon (Silastic@) y terapia de presión negativa, podría ser una alternativa11. El cierre cutáneo aislado a veces es posible, a pesar de no presentar tanta elasticidad el plano muscular inferior, llegando incluso a plantearse intervenciones en varios tiempos con expansores, que no parecen muy recomendables por las altas tasas de complicaciones (infección, hernia, fístula, seroma/hematoma, obstrucción intestinal, extrusión de malla, etc.)12,13.
El empleo del trasplante de la pared abdominal completo o parcial, del mismo donante que el injerto intestinal o multivisceral, desarrollado por Levi et al. desde 20033, puede ser una interesante alternativa en este contexto ya que presentan unas ventajas obvias en cuanto a la obtención de un cierre sin tensión, de un injerto en normoposición, bien vascularizado, que evita las complicaciones infecciosas de las mallas y puede ser una alarma de un rechazo en ciernes (presentación como un rash macropapular)14 y que se realiza en un solo acto quirúrgico2. Las experiencias iniciales de 15 y 17 pacientes han presentado buenos resultados2,15.
Estado actual del trasplante de la pared abdominal en el trasplante de órganosTrasplante de espesor parcialFascia no vascularizadaExisten 2 técnicas básicas de extracción descritas en la literatura:
- –
Técnica de Miami3. Consiste en realizar la extracción completa de la pared abdominal como si fuese un injerto completo, en bloque, para posteriormente en banco, independizar la lámina anterior de la fascia del recto.
- –
Técnica de Mount-Sinai/Favaloro16. Se realiza una incisión en cruz en el tejido subcutáneo y piel, resecándose la lámina anterior de la fascia del recto anterior en bloque a través de una incisión subcostal bilateral con peritoneo.
En ambos casos se independiza el injerto del resto del colgajo al final de la extracción, tras la perfusión, que no se realiza sincrónica al resto de los órganos extraídos. Se coloca el injerto en solución de preservación, realizándose la extracción del músculo y del tejido sobrante en banco.
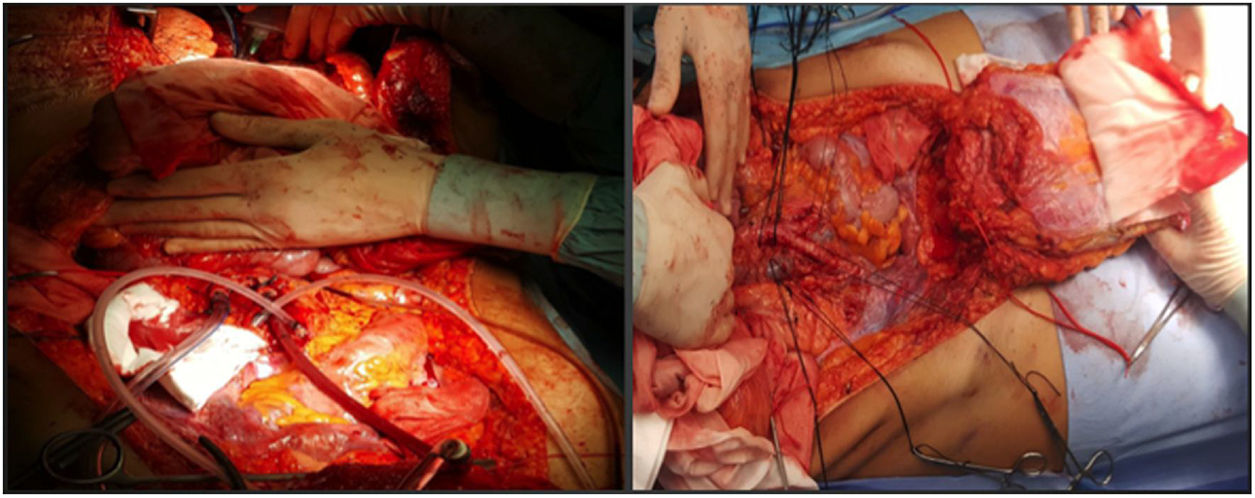
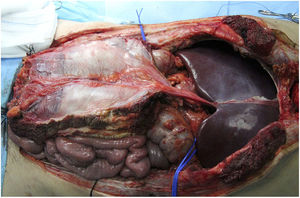
En nuestro centro se cánulan ambas arterias ilíacas externas del donante y se perfunde el colgajo completo del injerto, realizando posteriormente una técnica de extracción muy similar a la de Miami. El objetivo es conseguir un injerto completo en el donante (fig. 1) para decidir posteriormente en el receptor el tipo de injerto para cierre de pared que precise (en función de las pruebas de imagen preoperatorias especialmente la volumetría por tomografía axial computarizada (TAC), que deben ser confirmadas por el estado de tejidos en el momento del implante).
A pesar de que la mayoría de las series emplean la perfusión del injerto de pared con solución de preservación de Wisconsin, en nuestro centro pensamos que el empleo de la solución Celsior por su menor viscosidad debería ser superior al empleo de Wisconsin, aunque no hay evidencia suficiente en la literatura17.
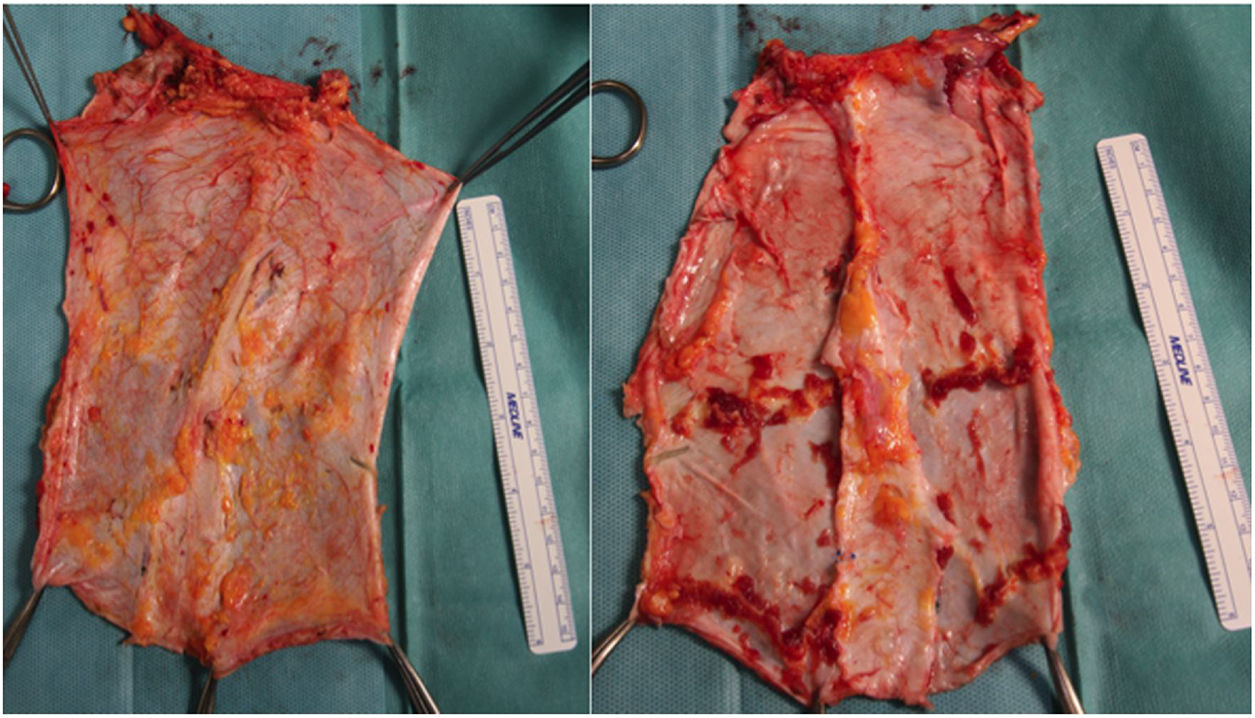
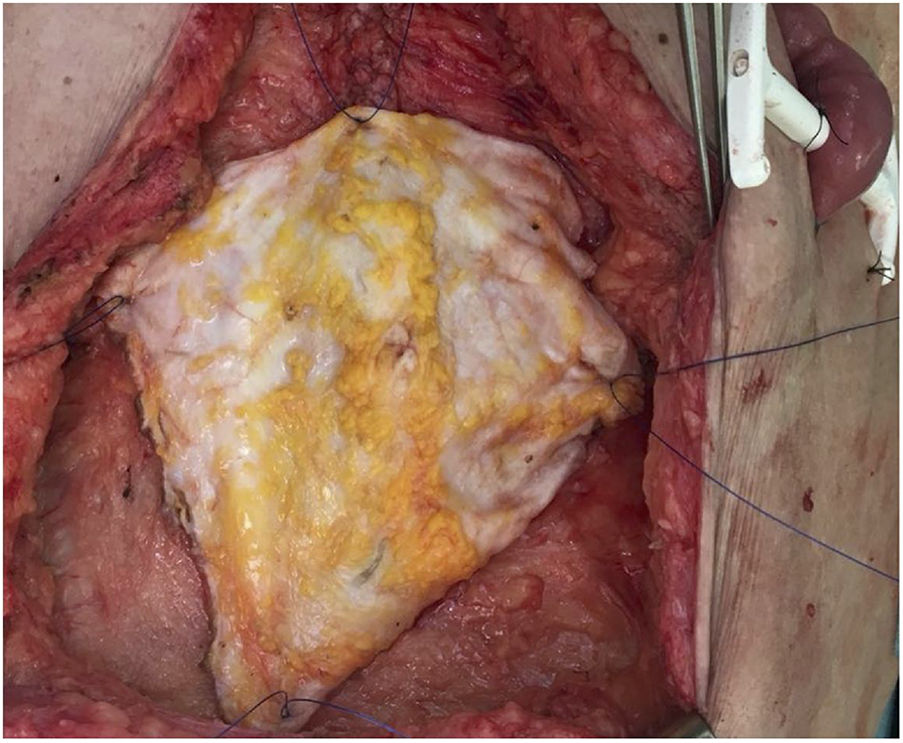
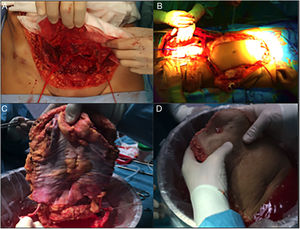
Posteriormente en banco se decide el empleo del tipo de injerto más acorde con las necesidades del receptor, y se realiza la exéresis del remanente de tejido innecesario (fig. 2). En el caso de la fascia no vascularizada es importante la exéresis de grasa y de tejido muscular, puesto que al no presentar soporte circulatorio sería muy susceptible a desarrollar necrosis y ser un foco de infección.
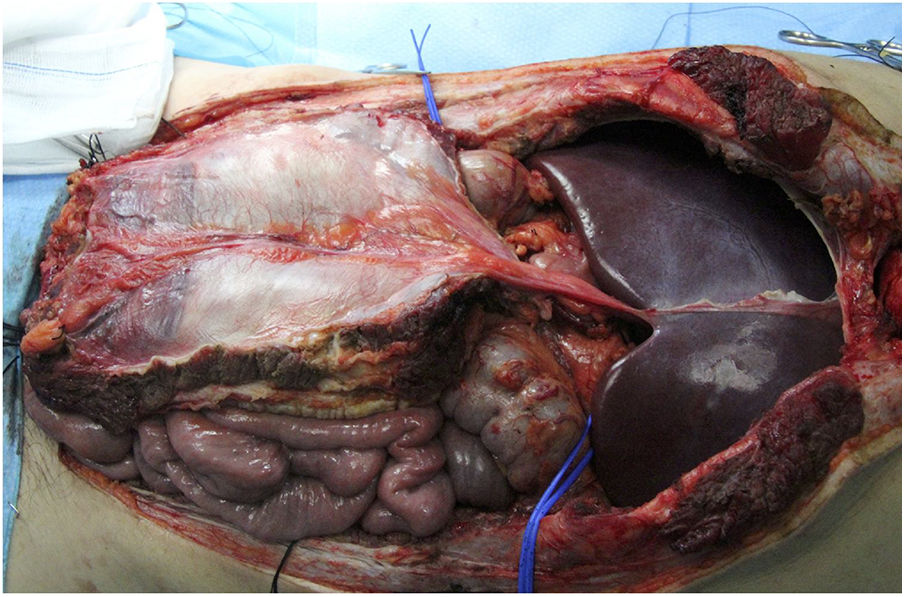
Fascia vascularizadaSe indica en caso de implantes de hígado aislado y combinado con intestino. Se realizaría la extracción hepática asociando el ligamento falciforme y la lámina posterior de la vaina del recto, que mantendría un cierto grado de flujo procedente de la arteria del ligamento falciforme (suele venir del hígado izquierdo) y drenaje por la vena umbilical, con una vascularización parcial del peritoneo y lámina posterior de la vaina de los rectos (fig. 3). La arteria del ligamento falciforme se presenta hasta en un 67% de las autopsias, aunque solo en un rango del 2-24% en las angiografías18. Parece una opción muy interesante en donantes y receptores pediátricos, puesto que en adultos se supone que está obliterada. Aparentemente presenta una mayor resistencia a la infección que la fascia no vascularizada y una mayor integración con el tejido circundante. El equipo de Chicago19 precisó acceder a la cavidad de un receptor en hasta 3 ocasiones, con buena viabilidad de la lámina (a pesar de ello el paciente falleció a los 51 días de infección fúngica). En los casos de la Universidad de Duke20 se empleó como una suerte de malla de refuerzo del cierre sin complicaciones aparentes en ambos casos (tabla 1).
Experiencia mundial con el trasplante de pared abdominal
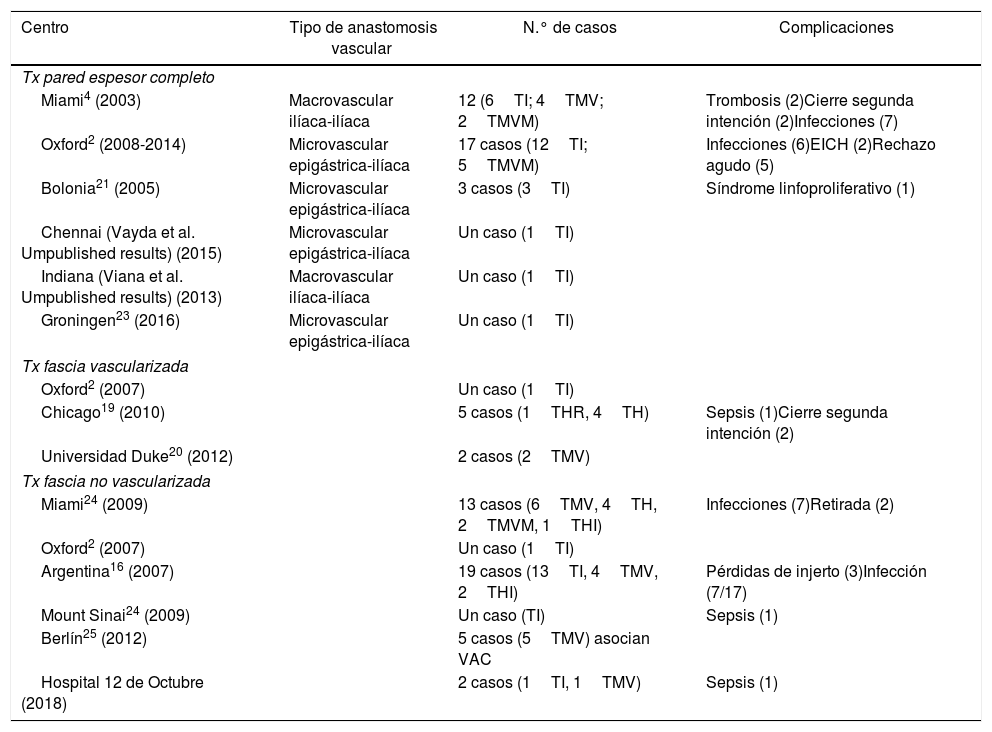
| Centro | Tipo de anastomosis vascular | N.° de casos | Complicaciones |
|---|---|---|---|
| Tx pared espesor completo | |||
| Miami4 (2003) | Macrovascular ilíaca-ilíaca | 12 (6TI; 4TMV; 2TMVM) | Trombosis (2)Cierre segunda intención (2)Infecciones (7) |
| Oxford2 (2008-2014) | Microvascular epigástrica-ilíaca | 17 casos (12TI; 5TMVM) | Infecciones (6)EICH (2)Rechazo agudo (5) |
| Bolonia21 (2005) | Microvascular epigástrica-ilíaca | 3 casos (3TI) | Síndrome linfoproliferativo (1) |
| Chennai (Vayda et al. Umpublished results) (2015) | Microvascular epigástrica-ilíaca | Un caso (1TI) | |
| Indiana (Viana et al. Umpublished results) (2013) | Macrovascular ilíaca-ilíaca | Un caso (1TI) | |
| Groningen23 (2016) | Microvascular epigástrica-ilíaca | Un caso (1TI) | |
| Tx fascia vascularizada | |||
| Oxford2 (2007) | Un caso (1TI) | ||
| Chicago19 (2010) | 5 casos (1THR, 4TH) | Sepsis (1)Cierre segunda intención (2) | |
| Universidad Duke20 (2012) | 2 casos (2TMV) | ||
| Tx fascia no vascularizada | |||
| Miami24 (2009) | 13 casos (6TMV, 4TH, 2TMVM, 1THI) | Infecciones (7)Retirada (2) | |
| Oxford2 (2007) | Un caso (1TI) | ||
| Argentina16 (2007) | 19 casos (13TI, 4TMV, 2THI) | Pérdidas de injerto (3)Infección (7/17) | |
| Mount Sinai24 (2009) | Un caso (TI) | Sepsis (1) | |
| Berlín25 (2012) | 5 casos (5TMV) asocian VAC | ||
| Hospital 12 de Octubre (2018) | 2 casos (1TI, 1TMV) | Sepsis (1) | |
EICH: enfermedad injerto contra huésped; TH: trasplante hepático; THI: trasplante hepato-intestinal; THR: trasplante hepato-renal; TI: trasplante intestinal; TMV: trasplante multivisceral; TMVM: trasplante multivisceral modificado; Tx: trasplante.
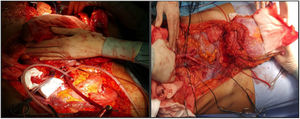
Parece la alternativa más fisiológica desde el punto de vista anatómico. Históricamente es la primera forma de trasplante de pared que se llevó a cabo, hecho que sorprende, habida cuenta que es la técnica más compleja, tanto para extracción como para implante. La extracción se realiza en 2 tiempos, al inicio y al final de la extracción multiorgánica. Desde el inicio de la extracción se realiza una incisión de colgajo de espesor completo «en casa», dejando el colgajo cutáneo-muscular movilizado y conectado al resto del donante por los vasos epigástricos inferiores. Una vez realizada la extracción multiorgánica se cánula la aorta y se perfunde el injerto de pared, previamente a su extracción y colocación en hielo con solución de preservación (fig. 4). En nuestro centro se prefiere la canulación de ambas arterias ilíacas externas de forma selectiva (ligando distal al conducto inguinal —arteria femoral— y en el origen de la arteria ilíaca externa) e independiente del proceso de perfusión del resto de los órganos a extraer.
Idealmente es la solución para los pacientes carentes de la pared abdominal e incluso de piel para el cierre cutáneo. Evitaría pues la necesidad de reducir el injerto o la limitación del pool de donantes en cuanto a la relación de 0,75 con el peso del receptor. Dado el peso habitual del receptor adulto en nuestro medio, la competencia con el donante pediátrico es habitual, por lo que el hecho de poder ampliar el rango de peso garantiza una mayor amplitud y calidad de órganos disponibles.
La reconstrucción del injerto de pared se realiza de diversas formas, dependiendo de la estructura vascular y anatómica de la pared del receptor. Se suele emplear una anastomosis entre un parche de la arteria ilíaca externa y de la arteria epigástrica inferior del donante con la bifurcación de las arterias ilíacas del receptor por tener mayor calibre. El grupo de Bolonia22 emplea una anastomosis directa entre los vasos epigástricos inferiores de donante y receptor, salvo en uno de los 3 casos en el que empleó la arteria circunfleja ilíaca superficial por lesión en el receptor de la epigástrica inferior.
Se ha preconizado la posibilidad de detección de rechazo intestinal o multivisceral a través de biopsias de la pared, aunque posiblemente no sean tan sensibles ni específicas como las biopsias intestinales (no se detectó rechazo en el caso de Bolonia aun existiéndolo en el intestino), aunque podría tener un gran valor para investigación22.
Nuestra experienciaSe basa en 2 pacientes con imposibilidad de cierre primario de la pared abdominal ni de cirugía reparadora debido al importante número de cirugías previas al trasplante.
Caso 1Se trata de una paciente de 50 años de edad, derivada a nuestro centro por síndrome de intestino corto secundario a múltiples resecciones (6 intervenciones) por isquemia mesentérica. Tras 3 años incluida como candidata a trasplante de intestino, y debido a la nutrición parenteral, desarrolla hepatopatía crónica que la convierte en candidata a trasplante multivisceral asociando trasplante renal por deterioro grave de su función. La paciente presenta un defecto de la pared abdominal muy importante de 10cm de diámetro transversal × 15cm de longitudinal, con la consiguiente disminución del continente abdominal.
Se le realiza trasplante multivisceral asociando riñón, según técnica estándar. En el momento del cierre de pared, se objetiva un defecto de la pared abdominal insalvable, asociado a una importante redundancia cutánea que permite el cierre con lamina anterior de la fascia de los rectos no vascularizada del donante, sin precisar el injerto abdominal completo. La paciente presenta múltiples complicaciones infecciosas por las que fallece (neumonía y colecciones abdominales), sin aparente relación con la pared abdominal en las pruebas de imagen realizadas ni en la autopsia. No requirió reintervención abdominal posterior al trasplante.
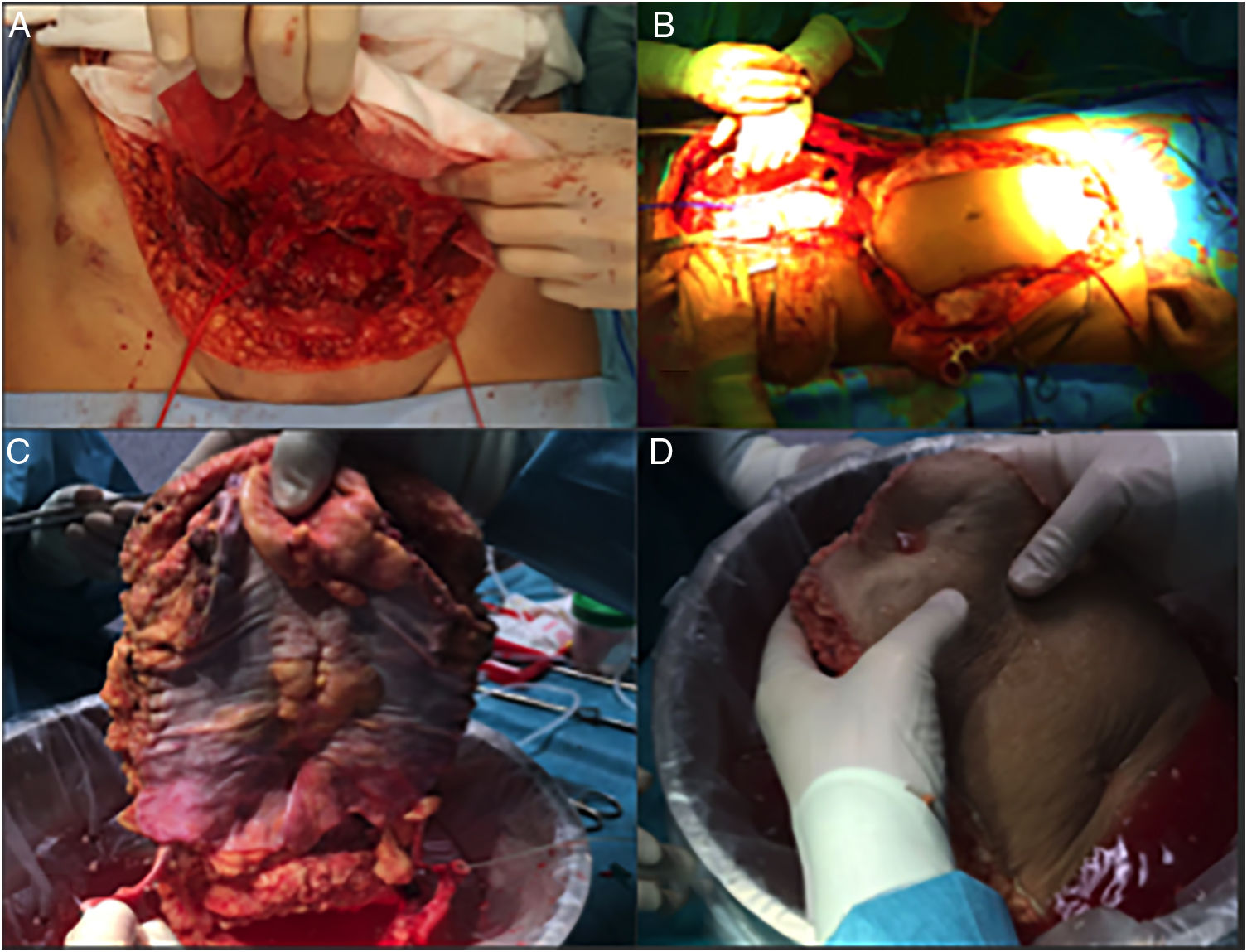
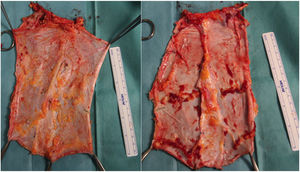
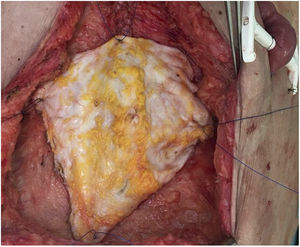
Caso 2Se trata de una paciente de 60 años derivada a nuestro centro por un tumor desmoide con infiltración de la pared abdominal. Se le habían realizado 2 laparotomías previas que confirmaban la irresecabilidad del mismo por amplia afectación de la arteria mesentérica superior. Dos años después de su inclusión en lista se realiza un trasplante de intestino aislado según técnica habitual. En el momento del cierre, y debido al síndrome post-reperfusión del injerto, presenta una imposibilidad de cierre de la pared abdominal (defecto de 16cm longitudinal × 20cm de defecto transversal). Se realiza trasplante de lámina anterior de la vaina de los rectos no vascularizada, con posibilidad de cierre cutáneo por primera intención (fig. 5). El postoperatorio cursa sin incidencias salvo episodio de rechazo leve, que precisa de la adición de everolimus al régimen inmunosupresor con corticoides y tacrolimus. En la TAC de control se objetiva excelente integración del colgajo de fascia (es una TAC normal, donde no se objetiva defecto de pared ni resalto de pared) sin colecciones ni signos de infección.
DiscusiónEl trasplante de la pared abdominal se ha consolidado como una alternativa válida para el cierre de la pared en pacientes donde se asocie otro trasplante de órgano abdominal. Hasta en un 40% de los casos el cierre de la pared abdominal complicará el trasplante multivisceral o intestinal, lo que lo convierte en uno de los problemas a solucionar26. Los resultados a largo plazo, especialmente de los injertos vascularizados, auguran un buen futuro, hasta el punto de haberse demostrado piloerección y un cierto grado de contracción muscular autónoma en algunos injertos27.
La elección de un tipo u otro de injerto está basada en la necesidad de reparación de la pared abdominal del receptor, en función del tamaño del defecto se prioriza el empleo del injerto que menos complique el implante, ya que en muchas ocasiones el defecto es músculo-aponeurótico, y no hace preciso añadir el espesor completo que obliga a sumar una doble anastomosis vascular. La alternativa de fascia vascularizada queda limitada a enfermos pediátricos que precisen al menos trasplante hepático.
Los injertos no vascularizados, aunque presenten una incidencia mayor de complicaciones, especialmente infecciosas, parecen una alternativa razonable, especialmente en sujetos de edad más avanzada, con mayor grado de ateroesclerosis que no permita un adecuado soporte vascular o se convierta en una anastomosis de riesgo24. Debe medirse dicha carga ateroesclerótica en receptores adultos, mediante TAC con contraste arterial, a la hora de realizar un balance de riesgo beneficio.
En receptores pediátricos probablemente las alternativas vascularizadas ganen mayor importancia. Beneficios como un potencial diagnóstico de rechazo, o al menos un muestreo menos invasivo y con menos complicaciones potenciales, hacen que pueda ser una alternativa muy atractiva, de cara al cierre de la pared en pacientes con múltiples reintervenciones28 y, de entrada, mejor estado vascular.
Resulta llamativa la aparente resistencia e integración en los tejidos de cualquiera de los tipos de trasplante de la pared abdominal, mostrándose como alternativa de cierre de la pared muy sólida especialmente en caso de reintervenciones, ya que en las series publicadas22 muestran una importante solidez, incluso llama la atención la ausencia de adherencias del paquete intestinal al injerto de la pared16. En los pacientes de nuestra serie, con un injerto no vascularizado, la presencia de una aparente fibrosis macroscópica en la necropsia de una y en las pruebas de imagen de la otra, permite objetivar una buena integración sin necesidad de soporte vascular.
Nuevas clasificaciones como la propuesta por el grupo de Light et al.29 podrían ser útiles en la planificación preoperatoria de las necesidades de injerto, así como para poder comparar los distintos injertos más allá del soporte vascular de los mismos.
El hecho de que los trasplantes multiviscerales e intestinales representen un porcentaje muy bajo del total, condiciona el menor empleo del trasplante de la pared abdominal, y probablemente haya limitado mucho su difusión, pero la posibilidad de empleo de este tipo de injerto en el receptor de trasplante hepático ante paredes abdominales hostiles, podría ser una vía de ampliación de la indicación, especialmente por la incidencia de complicaciones de las mallas de polipropileno (y su imposibilidad de colocación en contacto con vísceras) y los malos resultados con las mallas de politetrafluoretileno expandido en términos de reintervención e infección. Las alternativas con mallas biológicas empleadas en nuestro centro30 solo presentaron aceptables resultados en receptores pediátricos, con defecto pequeño y un coste económico muy elevado, por lo que se han abandonado en receptores adultos.
El empleo de dicho trasplante sin asociación con otras vísceras parece al menos controvertido, dadas las necesidades de inmunosupresión, y las alternativas en mallas y compuestos, más viables en pacientes no inmunosuprimidos.
ConclusiónEl trasplante de la pared abdominal es una alternativa válida en aquellos pacientes sometidos a trasplante con daño en la pared abdominal previa (que impidan su reparación por pérdida de planos musculares) o discrepancias de continente/contenido sin necesidad de reducción del injerto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.