El objetivo de este trabajo fue medir el coste del tratamiento del cáncer colorrectal en un hospital del sistema sanitario público vasco según el estadio clínico.
MétodosSe recogieron de forma retrospectiva variables demográficas, clínicas y uso de recursos de una muestra de 529 pacientes. Para los estadiosi aiii se midieron los costes iniciales y de seguimiento. El coste del estadioiv combinó los modelos lineales generalizados para relacionar el coste con la duración del seguimiento con el análisis de supervivencia de tipo paramétrico. Los costes unitarios se obtuvieron del sistema de contabilidad analítica del Servicio Vasco de Salud.
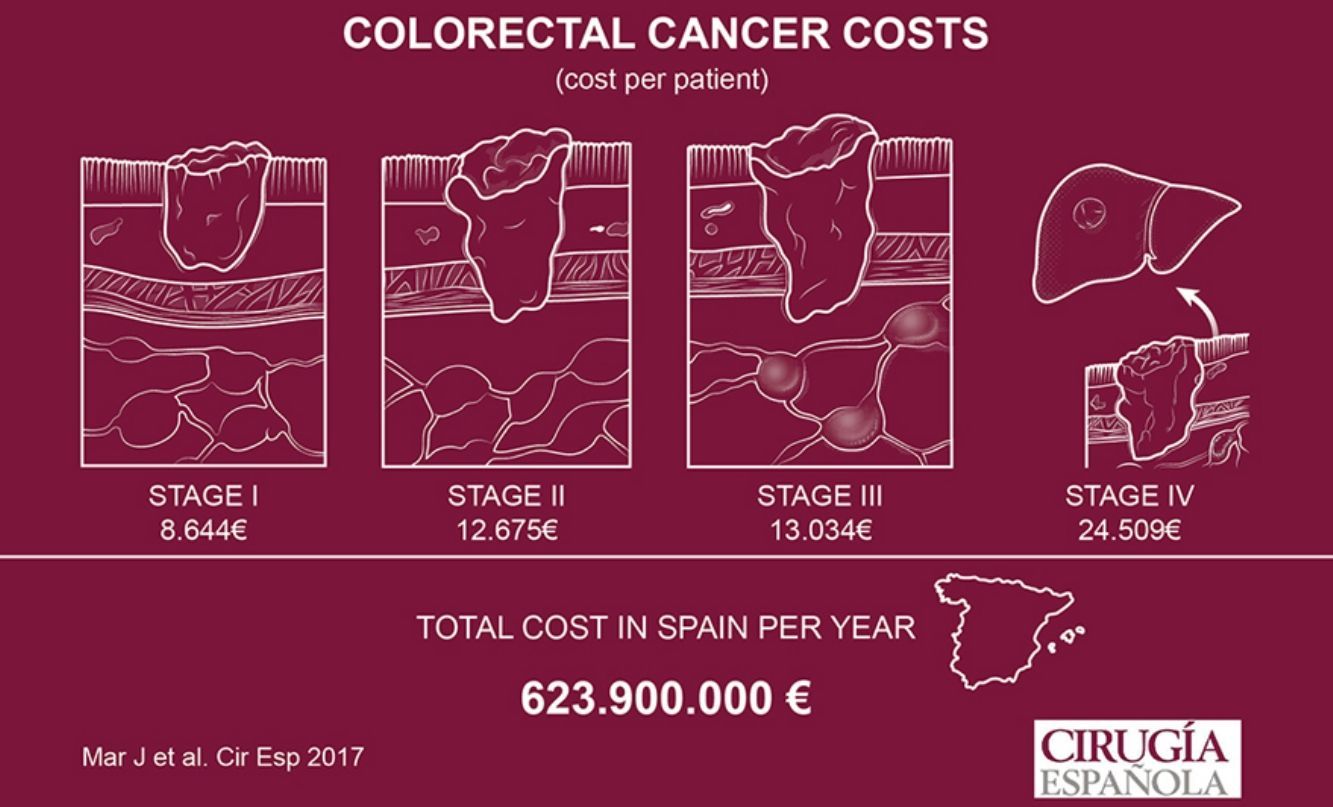
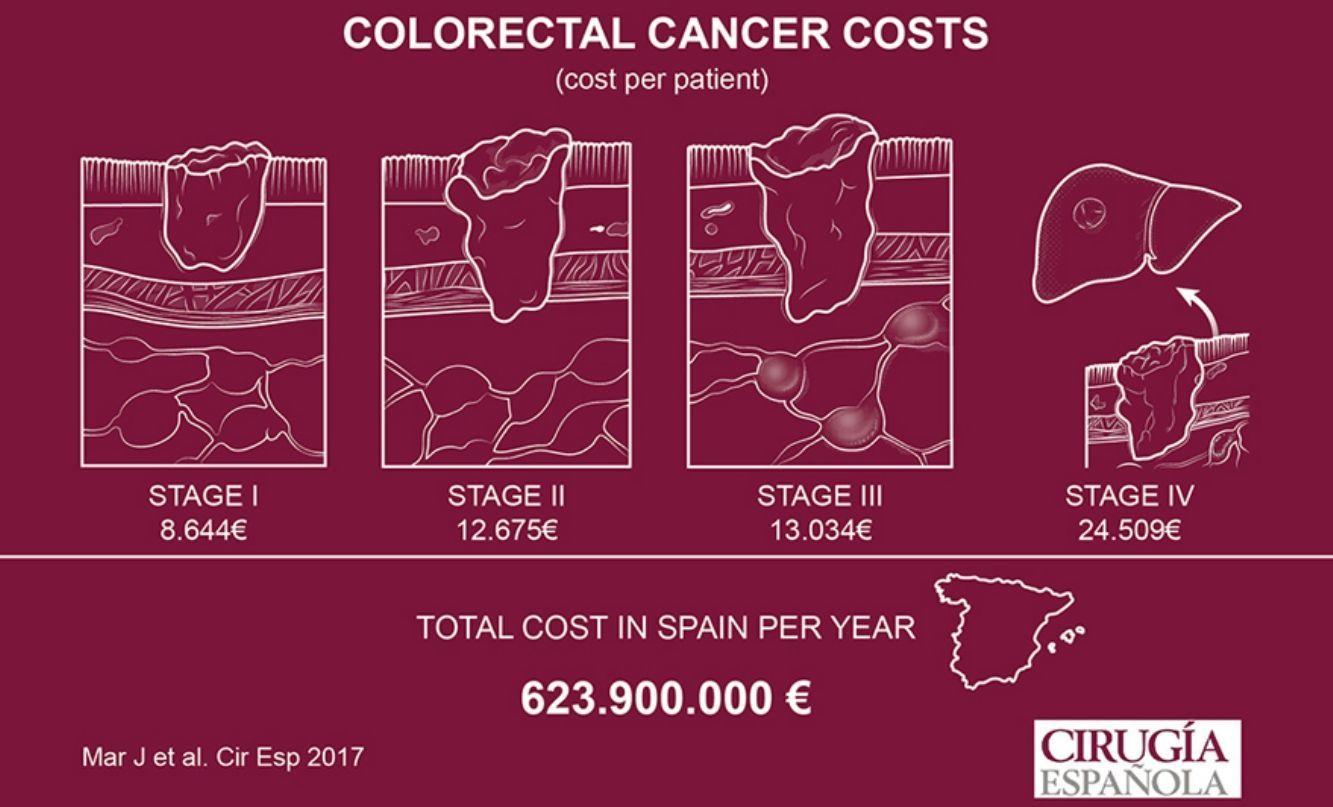
ResultadosLa muestra se distribuyó en 110 pacientes en estadioi, 171 en estadioii, 158 en el estadioiii y 90 en el estadioiv. El coste total inicial por paciente fue de 8.644 euros (€) en el estadioi, 12.675€ en el estadioii y 13.034€ en el estadioiii. El principal componente del coste fue la hospitalización. La supervivencia media calculada por extrapolación para el estadioiv fue de 1,27años. Su coste anual medio fue de 22.403€, y de 24.509€ hasta el fallecimiento. El coste anual total para el tratamiento del cáncer colorrectal extrapolado a toda España fue de 623.900.000€.
ConclusionesLa carga económica del cáncer colorrectal es importante y debe ser tenida en cuenta en la toma de decisiones. La combinación de los modelos lineales generalizados y el análisis de supervivencia para relacionar el coste con el seguimiento permite estimar el coste del estadio metastásico.
The aim of this study was to measure the cost of treatment of colorectal cancer in the Basque public health system according to the clinical stage.
MethodsWe retrospectively collected demographic data, clinical data and resource use of a sample of 529 patients. For stagesi toiii the initial and follow-up costs were measured. The calculation of cost for stageiv combined generalized linear models to relate the cost to the duration of follow-up based on parametric survival analysis. Unit costs were obtained from the analytical accounting system of the Basque Health Service.
ResultsThe sample included 110 patients with stagei, 171 with stageii, 158 with stageiii and 90 with stageiv colorectal cancer. The initial total cost per patient was 8,644€ for stagei, 12,675€ for stageii and 13,034€ for stageiii. The main component was hospitalization cost. Calculated by extrapolation for stageiv mean survival was 1.27years. Its average annual cost was 22,403€, and 24,509€ to death. The total annual cost for colorectal cancer extrapolated to the whole Spanish health system was 623.9million€.
ConclusionsThe economic burden of colorectal cancer is important and should be taken into account in decision-making. The combination of generalized linear models and survival analysis allows estimation of the cost of metastatic stage.
El cáncer colorrectal (CCR) es el tercer tipo de cáncer más frecuente en el sexo masculino, después del de próstata y pulmón, y el segundo más frecuente en el sexo femenino después del de mama1,2. En la Comunidad Autónoma Vasca su incidencia y mortalidad se han incrementado significativamente desde 19863,4. La gran incidencia del CCR y los nuevos tratamientos convierten el análisis de sus costes en un tema relevante para la financiación de los sistemas sanitarios5.
La atención al cáncer incurre en altos costes tanto en el cáncer no metastásico como en el estadio metastásico. La concentración de los costes al comienzo y al final del proceso determina que su evolución siga la característica forma en U6,7. Los estudios de costes de CCR disponibles en España son escasos8. Sin embargo, la atención al CCR ha cambiado con la puesta en marcha de programas de cribado que ha determinado un cambio en la distribución por estadios de los casos incidentes9-11. El beneficio económico de este adelanto diagnóstico se mide por la reducción de costes asociada al tratamiento inicial y a la menor probabilidad de desarrollar metástasis con el tiempo. Para poder estimar ese impacto se requiere disponer de datos de costes desagregados por estadio y tipo de recurso utilizado. El perfil de cuidados varía de forma importante en los diferentes países europeos, y en cada país se requieren datos específicos12. Frente a la limitada validez externa de los ensayos clínicos, la práctica quirúrgica y oncológica del CCR proporciona el escenario idóneo para medir sus costes, ya que permite a los decisores conocer el impacto económico de sus decisiones en el mundo real13,14.
El objetivo de este trabajo fue medir el coste de los recursos sanitarios utilizados en el sistema vasco de salud para el tratamiento del CCR según estadio clínico.
MétodosSe utilizó un diseño de tipo observacional y retrospectivo para analizar los registros de las bases de datos administrativas y clínicas de una muestra aleatoria de 529 pacientes con diagnóstico de CCR incluidos en el Registro del Hospital Universitario Araba entre los años 2010-2013. El total de casos en ese periodo fue de 1.228. Los casos de CCR se identificaron mediante los códigos 153.** (colon) y 154.** (recto) de la Clasificación Internacional de Enfermedades 9.ª Versión modificación clínica (CIE9-MC). El estudio fue aprobado por el Comité Ético de Investigación Clínica de Euskadi. Los criterios de los estadiosi, ii, iii yiv se tomaron de la literatura15.
Se recogieron variables demográficas (edad, sexo y año de diagnóstico), clínicas (localización y estadio) y uso de recursos (ingresos en hospitalización por cirugía y complicaciones de la cirugía, consultas, ingresos en hospitalización a domicilio, quimioterapia y radioterapia). Para los estadiosi aiii se midieron los costes iniciales y de seguimiento. Por coste inicial entendimos el asociado al tratamiento llevado a cabo a partir del momento del diagnóstico y sus complicaciones. En el estadioiv se contabilizó el uso de todos los recursos utilizados en el tratamiento del paciente desde el diagnóstico como metastásico hasta la muerte o el último contacto con el sistema sanitario. El coste de la cirugía y los stents paliativos de los CCR en estadioiv se incluyó en el de las hospitalizaciones. También se registró el estado vital al final del seguimiento (vivo o muerto).
El análisis se realizó desde la perspectiva del sistema público de salud, por lo que solamente se incluyeron los costes sanitarios15-17.
Costes unitariosTodos los costes unitarios se ajustaron al año 2012 y se muestran en la tabla 1. El coste de los diferentes tipos de ingreso hospitalario se calculó utilizando el sistema de contabilidad analítica del Servicio Vasco de Salud y el sistema GRD. Los costes unitarios para consultas externas (116euros [€] primera y 58€ sucesiva), visitas a urgencias (144€), hospitalización a domicilio (1.270€ por episodio) y hospital de día se obtuvieron del mismo sistema contable. Los costes de farmacia se recogieron de la Base de Datos del sistema de gestión económica del Servicios Vasco de Salud el 1 de enero de 2012. Por otra parte, para calcular el coste total de la sesión de quimioterapia se añadieron a los costes farmacéuticos los costes de la preparación, del hospital de día y de la consulta de control oncológico previa de la administración. La dosis se calculó para un peso de 75kg y un área de superficie corporal de 1,8m2. La estimación del coste anual de seguimiento incluyó colonoscopia, pruebas y consultas externas y fue de 450€ por año (véase apéndice técnico en Anexo A).
Costes unitarios de los diferentes recursos utilizados en el tratamiento del cáncer colorrectal obtenidos del sistema de contabilidad analítica del Servicio Vasco de Salud
| Coste en euros | |
|---|---|
| Consultas primeras | |
| Oncología médica | 131 |
| Cirugía general | 109 |
| Ingresos cirugía colon sin complicación | |
| Hemicolectomía derecha | 6.277 |
| Hemicolectomía izquierda | 6.277 |
| Sigmoidectomía | 6.277 |
| Colectomía | 6.277 |
| Otra escisión de colon | 6.277 |
| Ingresos cirugía recto sin complicación | |
| Escisión local recto | 2.575 |
| Resección anterior recto | 7.574 |
| Amputación abdominoperineal | 7.574 |
| Coloprotectomía | 6.925 |
| Otra escisión de recto | 7.574 |
| Ingresos complicaciones tardías | |
| Fístula intestinal | 4.985 |
| Oclusión/Íleo | 4.985 |
| Hernia colostomía | 2.575 |
| Prolapso colostomía | 2.575 |
| Estenosis colostomía | 2.575 |
| Estenosis anastomosis | 4.985 |
| Eventración | 3.443 |
| Otros recursos | |
| Urgencias | 144 |
| Hospitalización a domicilio | 1.270 |
| Radioterapia, sesión | 227 |
| Quimioterapias | |
| Capecitabina (6 meses) | 1.039 |
| Xelox (8 ciclos) | 2.182 |
| Folfox (6 ciclos) | 5.524 |
| Folfiri (12 ciclos) | 3.012 |
| FU (adyuvancia completa) | 3.642 |
| FU-capecitavina (neoadyuvancia completa) | 9.683 |
| Folfiri+Bevacizumab (sesión) | 1.485 |
| Bevacizumab (sesión) | 1.232 |
| Folfiri+Cetuximab (sesión) | 1.818 |
| Folfiri+Panitumumab (sesión) | 1.122 |
| Xelox+Panitumumab (sesión) | 1.425 |
Un informe del Departamento de Radioterapia y del sistema de contabilidad del Hospital Universitario Araba proporcionó el coste unitario de la sesión de radioterapia (227€) en base a la actividad, las inversiones y el personal en 2011.
Análisis estadísticoDado que el coste no sigue una distribución normal, se aplicó la prueba no paramétrica de Mann-Whitney para comparar las medianas de los costes de los cánceres metastásicos según localización. La relación del coste total del CCR metastásico con las diferentes características clínicas se analizó mediante modelos lineales generalizados (MLG), ya que el coste es una variable que no sigue una distribución normal18,19. Los MLG son una generalización de la regresión lineal de mínimos cuadrados que permite que la variable respuesta siga distribuciones con forma distinta a la normal. El tipo de distribución aplicado fue gamma, con la función potencia como enlace. En primer lugar se analizó un MLG completo con el coste total como variable dependiente y aplicando como variables independientes la muerte, el seguimiento, el sexo, la edad y la localización. Se usó un nivel de significación del 5%. Posteriormente y para calcular el coste de por vida se utilizó un MLG restringido en el que el coste total se utilizó como variable dependiente y la edad y el seguimiento como las variables independientes. El software estadístico empleado fue Stata en su versión 13.
Como el seguimiento de los pacientes fue una variable censurada, se utilizó el análisis de supervivencia paramétrico para extrapolar la esperanza de vida total. El tipo de función de supervivencia se seleccionó mediante el estadístico Akaike Information Criteria (AIC)20,21. Se aplicó un nivel de significación del 5%. El software estadístico empleado fue Stata en su versión 13.
Se calculó también el coste total anual de la incidencia del CCR en el País Vasco y en España, que se tomó del Registro de Cáncer en 2008. En total se diagnosticaron en el País Vasco 1.941 casos, distribuidos en un 14% en estadioi, un 28% en estadioii, un 31% en estadioiii y un 27% en estadioiv4. Los estadiosi-iii se multiplicaron por el coste inicial y se les añadió un seguimiento de 5años y el coste de la recurrencias. Este último coste se calculó multiplicando la probabilidad de recurrencia por estadio (9,3% para eli, 27,2% para elii y 56,1% para eliii) por el coste del estadioiv22. Para el estadioiv el coste de por vida se estimó en función de la supervivencia media21. A partir de los 21.000 casos por año citados en la literatura se estimó el coste de la incidencia en España8.
ResultadosLa muestra incluyó 529 casos, de los cuales 110 pacientes estaban en el estadioi, 171 en el estadioii, 158 en el estadioiii y 90 en el estadioiv. En la tabla 2 (estadiosi-iii) y la tabla 3 (estadioiv) se describen las características y el perfil de uso de recursos de la muestra estudiada. La duración del seguimiento en los pacientes en estadioiv tuvo una mediana de 1,16años (Q1: 0,21años; Q3: 1,87años). Con este seguimiento el 75% había fallecido. El coste del seguimiento fue de 450€ por año para los estadiosi, ii y iii.
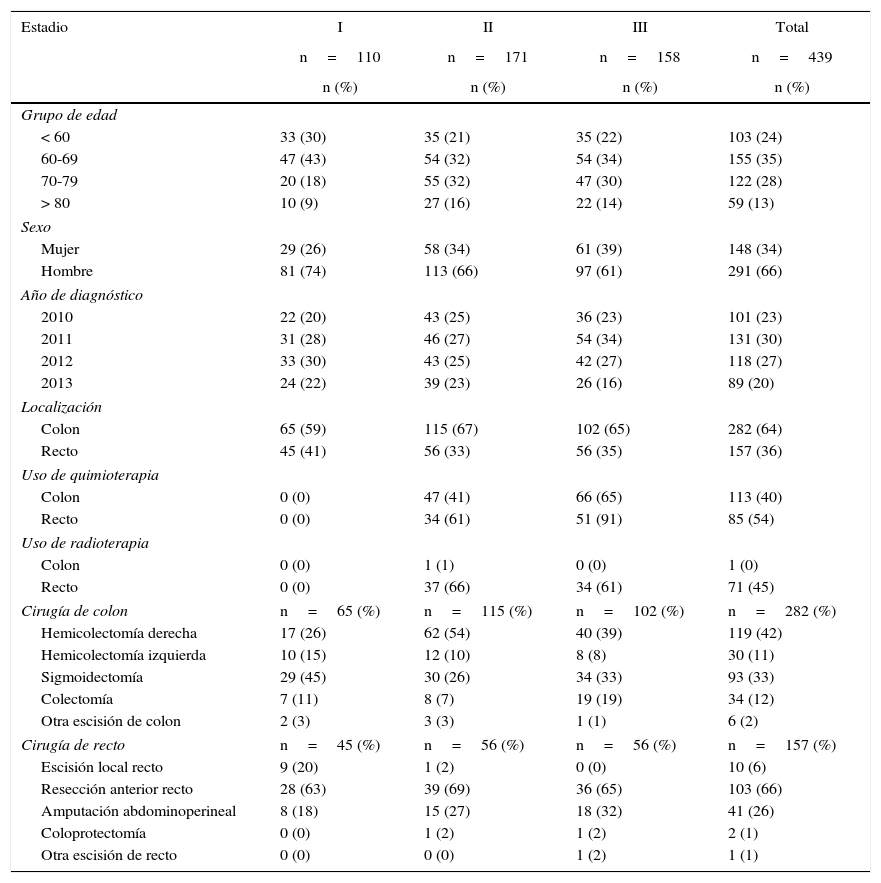
Características y perfil de uso de recursos de los cánceres no metastásicos según estadio
| Estadio | I | II | III | Total |
|---|---|---|---|---|
| n=110 | n=171 | n=158 | n=439 | |
| n (%) | n (%) | n (%) | n (%) | |
| Grupo de edad | ||||
| < 60 | 33 (30) | 35 (21) | 35 (22) | 103 (24) |
| 60-69 | 47 (43) | 54 (32) | 54 (34) | 155 (35) |
| 70-79 | 20 (18) | 55 (32) | 47 (30) | 122 (28) |
| > 80 | 10 (9) | 27 (16) | 22 (14) | 59 (13) |
| Sexo | ||||
| Mujer | 29 (26) | 58 (34) | 61 (39) | 148 (34) |
| Hombre | 81 (74) | 113 (66) | 97 (61) | 291 (66) |
| Año de diagnóstico | ||||
| 2010 | 22 (20) | 43 (25) | 36 (23) | 101 (23) |
| 2011 | 31 (28) | 46 (27) | 54 (34) | 131 (30) |
| 2012 | 33 (30) | 43 (25) | 42 (27) | 118 (27) |
| 2013 | 24 (22) | 39 (23) | 26 (16) | 89 (20) |
| Localización | ||||
| Colon | 65 (59) | 115 (67) | 102 (65) | 282 (64) |
| Recto | 45 (41) | 56 (33) | 56 (35) | 157 (36) |
| Uso de quimioterapia | ||||
| Colon | 0 (0) | 47 (41) | 66 (65) | 113 (40) |
| Recto | 0 (0) | 34 (61) | 51 (91) | 85 (54) |
| Uso de radioterapia | ||||
| Colon | 0 (0) | 1 (1) | 0 (0) | 1 (0) |
| Recto | 0 (0) | 37 (66) | 34 (61) | 71 (45) |
| Cirugía de colon | n=65 (%) | n=115 (%) | n=102 (%) | n=282 (%) |
| Hemicolectomía derecha | 17 (26) | 62 (54) | 40 (39) | 119 (42) |
| Hemicolectomía izquierda | 10 (15) | 12 (10) | 8 (8) | 30 (11) |
| Sigmoidectomía | 29 (45) | 30 (26) | 34 (33) | 93 (33) |
| Colectomía | 7 (11) | 8 (7) | 19 (19) | 34 (12) |
| Otra escisión de colon | 2 (3) | 3 (3) | 1 (1) | 6 (2) |
| Cirugía de recto | n=45 (%) | n=56 (%) | n=56 (%) | n=157 (%) |
| Escisión local recto | 9 (20) | 1 (2) | 0 (0) | 10 (6) |
| Resección anterior recto | 28 (63) | 39 (69) | 36 (65) | 103 (66) |
| Amputación abdominoperineal | 8 (18) | 15 (27) | 18 (32) | 41 (26) |
| Coloprotectomía | 0 (0) | 1 (2) | 1 (2) | 2 (1) |
| Otra escisión de recto | 0 (0) | 0 (0) | 1 (2) | 1 (1) |
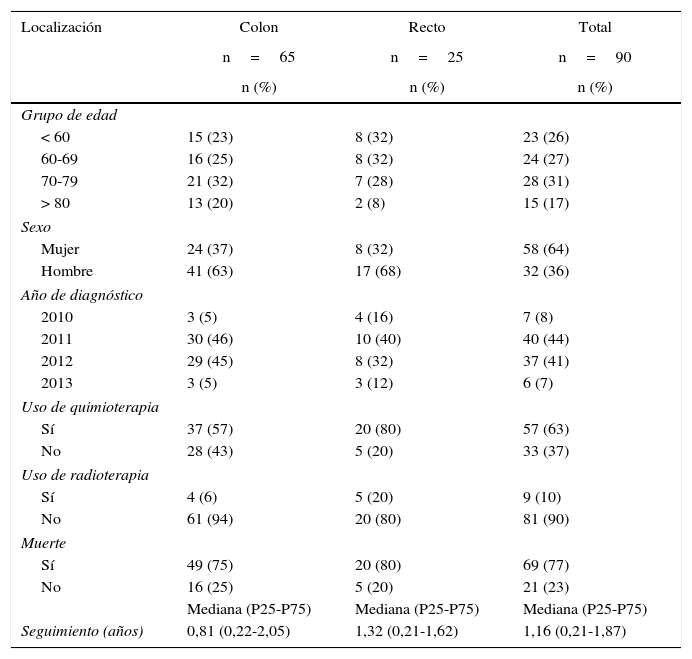
Características y perfil de uso de recursos de los canceres metastásicos según localización
| Localización | Colon | Recto | Total |
|---|---|---|---|
| n=65 | n=25 | n=90 | |
| n (%) | n (%) | n (%) | |
| Grupo de edad | |||
| < 60 | 15 (23) | 8 (32) | 23 (26) |
| 60-69 | 16 (25) | 8 (32) | 24 (27) |
| 70-79 | 21 (32) | 7 (28) | 28 (31) |
| > 80 | 13 (20) | 2 (8) | 15 (17) |
| Sexo | |||
| Mujer | 24 (37) | 8 (32) | 58 (64) |
| Hombre | 41 (63) | 17 (68) | 32 (36) |
| Año de diagnóstico | |||
| 2010 | 3 (5) | 4 (16) | 7 (8) |
| 2011 | 30 (46) | 10 (40) | 40 (44) |
| 2012 | 29 (45) | 8 (32) | 37 (41) |
| 2013 | 3 (5) | 3 (12) | 6 (7) |
| Uso de quimioterapia | |||
| Sí | 37 (57) | 20 (80) | 57 (63) |
| No | 28 (43) | 5 (20) | 33 (37) |
| Uso de radioterapia | |||
| Sí | 4 (6) | 5 (20) | 9 (10) |
| No | 61 (94) | 20 (80) | 81 (90) |
| Muerte | |||
| Sí | 49 (75) | 20 (80) | 69 (77) |
| No | 16 (25) | 5 (20) | 21 (23) |
| Mediana (P25-P75) | Mediana (P25-P75) | Mediana (P25-P75) | |
| Seguimiento (años) | 0,81 (0,22-2,05) | 1,32 (0,21-1,62) | 1,16 (0,21-1,87) |
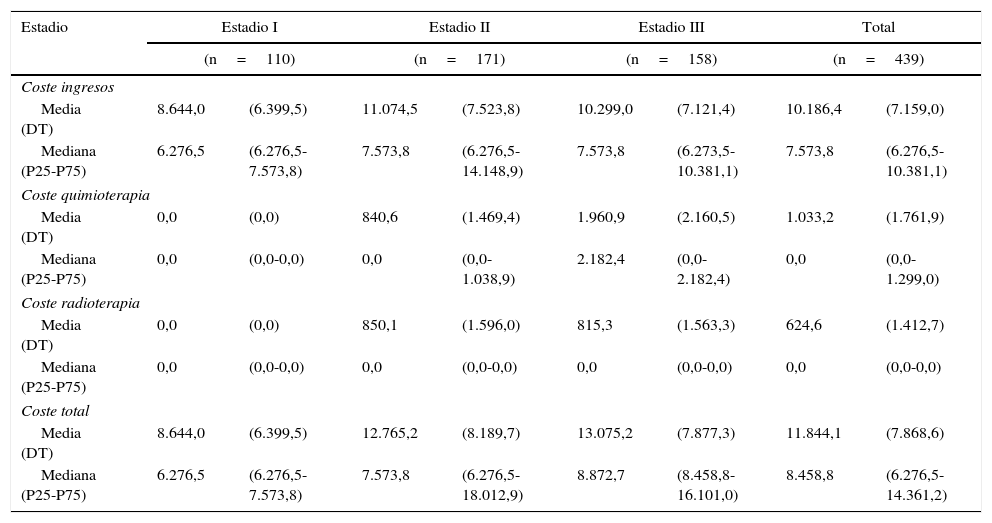
La tabla 4 recoge el coste de los pacientes con estadiosi-iii desagregado por los diferentes recursos asistenciales. El coste total por paciente va desde los 8.644€ del estadioi hasta los 12.765€ para el estadioii y los 13.075€ para el estadioiii. El principal componente del coste fueron los ingresos hospitalarios debidos a la cirugía.
Costes iniciales por paciente de los cánceres no metastásicos según estadio
| Estadio | Estadio I | Estadio II | Estadio III | Total | ||||
|---|---|---|---|---|---|---|---|---|
| (n=110) | (n=171) | (n=158) | (n=439) | |||||
| Coste ingresos | ||||||||
| Media (DT) | 8.644,0 | (6.399,5) | 11.074,5 | (7.523,8) | 10.299,0 | (7.121,4) | 10.186,4 | (7.159,0) |
| Mediana (P25-P75) | 6.276,5 | (6.276,5-7.573,8) | 7.573,8 | (6.276,5-14.148,9) | 7.573,8 | (6.273,5-10.381,1) | 7.573,8 | (6.276,5-10.381,1) |
| Coste quimioterapia | ||||||||
| Media (DT) | 0,0 | (0,0) | 840,6 | (1.469,4) | 1.960,9 | (2.160,5) | 1.033,2 | (1.761,9) |
| Mediana (P25-P75) | 0,0 | (0,0-0,0) | 0,0 | (0,0-1.038,9) | 2.182,4 | (0,0-2.182,4) | 0,0 | (0,0-1.299,0) |
| Coste radioterapia | ||||||||
| Media (DT) | 0,0 | (0,0) | 850,1 | (1.596,0) | 815,3 | (1.563,3) | 624,6 | (1.412,7) |
| Mediana (P25-P75) | 0,0 | (0,0-0,0) | 0,0 | (0,0-0,0) | 0,0 | (0,0-0,0) | 0,0 | (0,0-0,0) |
| Coste total | ||||||||
| Media (DT) | 8.644,0 | (6.399,5) | 12.765,2 | (8.189,7) | 13.075,2 | (7.877,3) | 11.844,1 | (7.868,6) |
| Mediana (P25-P75) | 6.276,5 | (6.276,5-7.573,8) | 7.573,8 | (6.276,5-18.012,9) | 8.872,7 | (8.458,8-16.101,0) | 8.458,8 | (6.276,5-14.361,2) |
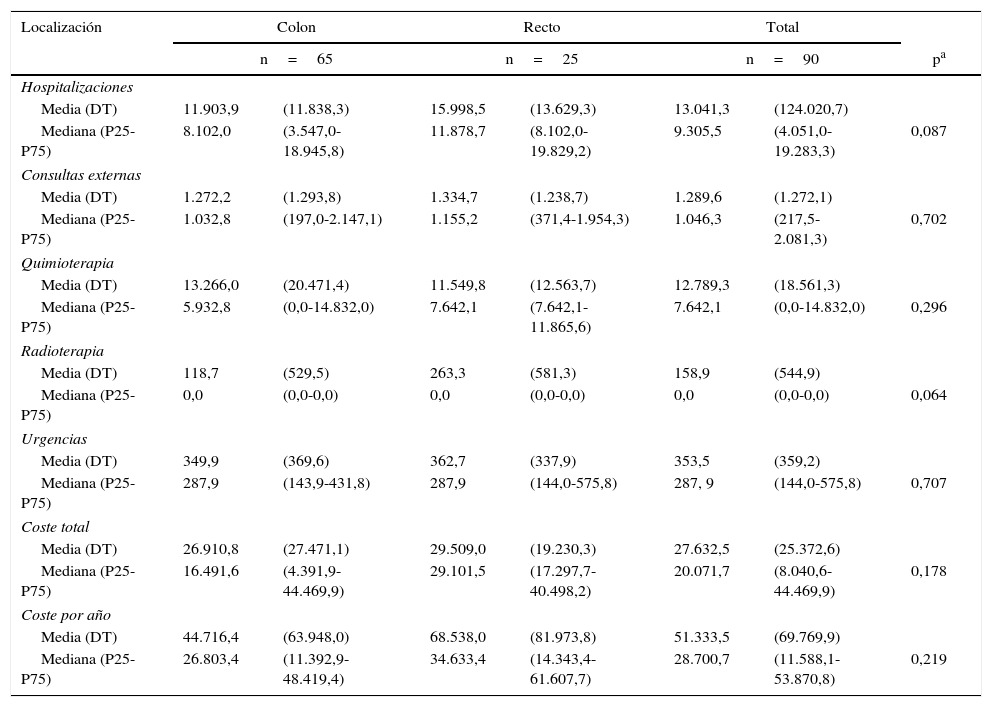
El coste de los pacientes metastásicos según localización y sus componentes de coste se describen en la tabla 5. También en este estadio las hospitalizaciones generaron la mayor parte del coste. La diferencia es que incluyeron sobre todo hospitalizaciones no quirúrgicas.
Costes por paciente de los cánceres metastásicos según localización
| Localización | Colon | Recto | Total | ||||
|---|---|---|---|---|---|---|---|
| n=65 | n=25 | n=90 | pa | ||||
| Hospitalizaciones | |||||||
| Media (DT) | 11.903,9 | (11.838,3) | 15.998,5 | (13.629,3) | 13.041,3 | (124.020,7) | |
| Mediana (P25-P75) | 8.102,0 | (3.547,0-18.945,8) | 11.878,7 | (8.102,0-19.829,2) | 9.305,5 | (4.051,0-19.283,3) | 0,087 |
| Consultas externas | |||||||
| Media (DT) | 1.272,2 | (1.293,8) | 1.334,7 | (1.238,7) | 1.289,6 | (1.272,1) | |
| Mediana (P25-P75) | 1.032,8 | (197,0-2.147,1) | 1.155,2 | (371,4-1.954,3) | 1.046,3 | (217,5-2.081,3) | 0,702 |
| Quimioterapia | |||||||
| Media (DT) | 13.266,0 | (20.471,4) | 11.549,8 | (12.563,7) | 12.789,3 | (18.561,3) | |
| Mediana (P25-P75) | 5.932,8 | (0,0-14.832,0) | 7.642,1 | (7.642,1-11.865,6) | 7.642,1 | (0,0-14.832,0) | 0,296 |
| Radioterapia | |||||||
| Media (DT) | 118,7 | (529,5) | 263,3 | (581,3) | 158,9 | (544,9) | |
| Mediana (P25-P75) | 0,0 | (0,0-0,0) | 0,0 | (0,0-0,0) | 0,0 | (0,0-0,0) | 0,064 |
| Urgencias | |||||||
| Media (DT) | 349,9 | (369,6) | 362,7 | (337,9) | 353,5 | (359,2) | |
| Mediana (P25-P75) | 287,9 | (143,9-431,8) | 287,9 | (144,0-575,8) | 287, 9 | (144,0-575,8) | 0,707 |
| Coste total | |||||||
| Media (DT) | 26.910,8 | (27.471,1) | 29.509,0 | (19.230,3) | 27.632,5 | (25.372,6) | |
| Mediana (P25-P75) | 16.491,6 | (4.391,9-44.469,9) | 29.101,5 | (17.297,7-40.498,2) | 20.071,7 | (8.040,6-44.469,9) | 0,178 |
| Coste por año | |||||||
| Media (DT) | 44.716,4 | (63.948,0) | 68.538,0 | (81.973,8) | 51.333,5 | (69.769,9) | |
| Mediana (P25-P75) | 26.803,4 | (11.392,9-48.419,4) | 34.633,4 | (14.343,4-61.607,7) | 28.700,7 | (11.588,1-53.870,8) | 0,219 |
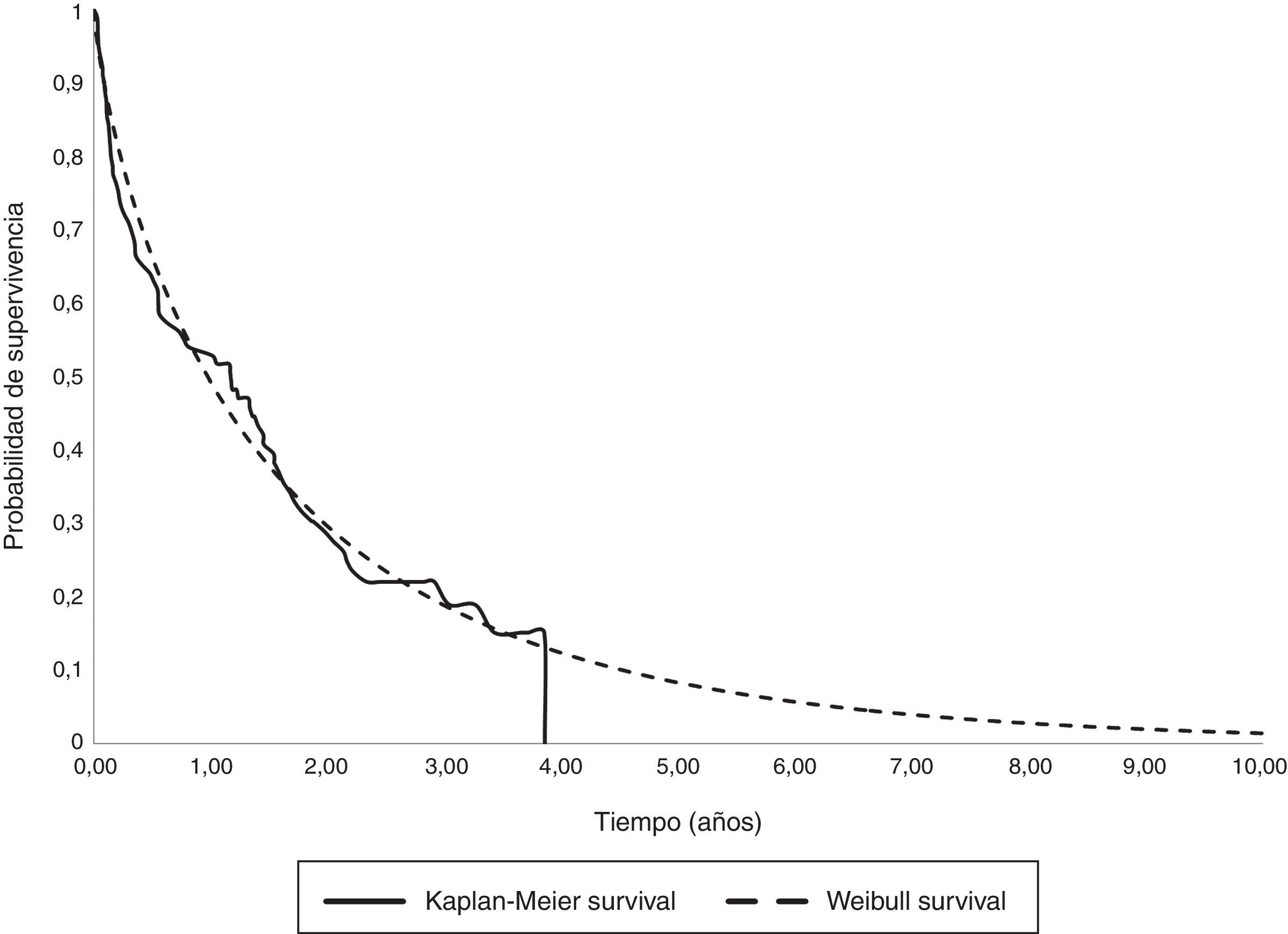
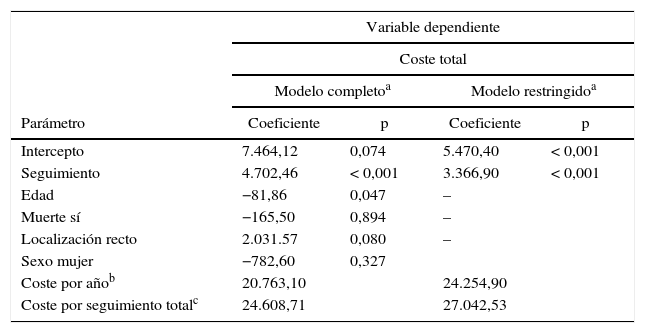
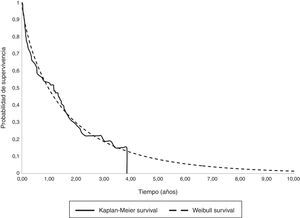
El análisis de supervivencia paramétrico de los cánceres metastásicos determinó que la distribución de Weibul fuese la más adecuada para extrapolar la supervivencia total media que se muestra junto con la curva de Kaplan-Meyer en la figura 1. Se construyó inicialmente un modelo amplio con los parámetros edad, muerte, localización y sexo que estimó una supervivencia media de 1,30años. Aunque la edad fue una variable significativa, la localización, la muerte y el sexo se mostraron como no significativas. En consecuencia, limitamos las variables incluidas en el modelo a la edad que siguió siendo significativa. Con este modelo restringido la supervivencia media calculada por extrapolación fue de 1,27años (tabla 6).
Resultados de los modelos de regresión lineal generalizada con el coste total en pacientes con metástasis como variable dependiente
| Variable dependiente | ||||
|---|---|---|---|---|
| Coste total | ||||
| Modelo completoa | Modelo restringidoa | |||
| Parámetro | Coeficiente | p | Coeficiente | p |
| Intercepto | 7.464,12 | 0,074 | 5.470,40 | < 0,001 |
| Seguimiento | 4.702,46 | < 0,001 | 3.366,90 | < 0,001 |
| Edad | −81,86 | 0,047 | – | |
| Muerte sí | −165,50 | 0,894 | – | |
| Localización recto | 2.031.57 | 0,080 | – | |
| Sexo mujer | −782,60 | 0,327 | ||
| Coste por añob | 20.763,10 | 24.254,90 | ||
| Coste por seguimiento totalc | 24.608,71 | 27.042,53 | ||
Al relacionar el coste total de los pacientes en estadioiv con las diferentes variables mediante modelos MLG solamente aparecieron diferencias estadísticamente significativas con el seguimiento (tabla 6). Por lo tanto, se construyó un modelo restringido a la variable seguimiento para poder calcular el coste anual medio por paciente, que fue de 24.254,9€. El coste total medio desde el diagnóstico hasta la muerte fue de 27.042,5€.
Extrapolando estos resultados a la incidencia reportada en la literatura, el coste de la incidencia del CCR en el País Vasco en 2012 fue de 49 millones de euros, y en el conjunto de la población española fue de 986 millones de euros.
DiscusiónEste trabajo estima por primera vez en un hospital del sistema sanitario español el coste del CCR desagregado por estadio y basado en el perfil de uso de recursos de la práctica clínica habitual. Además, este artículo aporta una metodología novedosa para el cálculo del coste de atención a los pacientes con cánceres metastásicos. Nuestro enfoque combina los MLG para relacionar el coste con la duración del seguimiento y el análisis de supervivencia de tipo paramétrico que permite calcular la supervivencia media de la muestra a pesar de que el seguimiento sea parcial. Aunque la muestra estudiada procede de un único hospital, creemos que los resultados de coste son extrapolables al conjunto de los hospitales públicos vascos dada la homogeneidad de condiciones salariales en el Servicio Vasco de Salud y la existencia de criterios comunes coordinados por el Consejo Asesor del Cáncer del País Vasco, creado en 2006. Las estimaciones de costes de la incidencia o estimaciones longitudinales de los costes médicos después del diagnóstico de la enfermedad son útiles para informar a los decisores acerca de la asignación de recursos y la incorporación de tratamientos específicos23,24.
La comparación de estos resultados con la literatura indica diferencias según se refiera a estudios llevados a cabo en Europa o en Estados Unidos. Los estudios europeos dan de forma consistente cifras de coste similares a nuestro estudio, claramente menores que las estimadas en Estados Unidos25,26. Para los mismos estadiosi-iii en Estados Unidos los costes suben hasta los aproximadamente 28.000, 38.000 y 46.000 dólares7,27. Para el cáncer metastásico un estudio holandés da una cifra de 24.000€, similar a la nuestra, mientras que el norteamericano se sitúa en un nivel más alto, con 41.562dólares7,25. Los mayores costes en Estados Unidos se deben tanto a una práctica clínica con mayor uso de recursos como a unos costes unitarios mayores que en Europa. Una limitación de nuestro trabajo es no haber diferenciado el coste unitario según la técnica quirúrgica (abierta y laparoscópica), que es un resultado relevante desde el punto de vista de la evaluación de los avances tecnológicos. Dado que nuestro objetivo no fue diferenciar el coste en función de la técnica quirúrgica sino la carga del tratamiento del CCR por estadio, pensamos que el coste unitario calculado es el coste medio del proceso de hospitalización quirúrgica.
En literatura se suele usar el mismo método para calcular el coste de todos los estadios. En este trabajo se ha aplicado ese método para los estadiosi, ii yiii porque siguen una pauta bastante homogénea por el peso de la cirugía inicial. Por el contrario, el coste del estadioiv muestra grandes variaciones individuales a lo largo del seguimiento según edad, tipo de metástasis, comorbilidad, grado de extensión del tumor y supervivencia del paciente. Por ellos su coste se ha basado en los análisis estadísticos en función del seguimiento. La ventaja de nuestro enfoque es que permite relacionar el coste con el seguimiento, que por la mortalidad de los pacientes suele ser distinto en los diferentes estudios y dentro de cada estudio entre los diferentes pacientes. Por un lado, los MLG permiten abordar el coste como variable dependiente resolviendo el problema de la falta de normalidad de su distribución18. Así como el coste de los pacientes en estadiosi aiii tiene un pico inicial de coste, el coste de los pacientes con metástasis se describe mejor con un enfoque longitudinal, ya que requieren un uso de recursos mantenido en el tiempo. La consecuencia es que no reproduce esa forma en U y que se describe mejor aplicando técnicas estadísticas.
La carga económica de la atención al CCR a nivel nacional descrita en el presente artículo (986 millones de euros) es muy importante y debe ser tenida en cuenta en la toma de decisiones28. Es suficiente para entender su relevancia en el presupuesto del sistema de salud y la necesidad de conocer cómo se distribuye entre los diferentes estadios. En España el cribado del CCR no se ha extendido al conjunto de la población por la limitación de recursos disponibles. Al mismo tiempo, el impacto presupuestario de los nuevos medicamentos para el tratamiento del CCR metastásico va a suponer una barrera para su acceso a los pacientes. Ante la necesidad de tomar decisiones para incorporar al sistema nacional de salud intervenciones de prevención primaria, secundaria y terciaria, la asignación de recursos deberá basarse en aquellas que maximicen el beneficio en salud dados los recursos disponibles16,17. Ya que el cribado permite diagnosticar el CCR en estadios más tempranos reduce el coste de los casos avanzados. Cuanto mayor sea el coste unitario de esos tratamientos mayor será el ahorro del impacto económico del cribado6. Por un lado, nuestros resultados permiten incorporar datos propios en los estudios coste-efectividad que se vayan a llevar a cabo para analizar la eficiencia de los nuevos tratamientos para el CCR metastásico. Al mismo tiempo sirven para evaluar los programas de cribado actualmente existentes y establecer conclusiones acerca de su extensión a todas las comunidades autónomas.
Acceso a la informaciónEl estudio fue aprobado por el CEIC del País Vasco y se han seguido los protocolos establecidos por los respectivos centros sanitarios para acceder a los datos de las historias clínicas a los fines de poder realizar este tipo de publicación con finalidad de investigación/divulgación para la comunidad científica.
FinanciaciónEste trabajo se ha llevado a cabo son los recursos propios de los servicios implicados y no ha contado con financiación de ninguna entidad pública ni privada.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses.